甲基紫精胁迫下转TheIF1A基因烟草的活性氧代谢
赵玉琳 杨桂燕,2 于丽丽 郭宇聪 赵 震 高彩球*
(1.东北林业大学林木遗传育种国家重点实验室,哈尔滨 150040; 2.西北农林科技大学林学院,杨凌 712100)
甲基紫精胁迫下转TheIF1A基因烟草的活性氧代谢
赵玉琳1杨桂燕1,2于丽丽1郭宇聪1赵 震1高彩球1*
(1.东北林业大学林木遗传育种国家重点实验室,哈尔滨 150040;2.西北农林科技大学林学院,杨凌 712100)
真核翻译起始因子eIF1家族基因具有一定的抗逆调节能力。前期研究表明柽柳TheIF1A基因能提高转基因植物的抗旱耐盐胁迫能力。本研究旨在对该基因的抗氧化能力进行分析,探讨TheIF1A基因是否具有抗氧化能力。组织化学染色结果显示,甲基紫精胁迫下转TheIF1A基因烟草叶片、保卫细胞、根尖积累的活性氧明显少于野生型烟草(WT),H2O2含量测定结果也表明转基因株系的H2O2含量显著低于非转基因株系。此外,甲基紫精胁迫下转TheIF1A基因烟草的CAT活性、POD活性显著高于WT株系,表明过表达TheIF1A可能通过提高保护酶活性来调节体内活性氧清除能力进而改善植株活性氧积累,提高抗氧化能力。
刚毛柽柳;甲基紫精胁迫;活性氧代谢;TheIF1A
真核翻译起始因子(eukaryotic initiation factor,eIF),是指参与真核翻译起始这一过程的蛋白质。与原核起始因子相比,真核起始因子种类多且复杂,目前已鉴定的真核起始因子共有12种[1]。其与核糖体、信使核糖核酸和起始转移核糖核酸等组成动态翻译起始复合体。在众多的翻译起始因子中只有eIF1A和eIF5A具有普遍的保守性[2]。其中eIF1A是一种在真核翻译起始过程中起重要作用的蛋白质,也是一种RNA结合蛋白,其主要的功能是稳定Met-tRNAi与40S核糖体亚基间的结合,参与激活mRNA的结合,还可以通过结合到40S亚基上以阻止其与60S亚基结合形成无活性的核糖体[3]。eIF1A能够促使eIF2:GTP:tRNA组成三元复合体,与40S核糖体亚基结合启动蛋白翻译过程[4]。
对植物和酵母细胞的研究表明,盐胁迫下eIF1A能够增强蛋白质的翻译能力,是维持其细胞生存不可或缺的蛋白,在植物和酵母的抗盐胁迫中起重要作用[5]。将柽柳TheIF1A基因导入烟草中,可提高烟草的抗旱性[6]。因此,在植物抗旱基因工程中TheIF1A具有一定的应用价值。但目前,对eIF1A基因的抗氧化能力研究较少,因此本研究拟对氧化胁迫下TheIF1A基因的抗逆功能进行分析,探讨TheIF1A基因的抗氧化功能,这将为拓展真核翻译起始因子的抗逆作用,为后续研究真核翻译起始因子的氧化胁迫抗性及相关应用奠定基础。
1 材料与方法
1.1 植物材料处理
将非转基因烟草(WT)及第3代转TheIF1A基因烟草株系1A#1、1A#3种子,分别进行表面消毒后播种于1/2MS培养基,4℃处理2~3 d后,萌发培养15 d,转移至灭菌营养土(花土∶蛭石∶珍珠岩=5∶3∶2),置于相对湿度为70±5%,温度22±2℃,光照周期14 h/10条件下生长1个月。用5 μmol·L-1甲基紫精(MV)分别喷洒各株系叶片,并浇灌根部,避光处理0、2、5 h后取整个植株进行酶活测定,取叶片、根尖及叶下表皮进行组织化学染色分析。
1.2CAT活性、POD活性和H2O2含量测定
取约0.1 g叶片,液氮研磨后,用0.05 mol·L-1pH7.8磷酸缓冲液4℃抽提30 min,12 000 r·min-1离心20 min,取上清,用0.3% H2O2启动反应,测定A240以计算CAT活性[7]。POD活性根据班巧英等人的方法进行测定[8]。H2O2含量的测定根据南京建成生物工程研究所(http://www.njjcbio.com/)过氧化氢试剂盒进行测定。每个处理至少重复3次。
1.3 DAB、NBT、DCFH-DA染色
DAB染色[9]:将烟草叶片置于2 mL离心管,加入1.5 mL 1 mg·mL-1DAB染色液,37℃染色12 h。曝光1 h,加入95%的乙醇+5%甘油沸水浴脱色。
NBT染色[9]:将烟草叶片置于2 mL离心管,加入1.5 mL 1 mg·mL-1NBT染色液,37℃染色过夜。加入95%的乙醇+5%甘油沸水浴脱色。
DCFH-DA染色[9]:撕取烟草叶下表皮,置于含100 mmol·L-1MES-KOH和30 mmol·L-1KCl的incubation buffer中,4℃,2 h,5 μmol·L-1DCFH-DA染色剂染色10 min,激光共聚焦显微镜观察染色结果。
每种染色至少选取5棵株系的叶片、根及叶下表皮。
2 结果与分析
2.1甲基紫精胁迫下转TheIF1A基因烟草保卫细胞和根中活性氧积累
DCFH-DA可以对体内ROS进行活体染色。当细胞产生的H2O2与DCFH反应时,能使DCFH形成有荧光的2,7-二氯甲烷双氢荧光素DCF。通过观察DCF的荧光强度可直接了解细胞内活性氧的水平。
对转TheIF1A基因烟草和WT烟草的DCFH染色结果表明,非胁迫条件下转基因株系1A#1、1A#3和WT的保卫细胞和根尖的荧光强度无明显差异,MV胁迫后,随着胁迫时间延长,荧光强度增强。但与WT相比,1A#1、1A#3的荧光强度明显要弱(图1),表明在MV胁迫下转TheIF1A烟草保卫细胞和根内产生的ROS积累小于WT株系。
2.2甲基紫精胁迫下转TheIF1A基因烟草叶片中活性氧积累
H2O2和O2-为活性氧(ROS)的主要类别。利用DAB染色可以反映体内产生的H2O2含量,染色的深浅代表体内积累的H2O2的多少。NBT主要对体内的超氧离子(O2-)水平进行着色,颜色越深表示积累的O2-越多。染色结果表明,非胁迫条件下,转基因株系1A#1、1A#3和野生型(WT)具有相似的DAB、NBT染色结果;MV胁迫2和5 h后,WT叶片的DAB、NBT着色明显比1A#1、1A#3深(图2)。
整个植株的H2O2含量测定结果也表明,非胁迫条件下3个株系间无显著差别,MV胁迫引起各株系H2O2含量增强,且随着胁迫时间的延长,各株系的H2O2含量增加,但转TheIF1A株系的H2O2含量显著低于WT株系。如胁迫5 h,WT中H2O2含量分别为1A#1、1A#3的1.64和1.36倍(图2)。表明过表达TheIF1A能有效的改善转基因株系在MV胁迫下的ROS积累。

图2 MV胁迫下转TheIF1A基因和WT烟草叶片DAB、NBT染色及H2O2含量比较Fig.2 The comparison of DAB, NBT staining and H2O2 content between transgenic lines and WT under MV stress
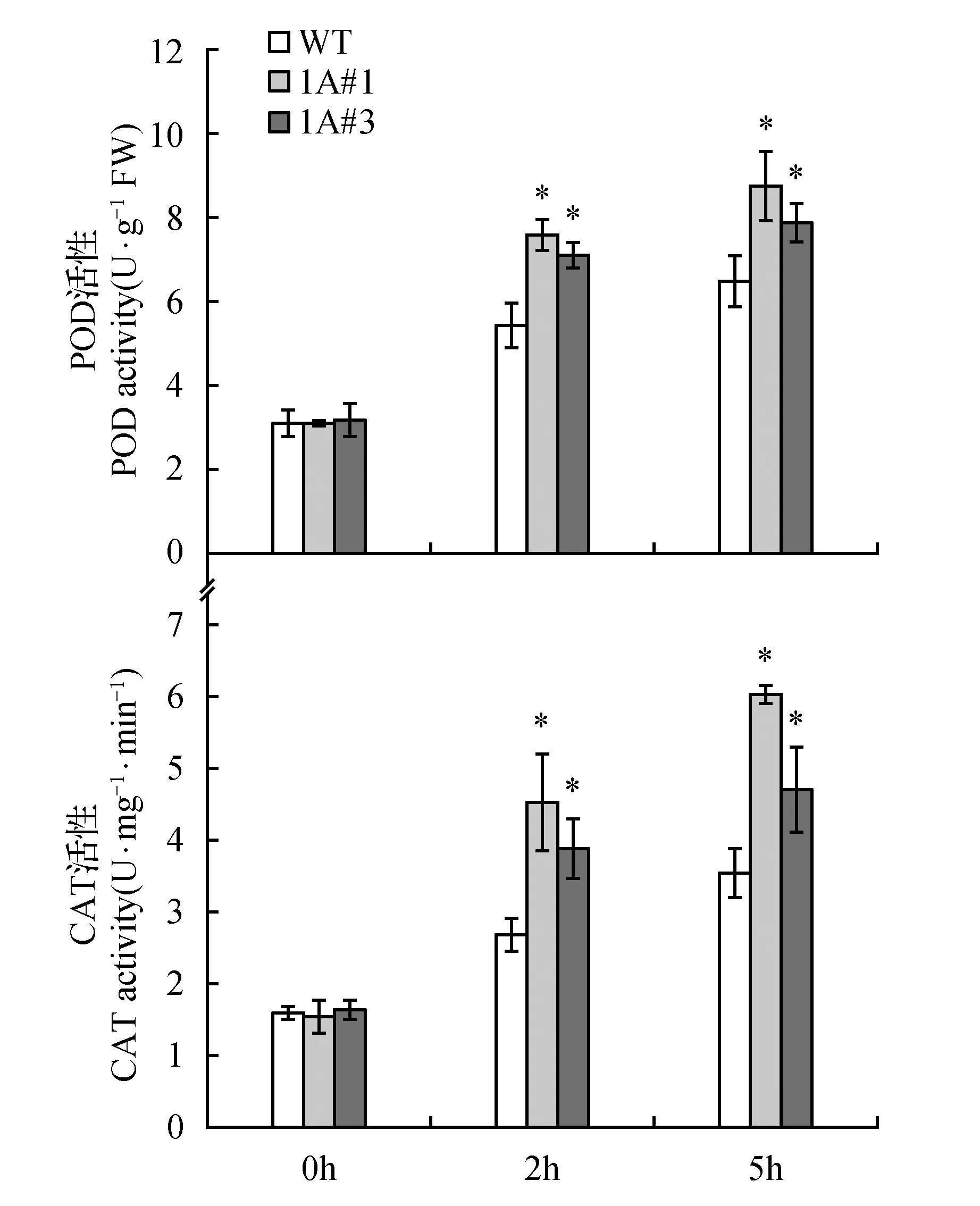
图3 MV胁迫下转TheIF1A基因和WT烟草POD和CAT活性比较Fig.3 The comparison of POD and CAT activities between transgenic lines and WT under MV stress
2.3甲基紫精胁迫下转TheIF1A烟草体内CAT和POD活性
过氧化氢酶(CAT)和过氧化物酶(POD)都是植物体内重要的清除活性氧类物质的酶类。对转TheIF1A基因烟草和WT的CAT、POD活性测定结果显示,非胁迫条件下,转TheIF1A基因烟草和WT的CAT、POD活性无明显差异,而胁迫后二者活性均明显增加,但转基因株系中CAT和POD活性明显高于WT。MV胁迫2 h后,1A#1和1A#3的POD活性分别为WT的1.40和1.32倍,5 h分别为WT的1.34和1.21倍。转TheIF1A基因株系和WT间的CAT活性差异更大,MV胁迫2 h后,WT的CAT活性分别为1A#1和1A#3的59.1%和69.0%;5 h后,WT的CAT活性分别为1A#1和1A#3的59.1%和75.6%(图3)。表明氧化胁迫下TheIF1A基因可能通过产生较高的保护酶活性来清除体内的活性氧,从而提高转基因植物的抗氧化胁迫能力。
3 讨论
本研究对转TheIF1A基因烟草进行甲基紫精胁迫处理,分析比较过表达TheIF1A植株的抗氧化表现,探讨TheIF1A是否具有抗氧化调节能力。非胁迫条件下转基因株系和非转基因株系组织化学染色结果显示各株系体内的活性氧积累相似,表明在正常生长条件下这些株系的活性氧水平一致。胁迫后各株系叶片、气孔、根尖的ROS积累均明显增加,可能是各株系对甲基紫精胁迫敏感,产生氧化应激,从而使体内的活性氧水平增加;但转基因株系的ROS积累显著低于野生型,表明过表达TheIF1A对甲基紫精胁迫引起的氧化胁迫具有调节作用,使其保持相对较低的活性氧积累。以往研究也表明翻译起始因子对植物包括氧化胁迫在内的多重非生物胁迫具有应答调控能力,如Sun et al.[10]指出eIF1可作为植物耐盐碱的指示基因,其耐盐碱调控与ROS代谢直接相关[11]。TaeIF3G具有多重抗非生物胁迫调控能力,其中包括氧化代谢相关的调控[12],eIF4E也具有相似的功能[13]。本研究以甲基紫精进行氧化胁迫更直接的证实了eIF1A在抗氧化胁迫调控中的功能。
甲基紫精胁迫不仅能引起植株的氧化应激响应,同时也会引起植株的光合效应[14]。吴长艾等人研究表明,甲基紫精胁迫引起植株的光氧化效应,进而引起叶绿素含量等的变化,导致光合作用的改变[15]。通常情况下,植物光合代谢与光照、水分、温度等有直接关系,活性氧积累和代谢也会一定程度的影响植株的光合代谢。如eIF5A的过表达直接影响植株在盐和干旱条件下的叶绿素积累情况,直接关系植株在胁迫条件下的光合代谢,而同时eIF5A的耐盐抗旱调节也与SOD等直接参与活性氧代谢的保护酶活性相关[16]。本研究中,1A#1和1A#3的气孔开度在胁迫前后均有所变化,如,1A#1在胁迫2 h气孔开放较0和5 h大(图1:A,Bright),表明过表达TheIF1A可能在一定程度上影响植株MV胁迫下的气孔开关运动,进而改变植株的光合代谢以影响植株的氧化应答能力。
在植株排除体内活性氧时,通常涉及SOD、POD、CAT、GST等保护酶活性的调控[7,17~18]。其中CAT是H2O2的清除酶类[7],POD则是过氧化物的清除酶[19],因此对这些保护酶活性的测定能反映各株系对氧化胁迫的应对能力。在非胁迫下各株系的POD、CAT活性均相似,表明正常生长条件下转基因株系和非转基因株系在氧化酶活性等方面是一致的。胁迫后虽然各株系的酶活性都增高,但相同条件下转基因株系的CAT、POD活性显著高于非转基因株系,表明植株受外界氧化胁迫时,过表达TheIF1A能够通过快速提高保护酶活性应对刺激保证正常的代谢。Diédhiou等[20]研究也表明,水稻eIF1也能通过调控逆境胁迫下的保护酶类活性参与调控离子代谢平衡,进而提高抗逆能力。表明调控保护酶类活性可能是eIF调控植物响应外界刺激进行应答调控的主要方式之一。
综上所述,TheIF1A基因过表达株系在MV胁迫下的活性氧积累少于WT,而体内的CAT、POD活性显著高于WT,表明TheIF1A可能通过调节体内的保护酶类活性来增强体内的活性氧清除能力从而提高植株的抗氧化胁迫能力。
1.Pain V M.Initiation of protein synthesis in eukaryotic cells[J].European Journal of Biochemistry,1996,236(3):747-771.
2.Mihailovich M,Militti C,Gabaldón T,et al.Eukaryotic cold shock domain proteins:highly versatile regulators of gene expression[J].Bioessays,2010,32(2):109-118.
3.漆梅芳.番茄和辣椒翻译起始因子4E相关基因的克隆与分析[D].武汉:华中农业大学,2008.
4.Olsen D A S,Savner E M,Mathew A,et al.Domains of eIF1A that mediate binding to eIF2,eIF3 and eIF5B and promote ternary complex recruitment in vivo[J].The EMBO journal,2003,22(2):193-204.
5.Rausell A,Kanhonou R,Yenush L,et al.The translation initiation factor eIF1A is an important determinant in the tolerance to NaCl stress in yeast and plants[J].The Plant Journal,2003,34(3):257-267.
6.高彩球,李艳霞,刘桂丰,等.翻译起始因子(eIF1A)基因的获得及抗旱性分析[J].东北林业大学学报,2007,35(8):6-9.
7.姜波.柽柳硫氧还蛋白过氧化物酶基因耐盐功能分析[D].哈尔滨:东北林业大学,2011.
8.Ban Q,Liu G,Wang Y.A DREB gene fromLimoniumbicolormediates molecular and physiological responses to copper stress in transgenic tobacco[J].Journal of plant physiology,2011,168(5):449-458.
9.Zhang X,Wang L,Meng H,et al.Maize ABP9 enhances tolerance to multiple stresses in transgenicArabidopsisby modulating ABA signaling and cellular levels of reactive oxygen species[J].Plant molecular biology,2011,75(4-5):365-378.
10.Sun Y L,Hong S K.Sensitivity of translation initiation factor eIF1 as a molecular target of salt toxicity to sodic-alkaline stress in the halophytic grassLeymuschinensis[J].Biochemical genetics,2013,51(1-2):101-118.
11.Wang Y,Ying Y,Chen J,et al.TransgenicArabidopsisoverexpressing Mn-SOD enhanced salt-tolerance[J].Plant Science,2004,167(4):671-677.
12.Singh B,Chauhan H,Khurana J P,et al.Evidence for the role of wheat eukaryotic translation initiation factor 3 subunit g(TaeIF3g) in abiotic stress tolerance[J].Gene,2013,532(2):177-185.
13.Ptushkina M,Malys N,McCarthy J E G.eIF4E isoform 2 in Schizosaccharomyces pombe is a novel stress-response factor[J].EMBO reports,2004,5(3):311-316.
14.王国莉,郭振飞.甲基紫精对水稻不同耐冷品种叶绿素荧光参数的影响[J].武汉植物学研究,2008,26(1):81-86.
15.吴长艾,孟庆伟,邹琦,等.小麦不同品种叶片对光氧化胁迫响应的比较研究[J].作物学报,2003,29(3):339-344.
16.Wang L,Xu C,Wang C,et al.Characterization of a eukaryotic translation initiation factor 5A homolog fromTamarixandrossowiiinvolved in plant abiotic stress tolerance[J].BMC plant biology,2012,12(1):118.
17.Yang G,Wang Y,Xia D,et al.Overexpression of a GST gene(ThGSTZ1) fromTamarixhispidaimproves drought and salinity tolerance by enhancing the ability to scavenge reactive oxygen species[J].Plant Cell,Tissue and Organ Culture(PCTOC),2014,117(1):99-112.
18.Li L,Yi H.Effect of sulfur dioxide on ROS production,gene expression and antioxidant enzyme activity inArabidopsisplants[J].Plant Physiology and Biochemistry,2012,58(3):46-53.
19.Liu D,Chen X,Liu J,et al.The rice ERF transcription factor OsERF922 negatively regulates resistance toMagnaportheoryzaeand salt tolerance[J].Journal of experimental botany,2012,63(10):3899-3911.
20.Diédhiou C J,Popova O V,Dietz K J,et al.The SUI-homologous translation initiation factor eIF-1 is involved in regulation of ion homeostasis in rice[J].Plant Biology,2008,10(3):298-309.
ReactiveOxygenMetabolismoftheTheIF1ATransgenicTobaccounderMethylViologenStress
ZHAO Yu-Lin1YANG Gui-Yan1,2YU Li-Li1GUO Yu-Cong1ZHAO Zhen1GAO Cai-Qiu1*
(1.State Key Laboratory of Tree Genetics and Breeding,Northeast Forestry University,Harbin 150040;2.College of Forestry,Northwest Agriculture & Forestry University,Yangling 712100)
Eukaryotic translation initiation factor eIF1 involved abiotic stress regulation in plant. Previous studies showed that overexpressedTheIF1Agene fromTamarixhispidaimproved drought and salt resistance of genetically modified plants. We further studied the function ofTheIF1Aresponse to methyl viologen(MV). The results of histochemical stainning showed that ROS were less accumulated in leaves, guard cells and root tips of theTheIF1Atransgenic lines than WT tobacco under MV stress. The H2O2content in transgenic lines were also less than WT under MV stress. Accordingly, the CAT and POD activity in transgenic lines were obviously higher than WT under MV stress. Therefore,TheIF1Acould improve plant oxidative stress resistance by regulating the protecting enzymes activity to increase the ROS scavenging ability.
Tamarixhispida;methyl viologen;ROS metabolism;TheIF1A
东北林业大学青年拔尖人才支持计划(PYTT-1213-09);教育部“新世纪优秀人才支持计划”(NCET-13-0709)
赵玉琳(1989—),女,硕士研究生,主要从事林木遗传育种研究。
* 通信作者:E-mail:gaocaiqiu@nefu.edu.cn
2015-07-28
Q943.2
A
10.7525/j.issn.1673-5102.2016.01.018

