响应面法优化荞麦茎中芦丁的提取工艺
李白存
(陕西学前师范学院 生物工程研究所,陕西 西安 710100)
响应面法优化荞麦茎中芦丁的提取工艺
李白存
(陕西学前师范学院 生物工程研究所,陕西 西安 710100)
以荞麦茎为原料,研究芦丁的最佳提取工艺。通过单因素实验及响应面法实验考察了料液比、提取温度、乙醇体积分数、提取时间4个因素对芦丁提取量的影响。结果表明,各因素对芦丁提取量的影响大小依次为:料液比>提取温度>乙醇体积分数>提取时间;荞麦茎中芦丁的最佳提取工艺条件为:料液比1∶22(g∶mL)、提取温度65 ℃、乙醇体积分数60%、提取时间2.0 h,在该条件下,芦丁提取量达到6.752 mg·(100 g)-1。
荞麦茎;芦丁;提取工艺;响应面法;优化
荞麦(buckwheat)是蓼科(polygonaceae)荞麦属(Fagopyrum)植物,主要有苦荞和甜荞两个栽培品种,具有生长周期短、适应性强的特点,是很好的救灾补种及填闲作物[1]。荞麦营养丰富,其籽粒、茎、叶、花中的蛋白质、脂肪酸、维生素和矿物质等营养元素的含量都高于小麦、大米和玉米等大宗作物。此外,荞麦中还含有其它禾谷类作物含量少或不含的芦丁物质等[2-3]。
芦丁,又名芸香甙、紫槲成甙,广泛存在于植物中。如芸香、苦荞麦、槐花蕾、楸树叶、蒲公英、番茄茎、赤豆等均含有丰富的芦丁,尤以槐花蕾和苦荞麦中含量最高[4]。芦丁属黄酮类化合物,具有凉血止血、清肝泻火、消炎抑菌、抗氧化及降血压等作用[5],能降低毛细血管通透性和脆性,保持及恢复毛细血管的正常弹性[6]。
邵美红等[7]研究发现,荞麦茎叶中也含有较高的芦丁类物质。我国荞麦资源丰富,在部分地区已成为优势农作物之一。但是,长期以来仅有传统荞麦食品加工生产,荞麦茎叶一直被作为饲料和秆肥,甚至丢弃,未得到高价值利用。鉴于此,作者以荞麦茎为原料,通过单因素实验和响应面法实验优化荞麦茎中芦丁的提取工艺,以期为荞麦茎资源化利用提供依据。
1 实验
1.1材料、试剂与仪器
荞麦茎,陕西淳化福基农业科技贸易有限责任公司。
芦丁标准品,上海沪宇生物试剂有限公司;无水乙醇、甲醇,天津富宇精细化工有限公司;亚硝酸钠、硝酸铝,重庆吉元化学试剂厂;氢氧化钠,天津红岩试剂厂。以上试剂均为分析纯。
FW177型高速粉碎机,郑州中原华通机械厂;电子分析天平,上海安亭电子仪器厂;752型紫外可见分光光度计,上海菁华科技仪器有限公司;DK-98-Ⅰ型电子恒温水浴锅,上海光学仪器厂。
1.2方法
1.2.1材料预处理
挑选干净的荞麦茎于60 ℃下烘干,用高速粉碎机粉碎,过50目筛后备用。
1.2.2芦丁标准曲线的绘制
1.2.2.1最大吸收波长的选择
分别配制浓度(mg·mL-1)为0、0.01、0.02、0.03、0.04、0.05的芦丁标准溶液,用紫外可见分光光度计在400~600 nm范围内扫描。以试剂空白为对照,确定最大吸收波长。结果显示:芦丁标准溶液在510 nm处有最大吸收峰,故本实验以510 nm作为测定波长[8]。
1.2.2.2芦丁标准曲线的绘制
精确称取芦丁标准品2.000 mg于100 mL容量瓶中,加入60%乙醇2.0 mL溶解,定容至刻度,即为0.20 mg·mL-1芦丁标准溶液。精密吸取芦丁标准溶液0.0 mL、0.4 mL、0.8 mL、1.2 mL、1.6 mL、2.0 mL,分别置于10 mL容量瓶中,加入5%亚硝酸钠溶液0.2 mL,摇匀后静置6 min,加入10%硝酸铝溶液0.2 mL,摇匀后静置6 min,加入4%氢氧化钠溶液2.0 mL,再加入60%乙醇定容至刻度,摇匀,静置15 min。在510 nm处测定吸光度,以芦丁浓度(c)为横坐标、吸光度(A)为纵坐标绘制标准曲线。
1.2.3芦丁提取量的测定
准确吸取提取液1.0 mL,放入10 mL容量瓶中,加入60%乙醇2.0 mL、5%亚硝酸钠溶液0.5 mL,摇匀后静置6 min,加入10%硝酸铝溶液0.5 mL,摇匀后静置6 min,加入4%氢氧化钠溶液4.0 mL,再加入60%乙醇定容至刻度,摇匀,静置15 min。于510 nm处测定吸光度。根据标准曲线方程计算提取液中芦丁浓度,按下式计算芦丁的提取量[mg·(100 g)-1]。
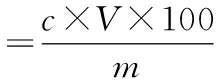
式中:c为提取液中芦丁的浓度,mg·mL-1;V为提取液的定容体积,mL;m为荞麦茎样品质量,g。
1.2.4单因素实验
1.2.4.1料液比对芦丁提取的影响
准确称取荞麦茎样品5.000 g,放入具塞三角瓶中,分别按料液比1∶10、1∶15、1∶20、1∶25、1∶30(g∶mL,下同)加入60%乙醇,60 ℃水浴浸提1 h后于510 nm处测定吸光度,根据标准曲线方程计算芦丁提取量,考察料液比对芦丁提取的影响。
1.2.4.2提取温度对芦丁提取的影响
准确称取荞麦茎样品5.000 g,放入具塞三角瓶中,按料液比1∶20加入60%乙醇,分别放入55 ℃、60 ℃、65 ℃、70 ℃、75 ℃水浴浸提1 h后于510 nm处测定吸光度,根据标准曲线方程计算芦丁提取量,考察提取温度对芦丁提取的影响。
1.2.4.3乙醇体积分数对芦丁提取的影响
准确称取荞麦茎样品5.000 g,放入具塞三角瓶中,按料液比1∶20加入体积分数分别为40%、50%、60%、70%、80%的乙醇,60 ℃水浴浸提1 h后于510 nm处测定吸光度,根据标准曲线方程计算芦丁提取量,考察乙醇体积分数对芦丁提取的影响。
1.2.4.4提取时间对芦丁提取的影响
准确称取荞麦茎样品5.000 g,放入具塞三角瓶中,按料液比1∶20加入60%乙醇,在60 ℃水浴分别浸提1.0 h、1.5 h、2.0 h、2.5 h、3.0 h后于510 nm处测定吸光度,根据标准曲线方程计算芦丁提取量,考察提取时间对芦丁提取的影响。
1.2.5响应面法实验
根据单因素实验结果,选择提取时间(A)、乙醇体积分数(B)、料液比(C)、提取温度(D)4个因素,以芦丁提取量为响应值,用Design Expert 8.0软件,按Box-Behnken设计4因素3水平响应面法实验,进一步确定最优提取工艺。响应面法实验的因素与水平见表1。
2 结果与讨论
2.1芦丁标准曲线(图1)
由图1可知,芦丁标准曲线方程为A=0.02611c-0.002707,R2=0.99974。
表1 响应面法实验的因素与水平
Tab.1Factors and levels of response surface methodology

水平因素A.提取时间hB.乙醇体积分数%C.料液比g∶mLD.提取温度℃-11.5501∶156002.0601∶206512.5701∶2570
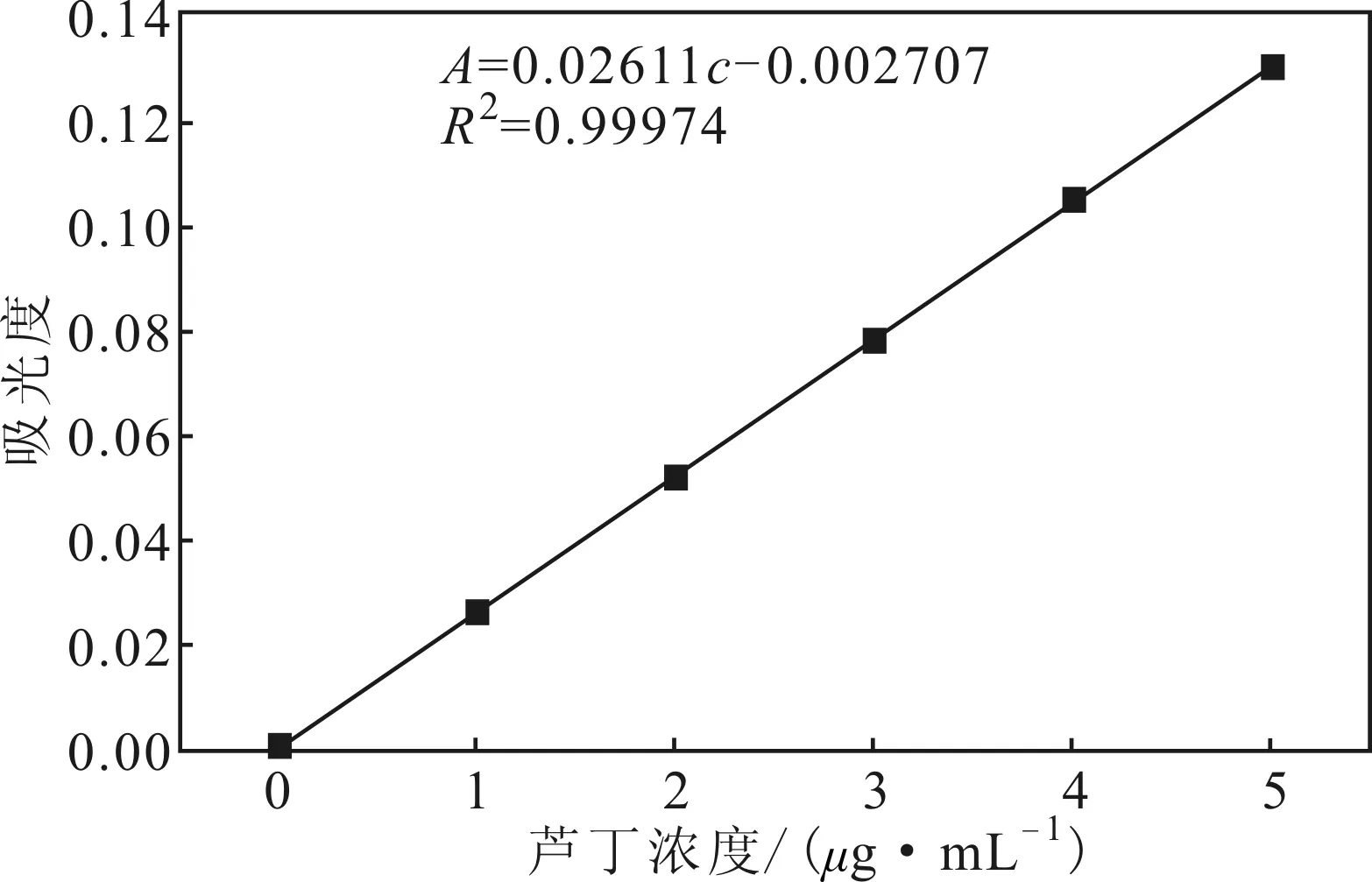
图1 芦丁标准曲线Fig.1 Standard curve of rutin
2.2单因素实验结果
2.2.1料液比对芦丁提取的影响(图2)
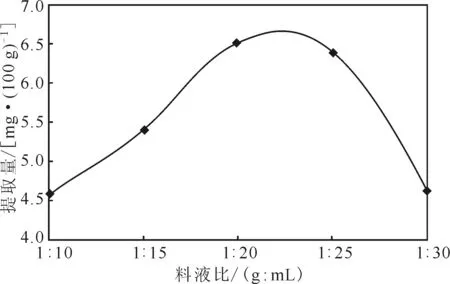
图2 料液比对芦丁提取的影响Fig.2 Effect of solid-liquid ratio on extraction of rutin
由图2可知,荞麦茎中芦丁提取量随着提取溶剂用量的增加先升高后降低,在料液比达到1∶20时,芦丁提取量达到最高。这是因为,乙醇用量过多,乙醇与荞麦茎有效接触率降低,影响了有效成分溶出,导致芦丁提取量降低,且增加乙醇用量会增加提取成本。故选择料液比1∶20作为响应面法实验的中心条件。
2.2.2提取温度对芦丁提取的影响(图3)
由图3可知,随着提取温度的升高,芦丁提取量先升高后降低,在提取温度达到65~70 ℃时,提取量较高。这是因为,提取温度升高加速了芦丁的扩散及溶解,提取量相应升高;但提取温度过高会导致芦丁氧化,
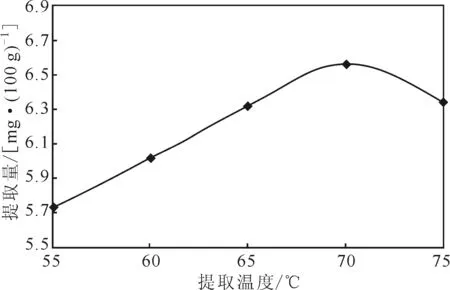
图3 提取温度对芦丁提取的影响Fig.3 Effect of extraction temperature on extraction of rutin
提取量相应降低。因此,选择提取温度65~70 ℃作为响应面法实验的中心条件。
2.2.3乙醇体积分数对芦丁提取的影响(图4)
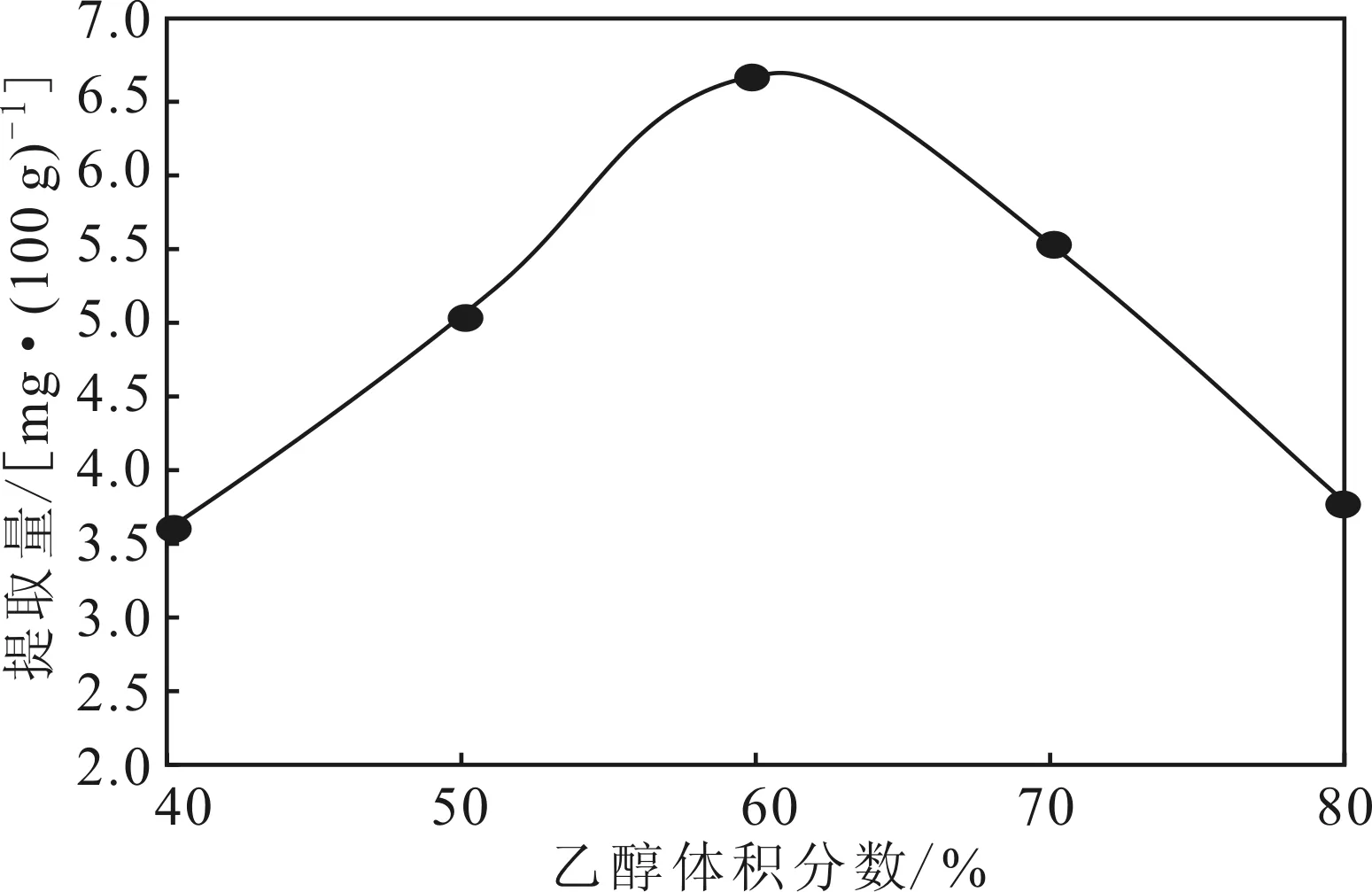
图4 乙醇体积分数对芦丁提取的影响Fig.4 Effect of ethanol volume fraction on extraction of rutin
由图4可知,随着乙醇体积分数的增加,芦丁提取量先升高后降低,在乙醇体积分数为60%时芦丁提取量达到最高。这是因为,当乙醇体积分数增加到一定值后,一些脂溶性有机物溶出量相应增加,抑制了芦丁的浸出。因此,选择乙醇体积分数60%作为响应面法实验的中心条件。
2.2.4提取时间对芦丁提取的影响(图5)
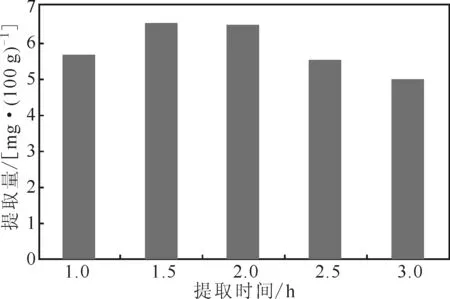
图5 提取时间对芦丁提取的影响Fig.5 Effect of extraction time on extraction of rutin
由图5可知,随着提取时间的延长,芦丁提取量先升高后降低,在提取时间为1.5~2.0 h时芦丁提取量较高。因此,选择提取时间2.0 h作为响应面法实验的中心条件。
2.3响应面法实验结果
2.3.1二次响应面回归模型与分析
响应面法实验Box-Behnken设计与结果见表2。
表2 Box-Behnken设计与结果

Tab.2 Design and results of Box-Behnken
应用Design Expert 8.0软件对表2数据进行回归分析,得到芦丁提取量(Y)与4个因素的拟合方程为:Y=6.70-1.66×10-3A-0.087B+0.22C-0.13D-0.057AB-0.22AC-0.59AD-5.0×10-3BC-0.11BD+0.08CD-0.63A2-0.37B2-0.25C2-0.77D2。
该回归模型的方差分析结果如表3所示。
表3 回归模型的方差分析

Tab.3 Variance analysis of regression model
注:**:P<0.05,差异显著;***:P<0.001,差异极显著。
2.3.2两因素交互作用比较分析
根据响应面曲线的陡峭程度及等高线的形状可分析因素间交互作用和影响程度。曲面越陡,等高线呈椭圆形,表明两因素间交互作用显著;反之,曲面平缓,等高线接近于圆形则交互作用不明显[10]。各因素间交互作用的响应面图和等高线图如图6所示。

图6各因素间的交互作用对芦丁提取量影响的响应面图和等高线图
Fig.6Response surface plots and contour plots for the effects of the interaction between each factors on extraction amount of rutin
由图6可知,料液比与提取时间、提取温度与提取时间、提取温度与乙醇体积分数、提取温度与料液比之间有显著的交互作用;而乙醇体积分数与提取时间、料液比与乙醇体积分数之间的交互作用不明显。芦丁提取量随着提取温度的升高和提取时间的延长均表现出先升高后降低的趋势(图6c)。这是因为,根据费克定律,适当延长提取时间有利于芦丁的浸出和扩散,升高提取温度有利于芦丁扩散与吸附。但是提取温度过高或提取时间过长,芦丁会发生氧化分解,导致提取量降低。
由图6f可知,随着提取温度的升高提取量先升高后降低。随着料液比的减小,即提取溶剂用量的增加,芦丁提取量不断升高;但是提取溶剂用量增加到一定程度后,芦丁提取量升幅减小,说明有效物质基本达到了分配平衡;若再增加提取溶剂用量,提取效果将不再明显,反而增加了生产成本。因此,需要选择适宜的料液比。
2.3.3最佳工艺条件验证实验
通过Design Expert 8.0软件分析计算得出最佳提取工艺条件为:提取时间1.97 h、乙醇体积分数58.88%、料液比1∶22.35、提取温度64.88 ℃,芦丁提取量预测值为6.754 mg·(100 g)-1。
结合生产实际,将各参数调整为:提取时间2.0 h、乙醇体积分数60%、料液比1∶22、提取温度65 ℃。在此条件下提取3次,荞麦茎芦丁平均提取量为6.752 mg·(100 g)-1,RSD为0.347%。表明该模型优化的提取工艺稳定性好,与实际情况拟合性良好。
3 结论
通过单因素实验和响应面法实验确定乙醇提取荞麦茎中芦丁的最佳工艺条件为:提取时间2.0 h、乙醇体积分数60%、料液比1∶22、提取温度65 ℃,此工艺下,芦丁提取量达到6.752 mg·(100 g)-1。该优化工艺能在较低温度和较短时间内提取荞麦茎中的芦丁,且提取量与模型预测值接近,工艺稳定、安全可行。本研究可为荞麦茎的开发和利用提供参考,并为相关食品和药品的开发奠定基础。
[1]汪灿,阮仁武,袁晓辉,等.荞麦茎秆解剖结构和木质素代谢及其与抗倒性的关系[J].作物学报,2014,40(10):1846-1856.
[2]文平,陈进红.荞麦芦丁的研究进展[J].中国粮油学报,2006,21(3):107-111.
[3]JIANG P,BURCZYNSKI F,CAMPBELI C,et al.Rutin and flavonoid contents in three buckwheat speciesFagopyrumesculerrtum,F.tataricum,andF.homotropicumand their protective effects against lipid peroxidation[J].Food Research International,2007,40(3):356-364.
[4]李裕,刘有智.苦荞麦中提取芦丁的工艺研究[J].华北工学院学报,2002,23(2):130-132.
[5]张宝善,陈锦屏,吴丽花.红枣芦丁提取工艺的研究[J].陕西师范大学学报(自然科学版),2003,31(1):89-93.
[6]杨德全,叶建阳,刘鸿云,等.从苦荞麦中提取芦丁的研究[J].延安大学学报(自然科学版),1997,16(4):69-71.
[7]邵美红,林兵,孙加焱,等.不同品种苦荞麦不同器官总黄酮含量的比较分析[J].植物资源与环境学报,2011,20(1):86-87.
[8]魏彩霞,谢俊峰,高媛媛,等.槐米中芦丁的超声辅助提取工艺研究[J].中国药业,2010,19(7):36-37.
[9]栾庆祥,赵杨,周欣,等.单因素试验结合响应面分析法优化杜仲最佳提取工艺[J].药物分析杂志,2013,33(5):859-865.
[10]林建原,季丽红.响应面优化银杏叶中黄酮的提取工艺[J].中国食品学报,2013,13(2):83-90.
Optimization of Extraction Process of Rutin from Buckwheat Straw by Response Surface Methodology
LI Bai-cun
(InstituteofBio-Engineering,ShaanxiXueqianNormalUniversity,Xi′an710100,China)
Theextractionprocessofrutinwasoptimizedusingbuckwheatstrawasarawmaterial.Effectsoffourfactorsincludingsolid-liquidratio,extractiontemperature,ethanolvolumefractionandextractiontimeonextractionamountofrutinwereinvestigatedbysinglefactorexperimentandresponsesurfacemethodology.Resultsindicatedthat,factorsinfluencingtherutinextractionamountwereintheorderasfollows:solid-liquidratio>extractiontemperature>ethanolvolumefraction>extractiontime.Theoptimumextractionconditionsofrutinfrombuckwheatstrawwereasfollows:solid-liquidratioof1∶22(g∶mL),extractiontemperatureof65 ℃,ethanolvolumefractionof60%,andextractiontimeof2.0h.Underaboveconditions,theextractionamountofrutinreached6.752mg·(100g)-1.
buckwheatstraw;rutin;extractionprocess;responsesurfacemethodology;optimization
陕西省农业科技创新与攻关项目(2015NY041),陕西学前师范学院科研项目(2015YBKJ030)
10.3969/j.issn.1672-5425.2016.10.009
R 284.2
A
1672-5425(2016)10-0039-06
李白存.响应面法优化荞麦茎中芦丁的提取工艺[J].化学与生物工程,2016,33(10):39-44.

