一株固化珊瑚砂的巴斯德芽孢杆菌的特性研究
张 楠,方祥位,洛桑银巴,李 捷,欧益希,高菱悦
(1.后勤工程学院 国防建筑规划与环境工程系,重庆 401311;2.后勤工程学院 军事土木工程系,重庆401311;3.95526部队,西藏 拉萨 850000;4.91241部队,广西 桂平 537200;5.93668部队,北京 100005)
一株固化珊瑚砂的巴斯德芽孢杆菌的特性研究
张楠1,方祥位2,洛桑银巴3,李捷2,欧益希4,高菱悦5
(1.后勤工程学院 国防建筑规划与环境工程系,重庆 401311;2.后勤工程学院 军事土木工程系,重庆401311;3.95526部队,西藏 拉萨 850000;4.91241部队,广西 桂平 537200;5.93668部队,北京 100005)
将一株具有分解尿素能力的巴斯德芽孢杆菌在不同温度、pH值、NaCl浓度下培养,通过测定脲酶活性探讨其最适生长条件;而后将最适生长条件下培养的菌悬液用于珊瑚砂固化实验,研究其固化珊瑚砂的能力。结果表明,该巴斯德芽孢杆菌最适生长条件为:温度30~33 ℃、pH值8.0、NaCl浓度20 g·L-1;将其用于固化珊瑚砂,可使松散的珊瑚砂颗粒胶结形成具有一定强度的砂柱,但受模具限制和砂柱固化过程中渗透性的影响,砂柱各部分固化强度不一致。
巴斯德芽孢杆菌;珊瑚砂;固化;特性
珊瑚砂是热带海洋中的一种疏松多孔、质脆易碎的特殊岩土介质,主要由珊瑚碎屑和其它海洋生物碎屑组成,碳酸钙含量高达96%以上[1]。近年来,我国加大了对海洋石油、渔业资源的开发以及国防现代化的建设,迫切需要建设大型的珊瑚岛礁工程。用传统的土壤(砂土)固化方法(化学固化和物理固化)固化远离陆地的珊瑚砂时,会遇到机械设备匮乏、原材料运输困难、施工环境差、破坏岛礁生态环境等问题,而微生物固化能够克服这些缺点,是一种经济环保的土壤固化方法。
微生物固化是自然界广泛发生的一种作用[2]。微生物矿物学最新研究表明,岩土中某些特定的微生物可利用尿素等有机物及钙离子源,较快地生成具有胶凝作用的碳酸钙,使松散砂土固化成为可能[3-9]。目前,对普通砂(硅砂)的微生物固化已取得一定进展,但对远离陆地、处于特殊环境(高含盐量海水)下的珊瑚砂的微生物固化需考虑盐度高、温差大等海洋环境因素,鲜有研究。
鉴于此,作者以固化珊瑚砂的巴斯德芽孢杆菌为对象,研究该菌在不同环境下的生长特性,探讨其最适生长温度、pH值、NaCl浓度,初步考察其对珊瑚砂的固化能力,拟为珊瑚砂的微生物固化提供参考。
1 实验
1.1菌种与培养基
巴斯德芽孢杆菌(Bacilluspasteurii),购于德国微生物菌种保藏中心(DSMZ)。
LB液体培养基:胰蛋白胨1 g,酵母浸出粉1 g,NaCl 2 g,蒸馏水定容至100 mL,2 mol·L-1的NaOH溶液调pH值至7.0,121 ℃高温蒸汽灭菌30 min。LB固体培养基需加入2 g琼脂粉。
LB-尿素液体培养基:在上述LB液体培养基灭菌30 min后,加入2 g尿素。LB-尿素固体培养基需加入2 g琼脂粉。
1.2菌悬液的制备
采用湿重法配制菌悬液:将巴斯德芽孢杆菌置于LB固体培养基上复活,挑取单菌落于LB液体培养基上,32 ℃、200 r·min-1振荡培养36 h,7 000 r·min-1离心5 min,去上清,称菌体湿重,用0.85%的无菌生理盐水配制质量分数为10%的菌悬液。
1.3珊瑚砂固化细菌的生长特性研究
1.3.1温度对菌株生长的影响
微生物生长的温度范围通常很宽,但有一个最适生长温度或范围。
1)适宜菌株生长的温度范围的确定
将巴斯德芽孢杆菌分区划线于LB平板上,分别置于20 ℃、30 ℃、40 ℃和50 ℃的生化培养箱中培养48 h,观察菌落的大小和数量,确定适宜菌株生长的温度范围。
2)菌株最适生长温度的确定
在上述温度范围内,选取适当的温度,取0.2 mL菌悬液加入100 mL的LB-尿素液体培养基中,于生化培养箱中静置培养48 h。采用DDS-307A型电导率仪(上海佑科仪器仪表有限公司)测定未加菌悬液时的初始电导率和培养48 h后的电导率,计算电导率变化值△K(以△K表征菌株的脲酶活性),确定菌株的最适生长温度(同时做3个平行实验,取平均值,下同)。
1.3.2pH值对菌株生长的影响
用2 mol·L-1的盐酸或2 mol·L-1的NaOH溶液将100 mL LB-尿素液体培养基的pH值分别调至6.0、7.0、8.0、9.0和10.0,加入菌悬液0.2 mL,于32 ℃、200 r·min-1振荡培养48 h,测定未加菌悬液时的初始电导率和培养48 h后的电导率,计算电导率变化值△K,确定菌株的最适生长pH值。
1.3.3NaCl浓度对菌株生长的影响
1)适宜菌株生长的NaCl浓度范围的确定
在100 mL LB-尿素液体培养基中分别加入不同质量的NaCl,使培养基中NaCl浓度(g·L-1)分别为5、25、50、75、100,加入菌悬液0.2 mL,于32 ℃、200 r·min-1振荡培养48 h,测定未加菌悬液时的初始电导率和培养48 h后的电导率,计算电导率变化值△K,确定适宜菌株生长的NaCl浓度范围。
2)菌株最适生长NaCl浓度的确定
在上述NaCl浓度范围内适当缩小考察范围,配制不同NaCl浓度的培养基,并加入0.2 mL菌悬液,于32 ℃、200 r·min-1振荡培养48 h,测定未加菌悬液时的初始电导率和培养48 h后的电导率,计算电导率变化值△K,确定菌株生长的最适NaCl浓度。
1.4珊瑚砂的微生物固化研究
1.4.1原理
产脲酶微生物可以利用环境中的尿素和钙离子源,较快地生成具有胶凝作用的碳酸钙。与一般化学作用生成的碳酸钙不同,这种微生物成因的碳酸钙材料的生成速度及强度可控,并可作为粘结剂将松散的砂粒粘结成强度及渗透性可控的人造砂砾石。
巴斯德芽孢杆菌固化珊瑚砂的原理如下[10-11]:
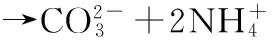
Ca2++cell(带负电的微生物细胞)→cell-Ca2+
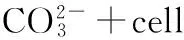
1.4.2固化过程
固化前准备:(1)将巴斯德芽孢杆菌加入pH值为8.0的LB-尿素液体培养基上,于32 ℃、200 r·min-1振荡培养48 h,备用;(2)用孔径为3.2 mm的检验筛对珊瑚砂进行筛分;(3)配制相同浓度、体积比为1∶1的尿素-氯化钙混合溶液作为粘结液;(4)用50 mL一次性注射器(内径3 cm、高11.5 cm)作为模具,按生化纤维棉-珊瑚砂-生化纤维棉依次铺设(图1)。
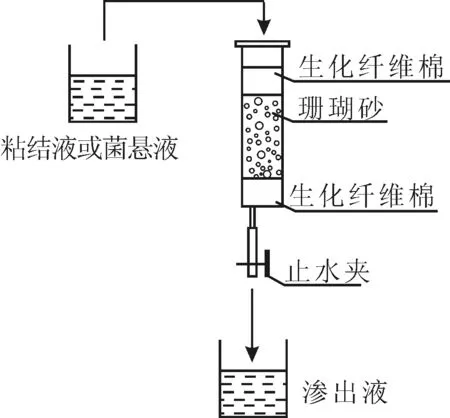
图1 珊瑚砂的微生物固化实验装置Fig.1 Equipment for biocementation of coral sand
固化:加入菌悬液,让其流过模具,使珊瑚砂充分截留细菌;加入粘结液;调节止水夹,控制粘结液以低流速流出模具,使粘结液与截留在珊瑚砂柱中的细菌充分反应,直至粘结液不再渗出;取下模具,置于恒温烘箱中烘干;取出珊瑚砂柱,观察固化效果。
2 结果与讨论
2.1珊瑚砂固化细菌的生长特性
2.1.1最适生长温度
将巴斯德芽孢杆菌分别在20 ℃、30 ℃、40 ℃和50 ℃下培养48 h。结果发现,菌株在20 ℃、30 ℃和40 ℃下生长较好,其中在30 ℃时的菌株个体形态最大,而50 ℃下肉眼几乎看不见单菌落。因此,选择适宜菌株生长的温度范围为20~40 ℃。
为确定最适生长温度,分别在24 ℃、27 ℃、30 ℃、33 ℃、36 ℃和39 ℃下进行培养,测定电导率,并计算电导率变化值△K,考察温度对细菌脲酶活性的影响,结果见图2。
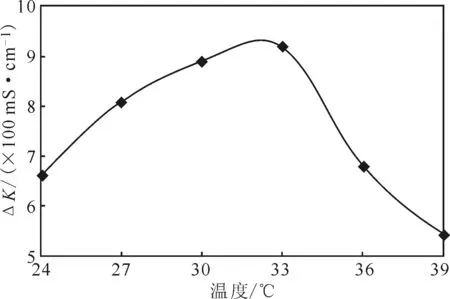
图2 温度对细菌脲酶活性的影响Fig.2 Effect of temperature on bacterial urease activity
由图2可见,随着温度的升高,△K先增大后减小,在30~33 ℃时△K达到最大值9.2;且24~30 ℃时的△K增大趋势明显比33~39 ℃的减小趋势缓和。表明,24~33 ℃比33~39 ℃更有利于巴斯德芽孢杆菌生长,而30~33 ℃最适宜巴斯德芽孢杆菌生长。因此,确定菌株的最适生长温度为30~33 ℃。
2.1.2最适生长pH值
pH值对细菌脲酶活性的影响见图3。
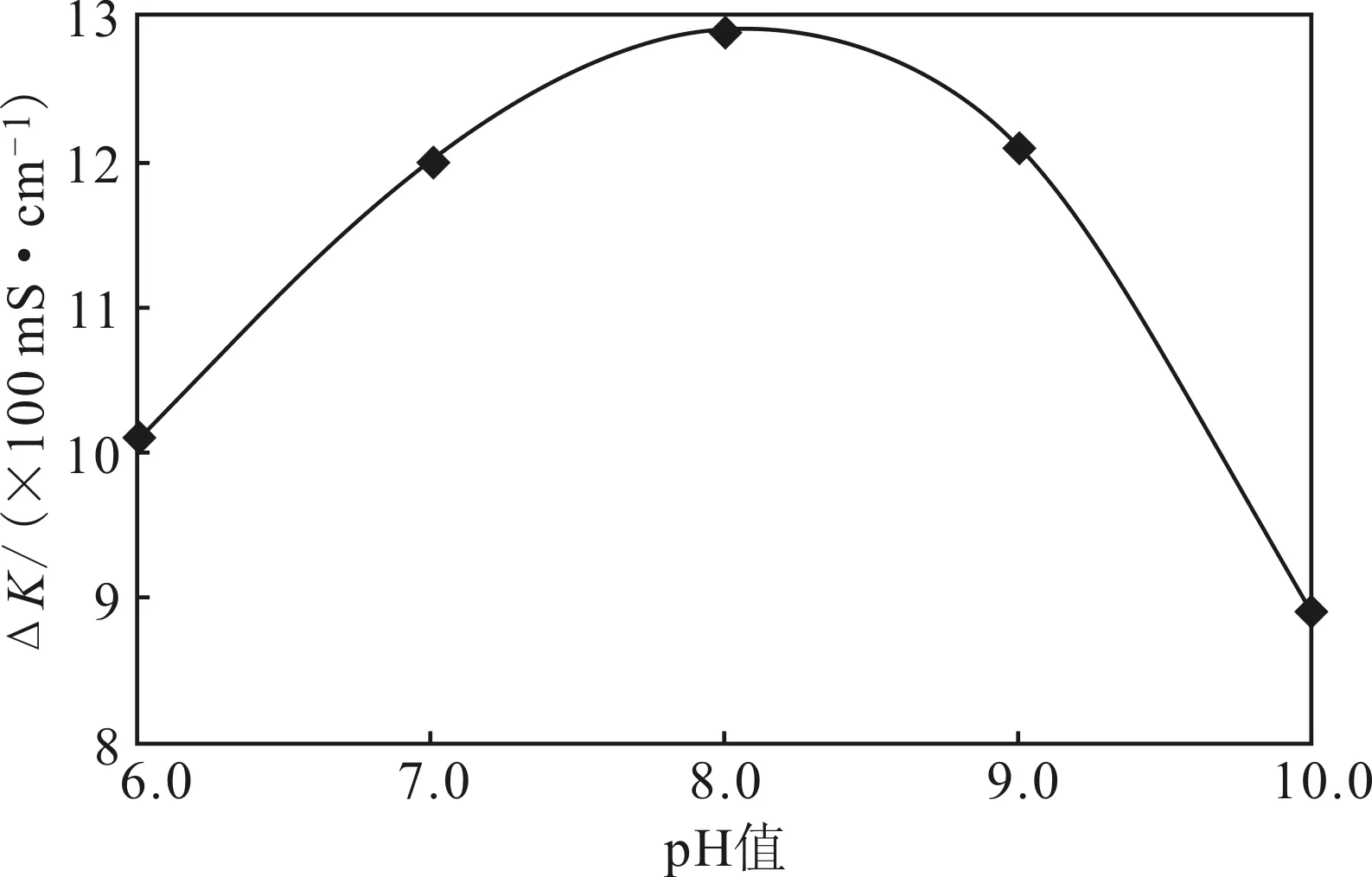
图3 pH值对细菌脲酶活性的影响Fig.3 Effect of pH value on bacterial urease activity
由图3可见,随着pH值的升高,△K先增大后减小,在pH值为8.0时△K达到最大值12.9。因此,确定菌株的最适生长pH值为8.0。
2.1.3最适生长NaCl浓度
在不同NaCl浓度的培养基中加入菌悬液,于32 ℃、200 r·min-1振荡培养48 h,考察NaCl浓度对细菌脲酶活性的影响,结果见图4。
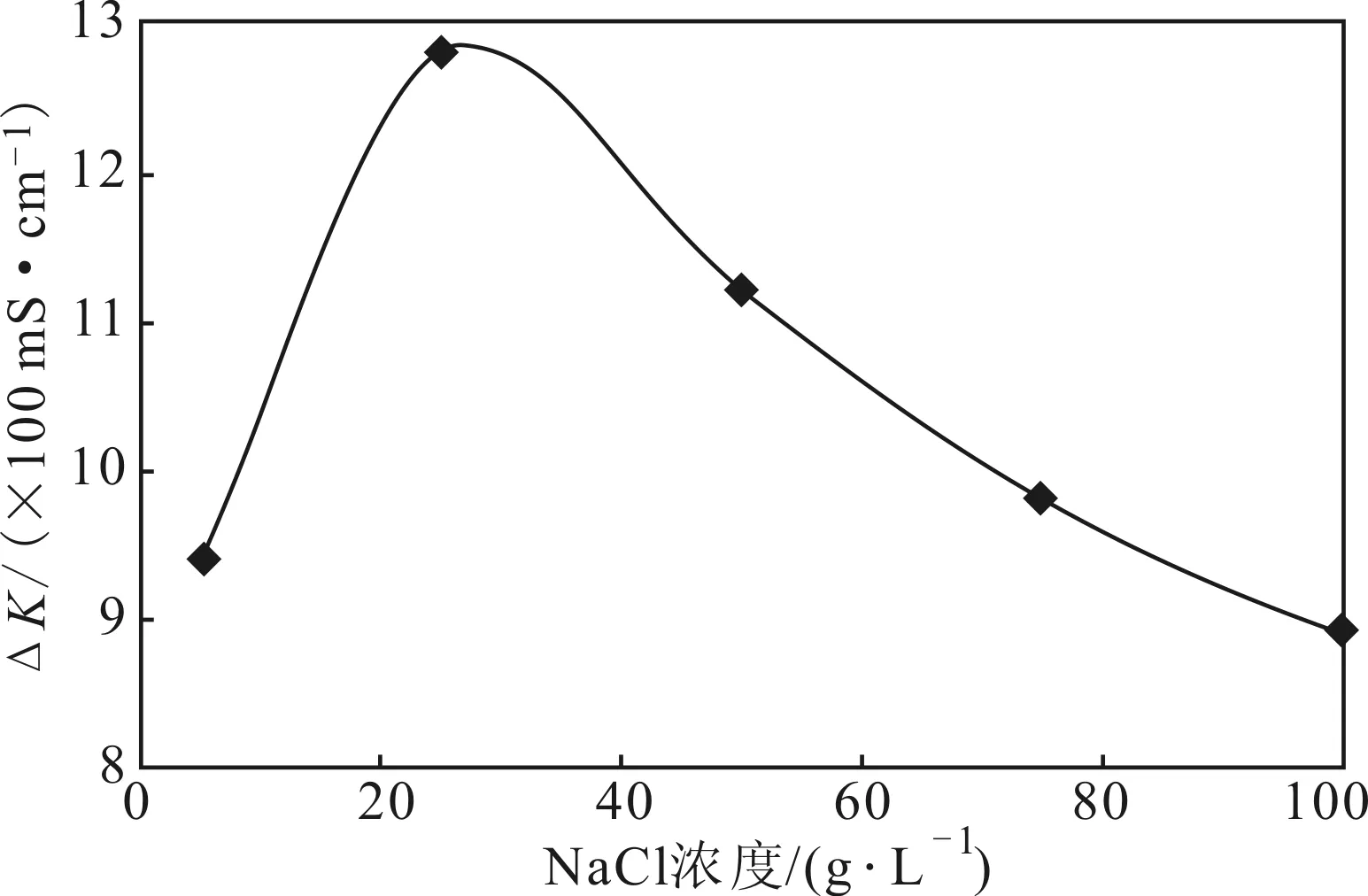
图4 NaCl浓度对细菌脲酶活性的影响Fig.4 Effect of NaCl concentration on bacterial urease activity
由图4可见,随着NaCl浓度的增加,△K先快速增大后缓慢减小,在NaCl浓度为25 g·L-1时达到最大值12.8;且在20~60 g·L-1范围内的△K均较大。因此,选择20~60 g·L-1为适宜菌株生长的NaCl浓度范围。
为确定菌株的最适生长NaCl浓度,分别在NaCl浓度(g·L-1)为20、30、40、50、60的培养基中培养,考察NaCl浓度对细菌脲酶活性的影响,结果见图5。
由图5可见,当NaCl浓度从20 g·L-1逐渐增加到60 g·L-1时,△K逐渐减小,在NaCl浓度为20~
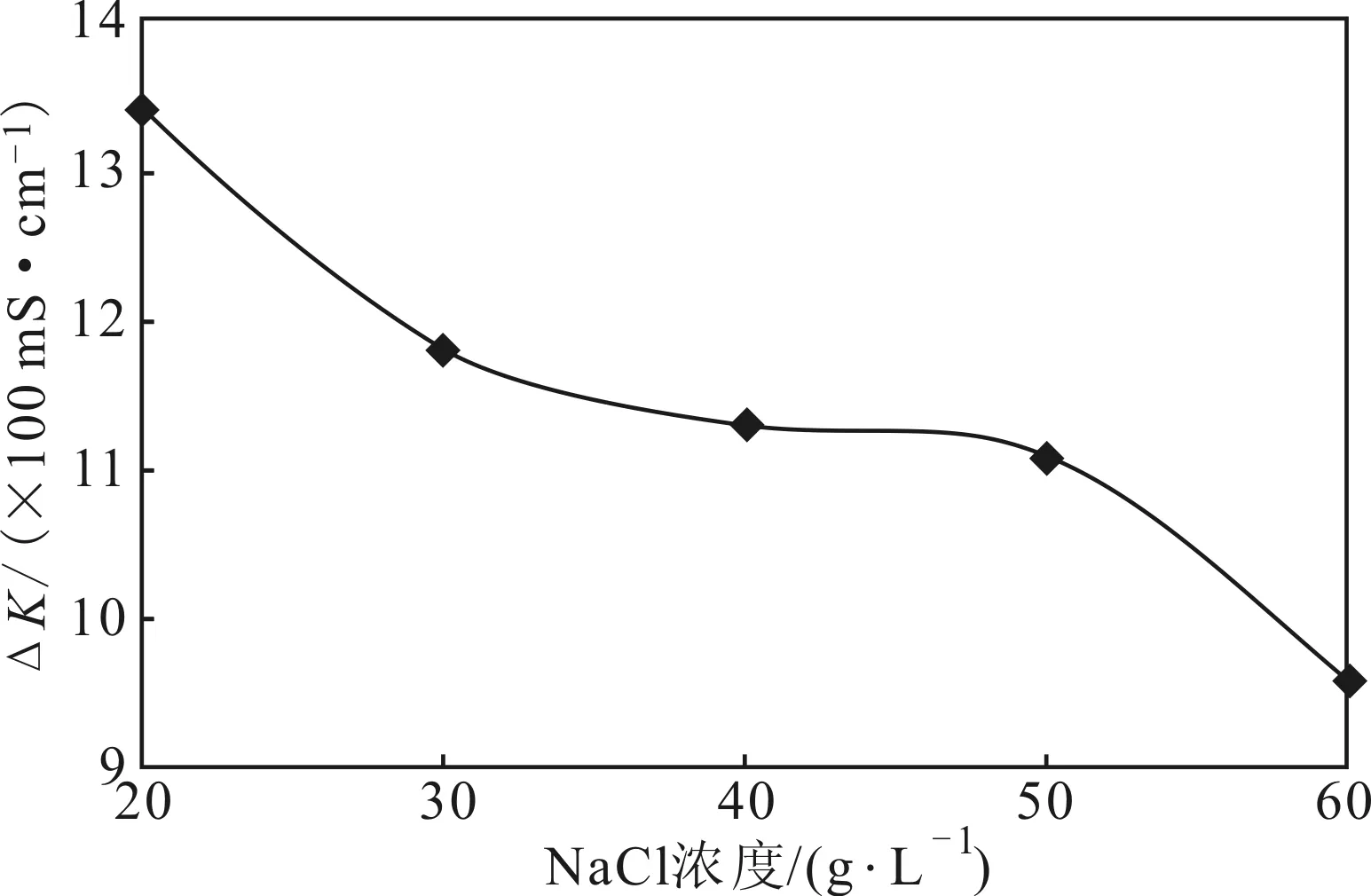
图5 最适生长NaCl浓度的确定Fig.5 Determination of optimal NaCl concentration
50 g·L-1时,△K减幅较小;在NaCl浓度超过50 g·L-1后,△K减幅明显增大。因此,确定菌株生长的最适NaCl浓度为20 g·L-1。
2.2珊瑚砂的微生物固化效果
经过72 h固化,将砂柱模具烘干,取出珊瑚砂柱(图6),观察固化效果。

图6 微生物固化珊瑚砂柱Fig.6 Biocementation column of coral sand
为了便于砂柱直立,图中砂柱与在模具中实际固化时的方向相反。由图6可见,通过多次浇注固化,原本松散的珊瑚砂颗粒最终胶结形成具有一定强度的砂柱。砂柱的下半部分(实际位于模具中的上半部)明显更加密实、纹路更少、空隙更小,固化效果更好。这可能是因为,加入菌悬液时,上半部快速反应并固化,使得上半部的珊瑚砂空隙变小,降低了粘结液在砂柱中的渗透性,导致下半部因碳酸钙含量不足而使砂柱强度降低。因此,为获得密实而均匀的珊瑚砂柱,须在后续实验中设计并完善模具,以提高珊瑚砂柱的固化强度。
3 结论
通过测定脲酶活性,确定巴斯德芽孢杆菌的最适生长条件为:温度30~33 ℃、pH值8.0、NaCl浓度20 g·L-1。将巴斯德芽孢杆菌在上述最适生长条件下培养后,用于珊瑚砂固化实验,结果表明,经多次浇注固化后,松散的珊瑚砂颗粒最终胶结形成具有一定强度的砂柱,但受模具限制和砂柱固化过程中渗透性影响,砂柱各部分固化强度不一致。因此,为获得密实而均匀的珊瑚砂柱,须在后续实验中设计并完善模具,提高珊瑚砂柱的固化强度。该研究具有重要的工程实用价值和广阔的应用前景。
[1]孙宗勋.南沙群岛珊瑚砂工程性质研究[J].热带海洋,2000,19(2):1-8.
[2]崔福斋.生物矿化[M].北京:清华大学出版社,2007:1.
[3]RODRIGUEZ-NAVARRO C,RODRIGUEZ-GALLEGO M,BEN C K,et al.Conservation of ornamental stone byMyxococcusxanthus-induced carbonate biomineralization[J].Applied and Environmental Microbiology,2003,69(4):2182-2193.
[4]RODRIGUEZ-NAVARRO C,JIMENEZ-LOPEZ C,RODRIGUEZ-NAVARRO A,et al.Bacterially mediated mineralization of vaterite[J].Geochimica et Cosmochimica Acta,2007,71(5):1197-1213.
[5]JIMENEZ-LOPEZ C,JROUNDI F,PASCOLINI C,et al.Consolidation of quarry calcarenite by calcium carbonate precipitation induced by bacteria activated among the microbiota inhabiting the stone[J].International Biodeterioration & Biodegradation,2008,62(4):352-363.
[6]van PASSEN L A,DAZA C M,STAAL M,et al.In situ soil reinforcement by microbial denitrification[C]//Proceedings of 1stInternational Conference BGCE.Netherlands:TU Delft,2008:124-133.
[7]KARATAS I,KAVAZANJIAN E,RITTMANN B E.Microbially induced precipitation of calcite usingPseudomonasdenitrificans[C]//Proceedings of 1stInternational Conference BGCE.Netherlands:TU Delft,2008:58-66.
[8]CASTANIER S,METAYER-LEVREL G L,PERTHUISOT J P.Ca-Carbonates precipitation and limestone genesis:the microbiogeologist point of view[J].Sedimentary Geology,1999,126(1/2/3/4):9-23.
[9]MÉTAYER-LEVRELA G L,CASTANIER S,ORIAL G,et al.Applications of bacterial carbonatogenesis to the protection and regeneration of limestones in buildings and historic patrimony[J].Sedimentary Geology,1999,126(1):25-34.
[10]GOLLAPUDI U K,KNUTSON C L,BANG S S,et al.A new method for controlling leaching through permeable channels[J].Chemosphere,1995,30(4):695-705.
[11]STOCKS-FISCHER S,GALINAT J K,BANG S S.Microbiological precipitation of CaCO3[J].Soil Biology and Biochemistry,1999,31(11):1563-1571.
Characteristics of aBacilluspasteuriiStrain for Cementation of Coral Sand
ZHANG Nan1,FANG Xiang-wei2,LUOSANG Yin-ba3,LI Jie2,OU Yi-xi4,GAO Ling-yue5
(1.DepartmentofNationalDefenseArchitecturePlanning&EnvironmentalEngineering,LogisticEngineeringUniversity,Chongqing401311,China;2.DepartmentofCivilEngineering,LogisticEngineeringUniversity,Chongqing401311,China;3.Unit95526,Lhasa850000,China;4.Unit91241,Guiping537200,China;5.Unit93668,Beijing100005,China)
TheoptimumgrowthconditionsofaBacillus pasteuriistrainthathadtheabilitytodecomposeureawerestudiedbymeasuringtheureaseactivityatdifferenttemperatures,pHvaluesandNaClconcentrations.TestsofcementationofcoralsandbyBacillus pasteuriiculturedundertheoptimumgrowthconditionswereconducted.Resultsindicatedthat,theoptimumgrowthconditionsofBacillus pasteuriiwereasfollows:temperatureof30~33 ℃,pHvalueof8.0,andNaClconcentrationof20g·L-1.AfterbiocementationofcoralsandbyBacillus pasteuriiculturedundertheoptimumgrowthconditions,loosecoralsandparticleswerebondedtoformsandcolumnswithcertainstrength.Duetothelimitationsoftestmouldandpermeabilityofsandcolumnincementingprocess,thestrengthsofdifferentpartsofsolidifiedsandcolumnwereinconsistent.
Bacillus pasteurii;coralsand;cementation;characteristics
国家自然科学基金资助项目(51479208,11272354),总后勤部基建营房部资助项目(CY114C022)
10.3969/j.issn.1672-5425.2016.10.005
X 172TU 411
A
1672-5425(2016)10-0023-04
张楠,方祥位,洛桑银巴,等.一株固化珊瑚砂的巴斯德芽孢杆菌的特性研究[J].化学与生物工程,2016,33(10):23-26.

