常压室温等离子体诱变选育生物表面活性剂高产菌株
郝建安,张晓青,姜天翔,杨 波,司晓光,杜 瑾,张爱君,张雨山,王 静
(国家海洋局天津海水淡化与综合利用研究所,天津 300192)
常压室温等离子体诱变选育生物表面活性剂高产菌株
郝建安,张晓青,姜天翔,杨波,司晓光,杜瑾,张爱君,张雨山,王静
(国家海洋局天津海水淡化与综合利用研究所,天津 300192)
采用常压室温等离子体诱变技术对Rhodococcussp. SY095菌株进行诱变,通过排油圈法与表面张力测定筛选到2株高产生物表面活性剂的突变株220-7与300-3。与野生型菌株相比,突变株220-7与300-3发酵液的最佳表面张力分别降至32.8 mN·m-1与28.6 mN·m-1,发酵液最佳表面活性分别提高14.4%和25.3%;连续传代实验结果表明,这2株突变株具有良好的遗传稳定性。
常压室温等离子体;Rhodococcussp. SY095;生物表面活性剂
生物表面活性剂是一类由微生物产生的具有表面活性的两亲分子。与化学表面活性剂相比,生物表面活性剂除具有较高的表面活性外,还具有热稳定性、可生物降解性等优点[1]。近年来,生物表面活性剂已经在石油回收[2]、食品工业[3]、环境工程[4]和生物科学领域[5]展现了良好的应用前景。然而,成本高一直是制约生物表面活性剂进一步工业生产的瓶颈[6]。研究人员使用廉价培养基、优化培养条件与分离过程等来降低生产成本,但效果并不明显。
常压室温等离子体(ARTP)诱变育种系统是利用氦气辉光放电产生的等离子体射流作用于微生物,引起微生物的突变[7-9],已被应用于多个领域,其突变效率高、操作方便、成本低。Wang等[10]应用ARTP技术诱导链霉菌(Streptomyces avermitilis)突变,突变株的生物活性提高了一倍。Hua等[11]应用ARTP技术,赋予耐盐的阴沟肠杆菌(Enterobacter cloacae)对石油污染盐碱土壤的生物强化能力。截至目前,绿色木霉(Trichoderma viride)[12]、产气肠杆菌(Enterobacter aerogenes)[8]、拜氏梭菌(Clostridium beijerinckii)[13]、白色链霉菌(Streptomyces albulus)[14]均成功运用ARTP技术提高了生物活性。
作者所在研究组已筛选出一株可产生物表面活性剂的红球菌SY095(Rhodococcussp.SY095),在此拟采用ARTP技术诱变该菌株,筛选高产生物表面活性剂菌株,为降低生物表面活性剂生产成本提供帮助。
1 实验
1.1菌种与培养基
红球菌SY095,自行保存,从天津塘沽海河入海口的污泥中筛选得到,其16S rDNA Genbank编号为GU184127.1。
LB液体培养基(g·L-1):蛋白胨 10,酵母粉 5,NaCl 10,pH值7.0。LB固体培养基添加1.5%~2.0%琼脂粉,1×105Pa灭菌30 min。
液体发酵培养基(g·L-1):K2HPO41,KH2PO41,MgSO4·7H2O 0.5,NH4NO31,酵母粉 0.01,大豆油2%,pH值7.5。固体发酵培养基添加1.5%~2.0%琼脂粉,1×105Pa灭菌30 min。
1.2ARTP诱变
本实验所用ARTP诱变育种系统由北京思清源生物科技有限公司提供。
取斜面保存的菌种,接种于LB固体培养基中,30 ℃培养箱中培养2 d。挑取单菌落转接到LB液体培养基中,30 ℃、160 r·min-1下培养2 d。取10 mL对数生长期菌液,6 000 r·min-1、4 ℃下离心5 min。收集菌体用10 mL无菌生理盐水冲洗2~3遍后,悬浮于无菌生理盐水中制备菌悬液,将菌悬液浓度调至OD600=0.5~0.7(106~108个·mL-1)。
取10 μL菌悬液涂布于已灭菌的金属载片上,将载片置于载物台上,调整照射距离2 mm、氦气流量10 slpm、功率100 W[7,10],分别照射30 s、60 s、90 s、120 s、150 s、180 s、210 s、240 s、270 s、300 s、330 s。
将照射后的载片转移到装有1 mL无菌生理盐水的EP管中,振荡1~2 min,使附着在载片上的菌体洗脱到生理盐水中,形成新的菌悬液。将新菌悬液稀释至10-4、10-5、10-63个梯度,每个梯度涂布3个LB固体培养基平板,30 ℃培养箱中培养1 d。以未照射样品为参照,通过菌落计数法按下式计算致死率:

1.3突变株的筛选
将突变株转接到液体发酵培养基中,30 ℃、160 r·min-1下振荡培养72 h,发酵液进行2轮表面活性筛选。初筛采用排油圈法:取直径10 cm的培养皿,加入20 mL蒸馏水,再取5 mL液体石蜡置于蒸馏水表面,待液体石蜡在水面上形成稳定的油膜后,用移液器分别吸取500 μL不同突变株的发酵液滴在油膜中央,观察记录排油圈直径[15]。复筛采用排油圈法结合表面张力测定:使用科诺A101型表面张力仪通过白金板法测定发酵液表面张力。
1.4突变株与野生型菌株的活性对比
将突变株与野生型菌株分别接种于固体发酵培养基上,30 ℃培养箱中培养2 d。挑取单菌落接种于液体发酵培养基中,30 ℃、160 r·min-1下振荡培养2 d。将发酵液接种到液体发酵培养基(体积比1∶100)中,30 ℃、160 r·min-1下振荡培养,同步记录突变株与野生型菌株的生长曲线和表面张力曲线。
1.5突变株的遗传稳定性分析
突变株进行传代培养,测定不同传代次数下突变株发酵液的表面张力,分析突变株的遗传稳定性。
2 结果与讨论
2.1照射时间的确定
研究表明,当致死率达到90%以上时,菌株会获得高突变率[11,16]。红球菌SY095在不同照射时间下的致死率如图1所示。
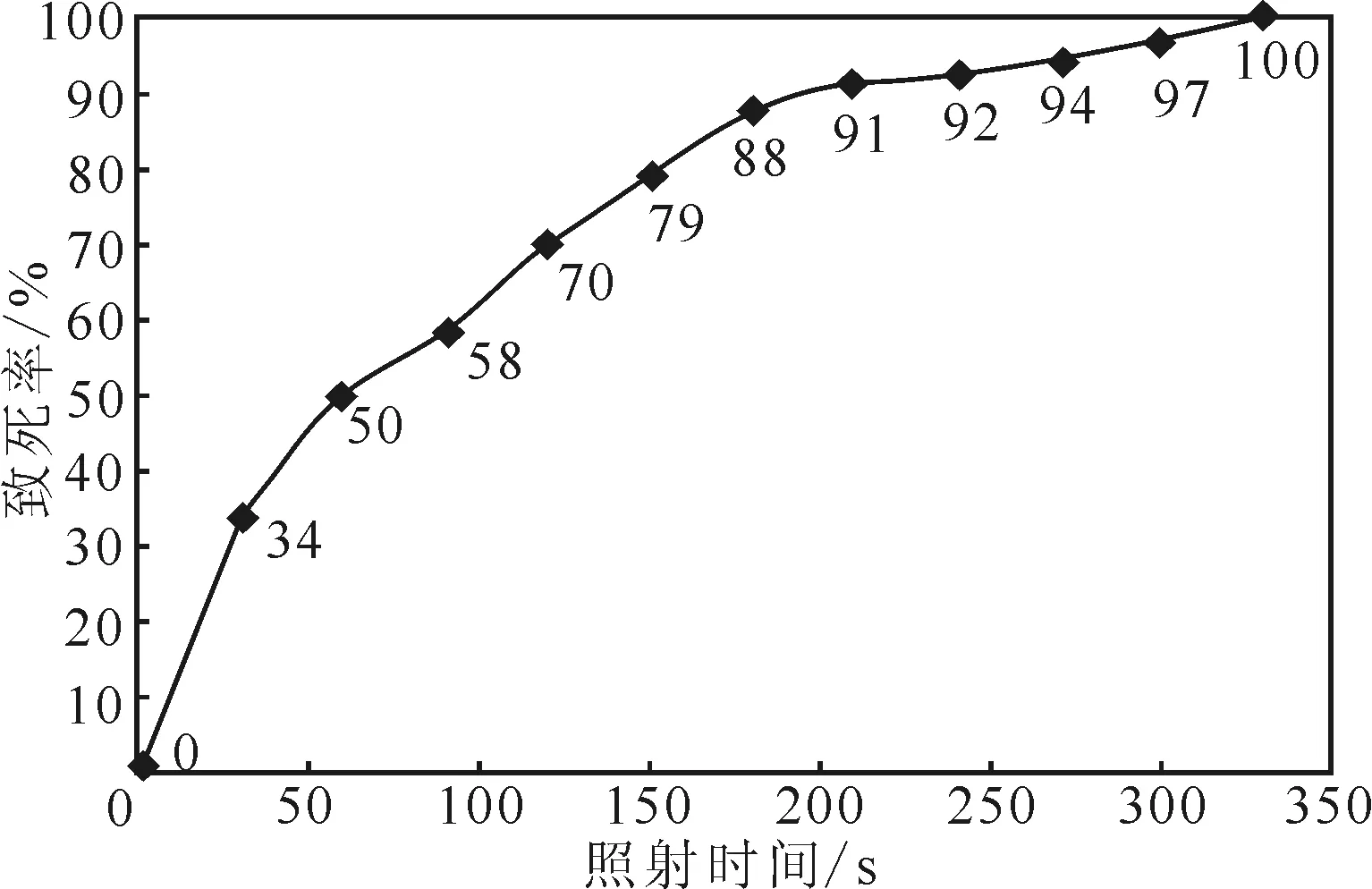
图1 红球菌SY095在不同照射时间下的致死率Fig.1 Lethality rate of Rhodococcus sp.SY095 irradiated different time
从图1可以看出,照射时间与红球菌SY095致死率之间有明显的剂量累积效应,随着照射时间的延长,致死率不断升高。当照射时间为30 s时,致死率约为34%;而照射时间为210 s时,致死率升高到91%;照射时间为330 s时,致死率达100%。因此,确定照射时间为210~330 s。
2.2生物表面活性剂高产菌株的筛选
研究表明,排油圈直径与表面张力间呈负相关关系,排油圈直径与生物表面活性剂的产量是相关的[17]。本实验中,照射时间为210~330 s时,共获得133株突变株;采用排油圈法初筛获得34株排油圈直径大于5 cm的菌株。为了避免误差,复筛使用排油圈法结合表面张力测定筛选生物表面活性剂高产菌株,结果如图2所示。
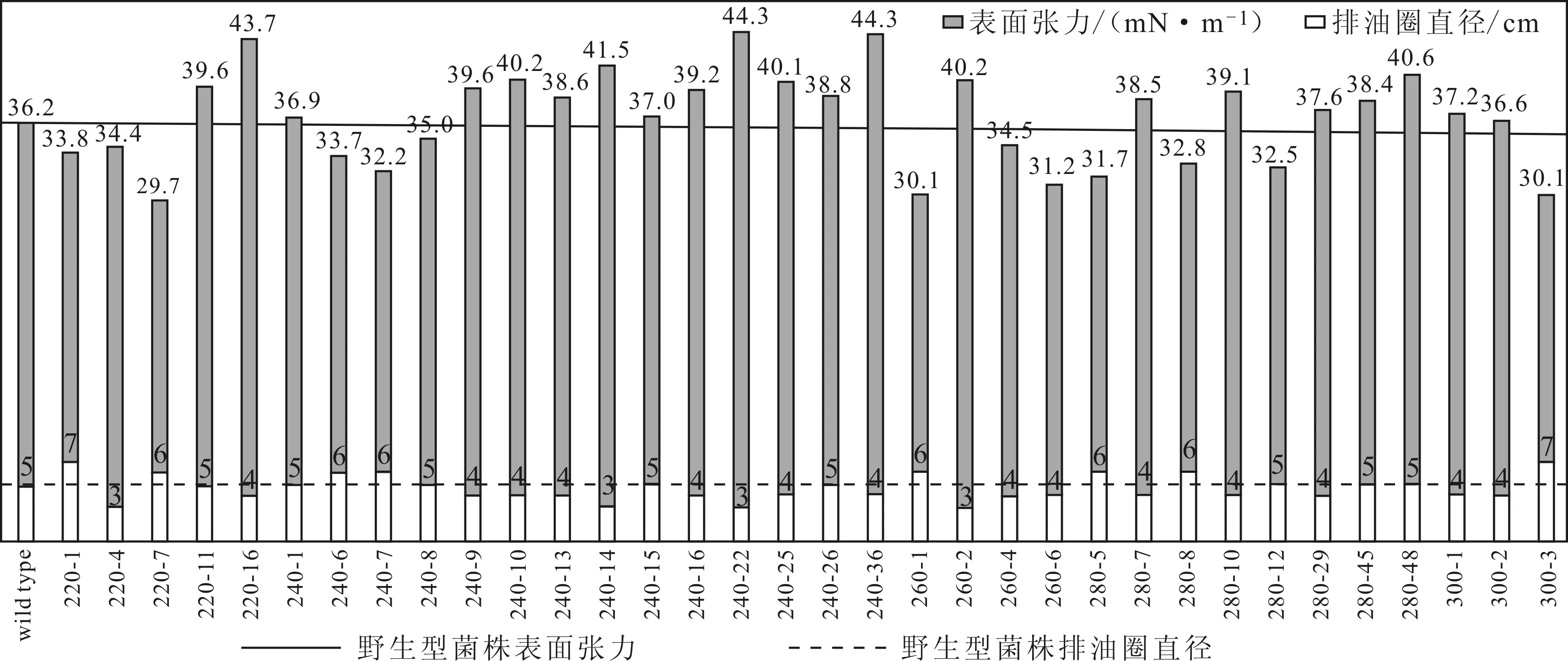
图2 突变株的筛选Fig.2 Screening of mutants
从图2可以看出,有13株突变株发酵液的表面张力低于野生型菌株,有8株突变株发酵液的排油圈直径大于野生型菌株。突变株220-7与300-3发酵液的表面张力分别为29.7 mN·m-1、30.1 mN·m-1,排油圈直径分别为6 cm、7 cm,具有最佳表面活性。
2.3突变株与野生型菌株的活性对比
突变株220-7、300-3与野生型菌株的生长曲线和表面张力曲线见图3。
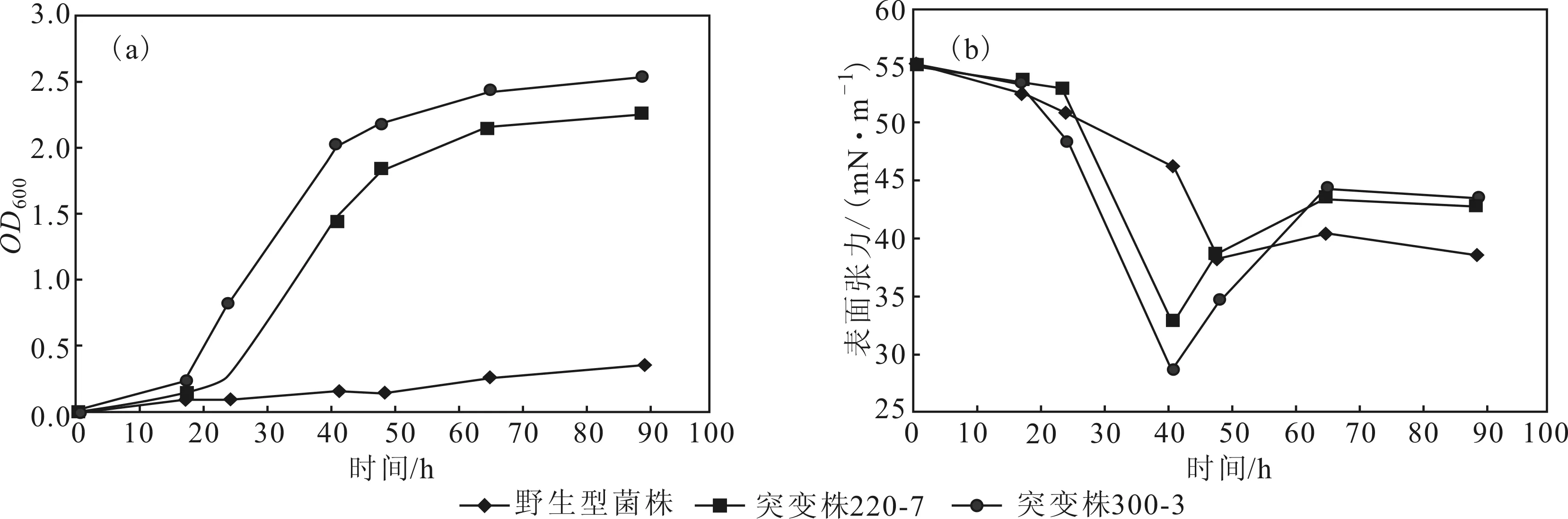
图3 生长曲线(a)和表面张力曲线(b)Fig.3 Growth curves(a) and surface tension curves(b)
从图3a可看出,突变株比野生型菌株生长更为迅速,突变株与野生型菌株几乎同时进入对数生长期,之后,突变株的生长速度明显加快。从图3b可看出,发酵液的表面张力与菌株的生长状态相关;当菌株进入对数生长期时,表面活性物质大量积累,野生型菌株、突变株220-7与300-3的发酵液最佳表面张力分别达到38.3 mN·m-1、32.8 mN·m-1、28.6 mN·m-1;与同期野生型菌株相比,突变株220-7与300-3发酵液的最佳表面活性分别提高14.4%、25.3%。
2.4遗传稳定性分析
通过连续传代培养来分析突变株的遗传稳定性。连续培养6代的突变株发酵液的表面张力见图4。
从图4可看出,连续培养6代,突变株产表面活性剂的能力十分稳定。表明,突变株的遗传稳定性良好。
2.5讨论
诱变是一种提高生物表面活性剂产量的常用方法。
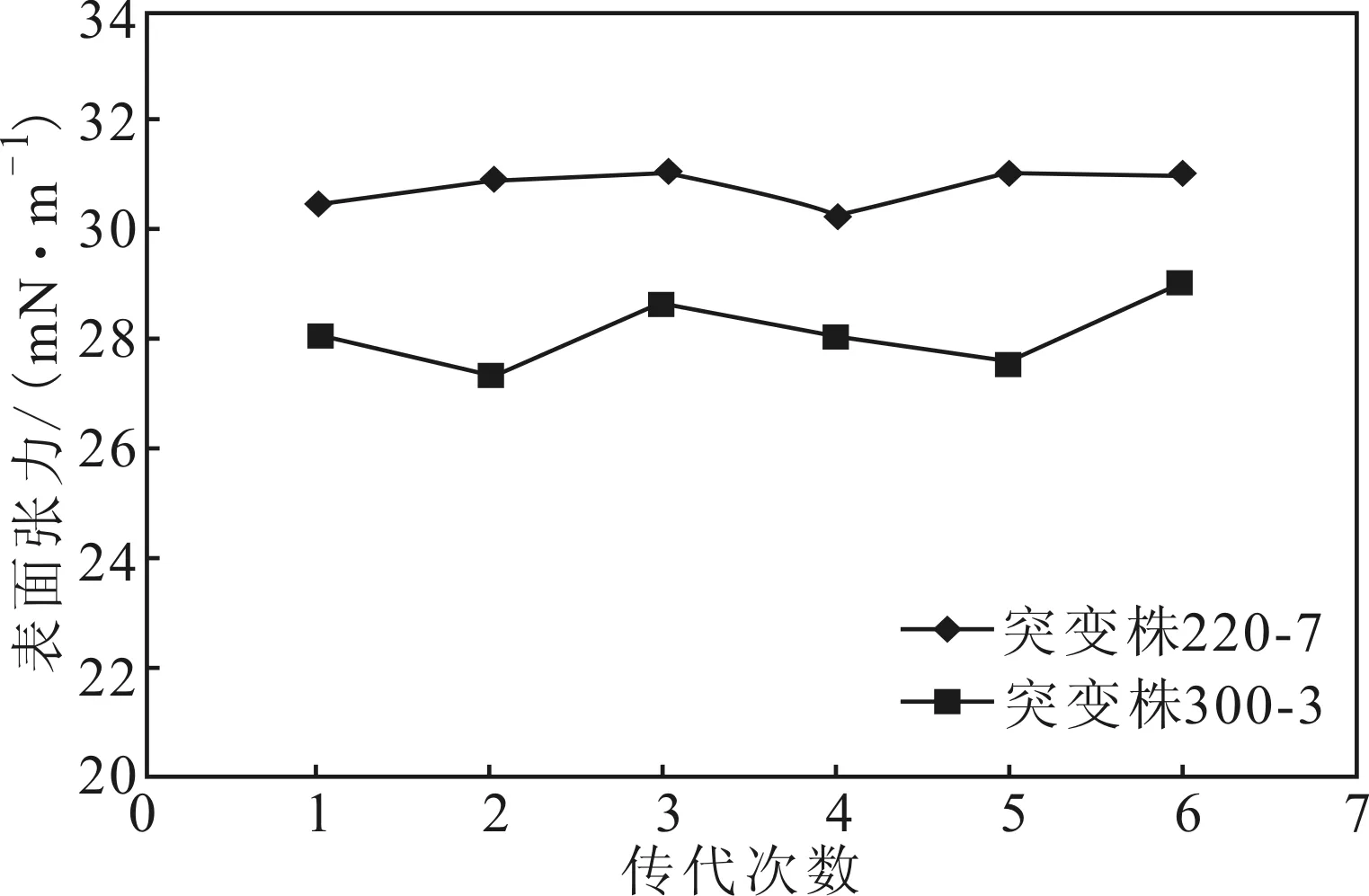
图4 突变株的遗传稳定性Fig.4 Genetic stability of mutants
Mulligan等[18]使用紫外线诱变的枯草芽孢杆菌ATCC 21332突变株的生物表面活性剂产量超过野生型3倍以上。Iqbal等[19]使用γ-射线诱导的铜绿假单胞菌EBN-8突变株的烃乳化/转换活性是原始菌株的3~4倍。Tahzibi等[20]利用N-甲基-N-硝基亚硝基胍诱变的铜绿假单胞菌突变株可产生比原始菌株多10倍的鼠李糖脂。Shabtai等[21]利用十六烷基三甲基溴化铵(CTAB)诱导的不动杆菌RAG-1突变株产高分子乳化剂Emulsan的水平明显升高。Koch等[22]利用转座子Tn5转基因诱导的铜绿假单胞菌PG201突变株可以产生比亲本高2倍的生物表面活性剂。Ohno等[23]制备的含有重组质粒pC112的枯草芽孢杆菌MI113产生的生物表面活性剂是枯草芽孢杆菌RB14的8倍。与上述诱变方法相比,本实验使用的ARTP诱变方法在诱变效果方面并不是最突出的,但该法有效(超过20%的突变率)、快速(仅需几分钟)、方便(不需要特别处理)和环保(不产生有毒有害物质)。迄今为止还没有利用ARTP技术来提高红球菌所产生物表面活性剂产量的报道。本研究拓宽了ARTP技术的应用范围,证实ARTP技术可以很好地应用于红球菌SY095的诱变(诱变率高于20%),为提高生物表面活性剂产量提供了一种新的快速便捷的手段。
针对不同菌种,ARTP技术所引起的突变方式非常多样,多数突变子都出现了快速生长现象。本实验中,突变株在进入对数生长期后,生长速度明显快于野生型菌株,而生物表面活性剂与菌株的生长状态密切相关,因此突变株发酵液的生物表面活性也相应提高。
菌株退化是诱变过程中常发生的问题,退化的原因通常分为外部原因和内部原因,外部原因主要是环境的变化,内部原因是菌株自身的变化。连续培养往往是菌株活性降低的直接原因。本实验中,突变株在经过连续多代培养后仍可很好地保持活性的稳定;放大到50 L发酵罐时,突变株发酵液的表面张力仍可以达到28.16 mN·m-1。表明,突变株具有稳定的突变效应,可以作为生产菌株应用于工业生产。
3 结论
利用常压室温等离子体诱变技术诱变红球菌SY095,通过排油圈法与表面张力测定筛选出2株高产突变株220-7与300-3。与同期培养的野生型菌株相比,突变株220-7与300-3发酵液的最佳表面张力分别降至32.8 mN·m-1与28.6 mN·m-1,发酵液的最佳表面活性分别提高14.4%和25.3%。连续传代实验结果表明,这2株突变株具有良好的遗传稳定性。
[1]MAIER R M.Biosurfactants:evolution and diversity in bacteria[J].Advances in Applied Microbiology,2003,52:101-121.
[2]KUYUKINA M S,IVSHINA I B,MAKAROV S O,et al.Effect of biosurfactants on crude oil desorption and mobilization in a soil system[J].Environment International,2005,31(2):155-161.
[3]NITSCHKE M,COSTA S G V A O.Biosurfactants in food industry[J].Trends in Food Science & Technology,2007,18(5):252-259.
[4]MULLIGAN C N.Environmental applications for biosurfactants[J].Environmental Pollution,2005,133(2):183-198.
[5]SINGH P,CAMEOTRA S S.Potential applications of microbial surfactants in biomedical sciences[J].Trends in Biotechnology,2004,22(3):142-146.
[6]MULLIGAN C N,GIBBS B F.Biosurfactants:Production,Properties[M].New York:Marcel Dekker,1993:329-371.
[7]LI G,LI H P,WANG L Y,et al.Genetic effects of radio-frequency,atmospheric-pressure glow discharges with helium[J].Applied Physics Letters,2008,92(22):221504.
[8]LU Y,WANG L Y,MA K,et al.Characteristics of hydrogen production of anEnterobacteraerogenesmutant generated by a new atmospheric and room temperature plasma(ARTP)[J].Biochemical Engineering Journal,2011,55(1):17-22.
[9]ZHANG X,ZHANG X F,LI H P,et al.Atmospheric and room temperature plasma (ARTP) as a new powerful mutagenesis tool[J].Applied Biochemistry and Microbiology,2014,98(12):5387-5396.
[10]WANG L Y,HUANG Z L,LI G,et al.Novel mutation breeding method forStreptomycesavermitilisusing an atmospheric pressure glow discharge plasma[J].Journal of Applied Microbiology,2010,108(3):851-858.
[11]HUA X F,WANG J,WU Z J,et al.A salt tolerantEnterobactercloacaemutant for bioaugmentation of petroleum- and salt-contaminated soil[J].Biochemical Engineering Journal,2010,49(2):201-206.
[12]XU F,WANG J,CHEN S,et al.Strain improvement for enhanced production of cellulase inTrichodermaviride[J].Applied Biochemistry and Microbiology,2011,47(1):53-58.[13]GUO T,TANG Y,XI Y L,et al.Clostridiumbeijerinckiimutant obtained by atmospheric pressure glow discharge producing high proportions of butanol and solvent yields[J].Biotechnology Letters,2011,33(12):2379-2383.
[14]ZONG H,ZHAN Y,LI X,et al.A new mutation breeding method forStreptomycesalbulusby an atmospheric and room temperature plasma[J].African Journal of Microbiology Research,2012,6(13):3154-3158.
[15]QIAO N,SHAO Z Z.Isolation and characterization of a novel biosurfactant produced by hydrocarbon-degrading bacteriumAlcanivoraxdieseloleiB-5[J].Journal of Applied Microbiology,2010,108(4):1207-1216.
[16]JIANG M,WAN Q,LIU R M,et al.Succinic acid production from corn stalk hydrolysate in anE.colimutant generated by atmospheric and room-temperature plasmas and metabolic evolution strategies[J].Journal of Industrial Microbiology & Biotechnology,2014,41(1):115-123.
[17]YOUSSEF N H,DUNCAN K E,NAGLE D P,et al.Comparison of methods to detect biosurfactant production by diverse microorganisms[J].Journal of Microbiological Methods,2004,56(3):339-347.
[18]MULLIGAN C N,CHOW T Y K,GIBBS B F.Enhanced biosurfactant production by a mutantBacillussubtilisstrain[J].Applied Microbiology and Biotechnology,1989,31(5):486-489.
[19]IQBAL S,KHALID Z M,MALIK K A.Enhanced biodegradation and emulsification of crude oil and hyperproduction of biosurfactants by a gamma ray-induced mutant ofPseudomonasaeruginosa[J].Letters in Applied Microbiology,1995,21(3):176-179.
[20]TAHZIBI A,KAMAL F,ASSADI M M.Improved production of rhamnolipids by aPseudomonasaeruginosamutant[J].Iranian Biomedical Journal,2004,8(1):25-31.
[21]SHABTAI Y,GUTNICK D L.Enhanced emulsan production in mutants ofAcinetobactercalcoaceticusRAG-1 selected for resistance to cetyltrimethylammonium bromide[J].Applied Environmental Microbiology,1986,52(1):146-151.
[23]OHNO A,ANO T,SHODA M.Production of a lipopeptide antibiotic,surfactin,by recombinantBacillussubtilisin solid-state fermentation[J].Biotechnology and Bioengineering,1995,47(2):209-214.
Screening of High-Yield Biosurfactant-Producing Strain by Atmospheric and Room Temperature Plasma Mutation
HAO Jian-an,ZHANG Xiao-qing,JIANG Tian-xiang,YANG Bo,SI Xiao-guang,DU Jin,ZHANG Ai-jun,ZHANG Yu-shan,WANG Jing
(InstituteofSeawaterDesalinationandMultipurposeUtilization,SOA,Tianjin300192,China)
Throughoilspreadingmethodanddeterminationofsurfacetension,twohigh-yieldbiosurfactant-producingmutants220-7and330-3werescreenedfromthestrainRhodococcussp.SY095byatmosphericandroomtemperatureplasmamutation.Comparedwiththewildstrain,theoptimalsurfacetensionsoffermentationbrothofmutants220-7and300-3reducedto32.8mN·m-1and28.6mN·m-1,respectively,andtheoptimalsurfaceactivitiesoffermentationbrothoftwomutantsincreased14.4%and25.3%,respectively.Continuouspassageexperimentconfirmedthesetwomutantshadgoodgeneticstabilities.
atmosphericandroomtemperatureplasma;Rhodococcussp.SY095;biosurfactant
海洋公益性行业科研专项资助项目(201305022-5),国家自然科学基金资助项目(21406042),中央级公益性科研院所基本科研业务费专项资金团队项目(K-JBYWF-2015-T11),中央级公益性科研院所基本科研业务费专项资金项目(K-JBYWF-2015-G16)
10.3969/j.issn.1672-5425.2016.10.006
Q 939.9
A
1672-5425(2016)10-0027-04
郝建安,张晓青,姜天翔,等.常压室温等离子体诱变选育生物表面活性剂高产菌株[J].化学与生物工程,2016,33(10):27-30,34.

