GPER激动剂对发情周期小鼠卵巢 EGFR表达的影响
王 璐,刘红改,于得水,李 晶,刘 慧,赵慧英
(西北农林科技大学 动物医学院,陕西 杨凌 712100)
GPER激动剂对发情周期小鼠卵巢 EGFR表达的影响
王璐,刘红改,于得水,李晶,刘慧,赵慧英
(西北农林科技大学 动物医学院,陕西 杨凌 712100)
【目的】 探讨G蛋白耦联雌激素受体(G-protein-coupled estrogen receptor,GPER) 激动剂对卵巢表皮生长因子受体(Epidermal growth factor receptor,EGFR)表达的影响,为阐明GPER和EGFR 在卵巢功能维持中的作用奠定基础。【方法】 取间情期小鼠,将其分为40,200,1 000 ng/只G-1腹腔注射组和对照组(腹腔注射等体积生理盐水),每组20只,各组小鼠进行相应的处理。注射G-1后,依次取发情前期、发情期、发情后期和间情期小鼠各5只,脱颈处死,迅速取出卵巢,采用免疫组织化学SP法和实时定量RT-PCR法,研究不同剂量GPER激动剂G-1对发情周期小鼠卵巢EGFR分布及其 mRNA表达的影响。【结果】 EGFR在小鼠卵巢的各级卵泡、黄体和间质中均有表达,且在卵泡颗粒细胞和卵母细胞中表达最明显,在黄体和间质中的表达较微弱。同一发情时期卵巢中,EGFR的相对表达量随注射G-1剂量的增加而升高,除发情后期外,其他3个时期以1 000 ng/只 G-1注射组均极显著高于对照组(P<0.01);间情期和发情前期则以200 ng/只 G-1注射组显著高于对照组(P<0.05)。各组发情周期小鼠卵巢中EGFRmRNA表达量的变化规律与EGFR相对表达量的表现基本一致。【结论】 G-1对发情周期卵巢中EGFR的表达有一定的上调作用,提示GPER可介导雌激素经EGFR信号级联参与卵巢周期性生殖活动和卵泡生长发育的调节。
G蛋白耦联雌激素受体;表皮生长因子受体;发情周期卵巢
雌激素通过与其受体(Estrogen receptor,ER)结合参与卵巢生理功能的调节。最初,人们认为雌激素的生物效应完全由核受体来介导[1],但深入研究后发现,雌激素还存在膜受体。2005年Revankar等[2]和Thomas等[3]先后提出G蛋白耦联雌激素受体(G-protein-coupled estrogen receptor,GPER)为一种新型雌激素膜受体,介导雌激素的快速非基因组效应。Pang等[4]证实, GPER参与调节卵泡发育和卵母细胞的成熟。本研究组也证实GPER在小鼠[5]和奶山羊[6]发情周期卵巢的生理调节中发挥着重要作用。表皮生长因子受体(Epidermal growth factor receptor,EGFR)是酪氨酸激酶受体家族中的一种跨膜受体,与其配体结合可介导细胞生长、增殖和分化等生命活动。研究发现,在人[7]和山羊[8]等动物卵巢中均有EGFR表达,且其可通过卵丘细胞来调节卵母细胞成熟及卵泡发育[9]。近年来,在研究GPER信号通路的过程中发现,GPER介导的ERK和PI-3K信号通路是通过EGFR的转录激活而完成的[10];雌激素通过GPER所介导的EGFR反式激活,可调节斑马鱼卵母细胞的减数分裂阻滞[11],刺激鸡原始生殖细胞的增殖[12]。目前,有关动物发情周期卵巢中GPER和EGFR的调节作用尚未见文献报道。因此本试验运用免疫组织化学技术和实时定量RT-PCR法,研究了GPER激动剂G-1[13]对发情周期小鼠卵巢中EGFR表达的影响,旨在为阐明动物卵巢中GPER和EGFR的作用机制提供基础资料。
1 材料与方法
1.1材料
1.1.1试验动物雌性昆明白品系小鼠,体质量20~25 g/只,购于第四军医大学实验动物中心。小鼠自由采食、饮水条件下适应性饲养,期间保持13 h/11 h 的明暗周期变化(07:00-20:00 光照),2周后用于试验。
1.1.2主要试剂和仪器兔抗EGFR多克隆抗体,北京博奥森生物技术有限公司;免疫组化SP超敏试剂盒(兔)、柠檬酸组织抗原修复液、四盐酸3,3-二氨基联苯胺(DAB),福州迈新生物技术开发公司;RNAiso PLUS总RNA提取试剂,TaKaRa公司;反转录试剂盒RevertAid First Strand cDNA Synthesis Kit,Thermo Scientific;TransStart Tip Green qPCR SuperMix,北京全式金生物技术有限公司。
CM2235轮转式切片机(德国Leica公司),Motic数码显微镜(麦克奥迪实业集团有限公司),ABI stepone plus实时荧光定量PCR仪(美国ABI公司)。
1.2试验设计
对小鼠所处的发情时期进行鉴定,取间情期小鼠,参考文献[14]将小鼠分为40,200,1 000 ng/只G-1腹腔注射组和对照组(腹腔注射等体积生理盐水),每组20只,各组小鼠进行相应的处理。注射G-1后,依次取发情前期、发情期、发情后期和间情期小鼠各5只,脱颈处死,迅速取出卵巢,其中一侧用生理盐水冲洗后置于40 g/L多聚甲醛固定液中固定24~48 h,用于免疫组织化学试验;另一侧置于液氮中保存,用于实时荧光定量分析。
1.3石蜡切片的制备及免疫组化SP法染色
将固定好的卵巢流水冲洗12 h,取出依次经梯度酒精脱水、二甲苯透明、浸蜡、包埋等常规处理后,进行连续切片(片厚5 μm),再经展片、烤片、脱蜡复水和微波柠檬酸盐抗原修复20 min后,参考免疫组化SP试剂盒提供的程序进行染色:依次滴加A液(过氧化物酶阻断液)、B液(动物非免疫血清)、C液(生物素标记的二抗)、D液(链霉素抗生物素蛋白-过氧化物酶),室温各孵育15,15,10和10 min,并在B液染色之后滴加兔抗EGFR多克隆抗体(1∶200稀释),同时设阴性对照组(以0.01 mol/L PBS替代一抗),4 ℃过夜;以上每步完成后均用0.01 mol/L PBS漂洗3次(B液直接甩去即可),每次5 min;DAB显色,显微镜下观察控制反应时间,双蒸水终止反应;苏木素复染、脱水、透明、封片。
从各组切片中随机选取5张进行显微观察和拍照,使用Image-Pro Plus软件对图片进行分析,测量阳性细胞的平均光密度、总面积,计算相对表达量(μ2):μ2=光镜倍数×平均光密度×阳性面积/像素。再应用SPSS V18.0软件对其进行方差分析。
1.4小鼠卵巢中EGFRmRNA表达的RT-PCR检测
将卵巢从液氮中取出,在无RNase污染条件下快速提取总RNA。以此RNA为模板,按照反转录试剂盒说明进行反转录合成cDNA。通过GenBank查得小鼠EGFR基因序列,应用Primer 5.0软件设计引物,EGFR基因上下游引物序列为:(F) 5′-TCTTCAAGGATGTGAAGTGTG-3′,(R) 5′-GTGTACGCTTTCGAACAATGT-3′,目的片段大小为146 bp。选择持家基因GAPDH作为内参,其上下游引物序列为:(F) 5′-GTGTTCCTACCCCCAA-TGTGT-3′,(R) 5′-ATTGTCATACCAGGAAATGAGCTT-3′。PCR反应体系为20 μL,其中2×TransStart Tip Green qPCR SuperMix 10 μL、50×Passive Reference Dye 0.4 μL、上下游引物(10 μmol/L)各0.4 μL、cDNA 2 μL、ddH2O 6.8 μL。反应条件为:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s,进行40个循环。采用ΔCT法来计算EGFRmRNA的相对表达量,并用SPSS V18.0软件对相对表达量进行差异性分析。
2 结果与分析
2.1G-1对发情周期小鼠卵巢中EGFR表达的影响
G-1对发情周期小鼠卵巢中EGFR表达影响的形态表现见图1。
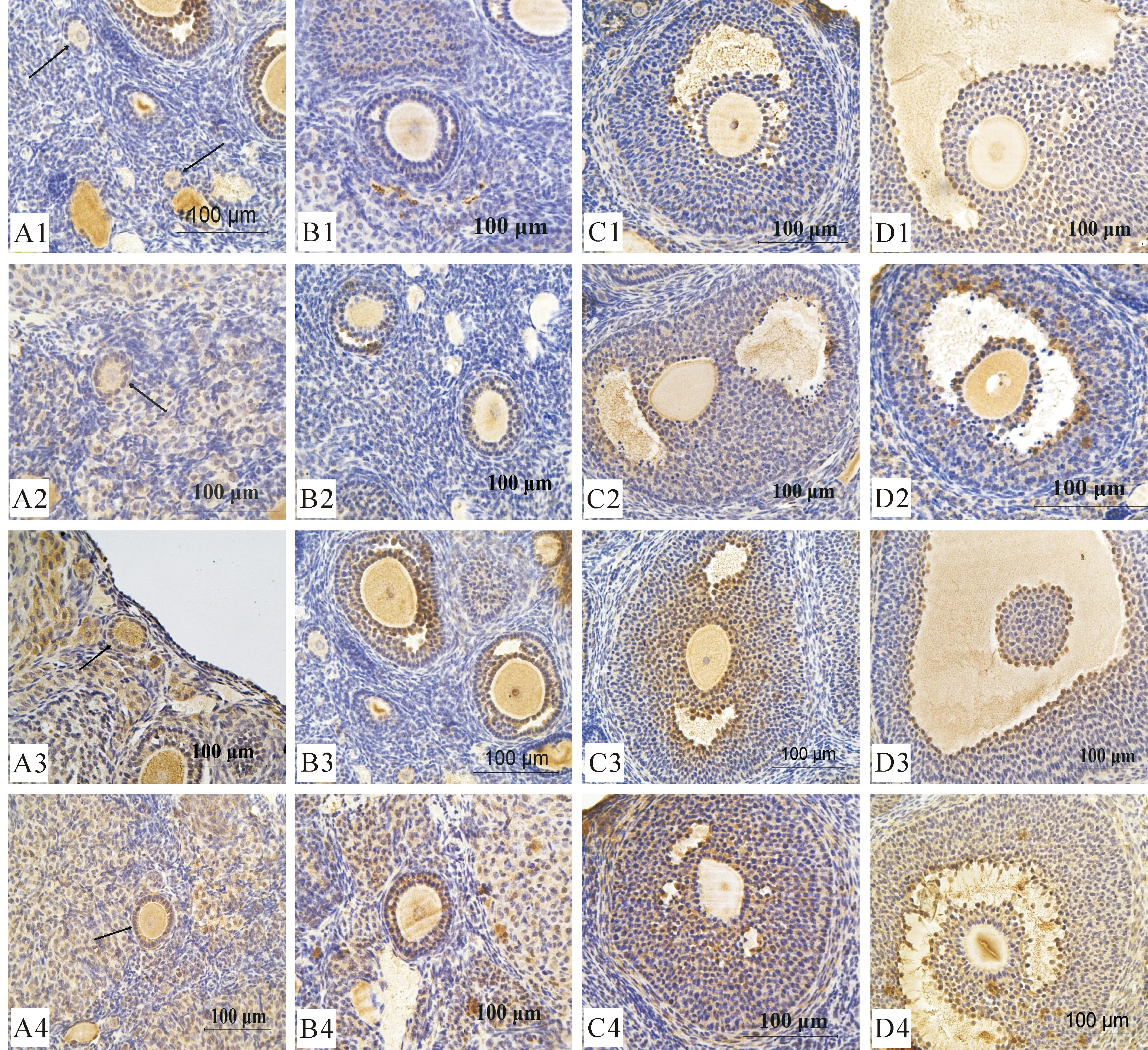
图 1G-1对发情周期小鼠卵巢中EGFR表达的影响(×400)
A1-A4.发情后期初级卵泡;B1-B4.间情期次级卵泡;C1-C4.发情前期三级卵泡;D1-D4.发情期成熟卵泡;
A1-D1.对照组;A2-D2.40 ng/只 G-1组;A3-D3.200 ng/只 G-1组;A4-D4.1 000 ng/只 G-1组
Fig.1Effect of G-1 on EGFR expression in mouse ovary during estrous cycle (×400)
A1-A4.Primary follicle in metestrous;B1-B4.Secondary follicle in diestrous;C1-C4.Tertiary follicle in proestrus;D1-D4.Mature follicle in estrus;A1-D1.Control;A2-D2.40 ng G-1 group;A3-D3.200 ng G-1 group;A4-D4.1 000 ng G-1 group
EGFR在小鼠卵巢的卵泡、黄体和间质中均有表达,在卵泡中的表达最明显,在黄体和间质中的表达较微弱。卵泡中,以卵泡颗粒细胞阳性着色最深,且越靠近卵母细胞的颗粒细胞阳性着色越强;卵母细胞中,除原始卵泡中的EGFR表达微弱外,其他卵泡卵母细胞均呈中等强度表达,且EGFR阳性产物随卵泡体积的逐渐增大而增多(图1-A1-D1),卵泡液中也有一定程度的EGFR表达。
EGFR在各组小鼠卵巢中的表达量随G-1注射剂量的增加而增强,注射40 ng/只G-1的小鼠卵泡中EGFR的表达较对照稍增强,呈稍深的棕黄色(图1-A2-D2);注射200和1 000 ng/只G-1的小鼠卵泡中EGFR阳性表达明显增强,呈棕褐色(图1-A3-D3、A4-D4)。
小鼠卵巢中EGFR的相对表达量统计分析结果如图2所示。由图2可知,小鼠卵巢中EGFR相对表达量表现为发情期>发情前期>间情期>发情后期,且随G-1注射剂量的增大而增加;40 ng/只 G-1注射组小鼠各发情时期与对照组相比均无显著差异;200 ng/只G-1注射组中,发情期与对照组相比差异极显著(P<0.01),间情期和发情前期与对照组相比差异显著(P<0.05); 1 000 ng/只G-1注射组小鼠在除发情后期外的其他3个发情时期EGFR的相对表达量均极显著高于对照组(P<0.01)。

图 2G-1对发情周期小鼠卵巢中EGFR相对表达量的影响
与对照组相比,柱上标*表示差异显著(P<0.05),标**表示差异极显著(P<0.01)
Fig.2Effect of G-1 on EGFR relative expression in mouse ovary during estrous cycle
* means significant difference(P<0.05),and ** means extremely significant difference(P<0.01)
2.2G-1对发情周期小鼠卵巢中EGFRmRNA表达的影响
GPER激动剂G-1对间情期、发情前期、发情期、发情后期小鼠卵巢中EGFRmRNA表达的影响见图3。

图 3G-1对发情周期小鼠卵巢中EGFRmRNA表达的影响
同一发情时期不同处理相比,柱上标不同小写字母表示差异显著(P<0.05),标不同大写字母表示差异极显著(P<0.01)
Fig.3Effect of G-1 onEGFRmRNA expression in mouse ovary during estrous cycle Different lowercase letters mean significant difference in each period among treatments (P<0.05),
and different uppercase letters mean extremely significant difference(P<0.01)
荧光定量结果 (图3) 显示,EGFRmRNA在发情期表达量最高,发情前期和间情期次之,发情后期最低;同一发情时期卵巢中EGFRmRNA的表达量随G-1注射剂量的增加而升高;不同剂量G-1注射组间在发情期的差异均达极显著水平(P<0.01),在其他3个发情时期,1 000和200 ng/只 G-1注射组卵巢中EGFRmRNA的表达量均极显著高于40 ng/只G-1注射组(P<0.01),间情期和发情前期的40 ng/只G-1注射组显著高于对照组(P<0.05)。
3 讨 论
EGFR作为表皮生长因子家族受体,调控细胞生长、增殖和分化。研究证实,EGFR在人卵巢组织的各级卵泡卵母细胞和颗粒细胞中均有表达[7];在山羊卵巢颗粒细胞中EGFR呈强阳性表达,且越靠近卵母细胞表达越强[8]。Ge等[12]提出,卵母细胞和卵泡细胞之间以旁分泌的形式进行信息交流,卵母细胞产生的EGF家族因子与相应靶细胞上的EGFR结合,调节卵泡生长及卵母细胞成熟的过程,这与本研究中“EGFR不仅在各级卵泡中均有表达,且随着卵泡的生长其表达量逐渐增多,同时EGFR在距卵母细胞较近的颗粒细胞和卵丘颗粒细胞中表达增强”的结果一致,进一步证实了EGFR可促进卵泡的生长发育以及调节卵母细胞成熟的结论。
GPER作为雌激素的膜受体,通过与雌激素结合,转录激活EGFR,进而激活MAPK和PI-3K信号通路,介导雌激素的非基因组效应[15]。Filardo等[16]研究证实,在哺乳动物细胞中雌激素激活GPER的同时,可通过G蛋白的βγ亚基信号通路反式激活EGFR。随后,Peyton等[11]发现,雌激素处理可引起依赖于EGFR反式激活的MAPK磷酸化,说明MAPK是EGFR的下游信号;同时,运用EGFR的抑制剂可阻断由雌激素或G-1引起的MAPK磷酸化效应,表明EGFR位于MAPK信号级联反应的上游。雌激素激活GPER的信号通路涉及Src、MMP、EGFR和MAPK等信号因子。上述研究结果与本试验中给予小鼠GPER特异性激动剂G-1处理后,发情周期卵巢中EGFR的表达量明显升高的结果相符,表明小鼠卵巢内GPER的活化可反式激活EGFR及其下游信号级联反应,从而参与卵泡发育和卵母细胞成熟的调节。
G-1与雌激素一样可上调多种雌激素应答基因的表达[17],EGFR作为GPER信号通路中的下游信号分子,其表达量与GPER的调节作用密切相关。G-1与卵泡细胞中的GPER结合可促进EGFR配体的生成,进一步促进EGFR的活化,上调其表达[15]。耿阳雪等[5]也已证实,GPER在小鼠发情期卵巢中的表达量最高,这与本试验中G-1对发情期卵巢中EGFR表达的上调作用最明显的结果一致。Ge等[12]运用G-1首次证实,GPER经EGFR-PI3K信号级联反应可介导雌激素促进原始生殖细胞的增殖。本试验中给予间情期小鼠G-1处理后,卵巢中的GPER被特异性激活,上调卵巢中EGFR的表达,且与G-1的注射剂量相关[14],推测在哺乳动物卵巢内,雌激素通过与其膜受体GPER结合,经EGFR信号通路介导非基因组效应,参与卵巢功能调节。
[1]Emmen J M,Couse J F,Elmore S A,et al.Invitrogrowth and ovulation of follicles from ovaries of estrogen receptor (ER){alpha} and ER{beta} null mice indicate a role for ER{beta} in follicular maturation [J].Endocrinology,2005,146(6):2817-2826.
[2]Revankar C M,Cimino D F,Sklar L A,et al.A transmembrane intracellular estrogen receptor mediates rapid cell signaling [J].Science,2005,307:1625-1630.
[3]Thomas P,Pang Y,Filardo E J,et al.Identity of an estrogen membrane receptor coupled to a G protein in human breast cancer cells [J].Endocrinology,2005,146(2):624-632.
[4]Pang Y F,Thomas P.Role of G protein-coupled estrogen receptor 1,GPER,in inhibition of oocyte maturation by endogenous estrogens in zebrafish [J].Developmental Biology,2010,342(2):194-206.
[5]耿阳雪,蒋振兴,熊东升,等.GPR30在小鼠发情周期卵巢中的分布和表达 [J].安徽农业大学学报,2012,39(6):863-866.
Geng Y X,Jiang Z X,Xiong D S,et al.The distribution and expression of GPR30 in mice ovary during the estrous cycle [J].Journal of Anhui Agricultural University,2012,39(6):863-866.
[6]王文丽,代盈盈,赵慧英,等.发情周期关中奶山羊卵巢中GPR30和NGF的表达 [J].中国兽医科学,2013,43(5):522-526.
Wang W L,Dai Y Y,Zhao H Y,et al.Expression of GPR30 and NGF in Guanzhong dairy goats ovary during the estrous cycle [J].Chinese Veterinary Scinece,2013,43(5):522-526.
[7]Qu J,Nisolle M,Donnez J.Expression of transforming growth factor-alpha,epidermal growth factor,and epidermal growth factor receptor in follicles of human ovarian tissue before and after cryopreservation [J].Fertility and Sterility,2000,74(1):113-121.[8]Gall L,Chene N,Dahirel M,et al.Expression of epidermal gro-wth factor receptor in the goat cumulus-oocyte complex [J].Molecular Reproduction and Development,2004,67:439-445.
[9]Gall L,Boulesteix C,Ruffini S,et al.EGF-induced EGF-receptor and MAP kinase phosphory lation in goat cumulus cells duringinvitromaturation [J].Molecular Reproduction and Development,2005,71(4):489-494.
[10]Quinn J A,Graeber C T,Frackelton A R,et al.Coordinate regulation of estrogen-mediated fibronectin matrix assembly and epidermal growth factor receptor transactivation by the G protein-coupled receptor, GPR30 [J].Journal of Molecular Endocrinology,2009,23:1052-1064.
[11]Peyton C,Thomas P.Involvement of epidermal growth factor receptor signaling in estrogen inhibition of oocyte maturation mediated through the G protein-coupled estrogen receptor (Gper)in zebrafish (Danio rerio) [J].Biology of Reproduction,2011,85:42-50.
[12]Ge C,Yu M,Zhang C.G protein-coupled receptor 30 mediates estrogen induced proliferation of primordial germ cells via EGFR/Akt/-catenin signaling pathway [J].Endocrinology,2012,153:3504-3516.
[13]Bologa C G.Virtual and biomolecular screening converge on a selective agonist for GPR30 [J].Nature Chemical Biology,2006,2:207-212.
[14]Dennis M K,Burai R,Ramesh C,et al.Invivoeffects of a GPR30 antagonist [J].Nature Chemical Biology,2009,5(6):421-427.
[15]Pandey D P,Lappano R,Albanito L,et al.Estrogenic GPR30 signalling induces proliferation and migration of breast cancer cells through cTGF [J].Embo Journal,2009,28:523-532.
[16]Filardo E J,Thomas P.GPR30:a seven-transmembrane-spanning estrogen receptor that triggers EGF release [J].Trends in Endocrinology and Metabolism,2005,16:362-367.
[17]Albanito L,Lappano R,Madeo A,et al.G-protein-coupled receptor 30 and estrogen receptor-are involved in the proliferative effects induced by atrazine in ovarian cancer cells [J].Environmental Health Perspectives,2008,116:1648-1655.
Effect of G-protein-coupled estrogen receptor (GPER) agonist on expression of EGFR in mice ovary during estrous cycle
WANG Lu,LIU Honggai,YU Deshui,LI Jing,LIU Hui,ZHAO Huiying
(CollegeofVeterinaryMedicine,NorthwestA&FUniversity,Yangling,Shaanxi712100,China)
【Objective】 This study explored the effect of G-protein-coupled estrogen receptor (GPER) agonist on the expression of epidermal growth factor receptor (EGFR) in ovary to lay foundation for clarifying the functional relationship between GPER and EGFR.【Method】 The diestrus mice were divided into 40,200 and 1 000 ng dose of G-1 intraperitoneal injection groups and the control group (intraperitoneal injection of normal saline).Each group included twenty mice.Five mice were selected in proestrous,estrous,metestrous and diestrous and sacrifying periods after injection of G-1 and their ovaries were removed quickly.Immunohistochemical SP method and real-time quantitative RT-PCR were used to study the distribution of EGFR and expression ofEGFRmRNA in mice ovary during the estrus cycle.【Result】 EGFR distributed in mice ovarian follicles,the corpus luteum and stroma with the largest expression in granulosa cells and oocytes and weak expression in corpus luteum and stroma.The expression of EGFR increased with the increasing dose of G-1 during the same period.Except for metestrous,the EGFR expression in ovary of 1 000 ng G-1 group was significantly higher than the control in other three periods (P<0.01).The expression in ovary of 200 ng G-1 group in diestrus and proestrus periods was significantly higher than the control (P<0.05).The expression ofEGFRmRNA was consistent with the relative expression of EGFR in each group.【Conclusion】 G-1 upregulated the expression of EGFR in ovary during estrous cycle.Suggesting GPER can mediate estrogen involved in regulating cyclical ovarian reproductive activity and follicular development by EGFR signaling cascade.
G-protein-coupled estrogen receptor;epidermal growth factor receptor;estrous cycle ovary
时间:2016-08-0909:40DOI:10.13207/j.cnki.jnwafu.2016.09.004
2015-02-07
抗病转基因牛新品种培育重点专项基金项目(2009ZX08007)
王璐(1989-),女,河南社旗人,在读硕士,主要从事基础兽医学研究。
赵慧英(1966-),女,陕西韩城人,教授,硕士生导师,主要从事动物神经内分泌研究。E-mail:xn6118@qq.com
Q492.5
A
1671-9387(2016)09-0022-05
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160809.0940.008.html

