利用鱼抗血清及鼠抗血清分析鱼肠道弧菌全菌蛋白抗原性❋
张铭伟,唐小千,绳秀珍,邢 婧,战文斌
(中国海洋大学水产动物病害与免疫实验室,山东 青岛 266003)
利用鱼抗血清及鼠抗血清分析鱼肠道弧菌全菌蛋白抗原性❋
张铭伟,唐小千❋❋,绳秀珍,邢婧,战文斌
(中国海洋大学水产动物病害与免疫实验室,山东 青岛 266003)
从患腹水症牙鲆脾脏组织中分离得到一株优势菌株CD86,经人工感染实验证实菌株CD86对牙鲆有较高的致病力,其半致死浓度为1.8×105CFU/尾。通过生理生化特征测定和16S rDNA基因序列分析,判定菌株CD86为鱼肠道弧菌(Vibrioichthyoenteri)。以福尔马林灭活的菌株CD86全菌分别免疫健康的小鼠和牙鲆,ELISA测定鼠抗血清和牙鲆抗血清效价分别为12800和1200。利用间接免疫荧光技术检测2种抗血清与菌株CD86的结合活性,结果显示,2种血清均可同菌体发生阳性反应,其中鼠抗血清阳性反应信号明显强于鱼抗血清。同时,利用Western blotting分析了菌株CD86全菌蛋白的抗原性,结果显示分子量为27、30和37kDa的菌体蛋白条带与2种血清均发生阳性反应;分子量为19、25、28、29和35kDa的菌体蛋白条带仅与鼠抗血清发生阳性反应;分子量为45kDa的菌体蛋白条带只与鱼抗血清发生阳性反应。研究结果表明,牙鲆对菌体抗原产生的抗体应答与小鼠存在明显差异,该发现对研筛鱼用高效的鱼肠道弧菌亚单位疫苗具有重要的参考价值。
鱼肠道弧菌;分离鉴定;ELISA;Western blotting;抗原性分析;抗血清
引用格式:张铭伟, 唐小千, 绳秀珍, 等. 利用鱼抗血清及鼠抗血清分析鱼肠道弧菌全菌蛋白抗原性[J]. 中国海洋大学学报(自然科学版), 2016, 46(10): 24-31.
ZHANG Ming-Wei, TANG Xiao-Qian, SHENG Xiu-Zhen, et al. Antigenic analysis of total protein ofVibrioichthyoenteriusing mice and flounder antisera[J]. Periodical of Ocean University of China, 2016, 46(10): 24-31.
弧菌(Vibrio)是海洋环境中最常见的细菌类群之一,广泛分布于近岸、河口海区的海水和生物体中,它是引发海水养殖动物疾病的重要病原菌类群,其致病性受宿主的生理状态及水质环境条件等综合因素的影响,是一类条件致病菌[1-3]。鱼肠道弧菌(Vibrioichthyoenteri)是水产养殖中新近发现的一种致病菌,1996年日本学者Ishimaru首次报道该菌对牙鲆具有较强的致病力,基于它的生化生理及分子生物学特征,将其定名为弧菌属的一个新种[4]。
近年来,国内相继报道了致病性鱼肠道弧菌可引起养殖大菱鲆(Scophthalmusmaximus)、红鳍东方鲀(Fugurubripes)、斜带髭鲷(Hapalogenysnitens)、牙鲆(Paralichthysolivaceus)等养殖鱼体发病,由该菌引起的养殖鱼类疾病表现出较高的死亡率和较广的流行范围,给水产养殖业造成了严重的经济损失[2-3,5-7]。目前国内外已针对鱼肠道弧菌在诊断检测、免疫防治方面开展了初步研究,制备了鱼肠道弧菌的多克隆及单克隆抗体,并建立了间接荧光抗体与免疫印迹检测技术[8-9];制备的鱼肠道弧菌灭活全菌和外膜蛋白免疫牙鲆均表现出一定的免疫保护效果[10-11],研究结果提示,外膜蛋白可作为鱼肠道弧菌亚单位疫苗研制的候选材料。但是,目前世界范围大多应用鼠、兔等高等动物免疫血清对病原菌进行抗原性分析,该方法不能如实反映鱼体对病原菌各抗原组分的应答情况,因而在筛选菌株亚单位疫苗候选蛋白时准确性会受一定程度的影响。
本研究在分离获得患腹水症牙鲆致病菌株CD86的基础上,通过制备灭活菌株CD86的鼠抗血清和牙鲆抗血清,结合运用Western blotting对鱼肠道弧菌全菌蛋白的免疫原性进行分析,以期掌握鱼肠道弧菌全菌蛋白引起牙鲆及小鼠抗体免疫应答的差异特点,为研制高效的鱼肠道弧菌亚单位疫苗提供数据。
1 材料与方法
1.1 病原菌分离
患病牙鲆取自山东省日照顺源牙鲆育苗厂,病鱼体色发黑,不摄食,腹部有明显膨胀,解剖后有大量腹水,肝脏、肾脏及脾脏均有不同程度肿胀,肠道内无食物且有淡黄色黏液。取内脏镜检,有大量细菌,无菌环境下以接种环挑取脾脏组织液划线接种于普通营养琼脂平板,28℃培养24h后观察发现,培养基平板上生长的菌落形态较为一致,通过划线法分离纯化得到单一优势菌株,定名为CD86。将纯化的菌株CD86保存在含15%甘油的普通营养培养基中,-80℃保存备用。
1.2 人工感染实验
感染实验用健康牙鲆,购于青岛胶南某牙鲆养殖厂,体长为12~13cm。实验前暂养一周,养殖水温为(22±1)℃,日换水1/4,每隔1天投喂人工配合饲料。将菌株CD86在普通营养琼脂平板上28℃培养24h,以无菌的0.01mol/L磷酸盐缓冲液(PBS)洗涤收集细菌,并以7500g离心洗涤菌体3次,每次5min。将洗涤后的PBS菌悬液以麦氏比浊仪将细菌浓度调整为1.0×108CFU/mL,然后进行10倍梯度稀释分别获得1.0×107、1.0×106和1.0×105CFU/mL 3个浓度梯度,将4种不同浓度的菌悬液以腹腔注射的方式感染健康牙鲆,每尾注射0.1mL,对照组鱼体注射等体积的生理盐水,每组注射20尾。攻毒后2周内连续观察与记录鱼体的发病与死亡情况。同时,随机取3尾攻毒后发病牙鲆,从病灶处再次分离细菌进行菌种鉴定。
1.3 菌株鉴定
将菌株CD86和攻毒感染后再次分离获得的菌株CD86-1接种于普通营养琼脂平板,置于28℃培养24h,制备细菌涂片进行革兰氏染色以确定其形态特征。使用法国梅里埃公司API鉴定系统的ID32E鉴定条对菌株的生化特性进行鉴定,标准鱼肠道弧菌生化特性引自《伯杰氏系统细菌学手册》(第二版)[12]。挑取单一菌落混于无菌去离子水中,100℃水浴5min,冷却后4℃ 10000g离心10min,取上清液作为PCR扩增反应的模板。细菌16S rDNA扩展的正向与反向引物分别采用F27和R1492[13],具体反应体系与反应条件的设置参考文献[14]进行。PCR扩增产物交送上海桑尼测序公司进行序列测定,将测定的16S rDNA基因序列通过Blast进行同源性比对分析,并从结果中选取其他相似度较高的菌株序列,使用ClustalX 2.0软件进行多序列比对,使用MEGA 5.0进行系统发育分析,采用邻位相连法构建系统进化树。
1.4 菌株CD86鼠抗及鱼抗血清的制备
1.4.1 菌株CD86的灭活将普通营养琼脂28℃培养24h的菌株CD86以PBS洗涤收集,7500g离心洗涤3次,将菌液浓度调整为5×108CFU/mL后,加入0.8%的甲醛在4℃条件下振荡灭活48h,无菌PBS离心洗涤3次后,以无菌PBS将浓度调整为5×108CFU/mL,取0.2mL菌液在无菌环境下涂布于普通营养琼脂平板28℃培养24h,验证菌体已被灭活。已经灭活后的菌悬液4℃保存备用。
1.4.2 菌株CD86鼠抗血清的制备灭活菌株CD86分4次分别免疫2只Balb/c小鼠,具体程序如下:基础免疫,灭活菌悬液与弗氏完全佐剂1∶1混匀,腹腔注射0.2mL;第二周后进行第1次加强免疫,灭活细菌悬液与弗氏不完全佐剂1∶1混匀,腹腔注射0.2mL;第三周、第四周再加强免疫各1次,尾静脉注射灭活细菌悬液0.2mL,无佐剂;最后一次加强免疫后第7天摘眼球一次性取血,室温倾斜放置2h,放置4℃过夜,次日8000g离心10min获得鼠抗血清,将2只小鼠抗血清混合后用于后续实验。
1.4.3 菌株CD86鱼抗血清的制备用以制备鱼抗血清的健康牙鲆,购于青岛胶南某牙鲆养殖厂,体长为23~25cm。实验前暂养1周,养殖水温(22±1)℃,日换水1/4,每隔1天投喂人工配合饲料。将灭活菌悬液与弗氏佐剂等体积混匀后分别免疫5尾牙鲆,采取腹腔注射方式,每尾注射0.2mL,首次免疫2周后加强免疫1次,首次免疫后35d尾静脉取血,室温倾斜放置1h后,置于4℃冰箱过夜,次日8000g离心10min收集牙鲆抗血清,将收集的5尾牙鲆抗血清混合后用于后续实验。
1.5 鱼抗血清和鼠抗血清抗体特性分析
1.5.1 ELISA检测鱼抗血清和鼠抗血清效价将灭活菌株CD86菌悬液浓度调整至1×108CFU/mL,将菌悬液以100μL/孔加至96孔酶标板中,设置3个重复,4℃包被过夜;次日PBST(含有0.5%Tween20的PBS缓冲液)洗涤后,加入含4%牛血清白蛋白(BSA)的PBS,37℃温育1h;PBST洗涤后,加入PBS稀释成不同浓度梯度的牙鲆抗血清100μL;同上温育洗涤后,加入鼠抗牙鲆IgM单克隆抗体2D8(本实验室制备,1∶1500)[15]100μL;同上温育洗涤后,加入碱性磷酸酶标记的羊抗鼠IgG(Sigma,1∶5000),37℃温育45min;洗涤后加入对硝基苯磷酸酯(pNPP)发色液,酶标仪测量在405nm的吸光值。测定鼠抗血清效价时,以鼠抗血清代替牙鲆抗血清,温育洗涤后直接加入碱性磷酸酶标记的羊抗鼠IgG,其余步骤与牙鲆抗血清效价测定方法一致。P/N≥2.1时为阳性。
1.5.2 间接免疫荧光技术检测2种抗血清特性参照张伟妮等[16]的方法进行间接免疫荧光检测。将菌株CD86菌悬液调整至1×108CFU/mL,将菌悬液滴在载玻片上,倾斜处理后室温下自然干燥,放入丙酮中固定15min,取出晾干。在玻片菌体位置滴加PBS稀释100倍的牙鲆抗血清,37℃湿盒中温育45min,取出载玻片以PBS洗3次,每次5min。然后,以PBS稀释600倍的鼠抗牙鲆IgM单克隆抗体2D8孵育菌体,37℃湿盒中温育45min,同上洗涤;最后,以PBS稀释256倍的FITC标记的羊抗鼠多抗(Sigma)进行孵育,37℃湿盒中温育45min,取出洗涤后甘油封片,荧光显微镜下观察结果并拍照。利用鼠抗血清进行免疫荧光反应时,以PBS稀释100倍的鼠抗血清作为第一抗体,孵育洗涤后滴加FITC标记的荧光抗体孵育,其余步骤与牙鲆抗血清免疫荧光操作方法一致。以PBS代替鼠抗血清和牙鲆抗血清作为阴性对照。
1.6 Western blotting分析菌株CD86全菌蛋白的抗原性
参照孙敏等[17]方法对菌株CD86全菌蛋白进行Western blotting分析。以超声波破碎的鱼肠道弧菌全菌,将全菌破碎液样品与电泳样品缓冲液等体积混匀,煮沸5min,冷却后加样进行SDS-PAGE,分离胶浓度为10%(v/v),在60mA恒定电流进行电泳。电泳结束后,凝胶用Mini-ProteanⅡcell系统(Bio-Rad)将蛋白转移到PVDF膜上(恒压30V,90min),转印后PVDF膜用PBS洗10min,均匀剪裁置于含4%BSA的PBS溶液中4℃封闭过夜,PBST洗涤3次,每次5min;一块膜在以PBS稀释100倍的牙鲆抗CD86血清中37℃温育1h,同上洗涤后在PBS稀释1000倍的鼠抗牙鲆IgM单克隆抗体2D8中37℃温育1h,同上洗涤后将膜置于PBS稀释5000倍的碱性磷酸酶标记的羊抗鼠IgG中,37℃温育45min后同上洗涤。最后将膜置于NBT/BCIP缓冲液中发色20~30min,去离子水洗涤膜以终止发色。另一块膜在封闭后以PBS稀释1000倍的鼠抗CD86血清进行孵育,洗涤后加入碱性磷酸酶标记的羊抗鼠IgG,其余操作步骤与第一块膜操作方法一致。晾干后观察记录反应结果。
2 结果
2.1 人工感染实验
健康牙鲆在注射感染菌株CD86后2~3d开始出现死亡,其中高浓度感染组在感染后第12天累计死亡率达到95%(见图1)。感染后发病鱼体主要表现出停止摄食,活动减少,感染1周以后大部分鱼体出现腹部胀大,部分牙鲆的体表出现不同程度的溃烂,解剖濒死牙鲆腹腔内有明显腹水,脾脏肿大,且肠道内有淡黄色黏液,人工感染鱼体的发病症状与自然发病鱼体表现出高度相似性,且从随机挑选的发病牙鲆病灶处可再次分离得到大量细菌,各个菌落形态一致,与菌株CD86高度相似,而对照组鱼体未表现任何症状。根据统计的不同浓度感染组鱼体的累计死亡率,按照改进的寇氏法[18]计算该菌株对牙鲆的半致死量,结果显示菌株CD86对健康牙鲆的半致死量(LD50)为1.8×105CFU/尾,表明菌株CD86具有较强毒力。
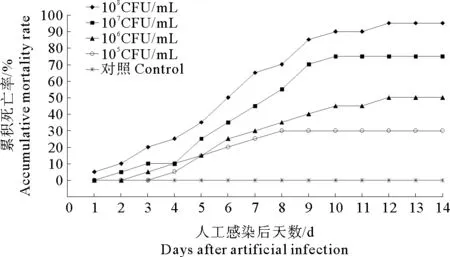
图1 人工感染实验结果Fig.1 Result of artificial infection experiment
2.2 菌株鉴定结果
菌株CD86革兰氏染色阴性,API系统ID32E鉴定条鉴定的生理生化结果见表1。结果显示,菌株CD86与菌株CD86-1生化结果与鱼肠道弧菌标准菌株[19]的生理生化指标相吻合。测序结果显示,菌株CD86与菌株CD86-1的16S rDNA序列完全一致,通过在NCBI数据库中对菌株CD86的16S rDNA序列进行同源比对分析,结果显示其与已发布的2株鱼肠道弧菌(Genbank no. DQ003270 和no. KC884634)16S rDNA序列相似度最高,均高于99.7%,通过挑取数据库中与菌株CD86的16S rDNA序列高度同源的20株弧菌菌株利用邻位相连法构建系统发育树,结果显示菌株CD86与2株鱼肠道弧菌聚为一支,置信度为100%(见图2)。
2.3 血清效价及免疫荧光检测结果
ELISA检测结果显示,当鼠抗血清稀释倍数小于12800时P/N>2.1,而当稀释倍数为25600时P/N<2.1,因此鼠抗血清效价为12800(见图3A);当牙鲆抗血清稀释倍数小于1200时P/N>2.1,而当稀释倍数为1400时P/N<2.1,因此牙鲆抗血清效价为12800(见图3B)。分别应用鼠抗血清和牙鲆抗血清对菌株CD86进行荧光检测,结果显示2种血清均能与菌体发生阳性反应,与牙鲆抗血清免疫荧光检测结果相比,鼠抗血清的显示出较强的绿色荧光信号,而阴性对照未观察到绿色荧光信号(见图4)。
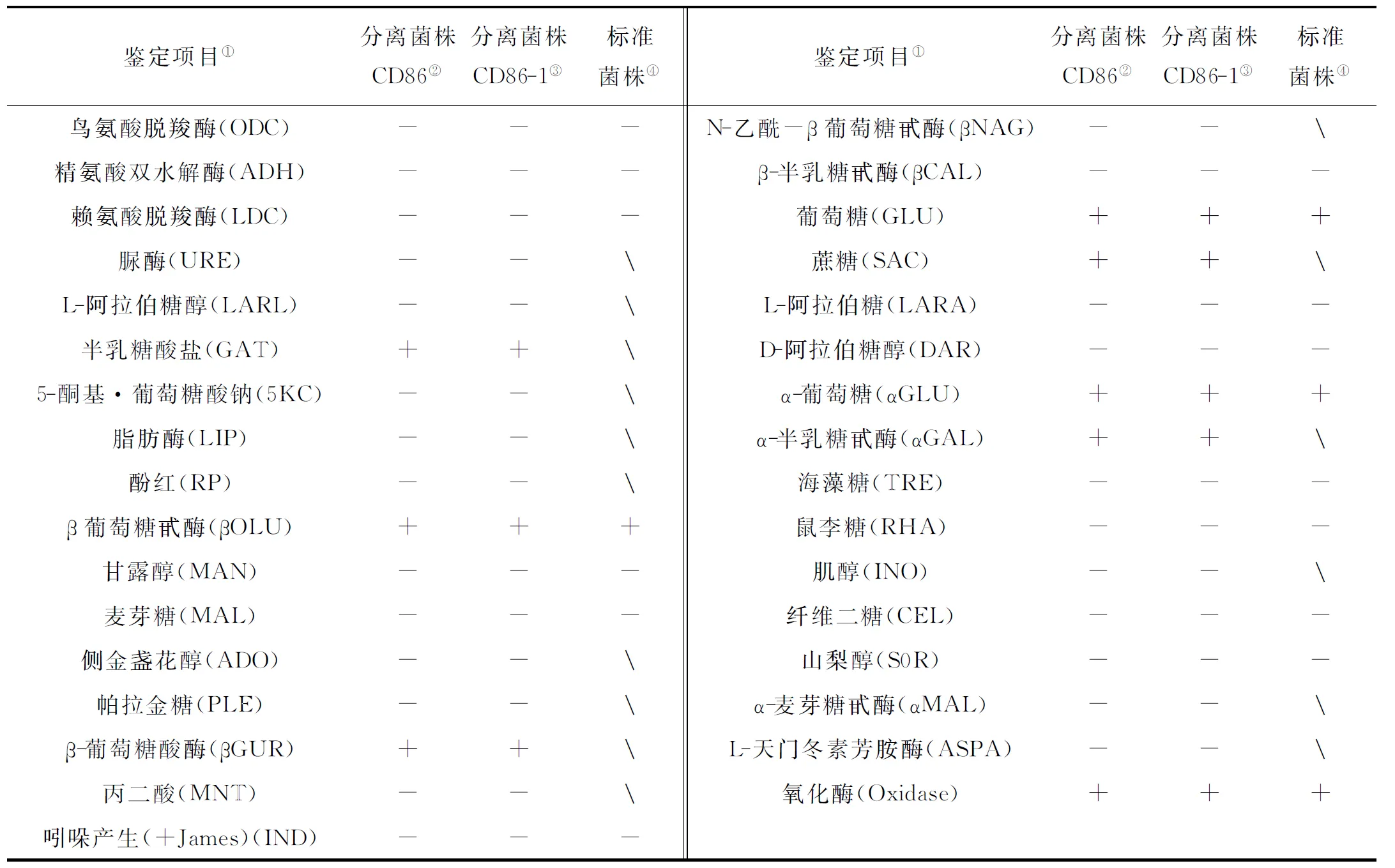
表1 生理生化鉴定结果Table 1 Result of Physiological and biochemical identification
(“+”表示阳性,“-”表示阴性,“” 表示未记述。“+” show positive, “-” show negative,“” show not described.)
①Identification category; ②Isolated strain CD86; ③Isolated strain CD86-1; ④Standard strain
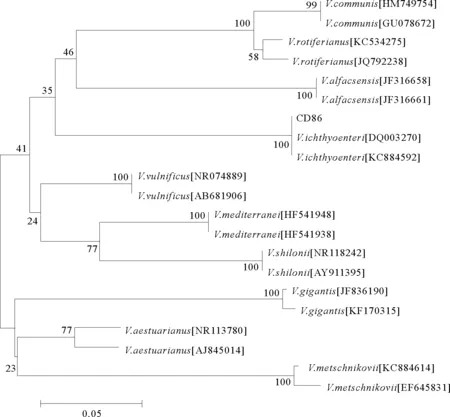
图2 基于16S rDNA基因序列构建的弧菌系统进化树Fig.2 Phylogenetic tree of Vibrio based on 16S rDNA genes
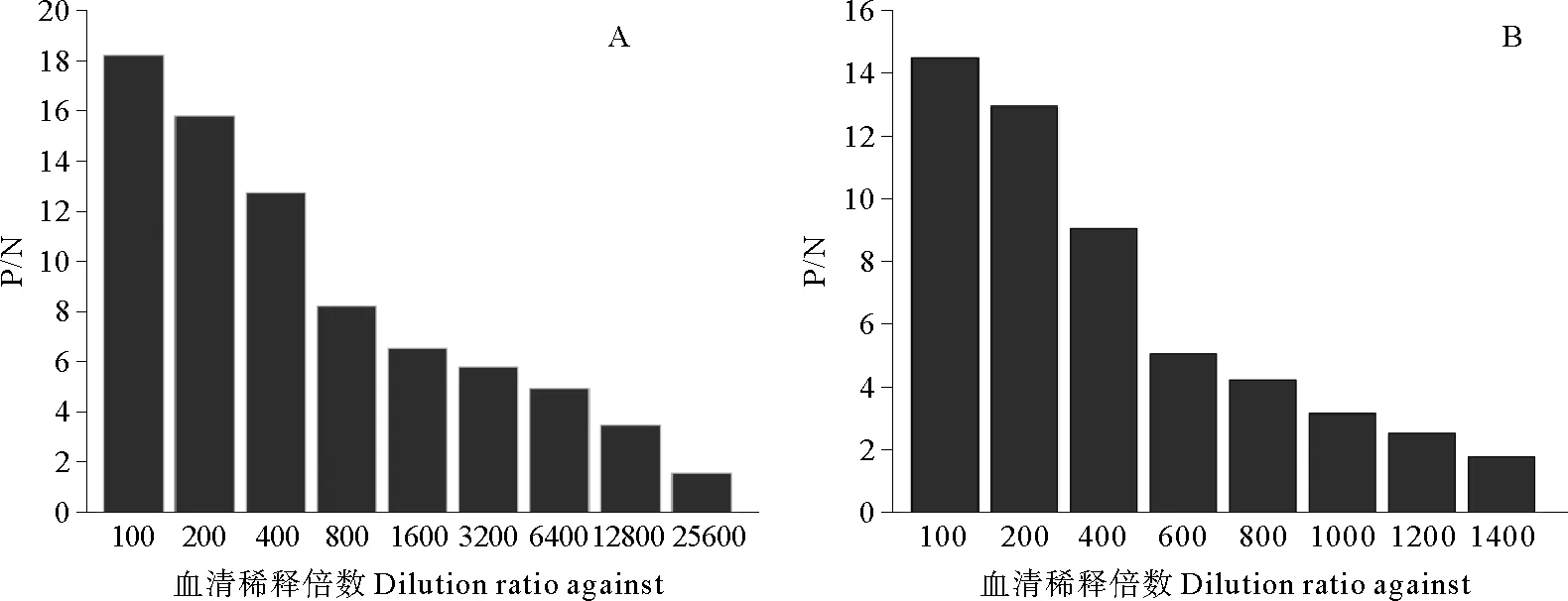
(A:鼠抗CD86血清效价测定结果 Detecting the titer of mouse serum against CD86;B:鱼抗CD86血清效价测定结果 Detecting the titer ofParalichthysolivaceusserum against CD86.)
图3测定抗CD86血清效价结果
Fig.3Detection of the titers of antisera against strain CD86
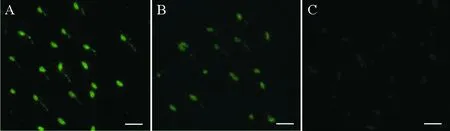
(A:鼠抗血清免疫荧光染色结果;B:牙鲆抗血清免疫荧光染色结果;C:阴性对照。(标尺=5μm)。A: The result of IFAT using mice antiserum; B: The result of IFAT using flounder antiserum; C: Negative control. (bar=5μm).)
图4利用鼠抗及牙鲆抗血清对菌株CD86的免疫荧光染色结果
Fig.4Immunofluorescence staining of strain CD86 using mice and flounder antisera
2.4 菌株CD86全菌蛋白免疫原性分析
Western blotting分析结果显示,鼠抗血清可与菌株CD86全菌分子量为19、25、27、28、29、30、35和37kDa的蛋白条带发生阳性反应;牙鲆抗血清可与菌株CD86分子量为27、30、37和45kDa的蛋白条带发生阳性反应;对比2种血清阳性反应蛋白条带发现,鼠抗血清和牙鲆抗血清均可与分子量为27、30和37kDa蛋白条带发生阳性反应;而分子量为19、28、29和35kDa的蛋白条带仅与鼠抗血清发生阳性发生,分子量为45kDa的蛋白条带仅与牙鲆抗血清发生阳性反应(见图5)。
3 讨论
人工感染实验显示,从患腹水症牙鲆体内分离的优势菌株CD86对健康牙鲆具有较高的致病力,且感染后鱼体表现出自然发病鱼体的典型症状,主要包括腹水及肠炎的出现,因而可以判定本研究分离的菌株CD86为牙鲆腹水症的病原菌。菌株CD86生理生化鉴定结果显示,其生化指标与标准菌株相吻合,但与张晓君等[6]报道的鱼肠道弧菌在β-半乳糖甙酶指标存在差异,推测其可能是由于不同地区分离菌株的变异造成的。通过对菌株CD86的16S rDNA序列进行同源性比对分析显示该序列与数据库中鱼肠道弧菌相似度最高,基于16S rDNA序列构建的系统进化树也显示菌株CD86与鱼肠道弧菌聚为一支。结合生化特性以及16S rDNA序列分析结果,判定菌株CD86为鱼肠道弧菌。
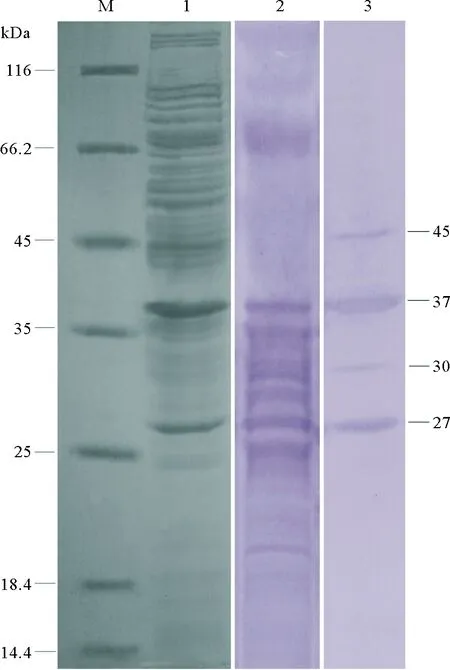
(M:蛋白质分子量标准;1:菌株CD86全菌SDS-PAGE结果;2:鼠抗血清Western blotting分析结果;3:牙鲆抗血清Western blotting分析结果。M: Marker; 1: SDS-PAGE of total bacterial proteins of strain CD86; 2: The result of Western blotting using mice antiserum; 3: The result of Western blotting using flounder antiserum.)
图5菌株CD86 SDS-PAGE和Western blotting分析结果
Fig.5SDS-PAGE and Western blotting of strain CD86
为了分析鱼肠道弧菌的抗原性,本研究分别制备了灭活菌株CD86的鼠抗和鱼抗血清,ELISA检测显示鼠抗血清效价显著高于鱼抗血清,免疫荧光结果同样显示鼠抗血清的免疫荧光阳性信号显著高于牙鲆抗血清,说明小鼠对于相同的菌体抗原表现出较高的免疫应答水平,产生的抗体水平显著高于牙鲆。另外,小鼠血清中产生的免疫球蛋白以IgG为主,牙鲆应答产生的免疫球蛋白以IgM为主,而IgG对抗原的亲和力显著高于IgM[20],这也与2种抗血清在效价及免疫荧光反应信号强度上存在差异密切有关。
利用鼠抗血清和牙鲆抗血清通过Western blotting分析了菌株CD86全菌蛋白的抗原性,结果显示鼠抗血清可与分子量在27~37kDa范围内绝大多数的蛋白条带发生阳性反应,而牙鲆抗血清仅与27、30、37、45kDa的4个蛋白条带发生明显的阳性反应,结果说明鼠抗血清和牙鲆抗血清中特异性抗体的种类和丰度存在显著差异,表明小鼠和牙鲆在免疫相同的菌体抗原后抗体应答具有明显差异,小鼠作为高等哺乳动物相比鱼体的抗体应答表现出更强的水平及更高的多样性。研究结果提示,在筛选细菌亚单位疫苗候选蛋白时,利用鱼体自身的免疫血清对病原菌进行抗原性分析,可以准确地反映鱼体对菌体不同抗原的应答情况,抗原性鉴定结果更具参考价值。因此,本研究利用牙鲆抗血清鉴定4条阳性反应条带,特别是45kDa蛋白,其仅与牙鲆抗血清发生阳性反应而未与小鼠抗血清发生阳性反应,它们将作为我们后续研制鱼肠道弧菌亚单位疫苗的重要候选靶标蛋白。另外,与前期鱼肠道弧菌抗性研究结果对比发现[21-22],本研究鉴定的免疫反应阳性蛋白条带在数量和分子量上存在一定差异,推测其原因可能是跟菌株自身特性及培养条件、免疫原的选择与处理方式及免疫动物不同有关。
4 结论
本研究证实分离鉴定的鱼肠道弧菌菌株CD86为引起牙鲆腹水症的病原菌,而利用制备的菌株CD86鼠抗血清与牙鲆抗血清从全菌蛋白中鉴定出的免疫原性蛋白条带存在明显差异,表明牙鲆对菌体抗原产生的抗体应答与小鼠存在一定差异,该结果对研筛鱼用高效的鱼肠道弧菌亚单位疫苗具有重要的参考价值。
[1]闫茂仓, 陈少波, 单乐州, 等. 海水养殖动物致病弧菌的研究进展[J]. 中国水产科学, 2009, 28(8): 475-481.
Yan M C, Chen S B, Shan L Z, et al. A critical review: PathogenicVibrioin maricultural animals[J]. Fisheries Science, 2009, 28(8): 475-481.
[2]陈翠珍, 房海, 张晓君, 等. 牙鲆鱼肠道弧菌感染症及病原特性研究[J]. 热带海洋学报, 2006, 25(5): 80-86.
Chen C Z, Fang H, Zhang X J, et al. Infection and characterization ofVibrioichthyoenteriisolated from flounder(Paralichthysolivaceus)[J]. Journal of Tropical Oceanography, 2006, 25(5): 80-86.
[3]张晓君. 三种海水养殖鱼类的主要细菌性疾病研究[D]. 青岛: 中国海洋大学, 2006: 58-61.
Zhang X J, Studies on the Main Bacterial Diseases in 3 Marine Fish[D]. QingDao: Ocean University of China, 2006: 58-61.
[4]Ishimaru K, Matsushita M, Muroga K.Vibrioichthyoenteria pathogen of Japanese flounder(Paralichthysolivaceus) larvae[J]. International Journal of Systematic Bacteriology, 1996, 46(1): 155-159.
[5]吕俊超, 李轩, 韩茵, 等. 养殖大菱鲆中牙鲆肠弧菌的分离鉴定及组织病理学[J]. 水产学报, 2009, 33(2): 311-317.
Lv J C, Li X, Han Y, et al. Isolation and identification ofVibrioichthyoenteriin farmed turbot(Scophthalmusmaximus)and histopathology study of the diseased fish[J]. Journal of Fisheries of China, 2009, 33(2): 311-317.
[6]张晓君, 陈翠珍, 阎斌伦, 等. 红鳍东方鲀病原鱼肠道弧菌的生物学特性研究[J]. 水生生物学报, 2009, 33(6): 1118-1125.
Zhang X J, Chen C Z, Yan B L, et al. Studies on biological characteristics of pathogenicVibrioichthyoenteriisolated from pufferfish(takifugu rubripsl)[J]. Acta Hydrobiologica Sinica, 2009, 33(6): 1118-1125.
[7]JIANG X B. Isolation and phylogenetic analysis ofVibrioichthyoenteristrains from hapalogenys nitens[J]. Agricultural Biotechnology, 2014, 3(1): 12.
[8]吴晓春, 邓灯, 刘慧, 等. 鱼肠道弧菌单克隆抗体的制备及应用[J]. 大连海洋大学学报, 2013, 28(3): 259-263.
Wu X C, Deng D, Liu H, et al. Preparation and characterization of monoclonal antibodies againstVibrioichthyoenteri[J]. Journal of Dalian Ocean University, 2013, 28(3): 259-263.
[9]刘慧, 邓灯, 王忠, 等. 鱼肠道弧菌免疫检测方法的研究[J]. 青岛农业大学学报(自然科学版), 2011, 28(3): 223-226.
Liu H, Deng D, Wang Z, et al. Studies on immunological detection methods forVibrioichthyoenteri[J]. Journal of Qingdao Agricultural University (Natural Science), 2011, 28(3): 223-226.
[10]程顺峰. 鱼肠道弧菌疫苗制备及免疫保护效果[J]. 中国农学通报, 2009, 25(17): 306-310.
Cheng S F. Preparation of vaccine againstVibrioichthyoenteriand evaluation of the immune efficiency [J]. Chinese Agricultural Science Bulletin, 2009, 25(17): 306-310.
[11]张新明, 程顺峰. 鱼肠道弧菌外膜蛋白疫苗对牙鲆免疫效果的初步研究[J]. 水产科技情报, 2011, 38(2): 106-108.
Zhang X M, Cheng S F. The immunological effects of outer membrane protein vaccine ofVibrioichthyoenterito the flounder (Paralichthysolivaceus)[J]. Fisheries Science & Technology Information, 2011, 38(2): 106-108.
[12]Garrity G M. Bergey′s Manual of Systematic Bacteriology (2nd edn) [M]. New York: Springer-Verlag, 2005: 110.
[13]Polz M F, Cavanaugh C M. Bias in template-to-product ratios in multitemplate PCR[J]. Applied and Environmental Microbiology, 1998, 64(10): 3724-3730.
[14]郭明元, 刘广锋, 冯娟. 1株军曹鱼病原弧菌的鉴定及其系统发育树分析[J]. 中国水产科学, 2006, 13(5): 823-828.
Guo M Y, Liu G F, Feng J. Identification and phylogenetic analysis of a pathogenicVibriosp. isolated fromRachycentroncanadum[J]. Journal of Fishery Sciences of China, 2006, 13(5): 823-828.
[15]李强. 牙鲆免疫球蛋白单克隆抗体的研制及其在牙鲆淋巴囊肿病研究中的应用[D]. 青岛: 中国海洋大学, 2007: 64-72.
Li Q. Development of Monoclonal Antibodies to Immunoglobulin of Japanese Flounder (ParalichthysOlivaceus) and Application in the Study of Lymphocystis Disease[D]. QingDao: Ocean University of China, 2007: 64-72.
[16]张伟妮. 大菱鲆腹水症病原菌的鉴定及其外膜蛋白的抗原性研究[D]. 青岛: 中国海洋大学, 2006: 40-43.
Zhang W N. Identification of a pathogen associated with swollen abdomen of cultured turbot and antigenicity of its outer membrane proteins[D]. QingDao: Ocean University of China, 2006: 40-43.
[17]孙敏, 唐小千, 赵娜, 等. 海豚链球菌胞外产物的抗原性及免疫保护效果研究[J]. 中国海洋大学学报(自然科学版), 2015, 45(4):35-39.
Sun M, Tang X Q, Zhao N, et al. Studies on the antigenicity and immunoprotecive efficacy of extracellular products from some strains ofStreptococcusIniae[J]. Periodical of Ocean University of China, 2015, 45(4):35-39.
[18]董丽, 王印庚, 张正, 等. 养殖大菱鲆细菌性红体病病原菌的分离与鉴定[J]. 海洋科学, 2009, 33(7): 57-63.
Dong L, Wang Y G, Zhang Z, et al. Isolation and identification of the pathogentic bacterium causing red body from cultured TurbotScophthalmusmaximus[J]. Marine Sciences, 2009, 33(7): 57-63.
[19]Gauger E, Smolowitz R, Uhlinger K, et al.Vibrioharveyiand other bacterial pathogens in cultured summer flounder,Paralichthysdentatus[J]. Aquaculture, 2006, 260(1): 10-20.
[20]Tada T, Takemori T. Selective roles of thymus-derived lymphocytes in the antibody response. I. Differential suppressive effect of carrier-primed T cells on hapten-specific IgM and IgG antibody responses[J]. The Journal of Experimental Medicine, 1974, 140(1): 239-252.
[21]王忠, 邓灯, 程顺峰, 等. 鱼肠道弧菌外膜蛋白抗原性分析[J].水产科学, 2010, 29(8): 455-459.
Wang Z, Deng D, Cheng S F, et al. Antigenicity of membrane proteins in pathogenic bacteriumVibrioichthyoenteri[J]. Fisheries Science, 2010, 29(8): 455-459.
[22]唐小千, 战文斌, 周丽, 等. 6种海洋致病性弧菌36kDa外膜蛋白特性分析[J]. 中国海洋大学学报(自然科学版), 2009, 39(2): 197-202.
Tang X Q, Zhan W B, Zhou L. Characterization of 36 kDa outer membrane proteins of six pathogenicVibriospecies[J]. Periodical of Ocean University of China, 2009, 39(2): 197-202.
责任编辑朱宝象
Antigenic Analysis of Total Protein ofVibrioichthyoenteriUsing Mice and Flounder Antisera
ZHANG Ming-Wei, TANG Xiao-Qian, SHENG Xiu-Zhen, XING Jing, ZHAN Wen-Bin
(Laboratory of Pathology and Immunology of Aquatic Animals, Ocean University of China, Qingdao 266003, China)
A dominant bacterial strain named CD86 was isolated from the spleen of flounderParalichthysolivaceuswith ascites. The artificial infection experiment revealed that strain CD86 was quite virulent to healthy flounder with an LD50value of 1.8×105CFU/fish. The biochemical test was performed with Rapid ID32E strip. The results showed that all the detected indexes of strain CD86 were in agreement with the standard strain. Meanwhile, the sequence of 16S rDNA of strain CD86 showed the highest similarity with that ofVibrioichthyoenteriretrieved from the gene bank database.Vibriophylogenetic tree based on 16SrDNA sequences also showed that strain CD86 andV.ichthyoentericlustered into one blade. Combining with its biochemical result we concluded that strain CD86 was actuallyV.ichthyoenteri. Furthermore, healthy mice and flounder were immunized with formalin inactivated strain CD86. The results of ELISA showed that the titers of the antisera from mice and flounder were determined to be 12 800 and 1 200, respectively. Indirect Immunofluorescence assay showed that antisera from mice and flounder could both react with strain CD86, whereas the mice antiserum showed a stronger reaction compared with flounder antiserum. Meanwhile, Western blotting was employed to analyze the antigenicity of the whole bacterial protein of strain CD86 using the antisera from mice and flounder, and the result showed that these two antisera could both reacted with three proteins with molecular weight (MW) of 27, 30 and 37 kDa, and the proteins with MW of 19, 25, 28, 29 and 35 kDa was only recognized by mice antisera, whereas a 45 kDa protein was only recognized by flounder antisera. These results demonstrated that the antibody response patterns of mice and flounder to bacterial antigen were much different, which has important reference value for screening and developing subunit vaccine ofV.ichthyoenteri.
Vibrioichthyoenteri; isolation and identification; ELISA; western blotting; antigenicity analysis; antisera
国家自然科学基金项目(31302216;31472295;31672685);国家重点基础研究发展规划项目(2012CB114406);泰山学者特聘专家项目;国家科技支撑计划项目(2012BAD17B01)资助
2016-02-01;
2016-05-20
张铭伟(1990-),男,硕士生,主要从事水产动物病害与免疫学研究。
❋❋通讯作者:E-mail:tangxq@ouc.edu.cn
S91
A
1672-5174(2016)10-024-08
10.16441/j.cnki.hdxb.20160031
Supported by National Natural Science Foundation of China (31302216; 31472295; 31672685); National Basic Research Program of China(2012CB114406); Taishan Scholar Program of Shangdong Province; National Science and Technology Supporting Program (2012BAD17B01)

