小鼠呼气末CO2分压快速检测方法及其在气道阻力评估中的应用研究*
孙泽,罗明志,陆云,张素娟,邓林红△
(1.常州大学生物医学工程与健康科学研究院暨常州市呼吸医学工程重点实验室,常州213164;2.常州大学机械工程学院,常州213164;3.常州市第一人民医院呼吸内科,213003)
1 引 言
支气管哮喘和慢性梗阻性肺病(chronic obstructive pulmonary disease,COPD)都是以气流受限为特征的呼吸道疾病。这两种疾病都属于气道慢性炎症性疾病,导致气道重塑,同时可见大、小气道的炎症性病变及气道平滑肌痉挛及粘液栓塞气道,最终出现气流限制[1-2],因此,人体气道阻抗是多种呼吸道慢性疾病诊断和病情变化监测的重要指标。目前采用强迫振荡法测算气道阻抗的方法已日趋成熟,并已开发出了相关产品[3-4]。但呼吸阻抗的检测需要大型装置,只能在少数医院才能进行相关监测,且价格昂贵。
与此同时,感染等多种疾病会引起呼吸系统障碍,会在短时间内产生剧烈的呼吸阻抗变化,需要即时监测患者的通气程度和缺氧状况[5],为相关诊断、治疗提供依据[6],因此简单、有效地监测人体呼吸功能变化十分重要。其中检测呼气二氧化碳分压(end-tidal carbon dioxide partial pressure,PetCO2)是一种较为简单、有效评估呼吸功能的手段。CO2分压是呼吸系统监测的重要指标,它可以反映出呼吸功能对酸碱平衡的调节能力和通气程度[7-8]。呼气末 CO2分压和气道阻抗(airway resistance,Rrs)是两个临床诊疗的重要检测指标,但在出现呼吸系统病发时,呼气末CO2分压和呼吸阻抗之间的关系未见相关报道。
鉴于此,本研究自行设计和制作了小型的CO2传感器,并对其检测准确性进行了标定,将该小型CO2传感器耦合至强制振荡小动物肺功能仪的气管插管端,组成能同时测量小鼠呼吸阻抗和呼气末CO2分压的实时监测实验装置。随后,采用这一实验装置实时测量了小鼠模型的呼吸阻抗和呼气末CO2分压,并分析了二者之间的关系。这些实验结果显示,采用本实验方法测量的小鼠呼吸阻抗和呼气末CO2分压呈正相关关系,这为后续采用呼气末CO2分压检测装置,实现快速便捷地检测呼吸阻抗奠定了良好的基础。
2 试验装置设计
2.1 CO2监测传感器及其原理
本研究采用非色散红外技术(non-dispersive infrared-red,NDIR)传感器检测CO2浓度,该技术基于比尔·朗伯定律。当红外线照射于CO2吸收介质表面时,光纤通过一定厚度的CO气体,部分光能被吸收,透射光强度有所减弱,这就是比尔·朗伯定律,其原理见图1。
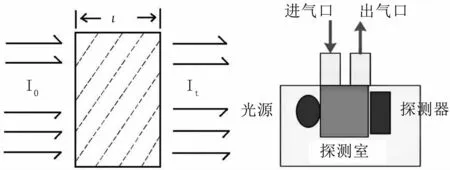
图1 比尔·朗伯定律与红外传感器示意图Fig 1 Schematic diagram of Beer-Lambert's law and infrared sensor
CO2对红外线吸收谱在3.7~4.5μm之间[9],当波长为4.26μm时,CO2对红外线吸收度最强,其吸光度:

I0为入射光强度;It为出射光强度;T为透射比,或称透光度;K为相关系数,可以为吸收系数或摩尔吸收系数;l为吸收介质的厚度(cm);c为吸光物质的浓度(g/L或 mol/L)
2.2 装置设计
CO2传感器型号为S-100H(韩国ELT sensor公司),工作湿度0~95%RH,测量范围0~10 000 ppm,监测精度±30 ppm±3%读数。使用有机玻璃将CO2传感器进行封装,排线由引脚引出,在传感器两端壁上预留出开口,一端一口,其中一端连接Y型管,另一端连接22G针头,见图2。

图2 封装传感器示意图Fig 2 Sketch of sealed sensor
3 试验方法
3.1 试验对象
昆明系小鼠12只,质量20~25 g(常州卡文斯实验动物有限公司)。戊巴比妥钠(德国Merck公司),溶于生理盐水,配制成1%溶液。乙酰甲胆碱(美国Thermo Scientific公司),溶于生理盐水,配制5个浓度的溶液(4、8、16、32和 64 mg/mL)。小动物肺功能测量仪,型号FlexiVent F1(加拿大SCIREQ公司)。
使用戊巴比妥钠作为麻醉剂,乙酰胆碱作为气道收缩剂,通过S-100H红外光学传感器加工封装来监测CO2浓度,并采用肺功能仪维持小鼠的机械通气并监测气道阻抗。
3.2 呼气末CO2监测装置标定
将封装好的传感器进行气密性和准确性的检测,具体操作是在整体管道中完成,一端高于标准大气压状态,另一端通过水锁用容器水封,观察气流通过的程度,并观察封装的腔室内有无异常(进水,回流,起雾等)。准确性检测借助于已知CO2浓度的气体,具体通过反复记录CO2传感套组的实时检测值与活细胞工作站的额定CO2浓度调节值,来线性标定CO2传感套组的准确性,见图3(a)。

图3 标定流程及拟合曲线(a)封装装置标定流程;(b)标定拟合线Fig 3 Process of calibration test and the fitting curve
标定得出拟合方程Y=1128.2210X-0.79439,回归直线的拟合优度R2=0.99833>0.99,可以认为标定测量结果可靠(见图3(b))。本实验中使用的S-100H传感器由于光程固定,无法调节,于是推测这是标定结果比传感器测量的结果要高出约11.28%的主要原因之一。另外在标定过程中,空气湿度也会对测量结果造成一些影响。在后续的试验中,传感器S-100H光程无法调节(略大或略小)所造成的误差将通过使用该拟合方程换算来修正。
3.3 呼吸阻抗和呼气末CO2浓度关系研究
(1)小鼠按100 mg/kg注射1%的戊巴比妥钠,进行麻醉。将麻醉的小鼠上颚部解剖并使用22G针头插管。22G针头连接封装的CO2监测传感装置,传感装置连接小鼠肺功能仪,插管及监测装置连接完成后,由肺功能仪机械通气一段时间,待呼气末CO2浓度与气道阻抗稳定后,开始雾化加入不同浓度(4、8、16、32和 64 mg/mL)的乙酰甲胆碱(Mch)各30μL,从而使小鼠产生不同程度的气道收缩变化,见图4。
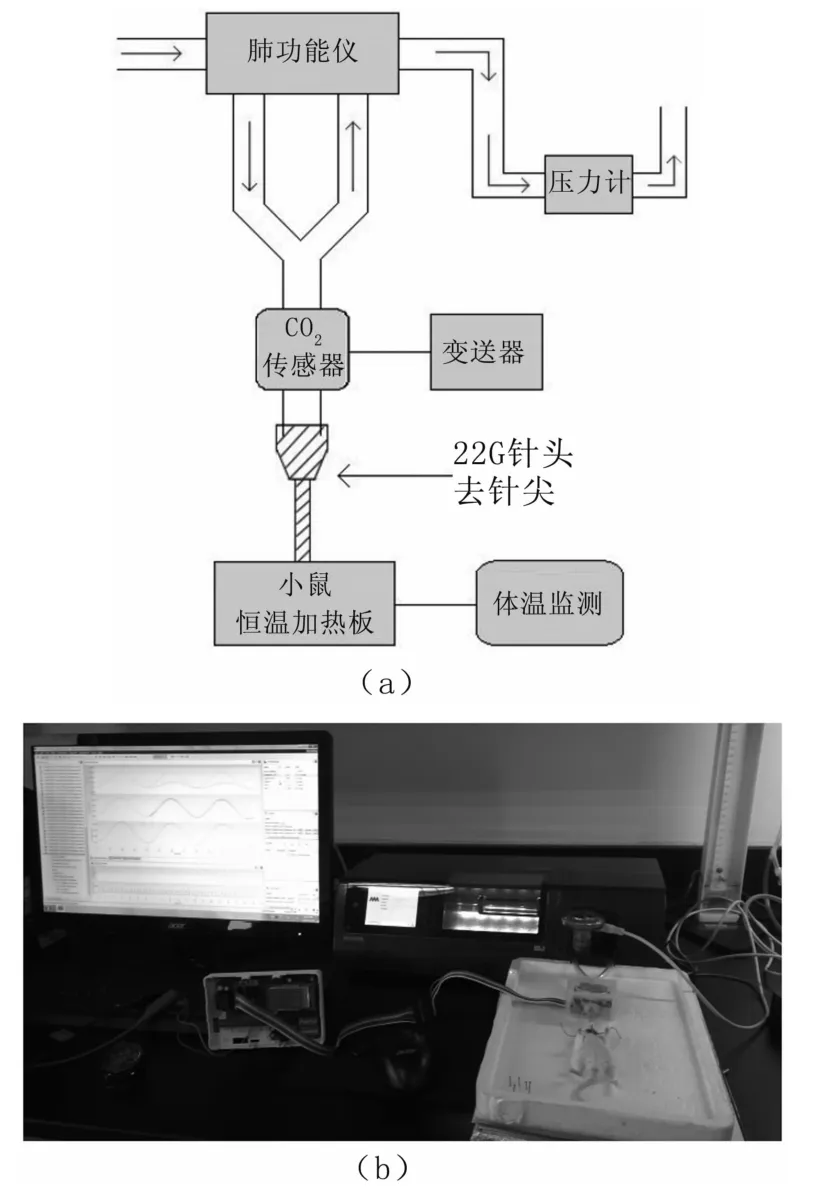
图4 实验流程与监测装置(a)实验流程图;(b)实验检测装置Fig 4 Experimental process and monitoring device
(2)雾化刺激小鼠气道的时间段内,保持一个恒定的通气量(潮气量10.72 mL/kg,约250μL/次,每分钟呼吸150次,呼吸末压力为3 cmH2O),对小鼠呼吸系统机械通气。期间,肺功能仪记录下小鼠受不同浓度Mch刺激时气道阻抗(Rrs)的变化,得到阻抗与时间的关系图(Rrs-t)。同时,连接在肺功能仪测量管道旁路的CO2检测装置持续监测小鼠的呼气末CO2浓度,通过专有的LabView程序,持续发送指令接收传感器反馈来的RS485信号,同时自动将十六进制数据转化为十进制数据并存贮到终端电脑,最后得到呼气末CO2浓度与时间的关系图(CO2-Mch)。
(3)分别获得呼吸阻抗—收缩剂浓度关系图(Rrs-Mch)和呼气末CO2分压—收缩剂浓度关系图(PetCO2-Mch),进而将二者整合在一张时间表图内,分析持续机械通其过程中,不同浓度Mch刺激下,呼吸阻抗与呼气末CO2的相关性。
4 结果
4.1 小鼠气道阻抗功能检测结果
采用不同浓度的Mch刺激小鼠,通过小动物肺功能仪检测其气道阻抗(airway resistance,Rrs)。实验结果表明,随着 Mch浓度的上升(4、8、16、32和64 mg/mL),气道阻抗持续升高(约为 1.5、2、2.5、3.1和3.7cmH2O.s/mL),见图5。
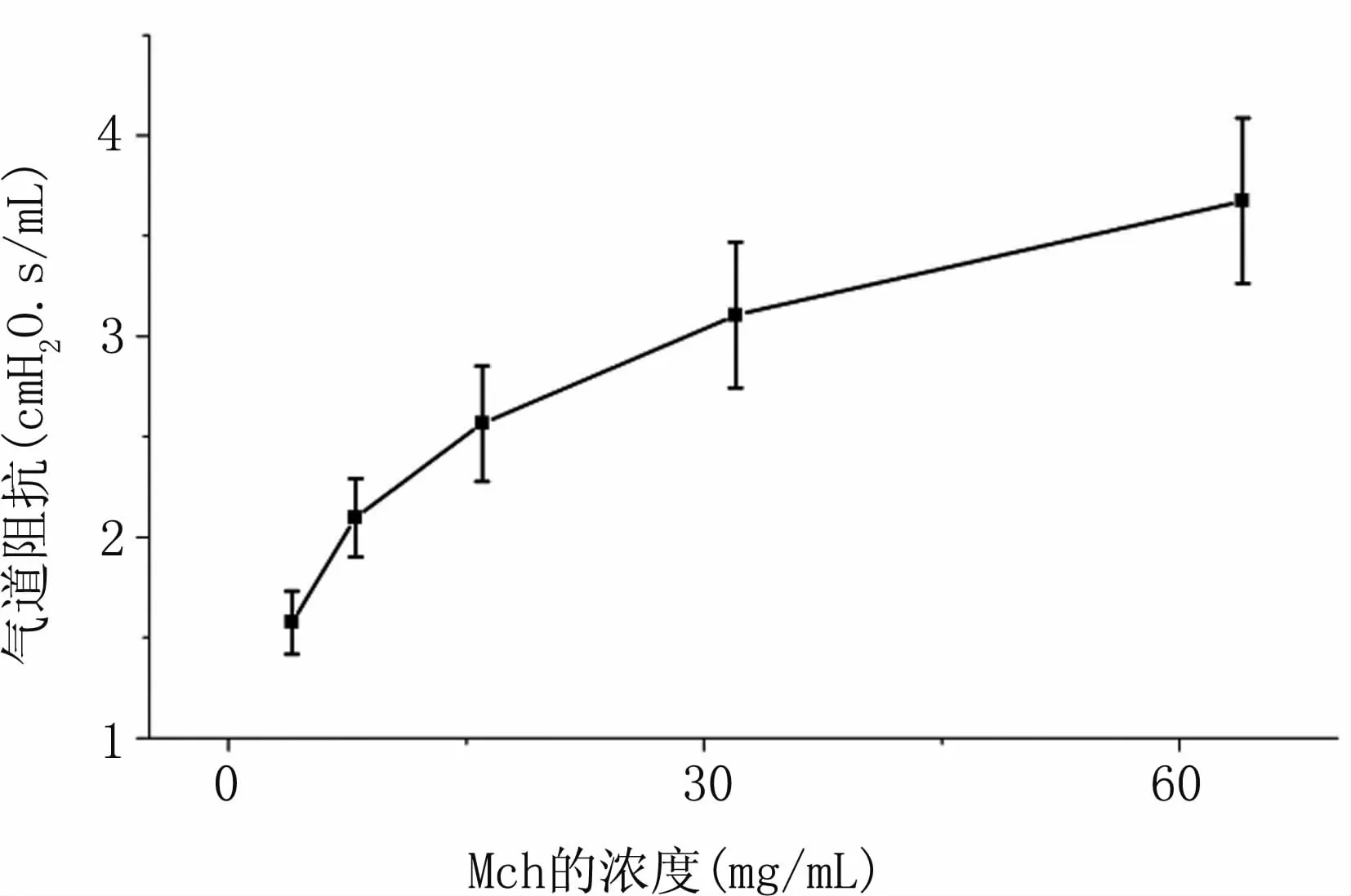
图5 气道阻抗与舒张剂(M ch)浓度关系图Fig 5 Correlation between airway resistance and concentration of the M ch
4.2 小鼠呼出气CO2浓度检测结果
采用不同浓度的Mch刺激小鼠,通过上述自主设计的CO2传感器装置检测其呼出气的CO2浓度。实验结果表明,雾化通入Mch刺激气道后,短时间内小鼠呼出气中CO2的浓度会急剧上升至一个峰值,然后下降至一个稳定值,达到一个新的稳定态。实验中,在下一个稳定态再次通入增高浓度的Mch,可以得到相似的变化过程,见图6(a)。随着Mch浓度的不断上升,实验装置测得的小鼠呼出气中CO2浓度的峰值及稳定态都显示逐层上升的趋势,即呼气末CO2分压(PetCO2)与 Mch浓度的关系,见图6(b)。
4.3 小鼠气道阻抗(Rrs)与呼气末CO2浓度的相关性
将相同实验条件下小鼠呼吸阻抗(Rrs)与其呼气末CO2浓度(PetCO2)整合在同一机械通气时间段内。限定条件为:定容的机械通气,允许通气模式短暂变化,Mch对气道的刺激逐渐增加。横轴为小鼠呼吸阻抗(Rrs)随气道收缩剂Mch浓度增加的变化值,纵轴为同一只小鼠所测得的呼气末气体CO浓度(PetCO2)随气道收缩剂Mch浓度增加的变化值。从观测数据中可以发现,在恒定的机械通气状态下,随着Mch浓度的增加,呼气末CO2浓度增加,气道阻抗也增加,即呼气末CO2浓度与气道阻抗变化呈正相关关系,见图7。
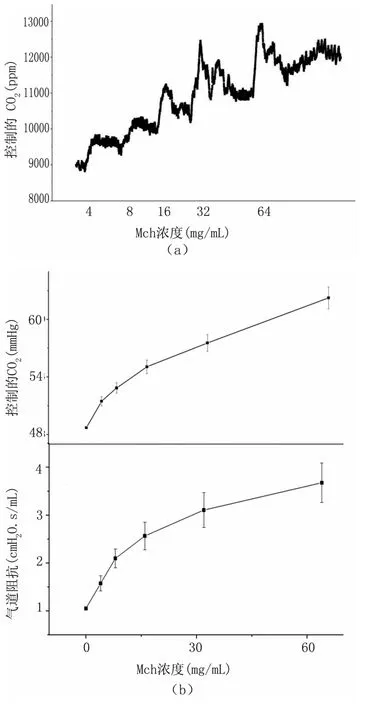
图6 呼气末CO2分压—M ch浓度关系图(CO2-M ch)(a)CO2浓度变化—时间/浓度相关;(b)呼气末CO2分压/单位转换修正与气道阻抗—Mch浓度相关Fig 6 Correlation between Pet CO2 and the concentration of M ch
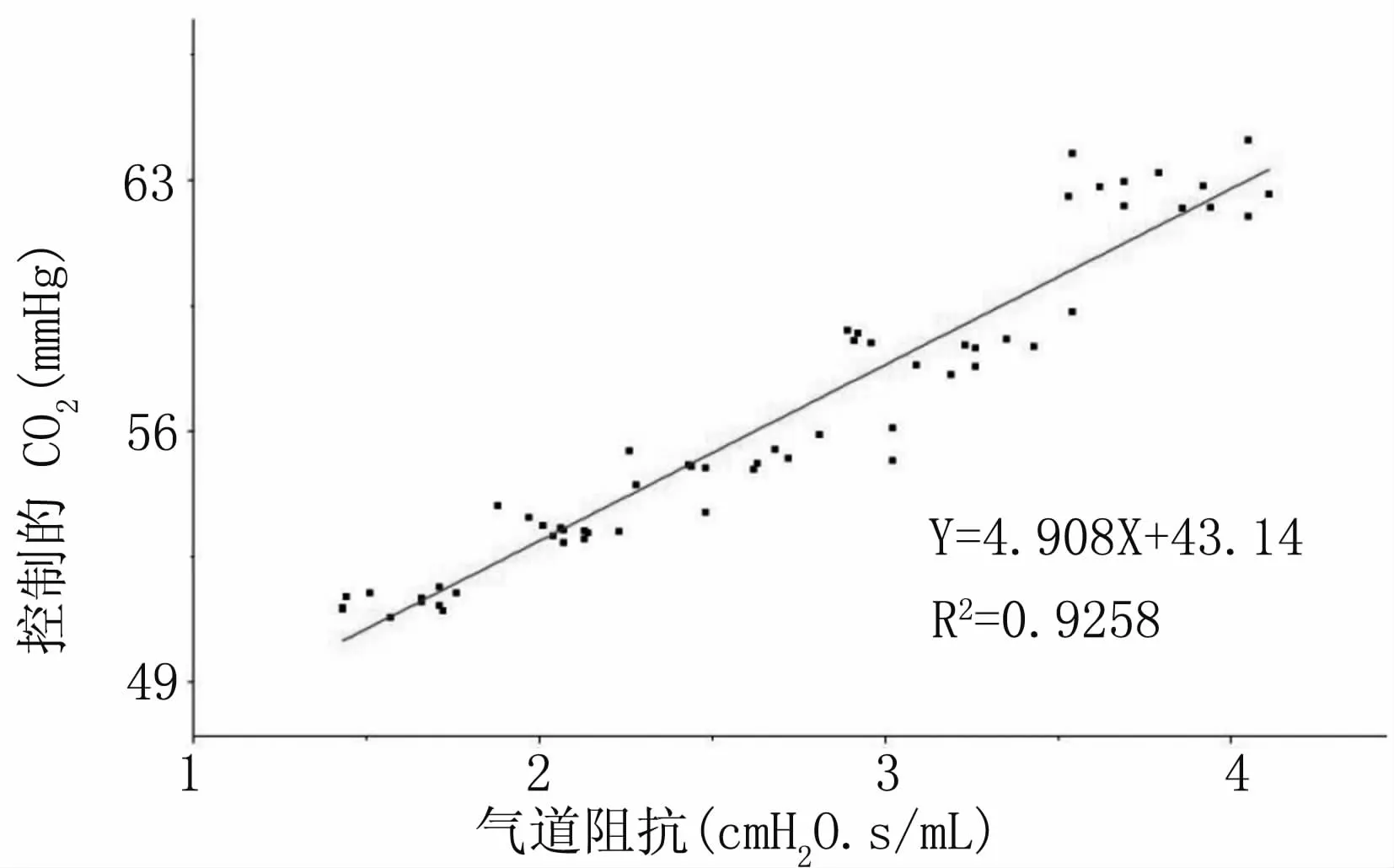
图7 呼吸阻抗与呼气末CO2的相关性图Fig 7 Correlation between Rrs and P CO
5 分析与讨论
实时监测气道阻抗对哮喘、COPD等多种呼吸道疾病的诊断、病理状态评估具有重要意义,目前要检测人体气道阻抗只能到较大型的医院进行,导致患者无法实时、动态的监测其病理状态和对治疗的响应等。呼气末CO2浓度是反应人体呼吸功能状态的一项重要生理指标,目前有多种方法可以快速监测呼气末CO2浓度,同时呼气末CO2浓度可能与气道通气状态有相关性。因此,本研究探究呼气末CO2浓度和气道阻抗的相关性,为利用呼气末CO2浓度监测评估气道阻抗状态提供试验依据。
本实验首先选择依据比尔·朗伯定律的一种价格低廉的红外CO2传感器,并自主设计和制作出一套小型便捷的气体CO2检测系统。随后利用标准CO2浓度的气体对该CO2检测系统进行标定,结果显示该系统对气体CO2浓度的检测有较好的灵敏度和准确性,为后续实验获得可靠的结果提供了保障。
随后,我们采用小鼠模型探究了呼气末CO2浓度与气道阻抗的关系。小鼠是一种良好的呼吸道功能研究动物模型,目前已能在小鼠构建哮喘和慢性炎症等疾病动物模型,具有气道重塑等典型呼吸系统疾病的相似特征[10]。小鼠气道使用收缩剂(如Mch)刺激,会使小鼠气道收缩,短时间内阻抗增加[11]。另外,临床上,随着机械通气量的增加,呼气末CO2的分压会上升[12-13]。由此推论,在一定的机械通气下,随着气道阻抗增加,呼气末CO2分压会随之上升。本实验结果显示,随着Mch浓度的增加,气道阻抗和呼气末CO2浓度不断增加,且二者具有较好的正相关关系。
实验结果还显示在机械通气至稳定的状态下,给呼吸道通入雾化的收缩剂,会瞬时地引发一个急性的气道收缩,导致呼气末CO2分压的检测波形陡增,这与在小鼠肺功能仪上检测到的阻抗变化波形是吻合的。但比较波形从波峰回落至稳定状态的时间,呼气末CO2从波峰回落至稳定状态的周期相对较长。为了降低非实验个体差异化导致的影响,我们对传感检测装置不断进行优化设计,主要通过缩短管体通路,达到对实际检测腔体积的压缩。同时,观测发现在Mch雾化率较高的试验中,小鼠受刺激过程较为明显,个体差异对呼气末CO2峰值的影响有显著的降低,同时,呼气末CO2浓度达到稳定态的时间周期也会相对较短,因此,测量数据可重复性更好。
采用血气分析仪测量正常态昆明系小鼠的血液二氧化碳分压为 5.26±0.49 kPa[14],或 39.45±3.68 mm Hg。在大气压为100 kPa时,计算可得小鼠血液二氧化碳浓度约为52 000 ppm。实验过程中,小鼠在从开始插管到机械通气一段时间达到稳定的监测数值,始终处于8 500至10 000 ppm之间,造成该结果的原因可能是呼吸机气体交换过程中会导入CO2含量低的外界空气。若麻醉状态下小鼠受自主呼吸的影响最小,对多个实验小鼠稳定态的观测可以认为监测时受外界大气的影响程度相同。另外,使用NDIR技术的传感器都会被水蒸气的广域吸收谱所影响,实验中默认小鼠呼吸过程中水汽含量不随时间变化。故数据分析中将呼气末CO2浓度的计算起始基线调整为52 000 ppm,并作为计算所有测量数据的参考值。
对监测装置的设计层面及雾化程度(人工操作层面)的改善,都会使监测过程中气体的交换速度改善,从而使准确度大幅提高。由此推断控制气体置换过程,如雾化率,监测腔大小,置换路径复杂程度,都会影响该监测装置的监测效率及数据的优化程度。
虽然本研究中所采用的检测系统经过多次优化,但其系统在设计上尚不完善。实际检测的结果只是初步验证了该封装CO2传感器检测装置基本可靠,并且可以在一定程度上反映小鼠的机械通气程度与气道收缩程度。采用该装置可以在对小鼠定容机械通气的情况下,实现呼气末CO2浓度的快速准确测量,而且测量所得的CO2浓度值与小鼠呼吸阻抗呈正相关性,表明呼气末CO2浓度的变化间接反映了气道收缩程度的变化。这为临床实践中对呼吸功能的监控,如对哮喘和COPD患者气道阻力、气道高反应性的评估等提供了一种便捷化和普及化的可能途径。
6 结论
本实验设计了一种耦合在肺功能仪上的呼气末CO2分压实时监测系统,并采用该系统对小鼠呼气末CO分压与呼吸阻力关系进行了研究。结果验证了该系统测量的小鼠呼气末CO2分压与呼吸阻力具有显著正相关性,这为后续进一步研发通过呼气末CO2分压变化监测气道阻抗等肺功能参数变化的诊断技术奠定了基础。

