双源CT冠状动脉三维分割算法的研究*
赵洁,蒋世忠,黄展鹏,欧陕兴
(1.广东药科大学医药信息工程学院,广州510006;2.南方医科大学生物医学工程学院广东省医学图像处理重点实验室,广州510515;3.广州军区总医院放射科,广州510010)
1 引 言
据世界卫生组织2008年公布的统计结果,冠心病是当前世界范围内引发死亡的主要原因[1]。早诊断、早治疗是降低死亡率的方法。双源CT图像采集速度比多层螺旋CT快,可以在一个心动周期内采集心脏图像,并且辐射剂量要减少一半以上,在冠心病诊断中发挥着重要作用。但是,一名患者的心脏CT一般要产生大于400张图像,读片会耗费医生大量精力,增加误判率。如何帮助医生从大量CTA数据中准确快速的分割出冠状动脉,是我们研究的主要问题[2]。
冠状动脉的快速准确分割是血管定量、定性测量和疾病诊断的前提。但是由于心脏CTA图像数据量大、冠状动脉和其周边组织灰度比较相近、运动伪影和外部磁场引起的噪声干扰等问题,准确分割非常困难。目前,国内外对冠状动脉提取常规的方法分有:区域生长法、统计学方法、活动轮廓模型法、中心线法、多尺度模型,下面是几种方法的介绍[3-4]。
区域生长法较为简单,速度快,但是生长条件和种子点需人为指定,由于冠状动脉与心室灰度相近,当受到噪声和对比剂不均匀影响时,目标局部会出现孔洞和泄露问题。Metz等[5]在经典区域生长算法的基础上加入分支和泄露检测,提取出冠状动脉的三个大的血管分支,但是小分支仍无法分割。杨荣骞等[6,7]用形态学方法和区域生长法从双源CT数据中分割出心腔和冠状动脉。Tuchschmid等[8]用波传播技术,通过与空间结构一致的方向生长出冠状动脉。
统计学方法包括聚类法、分类器法、马尔科夫模型等。Yan Yang在2004年IEEE EMBS国际会议[9]提出一种基于CT的冠状动脉三维分割算法,具有一定代表性。Lacoste C等[10]利用Markov标记点进行2D造影图像的冠状动脉分割,但是,目前该方法仅限于2D数据,由于3D造影数据计算量庞大,尚未能扩展。
活动轮廓法在医学图像分割上用的较多,效果较好。1988年,Osher和 Sethian[11]提出了利用水平集方法来求解几何曲线的演化。水平集的演化曲线是闭合的,可以较好的收敛到目标边缘。但是,传统水平集存在对噪声敏感,弱边缘不易检测,易越过边缘的问题[12]。在对冠状动脉分割上,选取的初始轮廓必须在目标附近,并且由于和邻近组织灰度相近,容易扩展到心腔。针对血管泄露问题,Yan Yang等[13]通过在水平集中加入统计信息进行了改进,可以分割出左冠状动脉,左前降支,左旋支和右冠状动脉的主干,但是更细的血管未实现分割。
中心线血管分割主要包括:(1)跟踪法,(2)最小路径技术。跟踪法通常需要在初始点和分支点进行人工交互,为了自动判断分支结构,Piasque[14]提出利用球和平行六面体的连通分量来判断,蒋世忠、赵洁[15]和黄展鹏[16]提出构造球模型,通过层次聚类算法来自动判断分支。最小路径技术有利于局部病变血管的提取,快速行进法是最小路径技术的优化,可通过优化计算代价函数的欧几里得距离,产生亚像素精度的血管路径[5]。
通过在不同尺度下分析Hessian矩阵的特征值,可以判断每一个体素点是否属于管状结构。基于多尺度空间,Frangi[17]提出血管增强方法,Manniesing[18]提出血管增强扩散模型,均可以有效增强图像中的管状结构。
由于心脏CTA图像数据量大、冠状动脉和其周边组织灰度比较相近、运动伪影和外部磁场会引起噪声干扰等因素,血管的准确分割非常困难,而错误的分割会使重建和测量精确度受到影响,影响医生诊断。在已有的心脏血管分割文献中,一些方法在二维图像中可以很好的分割出血管,但是模型复杂、速度较慢,并不适合三维分割。本研究提出的三维自动分割方法,考虑了血管的形态、灰度和邻域特征,基于Hessian矩阵、统计模型和26邻域生长算法,可以自动分割冠状动脉并精确测量血管狭窄信息。
2 算法设计
为了检测血管,本算法同时从血管形态、灰度特征和邻域关系三个方面考虑。血管的形态是管状的,通过对每个像素点求Hessian矩阵的特征值增强管状结构。增强后的图像,血管区域灰度偏亮,背景区域偏暗,利用统计模型,对血管类和背景类进行高斯建模。在血管类中,通过26邻域生长来约束邻域关系,生长出冠状动脉。算法的流程见图1。
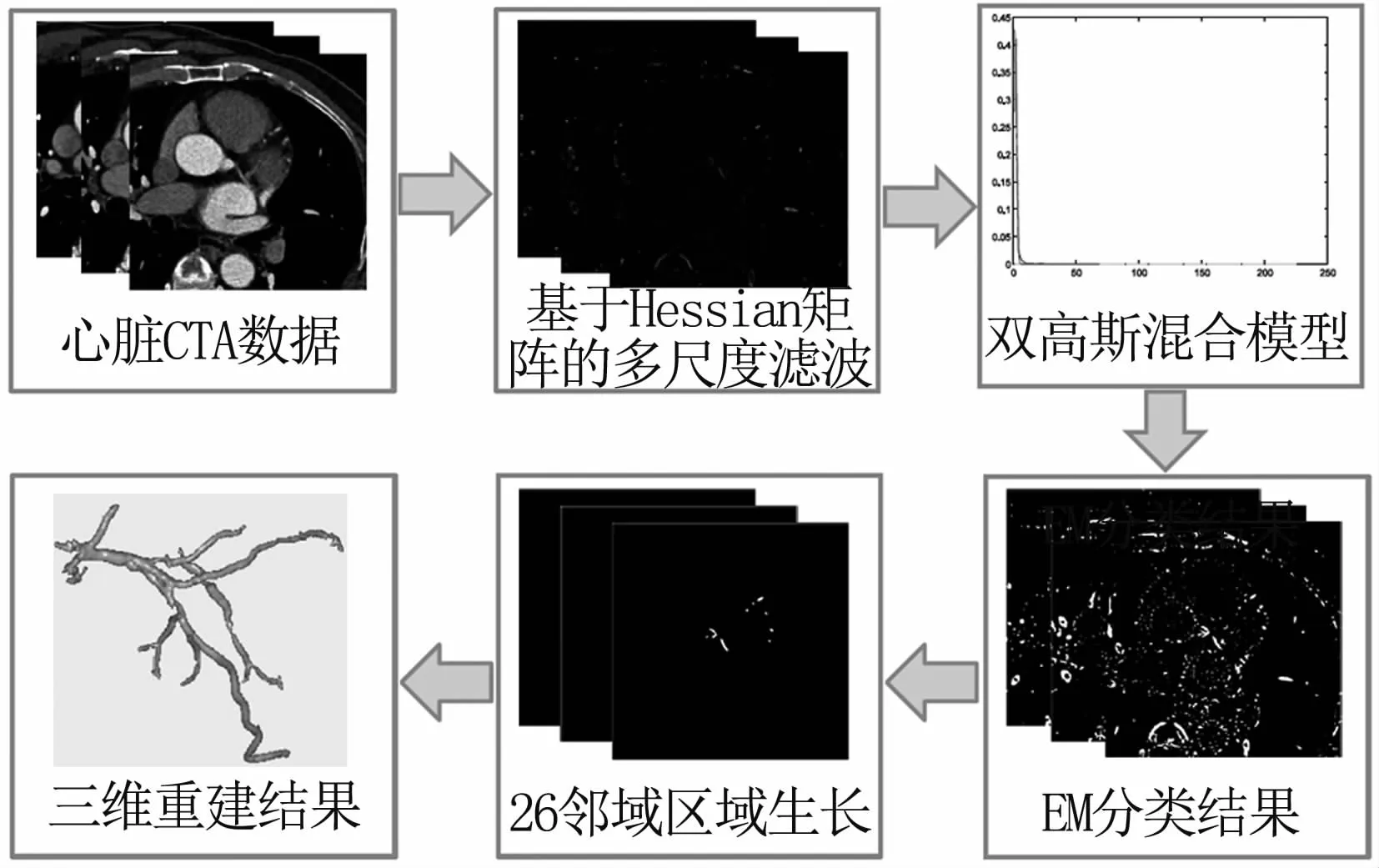
图1 算法流程图Fig 1 the flow chart of the proposed method
3 Hessian矩阵
Hessian矩阵可用来区分图像中的管状,片状,点状结构。冠状动脉的形态是近似管状,因此,利用Hessian矩阵的多尺度滤波可去除其他结构,增强血管。首先,对每个体素做Hessian矩阵运算,见公式(1)。
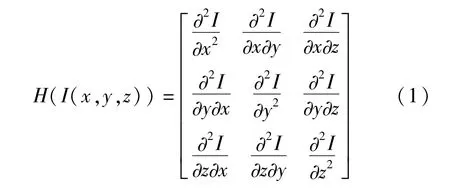
Hessian矩阵的差分被定义为图像与δ阶高斯倒数的卷积,见公式(2)。

对每个体素点的Hessian矩阵计算特征值λ1,λ2和λ3。特征值判断准则见公式(3),可以区分管状结构,如血管[15]。

Frangi定义了血管检测的方程:

其中:
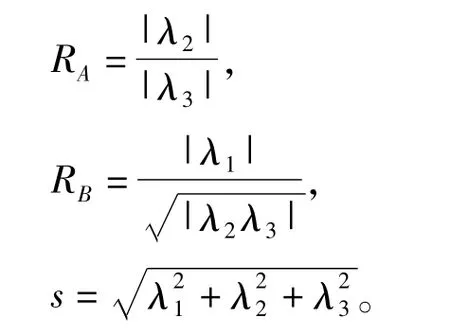
为增强冠状动脉,消除其他组织和主动脉,滤波尺度定为[13],步长为0.5。
4 概率决策分类
高斯混合模型假设每一类组织符合同一高斯分布,整个体数据的分布由各组织类的高斯概率线性组合而成。
在上一步骤中,通过Hessian矩阵增强了图像中的管状结构。假设增强后的图像分为2类,分别为背景和管状区。管状区包含血管、骨骼等管状结构和少量噪声。总的体数据概率分布由这2类组织的高斯概率密度混合而成,见式(5),wk为每一类所占的权重。
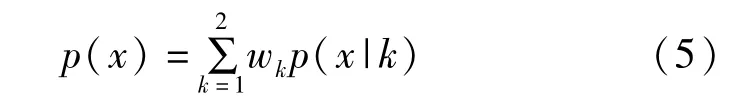
每一类组织符合同一高斯分布,见式(6)。
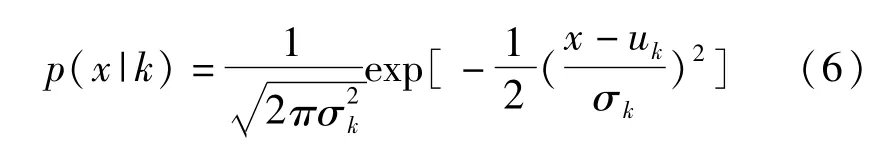
参数wk,uk,σk依靠最大期望算法估计。
E步利用分布参数计算每个实例的聚类概率,见式(7),t代表迭代步数。
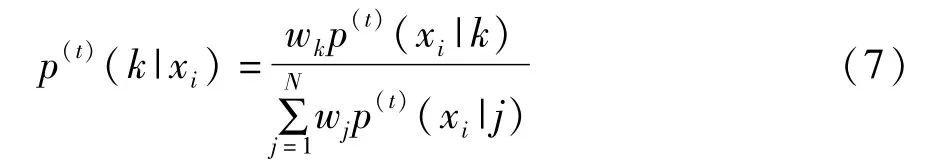
M步用最大似然估计重新估计分布参数,得到:
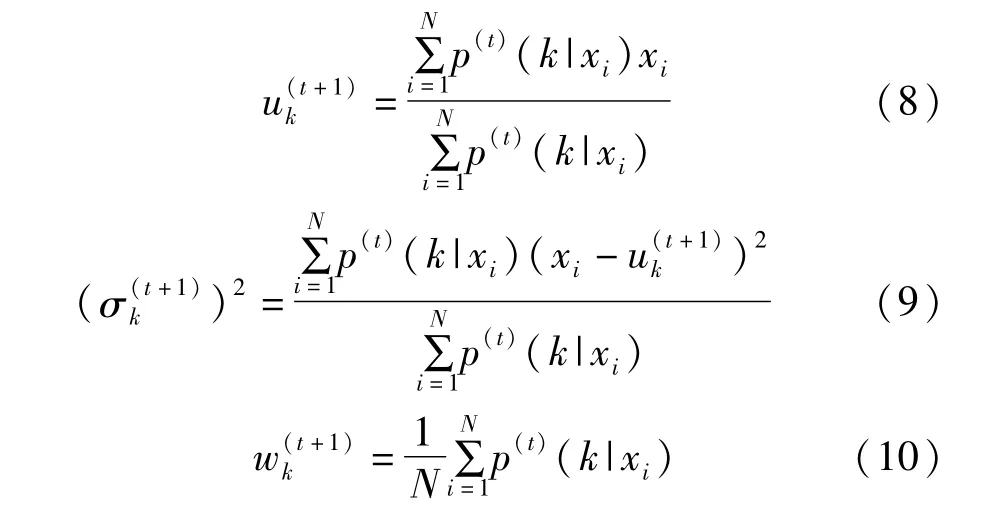
EM两步反复迭代直至收敛,得到高斯混合模型的参数。然后对每一个体素判别属于哪一类,判别条件为 wkp(x|k)>wjp(x|j),k~=j时属于第 k类[19-20]。
5 三维区域生长
概率决策分类后数据被分为2类,血管类和背景[21]。在冠状动脉上设置种子点,在三维体数据中进行区域生长,生长步骤如下:
(1)将种子点标记为1。
(2)搜索种子点26邻域,如果阈值小于设定值,则合并到种子区域,并将其置为1。
(3)直到无邻域点满足条件时生长截止。
由于在三维区域生长算法之前约束了血管形状和灰度,去除了心室等区域,可以在生长过程中避免泄漏。
6 实验结果
实验数据来自广州军区总医院的SOMATOM Definition双源CT,采用心电门控技术获取的心脏双源CT三维数据,分辨率为512×512×411。图2为位于一组CT序列的第1帧、第40帧和第60帧切片。

图2 心脏CTA图像(第1、40、60帧)Fig 2 Cardiac Computed tomography angiography images(slice1,slice40,slice60)
从图2第40帧和第60帧切片可以看出,左前降支与左回旋支均和左心室空间相邻并且灰度接近。如果直接使用区域生长或活动轮廓等方法进行分割,会发生灰度泄露。
用本研究提出的新方法,首先对体数据每个像素进行Hessian运算,利用式(4)检测出血管,得到图3,可以看出管状结构被增强。

图3 多尺度滤波结果(第1、40、60帧)Fig 3 Multi-scale filtering results(slice1,slice40,slice60)
用双高斯模型,多尺度滤波后的数据可分为背景和血管两大类,因此,三维的血管分割问题变为了双高斯模型的参数估计问题。根据EM算法,估计出每一类组织的均值和方差,拟合出图4。
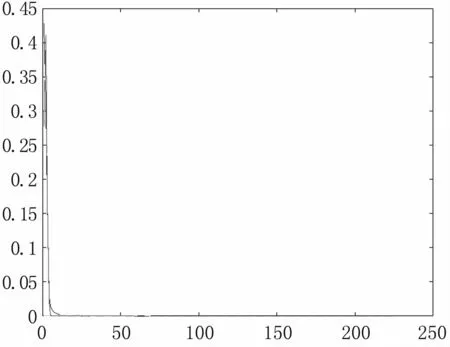
图4 双高斯直方图拟合Fig 4 Double Gaussian histogram fitting
以图4中的参数进行分割,得到分类结果,黑色为背景,白色为血管,见图5。
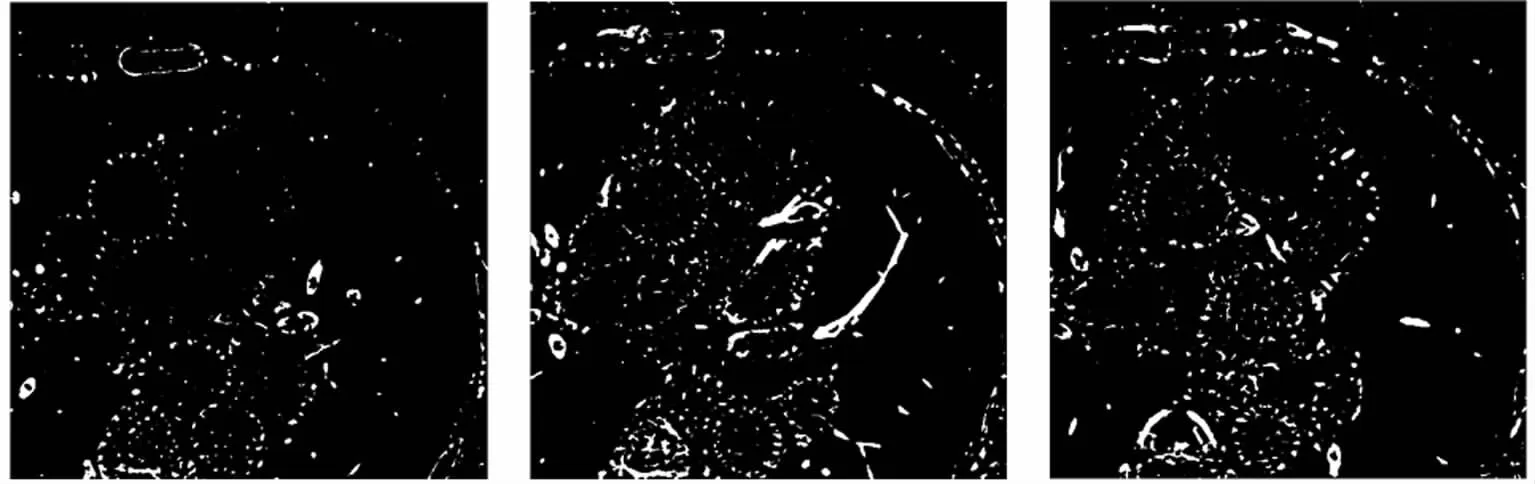
图5 统计分类结果(第1、40、60帧)Fig 5 Statistical classification results(slice1,slice40,slice60)
在冠状动脉与升主动脉结合部分任选1点作为种子点,进行26邻域区域生长,生长结果见图6。因为分类结果已被处理为黑白图,所以生长速度非常快。

图6 三维区域生长结果(第1、40、60帧)Fig 6 Three dimensional region growing results(slice1,slice40,slice60)
将分割好冠状动脉进行三维重建,可以看到血管的三维效果图,见图7,左冠状动脉重建效果较好,避免了血管泄露问题,无伪血管,动脉狭窄清晰可见。
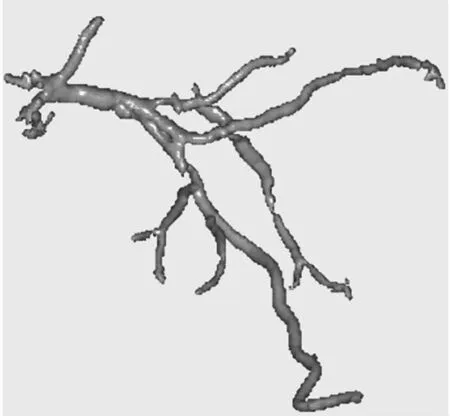
图7 左冠状动脉三维重建结果Fig 7 Three dimensional reconstruction of left coronary artery

图8 中心线提取结果Fig 8 Centerline extraction result
图8中明显有冠状动脉狭窄,狭窄处仅为1~2个像素宽,但本文算法依然可以正确分割,没有发生断裂。
为了对所提算法进行定量分析,本研究测试了MICCAI08中已手工标注了冠状动脉中心线的数据,数据来源于SOMATOM Definition,分辨率为512×512×288。图9为算法分割的冠状动脉中心线与金标准之间的对比。
根据鹿特丹冠状动脉评价软件计算[22],本研究分割的中心线与金标准之间的重合率为89%,经广州军区总医院放射科医生评价,主要的三级冠状动脉基本提取,符合医学诊断要求。
7 小结
本研究所提算法结合了血管灰度特征、形态特征和结构特征,基于统计分类,多尺度Hessian血管增强和三维区域生长构建出心脏血管模型。新算法对冠状动脉的分割比较准确,避免了灰度泄露等问题,重建效果好,能很好的应用于心脏双源CTA序列图像。正确的分割出冠状动脉是心血管疾病诊断的基础,下一步工作要解决的问题是自动检测冠状动脉狭窄,辅助医生实施合理的心血管疾病辅助诊断和心脏手术规划。

图9 本文算法中心线分割结果与金标准比较(a)本文算法;(b)金标准Fig 9 Comparison between the results of the proposed method and golden standard(a)the proposed algorithm(b)golden standard

