白藜芦醇对大鼠代谢网络通量的影响
胥连杰,王会松,庞广昌*
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
白藜芦醇对大鼠代谢网络通量的影响
胥连杰,王会松,庞广昌*
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
本研究设置了对照组以及白藜芦醇低、中、高3 个剂量(2、20、200 mg/kg)实验组,每组各6 只雄性大鼠,对灌胃后的大鼠建立代谢网络模型,进行乳酸代谢网络通量的研究。结果表明:在给大鼠喂食2 mg/kg的白藜芦醇时,机体分解代谢降低,但当白藜芦醇的剂量为20 mg/kg时,机体分解代谢增加,当白藜芦醇剂量为200 mg/kg时,机体分解代谢增加趋势更为明显。在白藜芦醇剂量为2 mg/kg时,机体分解代谢最低,低剂量的白藜芦醇可能有助于现代文明病的预防和治疗。当剂量达到200 mg/kg时,机体分解代谢明显增强,说明它可能会对机体造成毒副作用。显然,白藜芦醇只能在一定的剂量范围内发挥保健作用。
白藜芦醇;代谢通量;大鼠
大量研究报道证明,白藜芦醇对多种生物有明显的延寿作用,其中使酵母菌的寿命延长了接近50%[1-2]。将白藜芦醇作用于高脂饮食的老鼠,能改进机体的各项健康参数,包括葡萄糖稳态、耐受性和胰岛素抵抗[3-4],所以建议把白藜芦醇作为卡路里限制的模拟物[5-6]。卡路里限制引起的代谢缓慢可以延长寿命,并可以预防现代文明病,该发现已在很多模式生物中得到证实[7-8]。Sirtuintype(sirt)是哺乳动物中一种依赖烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+,辅酶Ⅰ)的组蛋白去乙酰化酶,有研究发现白藜芦醇能激活sirt基因[9];sirt基因又是卡路里限制的分子靶点[10-11]。sirt基因家族实际上是通过利用中间代谢物,如乙酰辅酶A(acetyl coenzyme A,AcCoA)、琥珀酰CoA、NAD+等,通过促进核小体的修饰控制主要代谢途径中酶的基因表达[12],进而控制代谢活性从而延长生物寿命[13]。在自然界,往往分解代谢越旺盛的生物寿命越短,相反代谢越缓慢生物相对寿命也越长。sirt基因家族其相应的功能就是降低中心代谢途径的分解代谢,并且sirt基因家族的3 种底物NAD+、还原型辅酶Ⅰ(NADH)、AcCoA都在中心代谢途径中发挥重要作用[14-18]。
高等动物需要通过血液循环在细胞、组织和器官之间进行能量、代谢物质流通与信息交换,以维护其基本生命活动。在生物体内血液构成了整个机体进行物质、能量和信息交流的动力系统,从而实现代谢途径和代谢网络贯穿于不同组织、器官和细胞间。乳酸能够穿梭在组织、细胞和细胞器中,在调节机体合成与分解代谢中发挥关键作用[19]。其作为一种中间产物参与糖酵解、生物合成和生物氧化,在调节中心代谢途径中起到了信号调节作用[20]。由此可见,乳酸代谢通量已经成为分解代谢的重要标志[21],乳酸盐通量增加,分解代谢增强。据此通过研究白藜芦醇对大鼠中心代谢途径的作用,对白藜芦醇健康和延寿机制进行探索。
1 材料与方法
1.1材料与试剂
Sprague-Dawley(SD)雄性大鼠(许可证号:SCXK-2012-0004),8 周龄左右,体质量为(220±20)g 中国人民解放军军事医学科学院实验动物中心。
白藜芦醇、4-羟乙基哌嗪乙磺酸(4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid,HEPES)、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、1,3-二磷酸甘油酸(1,3-diphosphoglycerate,1,3-BPG)、二羟基苯乙酮(dihydroxyacetophenone,DHAP) 美国Sigma公司;羧甲基纤维素 上海阿拉丁生化科技股份有限公司;KCl、MgSO4生工生物工程(上海)股份有限公司。
1.2仪器与设备
3K15高速冷冻离心机 美国Sigma公司;J2-21高速冷冻离心机 美国Beckman公司;HVE-50哈雅玛高压灭菌器 日本Hirayama Manufacturing公司;SBA-40C生物传感器分析仪 山东省科学院生物研究所。
1.3方法
1.3.1动物实验
在实验过程中,24 只大鼠都饲养在12 h /12 h的昼夜循环环境中,并保持环境温度25 ℃左右。在此期间大鼠自由摄食及饮水,给大鼠喂养普通饲料1 周后,随机分为对照组和实验组(低、中、高剂量白藜芦醇),每组6 只,白藜芦醇用0.5%的羧甲基纤维素溶解[22]。所有大鼠在上午8点进行灌胃,对应剂量分别为2、20、200 mg/kg。在灌胃后的2.5、3.5 h后进行眼眶取血。将采集到的血液样品静置,然后4 ℃、2 000 r/min离心10 min分离得到血清,将血清分装到离心管中,置于-80℃保存待测[23]。
1.3.2大鼠代谢网络图的构建
根据代谢网络(一个含有多种酶反应的系统,这些反应产生和消耗代谢物,并通过共同的前体物、产物或效应物相互影响)的研究方法及代谢网络的构建原则[24],以白藜芦醇为研究对象,以糖酵解(glycolysis,EMP)、磷酸戊糖途径(pentose phosphate pathway,PPP)和三羧酸循环(tricarboxylic acid cycle,TCA)为主要代谢途径,将没有分支的直线反应合并为一个反应,忽略不在研究范围内的代谢途径,减少代谢网络的反应数目,得到如图1所示的代谢网络图,该代谢网络图呈现出整个中心代谢途径的大致构架。
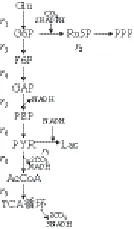
图1 中心代谢途径网络简化图Fig.1 Central metabolic pathways
1.3.3乳酸代谢通量的测定
由图1可知,需要测定的代谢速率有9 个,由胞内中间代谢产物可以确定的质量平衡方程有6 个。假设胞内中间代谢物的量均处于拟稳态,这6 个途径代谢物没有积累,它们的质量平衡方程均为0,这样就可以得到6 个约束向量。此时该系统的自由度F=3。而代谢产物系统中的NADH的代谢速率P、葡萄糖的变化速率r1、乳酸的变化速率r7可通过实验测得,已知速率为3 个,此方程可以得到唯一解(式1),进而通过计算方程(表1、2)得到乳酸的代谢通量[24-25]。

式中:v为葡萄糖、乳酸和NADH的反应速率。

表1 中心代谢途径生化反应方程式Table1 Biochemical reaction equations for central metabolic pathways

表2 质量平衡方程式Table2 Metabolic flux model equations
运用SBA-40C型生物传感器分析仪测定出不同剂量的白藜芦醇对实验动物体内葡萄糖、乳酸的含量,然后分别对其进行时间微分,测定出变化速率用于通量的计算。NADH、NADPH的含量测定采用酶偶联法,通过荧光化学发光检测仪进行测定,参考Teusink等[26]的方法,其反应体系为0.25 mmol/L HEPES/EDTA缓冲液、100 mmol/L KCl、10 mmol/L MgSO4、3 mmol/L 1,3-BPG、0.5 mmol/L DHAP、0.4 U/mL GAPDH。
1.4数据统计分析
使用Matlab 7.0软件以及SPSS 17.0软件进行计算。
2 结果与分析
2.1白藜芦醇作用于实验大鼠所产生的乳酸代谢网络通量
根据1.3.3节测定的葡萄糖、乳酸和NADH的数据进行通量分析,利用Matlab 7.0数据处理软件,得到对照组和白藜芦醇不同剂量组(2、20、200 mg/kg)的乳酸代谢通量,结果如图2所示。
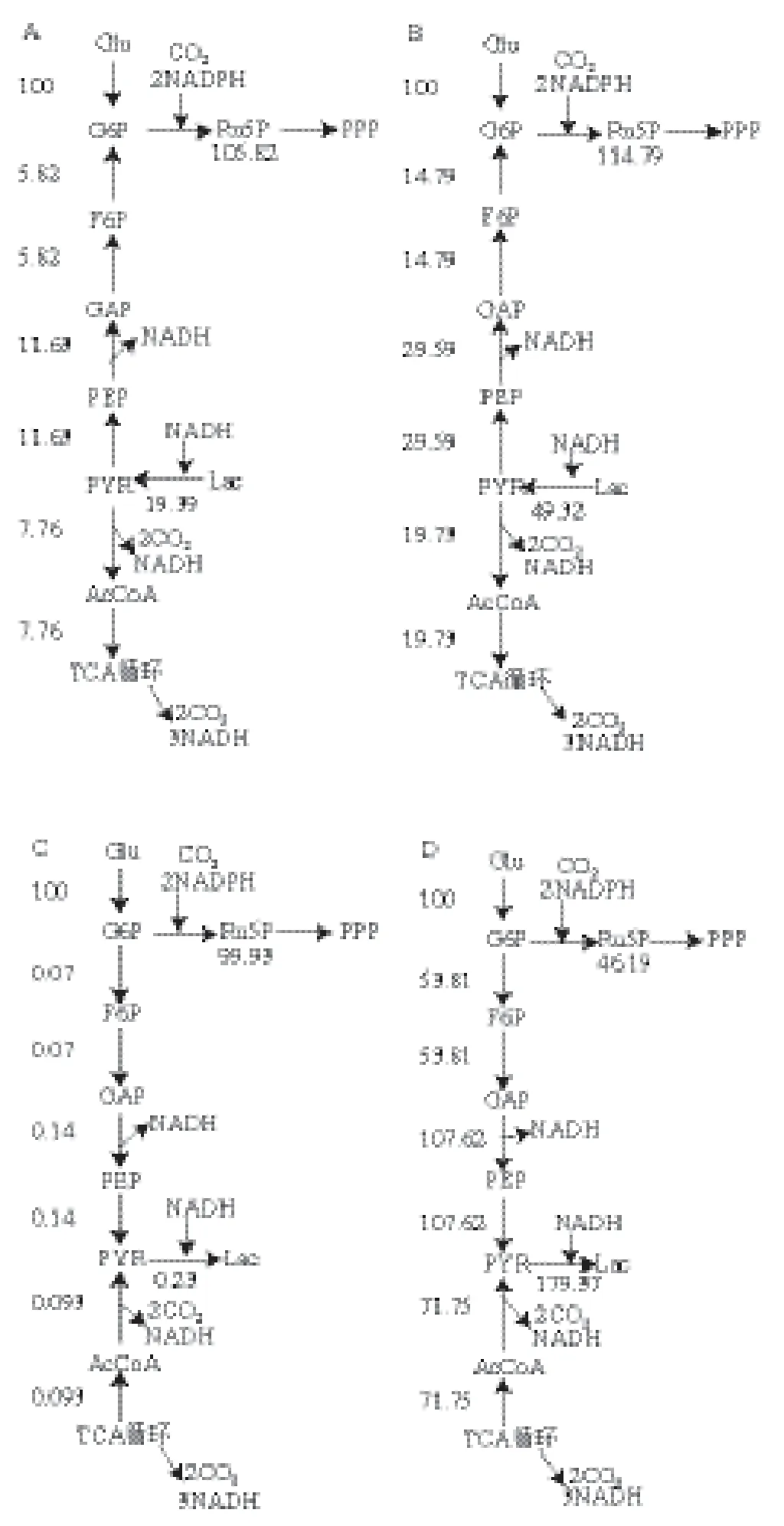
图2 白藜芦醇作用于实验大鼠所产生乳酸通量图Fig.2 Metabolic flux maps of lactic acid for resveratrol groups
2.1.1低剂量白藜芦醇作用于实验大鼠所产生的乳酸代谢网络通量
由图2B可知,给大鼠喂食低剂量(2 mg/kg)的白藜芦醇后与对照组相比乳酸盐通量由-19.39降低到-49.32,机体分解代谢降低,进入PPP的通量由105.82增加到114.79,机体合成代谢增强。一个普遍存在的自然规律是代谢越旺盛的生物寿命越短,代谢越慢的生物相对寿命也越长,延长寿命的本质就是最大程度地降低机体的分解代谢。
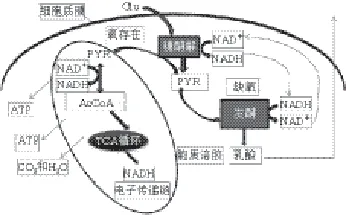
图3 丙酮酸的代谢流向图Fig.3 Metabolic flux direction of pyruvic acid
由图3可知,当氧气充足(机体呼吸不受限)时Glu主要由丙酮酸脱氢酶复合物催化生成 AcCoA,进入TCA循环,生成NADH,通过氧化磷酸化作用转变为NAD+,为机体提供能量。蛋白质的乙酰化过程需要用到代谢中间物-AcCoA作为底物,而去乙酰化酶中包含了一大类以NAD+作为底物的催化酶——沉默信息调节因子(sirt)[27-28]。乙酰化与脱乙酰化通过修饰核小体、组蛋白传递信号途径,乙酰化传递的是AcCoA过剩的信号,脱乙酰化传递的则相反。乳酸盐通量减少,机体氧化供能降低,通过氧化磷酸化为机体提供能量。白藜芦醇可能模拟卡路里限制,降低机体的代谢水平,这说明此剂量的白藜芦醇可能在对抗现代文明病以及延寿方面有积极的作用[6]。
2.1.2中、高剂量白藜芦醇作用于实验大鼠所产生的乳酸代谢网络通量
由图2C可知,给大鼠喂食中剂量20 mg/kg的白藜芦醇后相对于对照组,乳酸盐通量由-19.39增加到0.23,机体分解代谢升高,进入PPP的通量由105.82降低到99.93,机体合成代谢降低。喂食白藜芦醇中剂量20 mg/kg,机体分解代谢增强,但是增强的趋势不明显。如图2D所示,给大鼠喂食高剂量200 mg/kg的白藜芦醇后相对于对照组乳酸盐通量由-19.39增加到179,机体分解代谢升高,进入PPP的通量由105.82降低到46.19,机体合成代谢降低。喂食白藜芦醇高剂量200 mg/kg时,机体分解代谢大幅度增强。
由图3可知,当机体氧化呼吸链受限或者氧气不足的情况,线粒体内的氧化磷酸化过程受到阻碍。PYR转化为AcCoA进入TCA循环的过程受限,通过大幅提高乳酸脱氢酶的浓度使PYR流向Lac,重新获得NAD+来维持NADH/NAD+比例的平衡,机体把剩余的H+交给Lac,机体以乳酸盐的形式在血液进行不断地循环,血液中的乳酸盐含量增加。由图2C、D可知,当白藜芦醇超过一定限度时(排除受试对象本身的原因),乳酸盐通量增加,机体氧化供能增加。
从所有生物寿命与分解代谢的关系可知,本实验所有受试对象都不在运动或者应激状态下,所以推断白藜芦醇在小剂量时发挥抗炎作用,对由营养过剩导致的代谢紊乱疾病、机体应激状态以及免疫过强导致的自身免疫性疾病所引发的炎症起到减轻作用;对于机体来说可能在预防现代文明病以及延寿方面具有较好作用。当白藜芦醇剂量超过一定限度时,机体的免疫监视作用提高,分解代谢明显升高,机体通过和肠黏膜受体作用向机体传递分解代谢升高的信号[17]使得机体耗能过高、免疫过强,可能会对机体造成毒副作用,这也与Baur[5]和Lagouge[29]等报道的结果相吻合。
3 结 论
在喂食白藜芦醇低剂量2 mg/kg时,机体分解代谢降低,白藜芦醇可能模拟卡路里限制,降低机体的代谢水平,此剂量的白藜芦醇可能在预防现代文明病以及延寿方面发挥积极作用。在喂食白藜芦醇中剂量20 mg/kg时,机体分解代谢增强,但是增强的趋势不大;在喂食白藜芦醇高剂量200 mg/kg时,机体分解代谢明显增强,这说明在白藜芦醇剂量超过一定限度时,就会通过提高免疫监视作用进而增强机体的分解代谢,可能会对机体造成毒副作用,即中、高剂量的白藜芦醇都不利于现代文明病的预防和治疗,也不会发挥延寿作用。
[1] PEARSON K J, BAUR J A, LEWIS K N, et al. Resveratrol delays age-related deterioration and mimics transcriptional aspects of dietary restriction without extending life span[J]. Cell Metabolism, 2008, 8(2):157-168. DOI:10.1016/j.cmet.2008. 06.011.
[2] MEYNET O, RICCI J E. Caloric restriction and cancer: molecular mechanisms and clinical implications[J]. Trends in Molecular Medicine, 2014, 20(8): 419-427. DOI:10.1016/j.molmed.2014.05.001.
[3] VAISERMAN A M, MAROTTA F. Longevity-promoting pharmaceuticals:is it a time for implementation?[J]. Trends in Pharmacological Sciences, 2016,37(5): 331-333. DOI:10.1016/j.tips.2016.02.003.
[4] LIGT M D, TIMMERS S, SCHRAUWEN P. Resveratrol and obesity:can resveratrol relieve metabolic disturbances?[J]. Biochimica et Biophysica Acta (BBA)-Molecular Basis of Disease, 2014, 1852(6):1137-1144. DOI:10.1016/j.bbadis.2014.11.012.
[5] BAUR J A, PEARSON K J, PRICE N L, et al. Resveratrol improves health and survival of mice on a high-calorie diet[J]. Nature, 2006, 444: 337-342. DOI:10.1038/nature05354.
[6] TIMMERS S, KONINGS E, BILET L, et al. Calorie restriction-like effects of 30 days of resveratrol supplementation on energy metabolism and metabolic profile in obese humans[J]. Cell Metabolism, 2011,14(5): 612-622. DOI:10.1016/j.cmet.2011.10.002.
[7] HU Y, LIU J, WANG J, et al. The controversial links among calorie restriction, SIRT1, and resveratrol[J]. Free Radical Biology & Medicine, 2011, 51(2): 250-256. DOI:10.1016/ j.freeradbiomed.2011.04.034.
[8] YAN Y L, PETERSON C M, Ravussin E. Resveratrol vs. calorie restriction: data from rodents to humans[J]. Experimental Gerontology,2013, 48(10): 1018-1024. DOI:10.1016/j.exger.2013.04.005.
[9] RUSSELL S J, KAHN C R. Endocrine regulation of ageing[J]. Nature Reviews Molecular Cell Biology, 2007, 8(9): 681-691. DOI:10.103 8/ nrm2234.
[10] DIRK B, WU J, CUMINE S, et al. Resveratrol is not a direct activator of sirt1 enzyme activity[J]. Chemical Biology & Drug Design, 2009,74(6): 619-624. DOI:10.1111/j.1747-0285.2009.00901.x.
[11] DENU J M. Fortifying the link between SIRT1, resveratrol, and mitochondrial function[J]. Cell Metabolism, 2012, 15(5): 566-567.DOI:10.1016/j.cmet.2012.04.016.
[12] CANT☒ C, MENZIES K J, AUWERX J. NAD+, metabolism and the control of energy homeostasis: a balancing act between mitochondria and the nucleus[J]. Cell Metabolism, 2015, 22(1): 31-53. DOI:10.1016/ j.cmet.2015.05.023.
[13] CANT☒ C, AUWERX J. Caloric restriction, SIRT1 and longevity[J]. Trends in Endocrinology & Metabolism Tem, 2009, 20(7): 325-331.
DOI:10.1016/j.tem.2009.03.008.
[14] BROOKS G A, DUBOUCHAUD H, BROWN M, et al. Role of mitochondrial lactate dehydrogenase and lactate oxidation in the intracellular lactate shuttle[J]. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(3): 1129-1134.DOI:10.1073/pnas.96.3.1129.
[15] COPPARI R. Metabolic actions of hypothalamic SIRT1[J]. Trends in Endocrinology & Metabolism, 2012, 23(4): 179-185. DOI:10.1016/ j.tem.2012.01.002.
[16] CHOWDHURY S K R, DOBROWSKY R T, FERNYHOUGH P. Nutrient excess and altered mitochondrial proteome and function contribute to neurodegeneration in diabetes[J]. Mitochondrion, 2011, 11(6):845-854. DOI:10.1016/j.mito.2011.06.007.
[17] IMAI S I, GUARENTE L. Ten years of NAD-dependent SIR2 family deacetylases: implications for metabolic diseases[J]. Trends in Pharmacological Sciences, 2010, 31(5): 212-220. DOI:10.1016/ j.tips.2010.02.003.
[18] 庞广昌, 陈庆森, 胡志和, 等. 过度营养与人体代谢和疾病关系的研究进展[J]. 食品科学, 2013, 34(15): 373-396. DOI:10.7506/spkx1002-6630-201315075.
[19] 庞广昌, 陈庆森, 胡志和. 乳酸盐代谢及其在健康中的关键作用[J].食品科学, 2012(1): 1-15.
[20] 李阳, 王兴亚, 王茜茜, 等. 乳酸盐通量及其控制分析:食品功能的定量化评价方法[J]. 食品科学, 2015, 36(1): 185-190. DOI:10.7506/ spkx1002-6630-201501035.
[21] FAIZ H, CONJARD-DUPLANY A, BOGHOSSIAN M, et al. Cadmium chloride inhibits lactate gluconeogenesis in isolated human renal proximal tubules: a cellular metabolomic approach with 13 C-NMR[J]. Archives of Toxicology, 2011, 85(9): 1067-1077.
DOI:10.1007/s 00204-010-0633-6.
[22] 周逸亭, 万云, 黄杉, 等. 白藜芦醇改善高脂饮食小鼠的糖代谢并棕化腹股沟白色脂肪[J]. 上海医药, 2014(1): 55-58.
[23] 李阳. 不同加工方法的食品对人体中心代谢途径的作用[D]. 天津:天津商业大学, 2015: 48-50.
[24] STEPHANOPOUHOS G N, 赵学明, 白冬梅, 等. 代谢工程: 原理与方法[M]. 北京: 化学工业出版社, 2003: 110-133.
[25] 白冬梅, 付卫明, 赵学明, 等. 代谢通量分析优化米根霉R1021发酵生产L(+)-乳酸过程[J]. 食品与生物技术, 2002, 21(6): 554-558.DOI:10.3321/j.issn:1673-1689.2002.06.002.
[26] TEUSINK B, PASSARGE J, REIJENGA C A, et al. Can yeast glycolysis be understood in terms of in vitro, kinetics of the constituent enzymes? testing biochemistry[J]. European Journal of Biochemistry,2000, 267(17): 5313-5329. DOI:10.1046/j. 1432-1327.2000.01527.x.
[27] 明轩, 江松敏. 代谢酶乙酰化修饰对新陈代谢的调控[J]. 生物化学与生物物理进展, 2013, 40(2): 130-136.
[28] 高洋, 庞广昌. 白藜芦醇对SIRT1的调节作用及SIRT家族对代谢综合征的防治意义[J]. 食品科学, 2011, 32(23): 352-357.
[29] LAGOUGE M, ARGMANN C, GERHART-HINES Z, et al. Resveratrol improves mitochondrial function and protects against metabolic disease by activating SIRT1 and PGC-1alpha[J]. Cell, 2006,127(6): 1109-1122. DOI:10.1016/j.cell.2006.11.013.
Effect of Resveratrol on Metabolic Network Flux in Rats
XU Lianjie, WANG Huisong, PANG Guangchang*
(Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science,Tianjin University of Commerce, Tianjin 300134, China)
A large number of studies have shown that lactic acid metabolism flux can be used to quantitatively describe the state of the body in the condition of normal life. When it is reduced, the body is in good shape; in contrast, when it is increased, the body is in the state of inflammation or detoxification. In recent years, a number of reports have demonstrated the prevention of diseases of modern civilization by resveratrol and it is evident that this effect is closely related to lactate metabolism flux. However, studies on its metabolism in the body have rarely been reported. In the present study, one control group and three resveratrol treatment groups at low, medium and high doses (2, 20 and 200 mg/kg), each consisting of 6 male rats were designed. After the rats were administered by gavage, a metabolic network model for metabolic flux analysis was established. The results showed that the body catabolism was reduced by administration of 2 mg/kg of resveratrol, but it was increased dose-dependently when the dose was over 20 mg/kg. Based on these results, resveratrol at 2 mg/kg could result in the lowest body catabolism, suggesting that it can help prevent and treat diseases of modern civilization. As it resulted in a significant increase in the body catabolism, resveratrol at 200 mg/kg could cause toxic side effects to the body. Therefore,resveratrol can play a role in protecting the body against diseases only in a certain dose range.
resveratrol; metabolic fl ux; rat
10.7506/spkx1002-6630-201619037
TS255.1
A
1002-6630(2016)19-0222-05
胥连杰, 王会松, 庞广昌. 白藜芦醇对大鼠代谢网络通量的影响[J]. 食品科学, 2016, 37(19): 222-226. DOI:10.7506/ spkx1002-6630-201619037. http://www.spkx.net.cn
XU Lianjie, WANG Huisong, PANG Guangchang. Effect of resveratrol on metabolic network flux in rats[J]. Food Science, 2016,37(19): 222-226. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201619037. http://www.spkx.net.cn
2016-04-15
国家自然科学基金面上项目(31371773)
胥连杰(1990—),女,硕士研究生,研究方向为发酵工程。E-mail:1592303178@qq.com
庞广昌(1956—),男,教授,博士,研究方向为食品生物技术。E-mail:pgc@tjcu.edu.cn

