冷榨核桃粕液态发酵制备核桃多肽
高瑞雄,闫巧珍,岳珍珍,雷宏杰,徐怀德*
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
冷榨核桃粕液态发酵制备核桃多肽
高瑞雄,闫巧珍,岳珍珍,雷宏杰,徐怀德*
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
探讨以冷榨核桃粕为主要原料,采用纳豆芽孢杆菌进行液态发酵制备核桃多肽的方法。分析发酵时间、底物质量浓度、起始pH值、接种量及发酵温度对核桃多肽产量和水解度的影响,并通过单因素试验和Box-Behnken响应面分析法对工艺参数进行优化,得到的最优工艺参数为:发酵时间84 h、底物质量浓度8 g/100 mL、起始pH 8.0、接种量11%、发酵温度33 ℃。此发酵条件下核桃多肽质量浓度和水解度均达到最大值,分别为2.58 mg/mL和37.5%。
冷榨核桃粕;纳豆芽孢杆菌;液态发酵;多肽;工艺优化
核桃(Juglans regia L.)属胡桃科胡桃属植物,我国是世界第一大核桃生产国[1],栽培面积5 000多万亩,产量达150多万t[2]。核桃果仁营养丰富,脂肪质量分数达60%以上,蛋白质质量分数达20%,其氨基酸种类齐全、组成合理,是优质的植物蛋白资源。核桃的加工主要是榨油,冷榨核桃粕是核桃仁冷榨油后的副产物。相比热榨法,冷榨核桃粕蛋白变性少,蛋白质含量30%以上,还含有多种微量元素和不饱和脂肪酸,具有很高的营养价值[3]。多数核桃油生产企业将核桃粕用作饲料或肥料,核桃粕利用率低,资源严重浪费[4],因此,亟需开发新技术对其进行深加工利用。
人体摄取的蛋白质经消化后主要以肽的形式吸收[5]。核桃蛋白经过酶解后可制得小分子多肽,它具有溶解性高、黏度低、吸湿性强等功能特性,还具有抗氧化性、抑菌性、血管紧张素转化酶抑制活性、溶血活性、血小板聚集抑制活性等生理功能,但酶制剂价格昂贵、成本高、生产工艺复杂。目前已有研究采用枯草芽孢杆菌[6]或黑曲霉[7-8]发酵核桃粕制备天然抗氧化肽。微生物发酵法制备的植物多肽已广泛应用于农业、医药、食品及环保等领域[9-10],而以纳豆芽孢杆菌发酵制备核桃多肽的研究未见报道。
纳豆芽孢杆菌是我国食品药品监督管理总局公布的食品用益生菌,其具有改善人体肠道菌群生态、助消化、增强细胞免疫等功能[11]。纳豆芽孢杆菌发酵可产生包括蛋白酶、糖化酶、脂肪酶、淀粉酶等多种酶系。蛋白酶能降解大分子蛋白质,生成小分子功能性多肽,其他酶的产生可降解发酵基质中的大分子物质,从而提高机体对基质中营养成分的吸收利用率。
本研究以核桃粕为原料,采用纳豆芽孢杆菌进行液态发酵,分析发酵时间、底物质量浓度、起始pH值、接种量和发酵温度对核桃多肽质量浓度和水解度的影响,通过响应面分析优化发酵工艺条件,为核桃粕的综合利用、经济价值的提升提供理论依据和方法指导。
1 材料与方法
1.1材料、菌种与试剂
冷榨核桃粕(粗蛋白含量32.89%) 河北绿岭庄园食品有限公司。
纳豆芽孢杆菌 CICC10023 中国工业菌种保藏中心。
Gly-Gly-Tyr-Arg 美国Sigm a公司;其他试剂均为国产分析纯。
1.2仪器与设备
超净工作台 苏州安泰空气技术有限公司;YXQLS-50G立式压力蒸汽灭菌器 上海博迅实业有限公司;ZYF-161智能恒温培养振荡器 黑龙江东拓仪器制造有限公司;GNP-9050隔水式恒温培养箱 上海精宏实验设备有限公司;PB-10 pH计 赛多利斯(上海)贸易有限公司;HJ-4A数显恒温多头磁力搅拌器 金坛市杰瑞尔电器有限公司;KDC-40低速离心机 科大创新股份有限公司中佳分公司;FTX-FA1004电子天平 美国康州HZ电子科技有限公司。
1.3方法
1.3.1生长曲线测定
液体培养基组成:牛肉膏3 g/L、蛋白胨5 g/L、NaCl 5 g/L,pH 7.0,加入15 g/L琼脂得到基础培养基。采用分光光度法测定纳豆芽孢杆菌的生长曲线[12]。分别配制液体培养基和基础培养基,将保藏的菌种转接到基础培养基,37 ℃培养24 h使菌种活化。用接种环挑2 环活化的菌种到液体培养基中,置于恒温培养振荡器中培养(37 ℃,150 r/min),每隔3 h取样一次,样品稀释10 倍后,以液体培养基为对照,在660 nm波长处测定菌体的吸光度,以吸光度对培养时间作图得到生长曲线。
1.3.2蛋白酶活力测定
蛋白酶活力的测定参考GB/T 23527—2009《蛋白酶制剂》和福林-酚法[13]。
标准曲线制定:依次量取100 μg/mL的L-酪氨酸溶液0、1、2、3、4、5 mL于6 支试管中,然后加蒸馏水至10 mL。取上述溶液各1.00 mL,分别加入0.4 mol/L的碳酸钠溶液5 mL、福林-酚试剂1 mL,混匀后在40 ℃显色20 min,最后在680 nm波长处测定吸光度,以不含L-酪氨酸的空白管进行调零。以吸光度对L-酪氨酸浓度作标准曲线得到方程为:y=10.165 0x+0.004 6(R2=0.999 6)。根据式(1)计算蛋白酶活力。
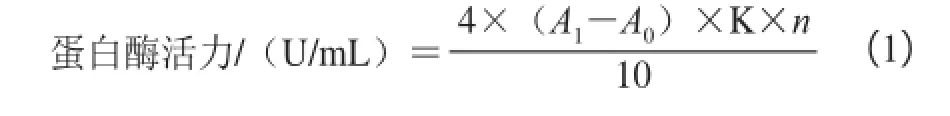
式中:A1、A0分别为样品和空白的吸光度;4为反应的总体积;n为稀释倍数;K为吸光常数,指A680nm=0时的L-酪氨酸质量(97.92 μg);10为反应时间/min。
将核桃粕发酵培养基灭菌冷却后,接入种子液,空白对照中加入等量的无菌生理盐水,同时进行发酵。每隔12 h取一定体积的发酵液,2 862×g离心15 min,取上清液适当稀释,空白对照与样品进行相同的处理。取试管加入1 mL上清液,置于40 ℃恒温水浴锅中,加入10 mg/mL的酪素1 mL(酪素需要在40 ℃水浴中预热5 min)开始反应,准确计时10 min后,立即取出加入0.4 mol/L的三氯乙酸2 mL,静置10 min,然后过滤。取1 mL滤液,分别加入0.4 mol/L的碳酸钠溶液5 mL、福林-酚试剂1 mL,混匀后在40 ℃显色20 min,最后在680 nm波长处测定吸光度。
1.3.3多肽质量浓度测定
采用双缩脲法测定多肽质量浓度[14]。
标准曲线制定:将Gly-Gly-Tyr-Arg用体积分数为5%的三氯乙酸依次配制成0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8 mg/mL的四肽标准溶液,分别取6.0 mL标准溶液加入4.0 mL双缩脲试剂,混匀静置10 min后,715×g离心10 min,取上清液在540 nm波长处测定吸光度,以5%三氯乙酸为空白调零。以吸光度对多肽质量浓度作标准曲线得到方程为:y=0.136 6x+0.000 8(R2=0.999 3)。
样品测定:准确吸取5 mL发酵液,1 118×g离心15 min,取2.5 mL上清液加入2.5 mL 10%的三氯乙酸溶液,混匀静置10 min,然后2 862×g离心10 min,将上清液全部转移到25 mL容量瓶中,用5%的三氯乙酸定容,取6.0 mL样液加入4.0 mL双缩脲试剂,混匀静置10 min,然后715×g离心10 min,取上清液在540 nm波长处测定吸光度,根据标准曲线得到样品中多肽的质量浓度。
1.3.4水解度测定
采用甲醛滴定法测定水解度[15]。取发酵液10 mL,2 862×g离心10 min,吸取5 mL上清液于烧杯中,加入25 mL蒸馏水。将烧杯置于磁力搅拌器上,插入pH电极。开动磁力搅拌器,用NaOH溶液调pH值至8.2,并且保持1 min不变,然后加入15 mL中性甲醛溶液,1 min后用0.05 mol/L NaOH标准溶液滴定pH值至9.2。记录消耗NaOH标准溶液滴定的体积(V1)。以接种等量无菌水的发酵培养基为空白对照,相同处理后,记录消耗NaOH标准溶液滴定的体积(V0)。按照式(2)计算水解度。

式中:V0、V1为分别空白液和发酵液加入甲醛后消耗的NaOH标准溶液体积/mL;c为NaOH标准溶液浓度/(mol/L);V为离心后取上清液的体积,取5 mL;ρ为发酵液中底物含量/(g/100 mL);ω为核桃粕的蛋白质量分数(32.89%);14.01为氮的摩尔质量/(g/mol);0.16为换算系数。
1.3.5核桃粕液体发酵单因素试验
将冷榨核桃粕粉碎过40 目筛网。分别称取核桃粕粉10 g、NaCl和葡萄糖各0.05 g,加水到一定底物含量,调pH值后,用高压灭菌锅121 ℃湿热灭菌15 min,冷却后接入种子液,并于恒温振荡器中发酵,转速150 r/min。接种后发酵120 h,每隔12 h测定多肽质量浓度和水解度,观察多肽质量浓度和水解度随时间的变化。此外分别研究底物质量浓度、起始pH值、接种量及发酵温度对发酵液中多肽质量浓度和水解度的影响。
1.3.6响应面优化试验
在单因素试验的基础上,固定发酵时间84 h,底物含量8 g/100 mL。通过Design-Expert 1.5软件,根据Box-Behnken试验设计(BBD)原理,选择对多肽质量浓度和水解度影响较大的起始pH值、接种量、发酵温度3 个因素为考察指标,进行响应面分析试验,并考察3 个因素的交互作用。
1.3.7验证实验
在优化条件下重复6 次实验,测定发酵液中的多肽质量浓度和水解度,进一步验证优化实验条件的准确性与稳定性。
1.4数据处理
所得的数据用Excel软件进行处理,用Design-Expert 1.5软件进行实验设计和数据分析。
2 结果与分析
2.1纳豆芽孢杆菌生长曲线
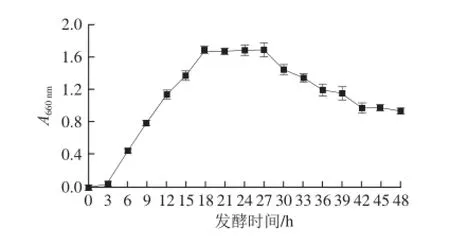
图1 纳豆芽孢杆菌生长曲线Fig.1 Growth curve o f Bacillus subtils natto
由图1可知,发酵前3 h为菌种的延滞期,在这个时间段,菌种适应新的环境,活菌总数几乎没有变化;3~18 h为菌种的对数生长期,菌体活跃并大量增殖,并在对数生长期结束时活菌数达到最大值;18~30 h为菌种的稳定期,在这个时间段,菌种增长的同时有部分菌种衰亡,增长量和衰亡量趋于平衡,活菌数保持稳定;30 h以后进入衰亡期,菌体衰亡加快,出现负增长。研究表明,培养基质的不同使纳豆芽孢杆菌生长期的各个时间段稍有差别,但生长曲线总体趋势相同[16]。对数生长期菌种代谢旺盛,抗不良条件能力强,本实验选取培养12 h的菌液为种子液。
2.2发酵液中蛋白酶活力随时间的变化
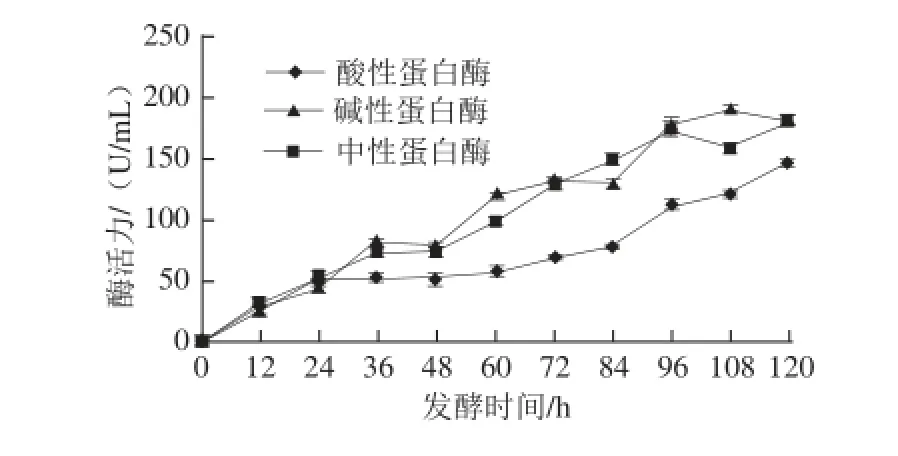
图2 蛋白酶活力随发酵时间的变化Fig.2 Changes in proteinase activities during fermentation
不同菌种在代谢过程中产生的酶的种类及活力不同。纳豆芽孢杆菌代谢产生的蛋白酶不是单一的蛋白酶,而是复合的蛋白酶系,而且以中性蛋白酶和碱性蛋白酶为主。从图2可以看出,随着发酵的进行,酸性蛋白酶、中性蛋白酶、碱性蛋白酶的活力都呈现增加趋势,在发酵120 h时,碱性蛋白酶和中性蛋白酶的活力分别达到190 U/mL和179 U/mL;在发酵60 h之前,碱性蛋白酶活力高于其他两种蛋白酶活力;发酵60 h以后,中性蛋白酶活力逐渐增大,与碱性蛋白酶活力相当,且明显高于酸性蛋白酶活力。这是由于在整个发酵过程中,菌种从延滞期到衰亡期,代谢产生的蛋白酶含量随着发酵时间的延长而不断积累,从而蛋白酶活力也呈现升高趋势,当菌种衰亡后,产酶能力下降,蛋白酶的活力也不再变化[17]。
2.3多肽质量浓度和水解度随发酵时间的变化

图3 多肽质量浓度和水解度随发酵时间的变化Fig.3 Changes in polypeptide and DH during fermentation
由图3可知,在整个发酵过程中,发酵液中的多肽质量浓度及水解度随着发酵时间的延长呈上升趋势。在84 h之前,纳豆芽孢杆菌增长繁殖产生多种蛋白酶,通过对核桃蛋白的降解,使得多肽质量浓度和水解度随发酵时间的延长逐渐上升[18];发酵84 h之后,到达发酵后期,纳豆芽孢杆菌开始衰亡,产生的蛋白酶量逐渐减少,且部分多肽在蛋白酶的作用下进一步降解生成游离氨基酸,导致多肽质量浓度略微降低,水解度则持续增加,但增加的幅度低于发酵前期。综合考虑,确定发酵时间为84 h。
2.4液态发酵核桃粕制备核桃多肽单因素试验结果
2.4.1底物质量浓度对核桃多肽质量浓度和水解度的影响
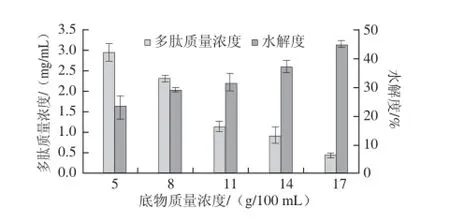
图4 底物质量浓度对多肽质量浓度和核桃粕蛋白水解度的影响Fig.4 Effect of feed concentration on polypeptide content and DH
由图4可知,底物质量浓度对发酵结束后核桃多肽质量浓度及核桃粕蛋白水解度的影响呈相反趋势,底物质量浓度越大,多肽质量浓度越高,水解度反而越低。这是由于低底物质量浓度时,纳豆芽孢杆菌繁殖产生的蛋白酶与底物充分接触反应,使得核桃蛋白水解度增大,但是底物质量浓度低,多肽的生成量相对较低。高底物质量浓度导致料液呈现黏稠状,溶氧量低,不利于纳豆芽孢杆菌的生长繁殖,底物量远远大于蛋白酶量,酶促反应弱,因此水解度较低[19];另外,发酵前原料的高压灭菌热处理使得部分核桃蛋白变性降解产生多肽,且产量随底物含量增大而增加。底物质量浓度为8 g/100 mL和11 g/100 mL时,多肽质量浓度分别为2.03、2.21 mg/mL,水解度分别为33.2%、16.3%,考虑到原料的利用率,确定底物质量浓度为8 g/100 mL比较适宜。
2.4.2起始pH值对多肽质量浓度和水解度的影响

图5 起始pH值对多肽质量浓度和水解度的影响Fig.5 Effect of initial pH on polypeptide content and DH
由图5可知,起始pH值对核桃多肽质量浓度及水解度的影响呈相反趋势,起始pH值越大,发酵结束后多肽质量浓度也越高,而水解度却越低。起始pH值小于7.0时,发酵液呈酸性,纳豆芽孢杆菌繁殖缓慢,但是发酵前高压热处理结合酸的作用,使蛋白质变性而部分蛋白降解产生多肽和游离氨基酸,最终导致多肽质量浓度较低、水解度较大。当起始pH值大于7.0时,纳豆芽孢杆菌大量繁殖,产生的碱性蛋白酶降解核桃蛋白形成多肽,使得多肽质量浓度升高,水解度相对酸性条件较低。这是由于弱碱性条件更适合纳豆芽孢杆菌的产酶以及蛋白酶活性的发挥[20]。可见起始pH值对多肽质量浓度及水解度变化影响较大,将作为进一步优化的因素。
2.4.3接种量对多肽质量浓度和水解度的影响
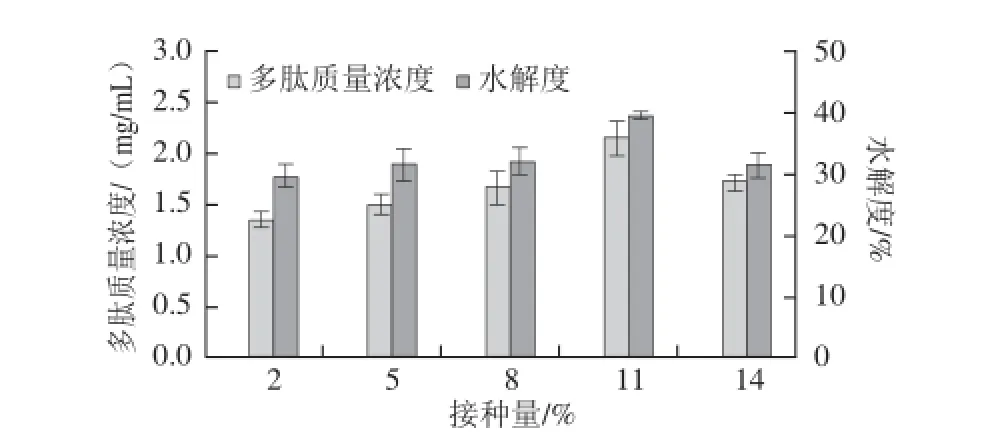
图6 接种量对多肽质量浓度和水解度的影响Fig.6 Effect of inoculum amount on polypeptide content and DH
由图6可知,多肽质量浓度和水解度随接种量的增加呈现先升高后降低的趋势,该试验条件下,接种量为11%时,多肽质量浓度和水解度均达到最大值,分别为2.36 mg/mL和35.7%,接种量太大或太小都不利于多肽质量浓度和水解度的提高[21]。这是由于接种量低于11%时,随着接种量增加,纳豆芽孢杆菌密度逐渐增大,产生的蛋白酶量也随之增加,使得多肽质量浓度和水解度呈现上升的趋势。当接种量大于11%时,菌体密度的增大导致繁殖速率下降,产酶量降低,使得多肽质量浓度和水解度降低。
2.4.4发酵温度对多肽质量浓度和水解度的影响
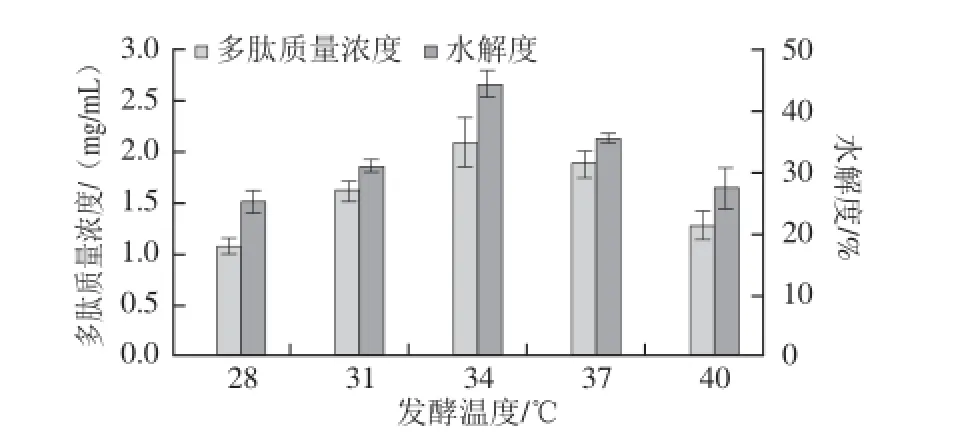
图7 发酵温度对多肽质量浓度和水解度的影响Fig.7 Effect of fermentation temperature on polypeptide content and DH
温度是影响微生物生长及蛋白酶活性的关键因素之一。由图7可知,多肽质量浓度和水解度随温度的升高呈现先增大后降低的趋势。该条件下,发酵温度为34 ℃时,多肽质量浓度和水解度达到最大值,分别为2.65 mg/mL和34.9%,说明纳豆芽孢杆菌在该温度条件下能较好的生长繁殖,且其代谢产生的蛋白酶具有较大的活性,过低或过高的温度都不利于纳豆芽孢杆菌的代谢产酶以及蛋白酶最大活性的发挥[21]。
2.5核桃粕液态发酵制备核桃多肽工艺响应面优化结果2.5.1 响应面试验结果回归模型方差分析
根据单因素试验结果,以多肽质量浓度和水解度为指标做BBD响应面分析,试验结果见表1,共15 个试验点,其中12 个析因点,3 个零水平点。

表1 BBD响应面优化试验设计和结果Table1 Experimental design and results for BBD response surface analysis
通过Design-Expert 1.5数据软件进行回归分析,结果见表2、3。由表2可知,以多肽质量浓度为响应值,该模型效应极显著(P=0.000 1),因变量与自变量之间的线性关系显著(R2=0.991 0),模型调整确定系数为,说明该模型能模拟97.48%响应值的变化,可信度高,与实际情况拟合良好,失拟项不显著(P>0.05),说明本试验的二次回归方程能很好地对多肽质量浓度进行分析和预测。各因素中二次项以及交互项表现为极显著;一次项以及二次项表现为显著,说明其对响应值多肽质量浓度影响极大。根据表2,各因素的影响顺序为接种量>起始pH值>发酵温度。所得二次回归方程为:
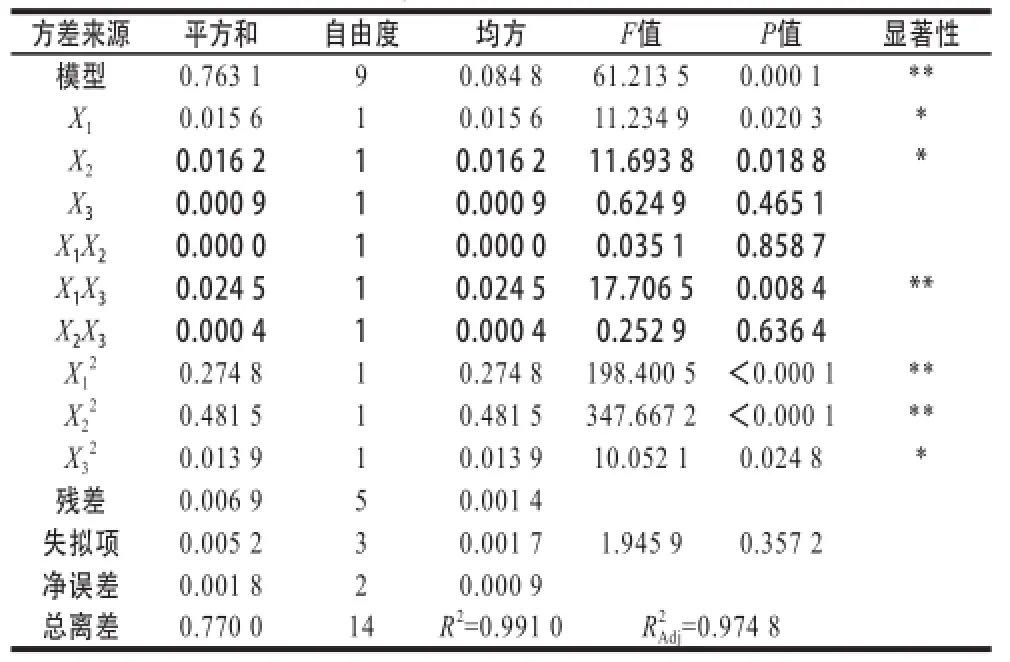
表2 多肽质量浓度回归模型方差分析Table2 Analysis of variance for the fitted quadratic model of polypeptide content
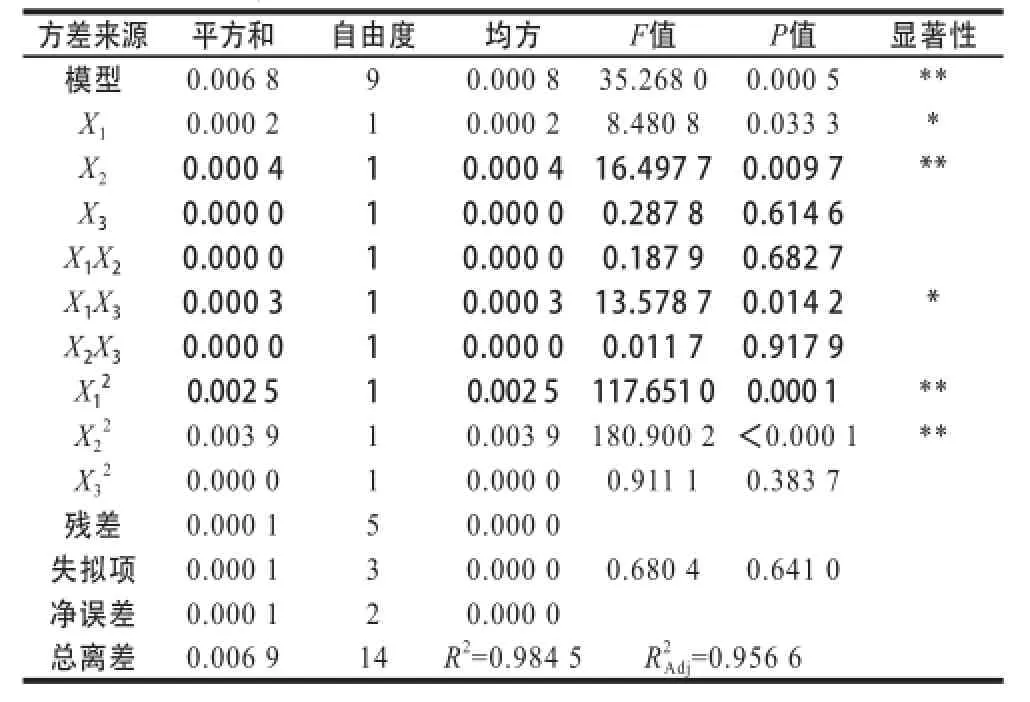
表3 水解度回归模型方差分析Table3 Analysis of variance for the fitted quadratic model of DH
由表3可知,以水解度为响应值,该模型效应极显著(P=0.000 5),因变量与自变量之间的线性关系显著(,模型调整确定系数为说明模型能模拟95.66%响应值的变化,可信度高,与实际情况拟合良好,失拟项不显著(P>0.05),说明本试验的二次回归方程能很好地对水解度进行分析和预测。各因素中一次项X2及二次项X12和X22表现为极显著;一次项X1和交互项X1X3表现为显著,说明它们对响应值水解度影响极大。根据表3,各因素的影响顺序为接种量>起始pH值>发酵温度。所得二次回归方程为:Y2=-1.833 0+0.321 1X1+0.186 3X2-0.005 2X3-0.000 5X1X2+0.002 8X1X3-0.000 04X2X3-0.026 0X12-0.008 1X22-0.000 3X32。
2.5.2因素交互作用分析与最优试验条件验证
通过软件分析,将其中的一个因素固定在零水平,可以得到两个因素的交互作用对响应值的响应面图及等高线图(图8、9),其中等高线为圆形,表示交互作用较弱,等高线为椭圆形的,表示交互作用较强。
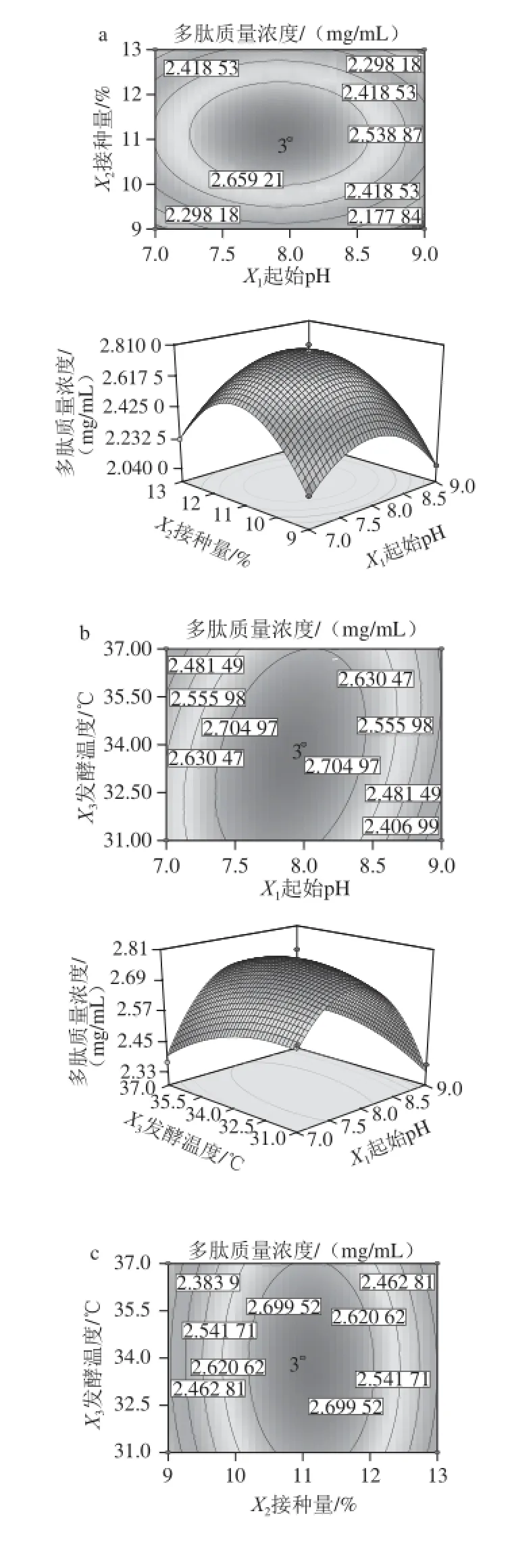

图8 各两因素交互作用对多肽质量浓度影响的等高线和响应面图Fig.8 Response surface and corresponding contour plots for the effects of fermentation parameters on polypeptide content
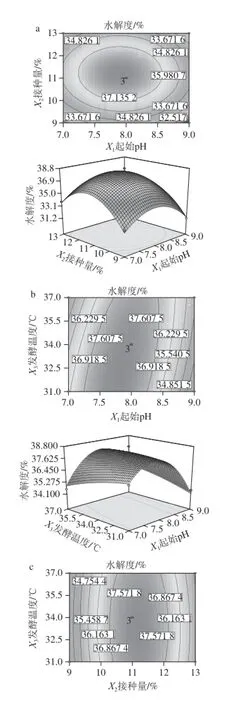
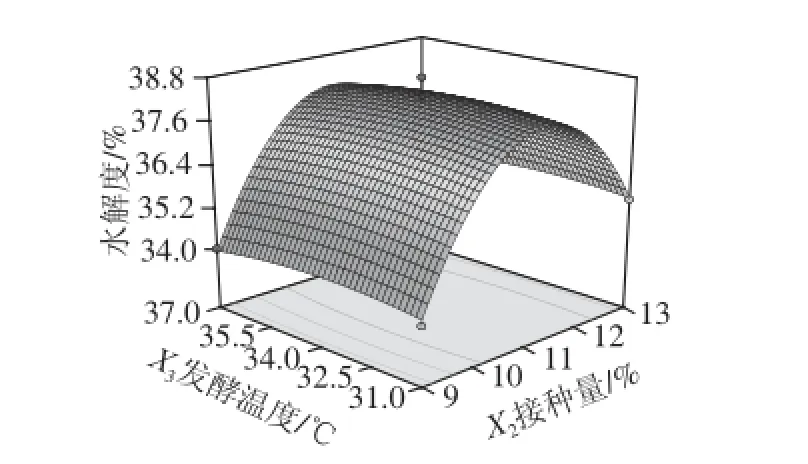
图9 各两因素交互作用对水解度影响的等高线和响应面图Fig.9 Response surface and corresponding contour plots for the effects of fermentation parameters on DH
图8a和9a都是起始pH值与接种量的交互作用,二者等高线图相似,同样,图8b和9b、图8c和9c分别对应着起始pH值和发酵温度、接种量和发酵温度的交互作用,且各自对应的等高线图相似。所以结合图8、9可以看出,图8a、9a的等高线接近圆形,说明起始pH值和接种量交互作用对多肽质量浓度和水解度的影响微弱;图8b和9b、图8c和9c的等高线均呈椭圆形,说明起始pH值与发酵温度交互及接种量与发酵温度交互作用对多肽质量浓度和水解度的影响显著;图8b、9b中,随着起始pH值的增大,多肽质量浓度和水解度迅速升高,在pH 8.0时达到最大值后迅速降低;图8c、9c中,随着接种量的增大,多肽质量浓度和水解度迅速升高,在接种量为11%时达到最大值后迅速降低。因此,结合图8、9可以看出,与起始pH值和接种量相比,发酵温度对多肽质量浓度的影响较弱,这与方差分析结果一致。
运用Design-Expert 1.5软件对试验结果进行优化,以多肽质量浓度为响应值优化得到模型的最优解为:起始pH值为8.63、接种量11.11%、发酵温度34.93 ℃,该条件下多肽质量浓度的预测值为2.646 8 mg/mL;以水解度为响应值优化得到模型的最优解为:起始pH 7.82、接种量11.21%、发酵温度32.41 ℃,该条件下水解度的预测值为38.33%。结合两个最优解,根据实际试验条件,将制备工艺条件修正为:起始pH 8.0、接种量11%、发酵温度33 ℃,以此条件对响应面结果的可靠性进行检验,在该条件下进行6 次重复实验,发酵测得的多肽质量浓度和水解度分别为2.58 mg/mL、37.5%,与理论预测值相比其相对误差分别约为2.52%、2.17%。优化后结果与之前研究对比,梁杏等[6]用枯草芽孢杆菌液态发酵核桃粕后的水解度为35%,谢翠品等[7]用黑曲霉发酵核桃粕优化后的多肽质量浓度为22.33 μg/mL,可见纳豆芽孢杆菌发酵效果优良。因此认为该响应面优化所得的工艺条件参数较为准确,具有实用价值。
3 结 论
本实验初步研究了纳豆芽孢杆菌液态发酵冷榨核桃粕制备核桃多肽的工艺条件。在发酵过程中,纳豆芽孢杆菌主要产中性蛋白酶和碱性蛋白酶。通过单因素试验和响应面法对工艺参数进行优化,得到最佳工艺参数:发酵时间84 h、底物质量浓度8 g/100 mL、起始pH 8.0、接种量11%、发酵温度33 ℃,在此发酵条件下所得发酵液核桃多肽质量浓度为2.58 mg/mL、水解度为37.5%,且纳豆芽孢杆菌的发酵效果优于黑曲霉和枯草芽孢杆菌。此外,在核桃多肽制备过程中,影响核桃多肽产量的因素还有很多,如核桃粕粉碎粒度、生长因子的种类和添加量等。因此,在后续工作中需要深入研究,使发酵条件得到进一步的改进。
[1] 侯立群, 赵登超. 国内外核桃产业现状与中国核桃产业发展趋势[C]//首届中国核桃大会论文集. 昆明: 云南科技出版社, 2008: 16-20.
[2] 孙丽霞. 陕西省商洛核桃优树选择及综合性状评价[D]. 杨凌: 西北农林科技大学, 2014: 30-34.
[3] 吕名蕊, 史宣明, 张骊, 等. 核桃多肽功能特性及制备工艺研究进展[J]. 中国油脂, 2013, 38(5): 34-38. DOI:10.3969/ j.issn.1003-7969.2013.05.009.
[4] 姜莉, 徐怀德, 何玉君, 等. 核桃渣中蛋白质的提取工艺及其功能性研究[J]. 食品科技, 2007, 32(4): 237-240. DOI:10.3969/ j.issn.1005-9989.2007.04.071.
[5] 贾靖霖, 陆健康, 汪莉莉, 等. 核桃多肽体外抗氧化活性研究[J]. 中国酿造, 2014, 33(5): 109-112. DOI:10.11882/j.issn.0254-5071.2014.05.024.
[6] 梁杏, 赵声兰, 曹冠华, 等. 液态发酵核桃饼粕的初步研究[J]. 中国酿造, 2013, 32(12): 66-69. DOI:10.3969/j.issn.0254-5071.2013.12.016.
[7] 谢翠品, 敬思群, 刘帅, 等. 黑曲霉发酵核桃粕生产核桃多肽工艺优化[J]. 中国酿造, 2013, 32(2): 53-57. DOI:10.3969/ j.issn.0254-5071.2013.02.013.
[8] 武万兴. 固态发酵核桃粕制备抗氧化活性肽的研究[D]. 昆明: 昆明理工大学, 2014: 15-20.
[9] AMADDOU I, LE G, SHI Y H, et al. Optimized Lactobacillus plantarum Lp6 solid-state fermentation and proteolytic hydrolysis im prove some nutritional attributes of soybean protein meal[J]. Journal of Food Biochemistry, 2011, 35(6): 1686-1694. DOI:10.1111/j.1745-4514.2010.00493.x.
[10] HE R, JU X R, YUAN J, et al. Antioxidant activities of rapeseed peptides produced by solid state fermentation[J]. Food Research International, 2012, 49(1): 432-438. DOI:10.1016/ j.foodres.2012.08.023.
[11] 王旭冰, 娄勇江. 纳豆芽孢杆菌的开发与利用[J]. 食品工业, 2010,35(4): 28-31. DOI:10.3969/j.issn.1000-9973.2010.04.002.
[12] 帅明, 黄占旺, 牛丽亚. 纳豆芽孢杆菌的固态发酵条件[J]. 食品与生物技术学报, 2009, 28(1): 122-126. DOI:10.3321/ j.issn:1673-1689.2009.01.025.
[13] AOYAMA M, YASUDA M, NAKACHI K, et a1. Soybean-milkcoagulating activity of Bacillus pumilus derives from a serine proteinase[J]. Applied Microbiology & Biotechnology, 2000, 53(4):390-395. DOI:10.1079/JOH2002122.
[14] 鲁伟, 任国谱, 宋俊梅. 蛋白质水解液中多肽含量的测定方法[J]. 食品科学, 2005, 26(7): 169-171. DOI:10.3321/ j.issn:1002-6630.2005.07.039.
[15] 周慧江, 朱振宝, 易华健. 核桃蛋白水解物水解度测定方法比较[J]. 粮油与油脂, 2012, 25(2): 28-30. DOI:10.3969/ j.issn.1008-9578.2012.02.008.
[16] YASUDA M, SAKAGUCHI M. Degradation of soybean protein by an acid proteinase from Monascus anka[J]. Food Science & Technology International Tokyo, 1998, 4(4): 6-8. DOI:10.3136/fsti9596t9798.4.6.
[17] NIELSEN M S, TORBEN M, FLAMBARD B, et a1. Peptide profiles and angiotensin-I-converting enzyme inhibitory activity of fermented milk products: effect of bacterial strain, fermentation pH,and storage time[J]. International Dairy Journal, 2009, 19(3): 155-165. DOI:10.1016/j.idairyj.2008.10.003.
[18] 郝常艳. 核桃多肽的制备条件优化及其抗氧化活性研究[D]. 太原: 山西大学, 2014: 31-35.
[19] 潘进权. 纳豆芽孢杆菌发酵产蛋白酶工艺优化[J]. 中国粮油学报, 2011, 26(9): 33-37. DOI:11-2864/TS.20110726.1700.001.
[20] 宗玉霞. 核桃粕制备多肽营养液的工艺研究[D]. 乌鲁木齐: 新疆农业大学, 2013: 38-40.
[21] HU Y L, QIN H H, ZHAN Z C, et al. Optimization of Saccharomyces boulardii production in solid-state fermentation with response surface methodology[J]. Biotechnology & Biotechnological Equipment, 2016,30(1): 173-179. DOI:10.1080/13102818.2015.1086689.
Polypeptide Production from Cold-Pressed Walnut Meal by Liquid-State Fermentation
GAO Ruixiong, YAN Qiaozhen, YUE Zhenzhen, LEI Hongjie, XU Huaide*
(College of Food Science and Engineering, Northwest A&F University, Yangling 712100, China)
Walnut meal, a by-product left after pressing walnuts for oil, contains rich protein and its nutritional value is high. Polypeptide production from cold-pressed walnut meal by liquid-state fermentation of Bacillus subtils natto was investigated in this study. The effects of fermentation time, feed concentration, initial pH, inoculum amount, and fermentation temperature on the content of polypeptide and the degree of hydrolysis (DH) were studied, and these fermentation parameters were optimized by single-factor experiments and Box-Behnken response surface methodology. Results showed that the optimum fermentation parameters were determined as follows: fermentation time, 84 h; feed concentration, 8 g/100 mL; initial pH value, 8.0; inoculum amount, 11% and fermentation temperature, 33 ℃. The maximum content of polypeptide and DH of 2.58 mg/mL and 37.5%, respectively were simultaneously obtained under these optimized conditions.
walnut meal; Bacillus subtils natto; liquid-state fermentation; polypeptide; process optimization
10.7506/spkx1002-6630-201619032
S255.6
A
1002-6630(2016)19-0190-07
高瑞雄, 闫巧珍, 岳珍珍, 等. 冷榨核桃粕液态发酵制备核桃多肽[J]. 食品科学, 2016, 37(19): 190-196.
DOI:10.7506/spkx1002-6630-201619032. http://www.spkx.net.cn
GAO Ruixiong, YAN Qiaozhen, YUE Zhenzhen, et al. Polypeptide production from cold-pressed walnut meal by liquidstate fermentation[J]. Food Science, 2016, 37(19): 190-196. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201619032. http://www.spkx.net.cn
2015-12-06
陕西省科技统筹创新工程计划项目(2016KTCQ02-22)
高瑞雄(1990—),男,硕士,研究方向为农产品加工与贮藏。E-mail:grx303303@sina.cn
徐怀德(1964—),男,教授,学士,研究方向为果品蔬菜贮藏与加工和天然产物提取。E-mail:xuhuaide@aliyun.com

