牡荆素调节自噬对小鼠肝缺血/再灌注损伤的保护作用
于瑶,何金丹,王振,李世朋,喻文立,杜洪印(.天津医科大学一中心临床学院,天津 3009;.天津市第一中心医院麻醉科,天津 3009)
肝缺血/再灌注损伤(HIRI)是肝脏手术过程中常见的病理生理变化[1],也是导致肝移植术后早期及晚期移植物功能衰竭甚至患者死亡的主要原因[2]。低温处理、缺血预处理及应用肝脏保护剂等多种手段已被用于减轻HIRI[3-5],但仍不能满足临床需要,探讨更好的肝脏保护机制已成为肝移植领域亟待解决的临床问题。自噬是广泛存在于真核生物中的一种溶酶体依赖性降解途径,是细胞存活、物质代谢和再利用的重要途径[6]。自噬在缺血/再灌注(I/R)过程中起着双重的调控作用,对于细胞的存活或凋亡起着至关重要的作用[7-9]。牡荆素是从山楂叶中提取的黄酮类有效成分,具有抗炎和抗氧化作用[10],被用于治疗心血管疾病。有研究显示牡荆素对大鼠心肌IRI具有良好的保护作用[11],但其在HIRI中的作用研究较少,机制尚不明确。本研究就牡荆素对小鼠HIRI的影响进行探究,为认识牡荆素调控自噬在I/R中的作用提供新思路。
1 材料与方法
1.1 实验动物:18只健康的雄性C57BL/6小鼠(体重为20~25 g),由天津医科大学实验动物中心提供。小鼠分笼饲养,每笼6只,普通饲料喂养,自由饮水,环境温度为22~24℃,相对湿度为40%~60%,自然昼夜。
1.2 试剂:牡荆素(纯度为99.8%,西安昊轩生物科技公司)、原位末端标记(TUNEL)试剂盒(德国Roche公司)、兔抗鼠自噬调控因子Beclin1、抗凋亡相关基因Bcl-2、微管相关蛋白轻链3(LC3)、天冬氨酸特异性半胱氨酸蛋白酶3(caspase-3)、β-肌动蛋白(β-actin)抗体以及羊抗兔辣根过氧化物酶(HPR)标记二抗(美国CST公司)、ECL Plus超敏发光液(北京Solarbio公司)。
1.3 建立小鼠肝脏HIRI模型[12]:将小鼠随机分为假手术组(Sham组)、缺血/再灌注组(I/R组)和牡荆素组(Vitexin组)。所有小鼠于实验前12 h禁食,自由饮水。Vitexin组于术前6 h腹腔注射10 mg/kg牡荆素。Sham组与I/R组给予等量生理盐水腹腔注射。所有小鼠称重后均腹腔注射10%水合氯醛麻醉,取仰卧位固定。I/R组和Vitexin组于腹部正中切口打开腹腔,暴露脏器,分离肝左叶和肝中叶。用血管夹夹闭肝左叶和中叶脉管总干,使70%肝脏缺血。阻断成功后,暂时关闭腹腔,保护腹部切口,1 h后松开血管夹,关闭腹腔。再灌注时间为12 h。Sham组仅进行开腹、游离第一肝门及关腹等操作,不夹闭脉管。
1.4 血生化指标分析 :实验完成后经下腔静脉取血1 ml,4℃ 3 000 rpm离心15 min后取血清,在天津市第一中心医院检验科检测血清中丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)水平。
1.5 病理检测:将各组小鼠肝组织固定于10%甲醛水溶液中,经梯度酒精脱水、二甲苯浸泡,制成肝组织石蜡块,冰冻切片后进行苏木精-伊红(HE)染色,观察肝组织病理变化。
1.6 TUNEL法检测肝细胞凋亡情况:将肝组织石蜡切片脱蜡和再水化,经蛋白酶K消化处理后,滴加TUNEL反应混合液,在37℃湿盒内避光孵育1 h。滴加4,6-二脒基-2-苯基吲哚(DAPI)溶液后于荧光显微镜下观察肝细胞凋亡情况。
1.7 蛋白质免疫印迹试验(Western Blot)检测肝组织目的蛋白表达水平:取肝组织样本加入组织蛋白酶裂解液后匀浆,4℃ 12 000 rpm离心15 min,取上清后用BCA法测定蛋白浓度。经十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(SDS-PAGE)、转膜、封闭,加一抗(兔抗鼠Beclin1、Bcl-2、LC3、caspase-3、β-actin,1:1 000稀释)后于4℃孵育过夜。洗膜,用HPR标记的羊抗兔二抗(1:2 500稀释)室温孵育1 h,洗膜,混合等体积的超敏发光液与聚偏二氟乙烯(PVDF)膜反应,在暗室中X线片曝光、显影和定影。
2 结 果
2.1 血清ALT和AST水平(表1):I/R组血清中ALT和AST水平明显高于Sham组;而与I/R组相比较,Vitexin组ALT、AST水平明显降低,差异均具有统计学意义(均P<0.05)。
表1 各组小鼠血清ALT、AST水平变化(±s)
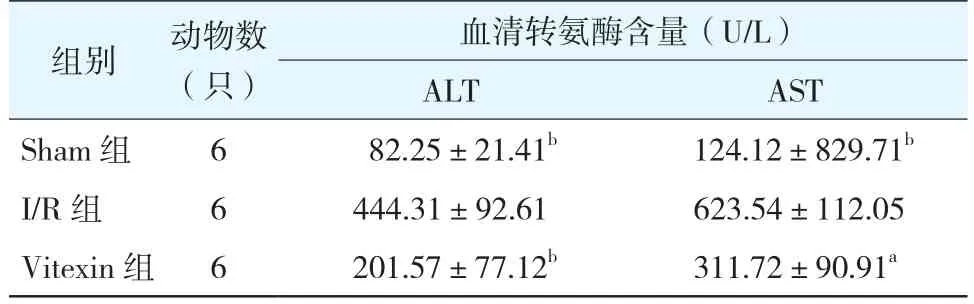
表1 各组小鼠血清ALT、AST水平变化(±s)
注:与I/R组相比较,aP<0.01,bP<0.001;Sham组为假手术组;I/R组为缺血/再灌注组;Vitexin组为牡荆素组
血清转氨酶含量(U/L)ALT AST Sham 组 6 82.25±21.41b 124.12±829.71b I/R 组 6 444.31±92.61 623.54±112.05 Vitexin 组 6 201.57±77.12b 311.72±90.91a组别 动物数(只)
2.2 各组小鼠肝脏病理学变化(图1):小鼠经I/R处理后,肝细胞水肿,气球样变,肝窦狭窄淤血,出现点灶状坏死,中性粒细胞大量浸润;而Vitexin组肝细胞损伤程度明显减轻,仅部分肝细胞见轻度水肿,中性粒细胞浸润也明显减少。

图1 各组小鼠肝脏病理学变化(HE×200)
2.3 TUNEL染色结果(图2):Sham组TUNEL标记的凋亡细胞数量较少;I/R组见大量凋亡的肝细胞;Vitexin组的凋亡细胞明显减少,各组之间的差异具有统计学意义(P<0.05)。
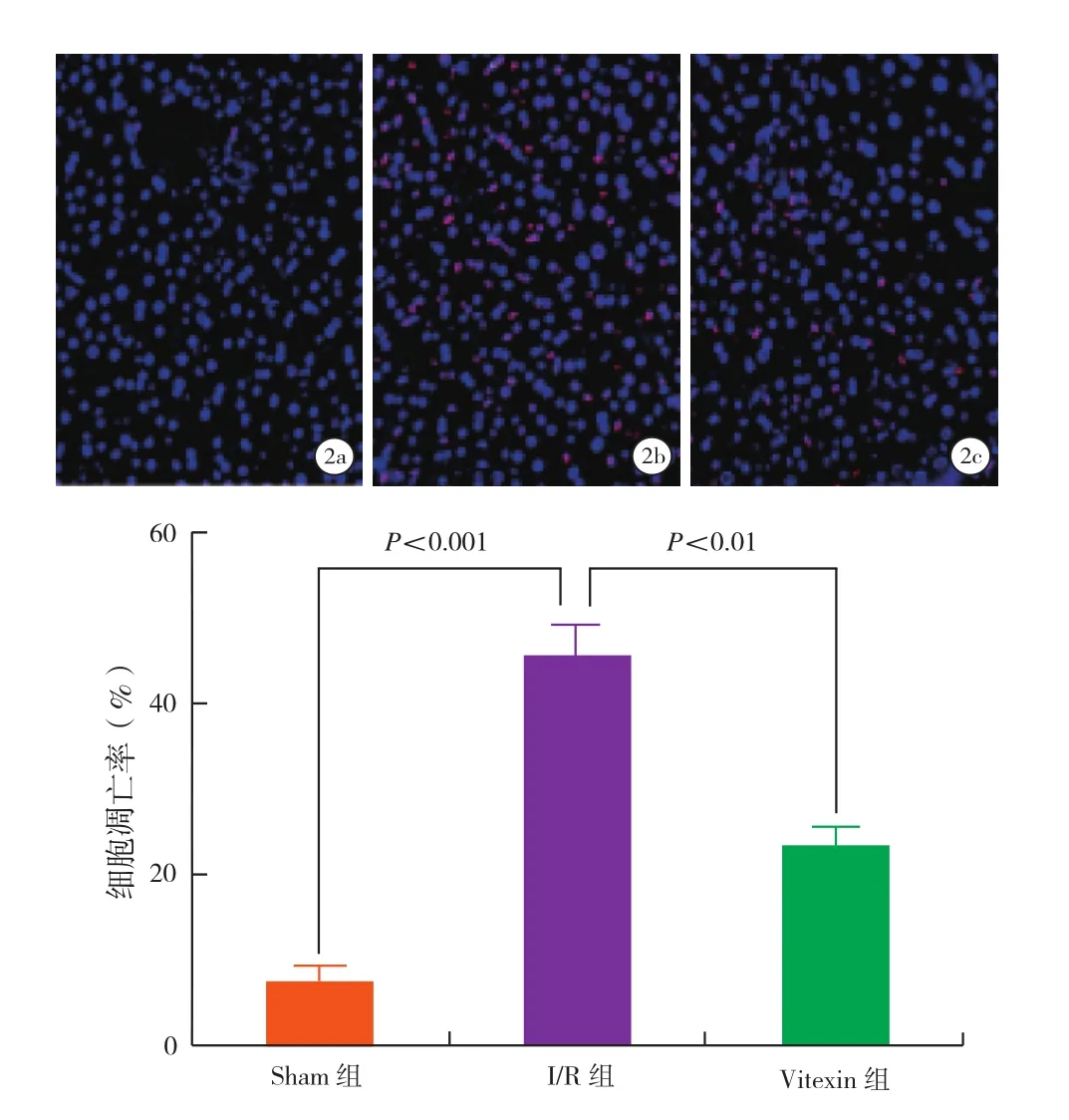
图2 TUNEL染色观察肝细胞凋亡情况(×200)
2.4 Western Blot结果(图3):I/R组小鼠肝组织caspase-3蛋白表达水平明显高于Sham组,Bcl-2蛋白表达水平则明显降低,自噬标记蛋白Beclin1和LC3Ⅱ的表达水平也明显高于假手术组(均P<0.05)。与I/R组相比较,Vitexin组小鼠肝组织caspase-3蛋白表达水平显著下降,而Bcl-2蛋白表达水平则明显升高,自噬标记蛋白Beclin1和LC3Ⅱ的表达水平明显下降(均P<0.05)。
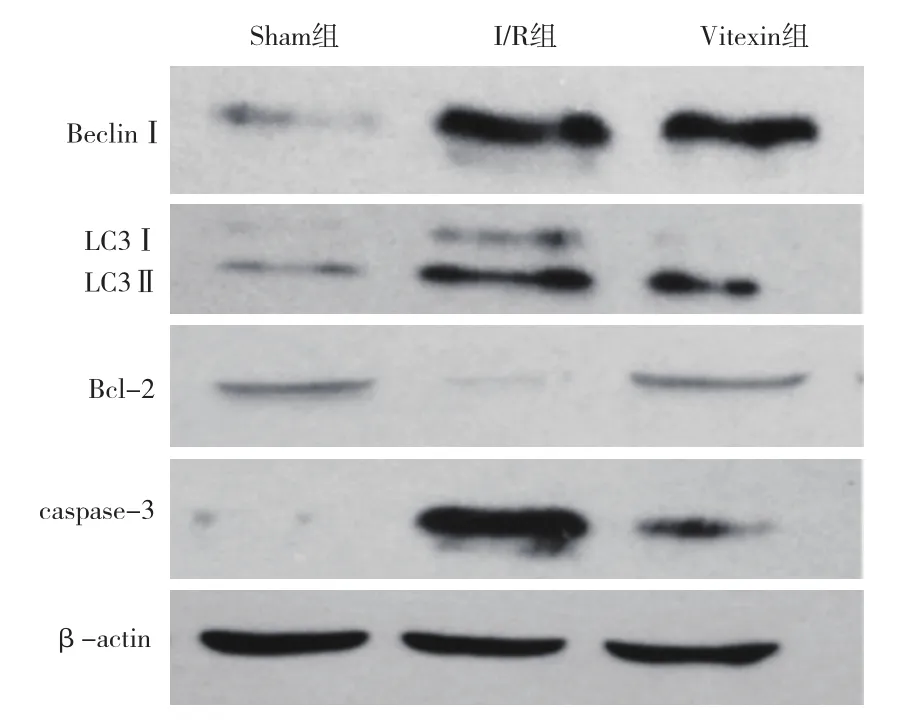
图3 各组小鼠肝组织目的蛋白的表达
3 讨 论
肝移植是目前终末期肝病最有效的治疗手段,随着外科手术技巧、早期诊断及相关临床辅助技术的不断提高,肝移植患者的生存率明显提高[13-14]。但术后早期移植物功能恢复延迟甚至原发性移植物无功能的发生率仍较高,成为影响肝移植预后的主要原因之一,其与供HIRI关系最为密切[15]。肝脏移植过程中的HIRI是难以避免的,产生的具体机制也尚不明确。因此,如何保护供肝减轻HIRI是目前肝移植研究领域的热点之一。自噬广泛存在于真核生物中,在进化上是具有高度保守性的生物学行为,细胞依赖溶酶体途径对自身蛋白质和细胞器进行降解,清除变性或错误折叠的蛋白质、损伤或衰老的细胞器,以维持细胞内环境的稳定。自噬机制被破坏将导致细胞异常甚至死亡[16]。自噬性细胞死亡又被称为Ⅱ型细胞凋亡,其与传统意义的细胞凋亡既有区别又有联系,二者通过复杂的分子机制相互影响,共同调控细胞的生存或死亡。越来越多的研究显示,自噬在肝脏疾病中具有重要作用,如在肝脏缺血时自噬能够使细胞适应环境的变化,增强细胞生存能力;但再灌注时,过强的自噬则直接导致细胞的程序性死亡,加重肝细胞损伤[17]。牡荆素是从山楂叶中提取的黄酮类有效成分,具有抗炎、抗氧化、降压和抗癌作用。有研究显示[18-19],牡荆素对大鼠脑和心肌IRI具有良好的保护作用,但对HIRI保护作用的相关研究较少。
基于此背景下,本文就牡荆素对小鼠HIRI的作用以及对自噬的影响进行探究,为认识牡荆素调控自噬减轻HIRI的作用提供依据。研究结果显示,经I/R处理后,小鼠肝组织自噬标记物Beclin1与LC3Ⅱ蛋白的表达水平增加,说明I/R能够诱导小鼠肝细胞的自噬活性增强;此时,肝细胞出现水肿、坏死,肝窦狭窄,中性粒细胞浸润,血清中ALT、AST水平明显升高,说明IRI了肝功能;同时,肝细胞凋亡相关蛋白caspase-3表达水平增加,而抗凋亡相关蛋白Bcl-2表达水平下降,TUNEL染色标记的凋亡细胞数量亦明显增加,表明I/R加重了肝损伤。相比之下,Vitexin组小鼠肝组织水肿减轻,中性粒细胞浸润减少,血清ALT、AST水平明显降低,表明牡荆素预处理能够减轻小鼠HIRI;通过比较分析自噬标记物水平与肝细胞凋亡之间的关系,发现Vitexin组小鼠肝细胞Beclin1、LC3蛋白表达减少,caspase-3蛋白表达水平也明显下降,而Bcl-2蛋白的表达明显增加,同时凋亡的肝细胞数量明显减少。
综上所述,牡荆素能够减轻小鼠HIRI,其机制可能是牡荆素抑制了再灌注时肝细胞自噬的信号通路,进而抑制了自噬性细胞死亡。我们认为牡荆素调控自噬在HIRI中发挥重要作用,减少肝移植过程中IRI的发生,为保护缺血的肝细胞提供依据,并为临床更好地保护供肝提供新思路。

