移植实验动物模型病理学
郭晖(华中科技大学同济医学院附属同济医院器官移植研究所,器官移植教育部重点实验室,国家卫生计生委器官移植重点实验室,湖北 武汉 430030)
器官移植研究是以实验为基础的研究项目,其中包括多种移植外科术式的探索、器官保存方式、排斥反应、免疫抑制以及免疫耐受机制的研究等,需要进行大量不同类型的实验研究。移植模型研究中的病理学观察是判断移植术式的可行性、器官保存方式的优劣和研究移植免疫机制的重要环节[1]。
1 移植动物模型的基本类型
1.1 依据供、受者遗传背景的差异分类:移植动物模型依据供、受者的品系组合可以分为同种同品系移植、同种异品系移植和异种移植[2]。同种同品系移植术常作为移植模型中的对照;同种异品系移植用于观测同种异体移植中的多种排斥反应及免疫耐受模型的建立;异种移植主要用于探讨异种器官应用于人体移植的可能性等。
1.2 依据移植部位分类:按移植部位的不同可以分为原位移植、异位移植和静脉输注移植[3]。其中原位移植是指将供者的器官移植到受者体内原来的解剖位置,进行此类移植需将受者器官切除;异位移植指供者的器官移植到与受者体内原解剖位置不同的其他位置;静脉输注移植主要为细胞移植,如输血、脾细胞输注和胰岛细胞移植等。
1.3 依据移植物类型分类:按移植物的类别可以分为细胞移植、组织移植和器官移植。细胞移植主要包括输血、脾细胞移植、骨髓移植、胰岛细胞移植、干细胞移植等;组织移植中常见为皮肤移植、血管移植和角膜移植等;器官移植包括肾移植、肝移植、心脏移植、胰腺移植、肺移植和小肠移植等。
移植动物模型中应用的动物主要包括小鼠、大鼠、兔、犬、猪和猕猴、狒狒等非人灵长类动物。这些动物在建立移植动物模型的研究中各有特点,可根据研究目的、经费情况和动物管理的难易程度予以选择。其中,小鼠已作为移植免疫学研究的首选动物,首先,目前已筛选繁殖出多种遗传背景良好,且能获取多种稳定转基因和基因敲除的小鼠,同时小鼠更容易诱导移植免疫耐受;其次,在技术方面,针对小鼠的生物学探针、单克隆抗体和其他实验试剂的生产和应用远远多于其他实验动物;同时小鼠的价格优廉、体积小而且便于实验操作。大鼠在移植研究中因其体积较大,适合作为需要进行血管吻合、淋巴管吻合以及神经吻合等显微外科操作的移植模型,相对于小鼠来说更易于操作及掌握;犬科动物是大动物移植模型的首选,已广泛用于移植实验外科各个方面,在研究新的移植手术方式等方面更具有优势;猪的器官和血管解剖结构、生理功能和免疫特性与人类相似,体积较大、经济且易于饲养,也广泛应用于各种器官移植动物模型实验中;非人灵长类动物应用于移植研究中的动物包括黑猩猩、大黑猩猩、猩猩、狒狒、猕猴和食蟹猴等,其进化程度高,在生理结构和功能方面与人类最为接近,是各种移植治疗、免疫抑制和免疫耐受诱导方案成功应用于临床的最后一道关键实验环节,但因其饲养困难,价格昂贵,常用于移植学发展的前沿研究,如异种移植研究中尝试将经过生物工程改造的猪器官首先移植给非人灵长类动物,以期最终可成功移植给人类来解决移植器官短缺的问题。
2 移植实验动物模型选择的基本原则
移植实验动物模型的选择主要包括供受体组合的选择和移植器官类型的选择两个方面。
2.1 移植模型中动物的选择:针对不同的实验目的选用不同的实验动物。例如啮齿类动物容易诱导耐受,常用于此类研究;而大动物解剖结构与人体相似,常用于外科技术研究;排斥反应的研究则根据实验的需要,两类动物均可以选择。此外,选用具有强排斥反应的模型,可用于免疫耐受的研究,从而展示处理因素的有效性。选用弱排斥模型,可迅速建立免疫耐受模型,通过加入处理因素而打破耐受,如Matzinger进行危险信号理论研究时,就选用了弱排斥模型[4]。
不同品系的动物,参与移植免疫应答的机制不同,产生免疫应答反应的强弱也不同[5]。以小鼠为例,其诱导免疫耐受的难易程度为:C57BL/6>BALB/C>DBA/2>CBA>C3H。即使两种近交系小鼠互为供受者,移植物排斥反应发生的时间也不同[6]。此外,不同品系的动物可发生不同的排斥反应,如以C3H小鼠作为供者,分别移植给C57BL/6小鼠(Th1参与为主)和BALB/C小鼠(Th2参与为主),前者引起典型急性细胞性排斥反应,而后者则引起急性血管性排斥反应。如果研究目的是Th1细胞相关细胞因子或CD8+T细胞介导的排斥反应时,应选择C57BL/6小鼠;如果研究Th2细胞相关细胞因子或CD4+T细胞介导的排斥反应时,则选择BALB/C小鼠。如进行移植免疫反应机制研究,应分别标明所用动物供受者的不同主要组织相容性复合物(MHC),只有当MHC存在明显差异时,研究得出的免疫反应抑制或耐受结果才有意义。
2.2 移植模型中移植器官的选择:不同器官的移植难度不同,这点在小动物模型中尤为明显,在选择移植器官类型时应避免片面追求技术难度和检测指标的“时髦”,这些均是选用移植模型方面的误区。移植研究中动物模型选择的基本原则是:① 只要能充分说明问题,选用的动物模型越简单越好,观测指标越简洁越好。能用皮肤移植就不要选用心脏移植,不要单纯为了追求技术含量或时髦的观测指标而本末倒置。越来越多的研究证据表明,器官切取、保存以及器官植入过程中对移植物造成的损伤与免疫反应密切相关,损伤引起机体释放炎症因子等危险信号[7-9],可能触发免疫应答的始动因子,因而尽可能减少移植物损伤对于获得良好的实验结果具有重要意义;② 移植术后产生的感染也会增强特异性免疫反应,影响移植物的存活时间,这点在皮肤移植方面尤为突出。严格地说,如果移植模型不是一个洁净的模型,不宜进行移植免疫反应研究。因此,在无菌操作、熟练掌握移植技术以及减轻损伤和感染的同时,必须建立严格的对照,尽量排除可能的污染因素,使其对结果的影响降至最低;③ 诱导免疫耐受的难易程度亦因不同脏器而异,由难到易依次为皮肤、小肠、心脏、胰岛、肾脏、肝脏。这与某些免疫学因素有关,如组织特异性抗原和移植物内抗原提呈细胞的含量等,也与移植物本身的解剖结构与生理功能具有一定的联系[10]。许多成功诱导心脏移植物免疫耐受的方案对同一供者来源的皮肤没有作用,设计实验研究应基于上述选择动物模型的原则。
3 移植实验动物模型病理学
移植动物模型研究中,为准确分析研究结果,除进行移植物大体肉眼观察和功能指标检测外,病理组织学检查更能反映移植物的真实情况,是结果分析中必不可少的环节。
3.1 移植实验动物模型中病理学研究的作用与内容:病理学观察是移植实验动物模型研究中结果分析的最佳手段,应贯穿于所有类型的移植研究中。其基本的研究作用与内容包括:① 观察移植术式研究中的移植物存活情况,判断该术式的可行性与安全性;② 在复制的移植排斥反应实验动物模型中,观察体液免疫与细胞免疫反应损伤的参与因子,协助排斥反应机制研究;③ 观察并记录各种类型排斥反应的组织病理学特点,为排斥反应的诊断提供依据;④ 观察各种器官保存液的效果与时限,评估其保存损伤;⑤ 研究移植物血管病等慢性排斥反应的机制以及治疗策略;⑥ 研究异种移植的可行性及其特殊类型排斥反应的病理学表现等。
3.2 移植实验动物模型病理学观察的注意事项:在移植实验动物病理学观察中需要注意的基本要点包括:① 在进行各种移植病理学模型观察之前,应充分了解移植模型的建立思路、实验目的、手术方法和术后免疫抑制等处理措施及动物存活时间等基本情况,便于有针对性地进行研究;② 熟悉各种移植实验动物基本的解剖学与组织学结构特点;③ 掌握各种移植模型排斥反应等的病理学变化特征;④ 熟练运用动物解剖、取材、制片等基本技术,以获得最满意的实验动物标本与切片,避免实验动物研究低于人体病理学诊断从而草率处理标本的观念,避免人为假象的形成干扰结果判断;⑤ 对每项实验课题应建立详细而全面的实验病理诊断与报告以及组织学图像资料;⑥ 对于研究生的移植实验动物模型研究,应在实验前应对实验动物解剖、标本获取、固定保存、选择合适的染色以及免疫组织化学染色方法等技术方面进行指导,以期获得准确的组织学结果;⑦ 移植病理研究者应主动参与移植动物模型的解剖,在解剖过程中可以肉眼直接观察移植物的改变,为镜下观察奠定基础;⑧ 了解移植学的新进展以及移植病理学的新方法。
3.3 各种移植实验动物模型的病理学特点
3.3.1 皮肤移植模型:小动物模型中同种皮肤移植常用于免疫预致敏手段,也可以作为实验动物形成免疫无能后通过脾细胞输注验证其细胞免疫功能的恢复情况。其排斥反应主要表现为移植皮肤真皮及表皮鳞状上皮内淋巴细胞浸润以及皮肤组织内的血管内皮炎。真皮组织内浸润的淋巴细胞散在于真皮结缔组织内,也可位于毛囊、汗腺周围以及毛囊与汗腺上皮。鳞状上皮层内可见淋巴细胞浸润以及部分上皮细胞坏死。严重者可见大部分皮片坏死。其主要的鉴别为感染,后者表现为移植皮片存在大量的中性粒细胞甚至脓细胞的浸润。
3.3.2 心脏移植模型:小动物同种异体心脏移植模型在移植实验研究中应用最多[11]。小鼠和大鼠心脏移植的排斥反应组织学表现基本相同,而小鼠移植心脏中可见由于血管吻合不良、狭窄、扭曲等手术技术因素形成的心肌组织广泛的缺血性梗死,可见大片心肌组织呈缺血性坏死,坏死灶周边可见明显的由大量中性粒细胞或脓细胞形成的炎症反应带,外围可残存少许心肌组织。如果为急性排斥反应,在心肌间质内可见不同数量的淋巴细胞浸润(图1),严重者可见局部心肌细胞坏死,甚至消失。心脏移植模型中典型的急性排斥反应者可见明显的心肌内冠状动脉分支内膜炎及内皮空泡变甚至内膜水肿(图2),管腔狭窄。对于小鼠或大鼠的异种心脏移植来说,肉眼可见移植心脏明显肿大,呈暗红色或紫红色(图3),心脏剖面甚至呈暗褐色出血状。镜下见心肌间质明显水肿以及出血,大量中性粒细胞浸润,大量心肌细胞坏死,静脉分支或少许动脉分支内可见纤维素样血栓栓塞。同种心脏移植的慢性排斥反应即冠状动脉血管病,可见心肌组织内冠脉分支明显的血膜增生甚至管腔闭塞(图4)。

图1 实验性移植心脏急性排斥反应,图示移植心脏心肌间质内淋巴细胞浸润(HE×200)

图2 移植心脏急性排斥反应的冠状动脉分支血管内膜炎(HE×200)

图3 小鼠异种移植心脏大体标本,图示移植心明显肿大,呈暗红色或紫红色(手术显微镜下观察)

图4 实验性心脏移植慢性排斥反应,移植心脏冠状动脉分支内膜明显增生(HE×200)
3.3.3 肾移植模型:同种肾移植模型中可见与人体移植肾排斥反应类似的组织学表现,其排斥反应病变以及程度划分均可以参考人体移植肾的相关特点与标准。在猕猴等灵长类动物的同种肾移植急性排斥反应中,肾组织内出现大量淋巴细胞浸润、肾小管上皮炎(图5)以及血管内膜炎,可见肾盂与输尿管明显水肿,镜下可见黏膜移行上皮以及黏膜下组织内明显的淋巴细胞浸润,提示肾盂以及输尿管损伤也是排斥反应的重要方面,而在临床人体肾移植中,一般对其注意不够。
实验研究中也常应用大鼠等动物肾动脉阶段性阻断的方式研究肾脏的缺血和缺血/再灌注损伤机制及其组织学与超微结构的变化。可见肾组织中肾小管上皮坏死甚至大片缺血性坏死的现象。
3.3.4 肝移植模型:肝移植模型是最为复杂的一种移植模型,主要用于肝移植的术式研究、肝脏保存后的移植以及肝脏特殊免疫特惠机制的研究等。大动物如猪或犬的肝移植动物模型对于临床肝移植前手术技术的熟练掌握及肝脏保存液的研究尤其重要,其中猪的肝脏解剖及生理与人体极其相似,已成为临床肝移植术前必备的实验模型之一。移植肝的存活时间与手术吻合技术处理的好坏具有很大的联系,技术不熟练常导致移植肝组织大面积区域性缺血坏死。而实验动物移植肝的排斥反应与人体肝移植类似,急性排斥反应主要表现为门管区炎症和小叶间胆管的炎性损伤(图6);慢性排斥反应呈门管区小叶间胆管的缺失(图7)。肝脏也常应用于阻断血流方法进行缺血和缺血/再灌注损伤以及治疗对策的研究,结合其模型可以进行肝细胞凋亡等免疫组织化学染色。
3.3.5 胰腺移植模型:临床胰腺移植手术技术复杂,大动物的胰腺移植模型研究对于摸索与熟练移植胰腺外分泌胰管的处理技术非常重要。而小动物胰腺移植实验模型对于在建立糖尿病模型后研究胰腺移植的治疗作用、移植胰腺内分泌功能的作用机制以及移植胰腺功能检测指标等方面具有价值。
大鼠胰腺移植后发生急性排斥反应时,在胰腺组织间质内出现大量淋巴细胞浸润以及胰腺导管上皮炎(图8),同时往往可见外分泌腺泡组织的溶解性坏死。严重的急性排斥反应可见血管分支的血管内膜炎。慢性排斥反应时可见胰腺外分泌腺泡组织广泛纤维化,动脉分支可见典型的移植物动脉血管病。
3.3.6 小肠移植模型:大鼠小肠移植模型中,急性排斥反应时可见移植小肠明显肿胀,肠壁增厚,小肠黏膜增厚而苍白。镜下可见黏膜层明显水肿,广泛的黏膜上皮糜烂甚至脱落,黏膜层内有大量淋巴细胞浸润及隐窝上皮炎。同时黏膜下层、肌层内也可见散在浸润的淋巴细胞,发生典型的急性排斥反应时可见肠壁黏膜下层、肌层以及外膜层内动脉血管分支内膜炎。
3.3.7 血管移植模型:在器官移植实验研究中,血管移植的动物模型不仅可以用于移植免疫学研究[12],还可以应用于慢性移植物血管病的研究,尤其对于后者来说,血管移植模型是最好的研究途径。慢性排斥反应导致的慢性移植物失功的主要特征性变化是慢性移植物血管病,设计一个能有效反映其病理变化的模型,对于此类疾病发病机制的研究具有非常重要的作用[13]。常规采用Lewis大鼠作为供者,Brown-Norway大鼠作为受者(两种MHC完全不匹配的近交系大鼠),进行胸腹主动脉移植,这是一种简化的慢性移植物血管病模型,与以前的模型相比,手术操作更为简单,基本能反映人类移植物动脉血管病的病理改变,并可以采用多种干预措施进行治疗性研究,因此,对于慢性移植物血管病的发病机制、病理组织学特征以及治疗研究都是首选的模型。在这一模型中可见移植物血管在术后早期典型的急性排斥反应所致的动脉内膜炎,还可以观察到急性排斥反应中参与的免疫细胞类型(图9)、动脉内膜增生情况以及采取不同的治疗措施后对动脉内膜增生即慢性移植物血管病的治疗作用。

图5 移植肾急性排斥反应,图示肾小管上皮内淋巴细胞浸润呈肾小管上皮炎(PAS×400)
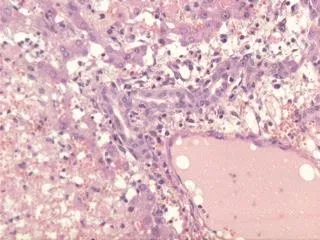
图6 大鼠移植肝急性排斥反应,汇管区内淋巴细胞浸润以及小叶间胆管上皮炎 (HE×200)

图7 大鼠移植肝慢性排斥反应,汇管区内小叶间胆管消失(HE×200)

图8 大鼠胰腺移植后急性排斥反应,胰腺小叶间导管上皮炎(HE×200)
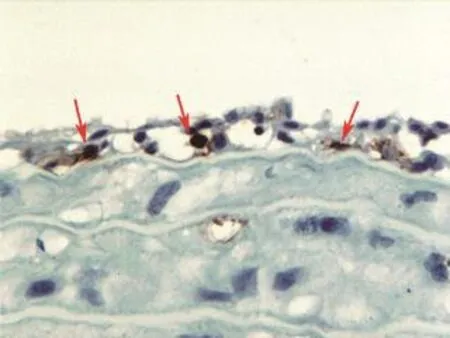
图9 移植动脉急性排斥反应的动脉内膜炎,内膜内浸润的淋巴细胞经免疫细胞化学染色多数为CD8+(免疫组化×200)
移植动物模型实验研究是移植研究的基础,贯穿于移植外科术式、器官保存、排斥反应机制、免疫抑制药物和免疫耐受机制等基础研究中,而其病理学观察是判断移植术式的可行性、器官保存方式的优劣和研究移植免疫机制不可缺少的内容。在实施移植动物模型研究及其病理学观察之前应对动物模型的类型进行划分、实验动物的选择原则等具有充分的了解。因移植动物模型的病理学改变主要以免疫性炎症病变为核心,故而在病理学观察时应把握其病变在不同移植器官和组织中的表现特征而予以准确的诊断和分析。

