观赏芍药幼胚不定芽离体诱导研究
魏冬霞 高 凯 袁燕波 汤正娇 于晓南*
(1.北京林业大学园林学院,北京 100083; 2.国家花卉工程技术研究中心,北京 100083; 3.花卉种质资源创新与分子育种北京市重点实验室,北京 100083; 4.洛阳农林科学院,洛阳 471002)
* 通信作者:E-mail:yuxiaonan626@126.com
观赏芍药幼胚不定芽离体诱导研究
魏冬霞1,2,3高 凯4袁燕波1汤正娇1于晓南1,2,3*
(1.北京林业大学园林学院,北京 100083;2.国家花卉工程技术研究中心,北京 100083;3.花卉种质资源创新与分子育种北京市重点实验室,北京 100083;4.洛阳农林科学院,洛阳 471002)
通过对芍药幼胚离体培养,可以有效缩短芍药的育种周期。本文以‘粉玉奴’、‘朱砂判’、‘团叶红’三个芍药品种不同采收期的种子为材料,研究不同胚发育时期、不同外殖体类型、消毒方式及启动培养基配方对芍药不定芽诱导的影响。结果表明,‘朱砂判’和‘团叶红’较适合胚培养成苗的发育时期分别为花后50和70 d;‘朱砂判’的合子胚相比于带胚乳胚,更适于启动和成苗培养;外殖体消毒的最佳方法为将心皮用70%酒精处理30~60 s,再用2%NaClO消毒20 min,之后取出胚珠用2%NaClO处理10 min;适宜的启动培养基配方为1/2MS+1.0 mg·L-1IAA+0.5 mg·L-1GA3。
芍药;胚培养;不定芽
芍药(PeaonialactifloraPall.)隶属于芍药科(Paeoniaceae)芍药属(Paeonia),是我国原产的著名传统花卉,已有约4000年的栽培历史[1]。芍药因其丰富的色彩、多变的花型及其广泛的用途,深受世界人民的喜爱[2~3]。长期以来,芍药主要采用实生苗繁殖和分株繁殖两种方法。分株繁殖要求有较多的繁殖材料,并且只能在生长季节进行,因此效率低下[1]。由于芍药种子存在复杂的连续休眠特性,自然条件下,芍药种子发芽需要两年左右的时间,此后还要经过多年的营养生长阶段才能开花,繁殖周期过长,也严重影响了杂交育种进程[4]。而其他传统繁殖方法则应用较少,且普遍效率低下,无法满足日益增长的市场需要,也影响了新品种培养进程,并进一步制约分子生物学的研究与开展[5]。
随着植物组织培养技术的发展,不仅很好的克服了上述问题,还加速了芍药的组织培养育种进程[6]。芍药的植物组织培养开始于20世纪60年代中期,Yamada和Sinoto通过培养山芍药的花瓣,首次成功诱导出愈伤组织。直到2006年,在加拿大Planteck Biotechnologies Inc.公司,首次开始宣传及推广芍药组培苗,令大家看到了芍药产业化生产的希望,但其可用于产业化生产的品种极为有限(后因经营不善而夭折)。2003年,Raghavan等将宿根亚麻(LinumperenneL.)与奥地利亚麻(L.austriacum)的杂交败育胚进行体外培养,并获得杂种植株,开创了胚培养技术在远缘杂交育种中应用的先河[7]。如今该技术广泛应用于植物的远缘杂交育种[8~9]。因此,用胚培养的技术进行芍药的繁育以解决远缘杂交育种中出现的各种问题,是加速芍药育种进程的必然趋势[10~11]。根据以往经验总结,成熟和未成熟的胚组织都是诱导产生胚状体和芽的适宜材料,本文以不同发育时期的幼胚为材料,探讨了基因型、消毒方式、外殖体以及胚龄等因素对芍药胚培养不定芽形成的影响。主要目的是:选择出合适发育时期的幼胚外殖体,筛选出最佳外殖体类型、消毒处理方式以及诱导芽发生的最佳启动培养基配方。本研究结果为芍药组培快繁和遗传转化体系的建立奠定基础,也为提高芍药杂交育种效率提供科学的方法。
1 材料与方法
1.1 材料
试验材料‘粉玉奴’(Peaonialactiflora‘Fen Yu Nu’)、‘朱砂判’(Peaonialactiflora‘Zhu Sha Pan’)和‘团叶红’(Peaonialactiflora‘Tuan Ye Hong’)均取自北京市昌平区小汤山基地,生长状况良好。
1.2 方法
1.2.1 消毒方式的筛选
以‘粉玉奴’、‘朱砂判’自然授粉 50 d的心皮和胚珠为材料,以包被于其中的合子胚为外殖体。首先,将心皮在流水下冲洗24 h,把其表面彻底刷洗干净;然后用洗洁精和NaClO浸泡20 min;最后在流水下冲洗30 min,用吸水纸吸干表面的水分,放置到超净工作台上进行消毒处理。此处消毒方式分为两种:①一步消毒处理,即心皮包被着胚珠进行消毒,最后直接取出合子胚进行接种。②两步消毒处理,即先心皮包被着胚珠进行一次消毒,再取出胚珠进行一次消毒,最后取出合子胚进行接种。具体消毒方式见表1(表中酒精或次氯酸钠消毒后,均用无菌水冲洗3次,每次3 min)。每处理15个外殖体,重复3次。消毒处理后转移至1/2MS+1.0 mg·L-16-BA+0.5 mg·L-1GA3培养基中,30天后统计数据。
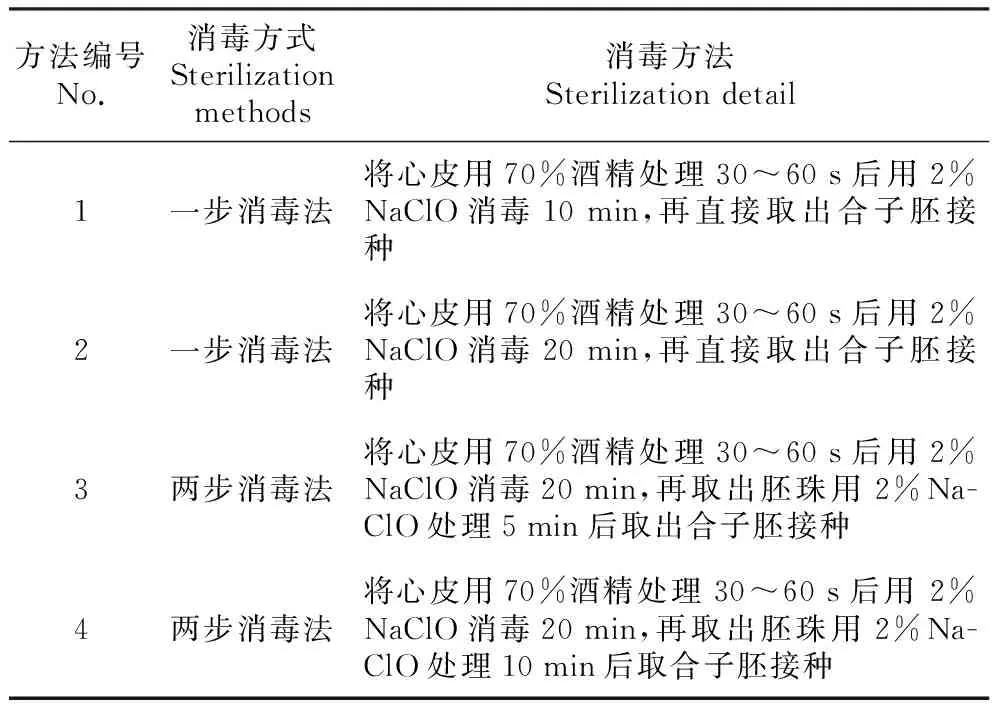
表1 外殖体的消毒方法
1.2.2 启动培养基的筛选
以‘朱砂判’自然授粉70 d的种子为试验材料,合子胚为外殖体。采用1.2.1筛选出的消毒方式进行消毒处理,1/2MS为基本培养基,激素组合设计见表2。每处理12个外殖体,3次重复。
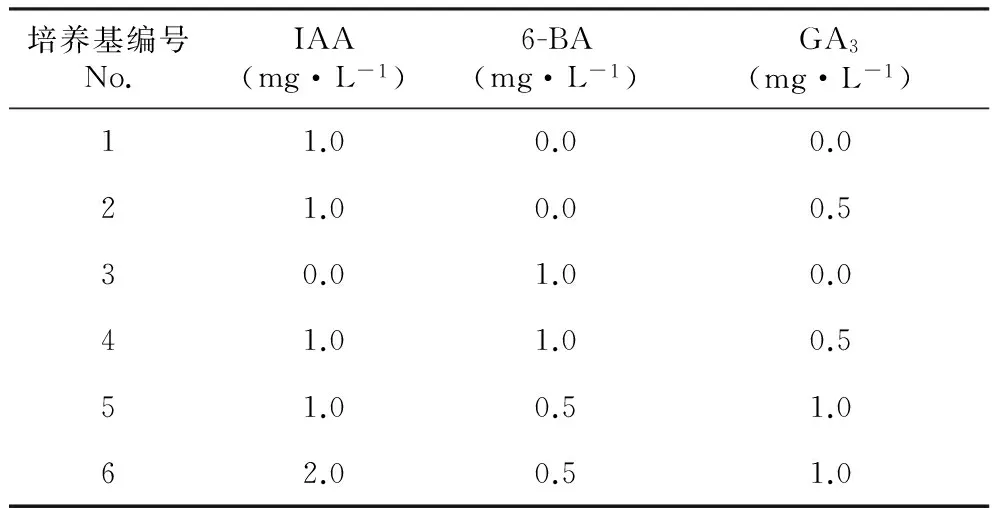
表2 不同激素组合设计
1.2.3 发育时期和外殖体类型对胚培养的影响
以‘朱砂判’自然授粉30、50、70、90 d和‘团叶红’自然授粉30、50、70 d的种子为试验材料,外殖体类型分别为胚珠、合子胚、带部分胚乳的合子胚(本文简称带胚乳胚)3种。以1.2.1筛选出的消毒方式进行消毒处理,接种于配方为1/2MS+1.0 mg·L-16-BA+1.0 mg·L-1GA3的培养基中,每处理24个外殖体,重复3次。
1.2.4 培养条件
培养基中添加蔗糖30 g·L-1、琼脂7 g·L-1,pH调为5.8~6.0,培养温度为(23±2)℃,光照时间14 h·d-1,光照强度为2 000~3 000 lx。
1.2.5 数据统计
百分数数据经过转换后,采用SPSS软件进行方差分析与多重比较。
污染率(%)=(接种污染数/接合子胚的总数)×100%
(1)
萌发率(%)=(萌发的外殖体数/接合子胚的总数)×100%
(2)
成苗率(%)=(成苗的外殖体数/接合子胚的总数)×100%
(3)
抽真叶率(%)=(抽出真叶的胚数/接合子胚的总数)×100%
(4)
胚轴膨大率(%)=(胚轴膨大的胚数/接合子胚的总数)×100%
(5)
抽茎率(%)=(抽出茎的胚数/接合子胚的总数)×100%
(6)
生根率(%)=(生根的幼苗数/接合子胚的总数)×100%
(7)
2 结果与分析
2.1 不同消毒方式的筛选
接种时,选用合适的外殖体消毒方法,可以很大程度地减少污染,降低频繁接种的工作量,并有利于在尽可能短的时间内建立起芍药胚离体培养体系。由表3可知,两个品种经过4种消毒方法消毒后的污染率均无显著性差异,但是两步消毒方式能得到较低的污染率以及较高的萌发率和成苗率。此外,两个品种经方法4消毒后,萌发率和成苗率均最高,污染率均最低。因此,本试验认为,将心皮用70%酒精处理30~60 s后,用2%NaClO消毒20 min,再取出胚珠用2%NaClO处理10 min(即方法4)能取得较好的消毒效果。
2.2 启动培养基的筛选
试验发现,生长调节剂的应用使各培养基上合子胚的胚轴普遍膨大,其中2号培养基的胚轴膨大率最高为94.44%,与1号培养基相比高出了30%以上,说明IAA与GA3配合使用可提高合子胚的膨大率。经方差分析,各培养基的胚轴膨大率差异不显著,说明无论是单一种类的激素还是激素的混合使用,对胚轴的刺激作用均不明显。就抽真叶率和抽茎率的指标而言,2号培养基表现最好,均与单一IAA处理的萌发效果差异显著。就生根率而言,2、3、6号培养基表现良好,相互间差异不显著,但均显著高于5号培养基。此外,2、4号培养基最终的成苗率最高,为58.33%,均与1、5号培养基差异显著,此时GA3的浓度均为0.5 mg·L-1;而当GA3的浓度升高到1 mg·L-1时,成苗率明显下降,可见当GA3的浓度过高时,不利于胚培养的成苗生长。具体情况见表4。综合以上指标的分析得出,1/2MS+1.0 mg·L-1IAA+0.5 mg·L-1GA3(2号培养基)为最适宜成苗的启动培养基。

表3 不同消毒方法的效果
表4启动培养基对‘朱砂判’合子胚启动生长和成苗的影响
Table4Effectsofmediumonembryocultureof‘ZhuShaPan’

编号No.抽真叶率Extractionrateofeuphylla(%)胚轴膨大率Swellrateofplumularaxis(%)抽茎率Extractionrateofstem(%)生根率Rootingrate(%)成苗率Seedlingsrate(%)150.00±16.67a63.89±31.55a44.44±12.73ab55.56±31.55ab30.56±9.62a280.56±12.73b94.44±9.62a69.44±4.81c66.67±25.00b58.33±16.67b358.33±16.67ab80.56±12.73a41.67±8.33ab69.44±12.73b36.11±9.62ab472.22±4.81ab83.33±8.33a66.67±8.33c63.89±19.25ab58.33±16.67b555.56±12.73ab69.44±9.62a27.78±12.73a27.78±12.73a25.00±8.83a666.67±16.67ab86.11±9.62a52.78±9.62bc69.44±4.81b36.11±12.73ab
2.3 不同发育时期和外殖体类型对胚培养的影响
结果表明,两个芍药品种早期(30 d)胚珠培养不成功,培养3天后几乎所有胚珠的种孔部位均出现乳白色液体,推测发生污染的原因是内部合子胚未完成器官分化。从表5可以得出,‘朱砂判’合子胚的胚轴膨大率显著高于带胚乳胚,由此说明接种时去掉胚乳有助于胚轴的膨大。此外,胚轴膨大率随着胚龄的增长成递增趋势,合子胚成熟后(90 d)的胚轴膨大率最高。就抽真叶率、抽茎率和生根率指标而言,花后50和90 d合子胚的生长表现优于70 d,但差异不显著。此外,花后50 d合子胚的成苗率显著高于花后50 d带胚乳胚和70 d的合子胚,与90 d的合子胚差异不显著。综合几个指标的分析可以得出,就外殖体而言,‘朱砂判’的合子胚与带胚乳胚相比,更适于启动和成苗培养。就发育时期而言,花后90 d的合子胚有助于幼苗的胚轴膨大、抽真叶以及生根生长;而花后50 d的合子胚有助于幼苗的抽茎和成苗生长,并显著高于花后70d的成苗率,由此得出‘朱砂判’花后50 d是比较适合胚培养成苗的发育时期。从表6可以看出,‘团叶红’花后70 d合子胚各个指标的生长表现均优于花后50 d时,其中胚轴膨大率和生根率与之差异显著。由此得出,‘团叶红’花后70 d是比较适合胚培养成苗的发育时期。综合两个品种花后50 d合子胚的数据来看,‘朱砂判’各项指标的表现均高于‘团叶红’;综合两个品种花后70 d合子胚的数据来看,‘团叶红’的抽真叶率、抽茎率和生根率均高于‘朱砂判’,而胚轴膨大率和成苗率两个指标与‘朱砂判’表现一致。综上所述,发育时期、外殖体类型和基因型是影响胚培养的重要因素。
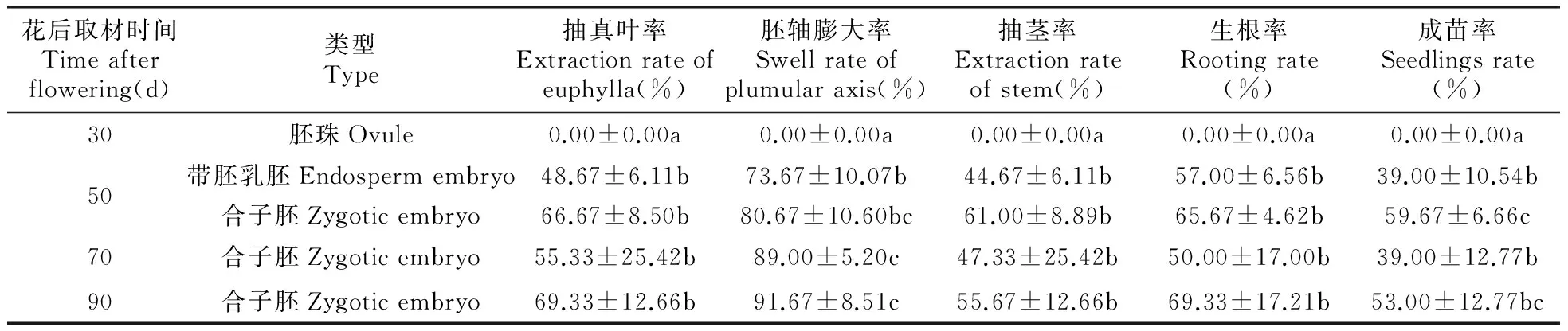
表5 不同发育时期和外殖体类型对‘朱砂判’启动培养和成苗的影响

表6 不同发育时期对‘团叶红’启动培养和成苗的影响
3 讨论
3.1 不同消毒方式的筛选
不同消毒方法的试验结果表明,将心皮用70%酒精处理30~60 s后用2%NaClO消毒20 min,再取出胚珠用2%NaClO处理10 min能取得较好的消毒效果,表现在污染率大幅降低、较高的萌发率和成苗率。芍药离体快繁中常用的消毒剂种类有酒精、次氯酸盐、HgCl2等[12~13],消毒方式的选择也不能一概而论,如何桂梅认为:牡丹胚珠离体培养时,应尽量采取直接消毒的方式,即胚珠经70%的酒精消毒30~60 s后,用0.1%的HgCl2处理6 min[8]。所以,应根据具体的需要筛选合适的消毒方式,从而保证良好的消毒效果[14]。
3.2 启动培养基的筛选
研究发现,1/2MS+1.0 mg·L-1IAA+0.5 mg·L-1GA3(2号培养基)为最适宜成苗的启动培养基,而且较高浓度的GA3(1 mg·L-1时)不利于胚培养的成苗生长。GA3和IAA配合使用能取得较好的解除休眠的效果,与王莹等人的研究结果基本一致[15]。于晓南等也认为GA3是诱导合子胚萌发和成苗的最主要因素[16]。高昌勇等试验中仅用GA3便打破芍药胚休眠,促使其萌发[10]。孙晓梅等在芍药胚离体培养研究中发现,GA3是影响上胚轴初代培养的关键因素,与6-BA配合使用可以有效打破芍药合子胚上胚轴休眠,刺激茎的伸长[17]。由此可见,适宜浓度的GA3在芍药合子胚的启动培养中发挥重要作用。
3.3 不同发育时期和外殖体类型对胚培养的影响
试验表明,外殖体的发育时期明显影响离体培养的结果,内部合子胚完成器官分化后方可培养成苗。而发育早期的胚珠(30 d)不能成功培养,与何桂梅的研究结果一致[8],在块根芍药(P.intermedia)和珊瑚芍药(P.mascula)的相关报道中也得到了相似结论[18]。推测其原因之一可能是:内部合子胚处于游离核或细胞化时期,而胚原基的发生涉及原始的反分化过程,这必然要求更为严格的发育环境;或是合子胚已经完成细胞化,处于胚原基发生和球形胚的阶段,此时为异养时期,需要从胚乳中吸取足够的营养物质,因而所需的培养基配方比较复杂。另一方面,早期的胚珠可能未完成受精作用,因此离体培养较为困难。相对而言,花后50、70、90 d的合子胚培养更为容易。‘朱砂判’和‘团叶红’分别于花后50和70 d适合胚培养成苗,与何桂梅认为的牡丹刚完成器官分化的早期子叶胚(约60~65 d)可很快离体培养成苗的观点基本一致[8]。
就外殖体类型而言,‘朱砂判’的合子胚比带胚乳胚更适于启动和成苗培养,推测原因可能是坚硬的外种皮阻碍了合子胚对营养成分的吸收,导致合子胚污染严重而不萌发。这一结论也与沈苗苗的研究结果一致[19~20]。而王莹[15]以花后90和120 d的紫斑牡丹种子为材料,发现以带全部胚乳的合子胚为外殖体进行接种,对抽真叶、抽茎等方面的萌发生长均有利。其原因可能是紫斑牡丹的胚乳中含有较多的还原糖和脂肪,为胚的萌发提供了丰富的营养物质[21]。综合本试验两个品种表现来看,‘朱砂判’花后50 d的各项指标表现均高于‘团叶红’,而‘团叶红’花后70 d的抽真叶率、抽茎率和生根率均高于‘朱砂判’。综上所述,合子胚发育时期、外殖体类型和基因型是影响胚培养的重要因素。综合前期杂交工作和本次胚培养的试验结果,我们认为在芍药远缘杂交育种中应尽可能选择发育较为早期的合子胚,以解决亲本的杂交不亲和或杂合子胚的早期败育问题。
1.秦魁杰.百花盆栽图说丛书——芍药[M].北京:中国林业出版社,2004:1-3,76-81.
2.郭芃芃,于晓南.引进欧美芍药切花品种适宜采收期的研究[C].中国观赏园艺研究进展,2009.
3.Ji Lijing,Wang Qi,Yu Xiaonan.The genetic diversity ofPaeoniaL.[J].Scientia Horticulturae,2012,143:62-74.
4.宋焕芝,于晓南,沈苗苗.芍药属植物种子双重休眠特性与破眠技术研究进展[J].种子,2011,30(3):67-70.
5.于晓南,宋焕芝,郑黎文.国外观赏芍药育种与应用及其启示[J].湖南农业大学学报:自然科学版,2010,36(2):159-162.
6.张庆瑞.芍药组织培养技术的初步研究[D].郑州:河南农业大学,2006.
7.Raghavan V.One hundred years of zygotic culture investigations[J].In Vitro Cellular & Developmental Biology-Plant,2003,39(5):437-442.
8.何桂梅.牡丹远缘杂交育种及其胚培养与体细胞胚发生的研究[D].北京:北京林业大学,2006.
9.Sharma D R,Kaur R,Kumar K.Embryo rescue in plants:a review[J].Euphytica,1996,89(3):325-337.
10.高昌勇.芍药胚离体培养的研究[J].北方园艺,2010(16):157-158.
11.Ji Lijing,Jaime A.Teixeira da Silva,Jianjun Zhang,et al.Development and application of 15 novel polymorphic microsatellite markers for sect.Paeonia(PaeoniaL.)[J].Biochemical Systematics and Ecology,2014,54:257-266.
12.沈苗苗.观赏芍药胚培养及茎段愈伤组织诱导研究[D].北京:北京林业大学,2013.
13.吴红娟.芍药品种地下芽诱导及愈伤组织培养研究[D].北京:北京林业大学,2011.
14.Yu Xiaonan,Wu Hongjuan,Jaime A.Teixeira da Silva and MiaoMiao Shen.Multiple shoot induction and rooting ofPaeonialactiflora‘Da Fu Gui’[J].African Journal of Biotechnology,2012,11(41):9776-9781.
15.王莹,何桂梅,韩丽晓.紫斑牡丹胚培养及幼苗生长的研究[J].湖南农业科学,2012(09):103-106.
16.于晓南,宋焕芝,王琪.北美新芍药品种引种适应性初报[J].林业实用技术,2011(12):50-51.
17.孙晓梅,王慧聪,周文强,等.芍药胚离体培养的初步研究[J].北方园艺,2013(10):97-99.
18.Batygina T B,Bytehro P T.Morphogenetic potential of the embryo of angiosperms with a reference to the represpentative of the genusPaeonia[J].Bot ZH,1981,66(1):1531-1548.
19.Shen M M,Wang Q,Yu X N,et al.Micropropagation of herbaceous peony(PaeonialactifloraPall.)[J].Scientia Horticulturae,2012,148:30-38.
20.Shen Miaomiao,Tang Zhengjiao,Jaime A,et al.Induction and proliferation of axillary shoots from in vitro culture ofPaeonialactifloraPall. mature zygotic embryos[J].New Zealand Journal of Crop and Horticultural Science,2015,43(1):42-52.
21.曹小勇.紫斑牡丹胚乳营养成分分析[J].植物生理学通讯,2003,39(3):248.
AdventitiousBudInductionwithImmatureEmbryoofHerbaceousPeony
WEI Dong-Xia1,2,3GAO Kai4YUAN Yan-Bo1TANG Zheng-Jiao1YU Xiao-Nan1,2,3*
(1.College of Landscape Architecture,Beijing Forestry University,Beijing 100083;2.National Flower Engineering Research Center,Beijing 100083;3.Beijing Key Laboratory of Ornamental Plants Germplasm Innovation and Molecular Breeding,Beijing 100083;4.Luoyang Academy of Agriculture and Forestry Sciences,Luoyang 471002)
Culture of zygotic embryos is an effective way to accelerate the breeding process of herbaceous peony. With the zygotic embryos of three herbaceous peony(PaeonialactifloraPall.) cultivars(‘Fen Yu Nu’, ‘Zhu Sha Pan’ and ‘Tuan Ye Hong’), we studied the affection of different embryo age, explant types, sterilization methods and starting medium formula on root initiation in vitro. The suitable development period were 50 and 70 d after flowering for embryo-culture of ‘Zhu Sha Pan’ and ‘Tuan Ye Hong’, respectively. We got better results when using excised zygotic embryos rather than keeping part of endosperm reserved. The optimal disinfection method for explant was that firstly treating carpel for 30-60 s with 70% alcohol, then for 20 min with 2% NaClO, and finally for 10 min with 2% NaClO. The optimal initial medium was 1/2MS+1.0 mg·L-1IAA+0.5 mg·L-1GA3.
Herbaceous peony;embryo-culture;root initiation
国家自然科学基金(31400591)
魏冬霞(1991—),女,硕士研究生。主要从事芍药资源与育种的研究。
2015-07-28
S682.1
A
10.7525/j.issn.1673-5102.2016.02.006

