滇龙胆GrCMS基因的克隆与表达分析
张晓东 李彩霞 王元忠
(1.玉溪师范学院资源环境学院,玉溪 653100; 2.云南省农业科学院药用植物研究所,昆明 650223)
* 通信作者:E-mail:boletus@126.com
滇龙胆GrCMS基因的克隆与表达分析
张晓东1李彩霞1王元忠2*
(1.玉溪师范学院资源环境学院,玉溪 653100;2.云南省农业科学院药用植物研究所,昆明 650223)
2-C-甲基-D-赤藓醇4-磷酸胞苷酰转移酶是赤藓糖磷酸酯(MEP)途径中的第三个催化酶。以滇龙胆转录组为基础,采用RT-PCR技术从滇龙胆幼叶克隆2-C-甲基-D-赤藓醇4-磷酸胞苷酰转移酶基因GrCMS,并进行原核表达和组织特异性表达分析。序列分析显示,GrCMS基因(登录号KJ917164)开放阅读框(ORF)长933 bp,编码310氨基酸,推测分子量为34.23 kD,等电点为7.68。蛋白质序列分析显示,GrCMS无信号肽,为亲水稳定蛋白,主要由α-螺旋和无规则卷曲构成,可能定位叶绿体;具有CMS保守结构域。进化分析结果表明,GrCMS蛋白与长春花CrCMS蛋白亲缘关系最近。原核表达结果表明,GrCMS与预期蛋白大小一致。定量PCR结果表明,GrCMS基因主要在叶中表达。结果为进一步研究该基因功能和龙胆苦苷生物合成途径奠定基础。
滇龙胆;2-C-甲基-D-赤藓醇4-磷酸胞苷酰转移酶;基因克隆;表达分析
滇龙胆(Gentianarigescens)为常用大宗药材,是200多种中药的主要成分[1]。近年来,龙胆市场需求量年递增约10%,国内外市场对龙胆的需求量高达3 000~4 000吨,导致野生滇龙胆遭到人为大肆破坏[1]。2013年7月,云南省启动了龙胆草航天育种工程,其目标主要是提高主要药效成分龙胆苦苷含量、抗逆性和扩大种植范围[2]。由于龙胆属区域性分布物种,在世界上其它国家,许多龙胆属植物也都相继成为濒危物种[3]。要解决龙胆药源问题和保护其野生资源,必须弄清其主要药效成分龙胆苦苷的生物合成途径及其调控机理,为培育龙胆新品种和通过生物工程手段生成龙胆苦苷提供帮助。
在植物中,龙胆苦苷是通过质体赤藓糖磷酸酯(MEP)途径和胞质甲羟戊酸途径(MVA)合成的[2,4]。2-C-甲基-D-赤藓醇4-磷酸胞苷酰转移酶(2-C-methyl-D-erythritol 4-phosphatecytidyltransferase,EC 2.7.7.60,在已报道文献中简写为CMS、MCT、ispD、ATMEPCT、IspD)是MEP途径中的第三个催化酶,能催化2-C-甲基-D-赤藓醇4-磷酸(MEP)生成4-胞苷-5-磷酸-2-C-甲基-D-赤藓醇(CDP-ME),该反应依赖于CTP和Mg2+的存在[4~8]。目前,CMS基因已从拟南芥(Arabidopsisthaliana)[9~10]、萝芙木(Rauvolfiaverticillata)[11]、曼地亚红豆杉(Taxus×media)[12]、银杏(Ginkgobiloba)[13]、橡胶树(Heveabrasiliensis)[14]、水稻(Oryzasativa)[15]、秦艽(Gentianamacrophylla)[4]和杜仲(Eucommiaulmoides)[16]等许多植物中分离。早在十多年前,CMS蛋白晶体结构就已获得[17]。CMS基因在模式植物拟南芥中研究的比较多。在拟南芥中,仅存在一个AtCMS基因[5],其开放阅读框(ORF)全长909 bp,将其中编码的76-302肽链在大肠杆菌内表达,获得的蛋白具有和大肠杆菌(E.coli)EcCMS酶同样的活性[10]。Hojo等对采用EMS化学诱变法获得的两种拟南芥CMS基因部分失活突变体isp1-1和isp1-2进行研究,结果发现二者隐性突变能导致叶绿素荧光增强、生长速率减慢和非光化学猝灭增加[6]。而拟南芥T-DNA插入突变体ispD-1和ispD-2则为白化致死表型,质体发育停止在前质体阶段,叶绿素和类胡萝卜素累积受阻[7]。采用反义技术获得的拟南芥MCT基因突变体AS1-1和AS3-1株系,也出现了与T-DNA插入突变体类似的表型,而且其对映贝壳杉烯含量减少[9]。
CMS基因的表达具有组织特异性,并被生物和非生物因素诱导,影响萜类及其衍生物的生物合成。在萝芙木中,RvCMS基因在嫩叶中的表达量最高,然后依次是老叶、树皮、根和茎[18]。使用乙酰水杨酸处理萝芙木毛状根24 h后,与对照组相比,RvCMS基因上调10倍以上[19]。最新研究结果表明,在AtPIF5过表达拟南芥培养细胞株系中,AtCMS基因的表达上调2~3倍[20]。在生物诱导剂(100 mg·mL-1酵母提取物)和非生物诱导剂(30 mmol·L-1Ag+)共同诱导36 h,丹参(Salviamiltiorrhiza)SmCMS基因在诱导后12 h内下降到最低,然后逐渐升高,在36 h时表达量达到最高[21]。在ABA处理的萝芙木毛状根中,MEP途径基因RvDXR(1-脱氧-D-木酮糖-5-磷酸还原异构酶)、RvCMS、RvMCS(2-C-甲基赤藓醇-2,4-环焦磷酸合成酶)、RvHDS(羟甲基丁烯基-4-磷酸合成酶)和RvHDR(1-羟基-2-甲基-2-(E)-丁烯酸-4-焦磷酸还原酶)的表达显著上调,而生物碱阿马里新途径特异性基因RvTDC(色氨酸脱羧酶)、RvSTR(异胡豆苷合成酶)和RvSGD(异胡豆苷合成酶)的表达并未上调,结果阿马里新干重含量提高约15.15%[22]。使用乙酰水杨酸处理萝芙木的毛状根,上调了MEP途径相关基因(RvDXR、RvCMS、RvMCS、RvHDS和RvHDR)的表达,但同时也下调了阿玛碱合成途径特异性基因RvSTR和RvSGD的表达,最终导致阿玛碱含量降低约6.71%[23]。并非所有的CMS基因均参与萜类的合成,如在橡胶树中,HbCMS1和HbCMS2参与类胡萝卜素的生物合成,而非橡胶的生物合成[14]。
目前,国内外对龙胆的研究主要集中在种子萌发、裂环烯醚萜苷鉴定[24]、药材辨别[25]、DNA条码、转录因子功能、新品种选育[2]等方面,还未见对滇龙胆GrCMS基因进行克隆和表达分析的报道。本研究是基于滇龙胆根和叶转录组预测的GrCMS基因序列,设计一对基因特异性引物,通过RT-PCR技术从栽培滇龙胆中成功扩增到GrCMS基因,并进行序列分析、原核表达和根茎叶中的表达分析,以期为滇龙胆GrCMS基因功能研究奠定基础。
1 材料和方法
1.1 材料
滇龙胆植株栽培于玉溪师范学院4教202室。使用滇龙胆无菌苗幼叶进行RNA提取和基因扩增。2014年5月17日,对土壤栽培滇龙胆的根、茎和叶采样,用于基因表达分析。
1.2 方法
1.2.1叶片总RNA提取及GrCMS基因ORF的克隆
按照RNA提取试剂RNAiso(Takara,大连)说明书从滇龙胆幼叶提取总RNA;按照反转录试剂盒(Takara,大连)说明书合成第一链cDNA。根据pGEX-4T-1质粒多克隆位点和滇龙胆转录组GrCMS基因序列,设计一对基因特异引物GrCMSBamHⅠ-F和GrCMSXhoⅠ-R(表1,捷瑞,上海)。以cDNA为模板进行PCR扩增,反应体系为TransTaqTaq DNA Polymerase High Fidelity(2.5 U·μL-1,全式金,北京)0.5 μL,10×TransTaqHiFi Buffer Ⅱ 5 μL,dNTP(2.5 mmol·L-1,Takara,大连)4 μL,模板2 μL,正反向引物(10 μmol·L-1)各1 μL,加ddH2O补足50 μL。PCR反应条件为:94℃预变性3 min;94℃变性30 s,55℃退火30 s,72℃延伸1 min,30循环;72℃延伸10 min。PCR产物经琼脂糖凝胶电泳分离后割胶,使用胶回收试剂盒(Qiagen,德国)回收目的片段,将其连接到pMD19-T载体(Takara,大连)。转化大肠杆菌DH5α(Takara,大连)后,进行蓝白筛选,挑取白斑摇菌;使用碱裂解法提取质粒,经质粒大小检测后,再进行酶切检测,正确后进行DNA测序(上海生工,上海),获得重组质粒pMD19-GrCMS。
表1GrCMS基因克隆和表达分析的引物
Table1PrimersforGrCMSgenecloningandreal-timePCRanalysis
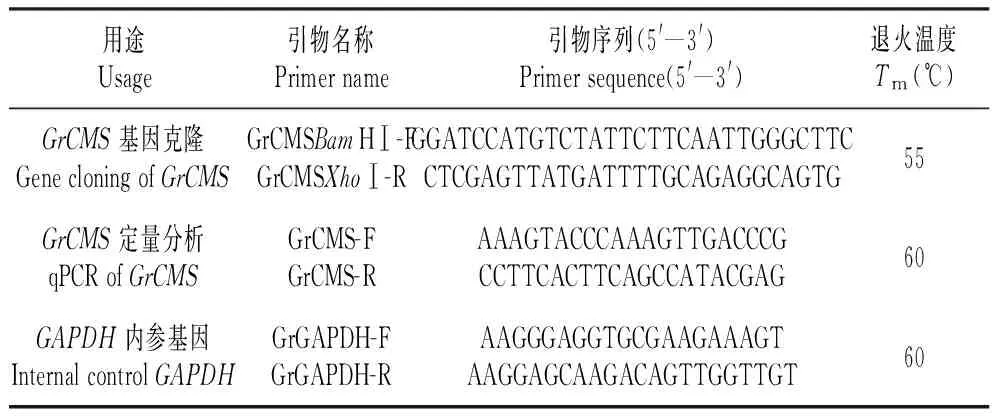
用途Usage引物名称Primername引物序列(5'—3')Primersequence(5'—3')退火温度Tm(℃)GrCMS基因克隆GenecloningofGrCMSGrCMSBamHⅠ-FGrCMSXhoⅠ-RGGATCCATGTCTATTCTTCAATTGGGCTTCCTCGAGTTATGATTTTGCAGAGGCAGTG55GrCMS定量分析qPCRofGrCMSGrCMS-FGrCMS-RAAAGTACCCAAAGTTGACCCGCCTTCACTTCAGCCATACGAG60GAPDH内参基因InternalcontrolGAPDHGrGAPDH-FGrGAPDH-RAAGGGAGGTGCGAAGAAAGTAAGGAGCAAGACAGTTGGTTGT60
1.2.2 GrCMS基因原核表达载体构建
对质粒pGEX-4T-1(Amersham,瑞典)和pMD19-GrCMS分别进行BamHⅠ(Takara,大连)和XhoⅠ(Takara,大连)双酶切,回收载体片段和目的基因,按摩尔比1∶4进行过夜连接,然后转化大肠杆菌DH5α感受态细胞(Takara,大连),涂布于添加100 mg·L-1氨苄青霉素(Takara,大连)的LB固体平板,12 h后挑取克隆;摇菌后,提取质粒,经质粒大小检测后,再进行酶切检测,检测正确后,获得原核表达载体pGEX-4T-1-GrCMS。
1.2.3 GrCMS基因的生物信息学分析
按表2中的软件分别进行序列拼接、多序列比对、系统发育分析、蛋白理化性质分析等。
1.2.4 GrCMS基因的原核表达
使用热激法将重组质粒pGEX-4T-1-GrCMS转化大肠杆菌Rosetta(DE3)感受态细胞(全式金,北京),挑取单菌落接种于含有氨苄青霉素的LB液体培养基中,37℃摇床培养12 h。然后以1∶100比例接种到无抗生素的LB液体培养基中,37℃摇床培养至OD600≈0.8,使用终浓度1 mmol·L-1IPTG进行诱导表达,以相同条件的pGEX-4T-1转化菌作对照;分别诱导0、2、4、6和8 h后,收集菌液2 mL。4℃离心集菌,弃上清,加入100 μL ddH2O、25 μL的5×SDS-PAGE上样缓冲液,震荡悬菌,沸水煮10 min。4℃离心5 min。取20 μL样品上样,进行SDS-PAGE(5%浓缩胶和12%分离胶)电泳检测。
表2GrCMS基因的生物信息学分析
Table2BioinformaticsanalysisofGrCMSgene

项目Item软件Software网址Website序列分析SequenceanalysisGenetyx6.1.8;DNAMAN7;BLASTn;BLASTphttp://blast.ncbi.nlm.nih.gov/Blast.cgi多序列比对MultisequencealignmentDNAMAN7http://www.lynnon.com系统发育树构建ConstructionofphylogenetictreeClustalX2.1MEGA6.0http://www.clustal.orghttp://www.megasoftware.net蛋白理化性质分析PredictionofproteinphysicochemicalpropertiesProtParamhttp://web.expasy.org/protparam/稀有密码子AnalysisofrarecodonCodonfrequencieshttp://molbiol.edu.ru/eng/scripts/01_11.html叶绿体转运肽预测PredictionofChloroplasttransitpeptideChloroPv1.1http://www.cbs.dtu.dk/services/ChloroP保守结构域预测PredictionofconservativedomainsInterprohttp://www.ebi.ac.uk/interpro/scan.html信号肽预测PredictionofsignalpeptideSignalP4.1http://www.cbs.dtu.dk/services/SignalP/蛋白疏水性预测PredictionofproteinhydrophobicityProtScalehttp://web.expasy.org/protscale/跨膜螺旋区预测PredictionoftransmembraneregionsTMHMM2.0http://www.cbs.dtu.dk/services/TMHMM/亚细胞定位预测PredictionofsubcellularlocalizationWOLFPSORThttp://www.genscript.com/psort/wolf_psort.html二级结构预测PredictionofsecondarystructureSSprohttp://download.igb.uci.edu/sspro4.html三级结构预测PredictionoftertiarystructureSwiss-ModelWorkspacehttp://swissmodel.expasy.org/workspace/
1.2.5 GrCMS基因的实时定量分析
分别取盆栽3年生滇龙胆的叶、茎和根,首先提取总RNA,进行琼脂糖凝胶电泳检测,然后使用DNaseⅠ处理除去基因组DNA。使用逆转录试剂盒(Takara,大连)合成第一链cDNA。根据GrCMS基因的cDNA序列设计基因特异性引物GrCMS-F和GrCMS-R(表1)。使用SuperReal PreMix Plus试剂盒(天根,北京)进行qPCR,PCR扩增条件为:95℃ 3 min,95℃ 15 s,60℃ 31 s。每个反应重复3次。反应在ABI7000荧光定量PCR仪(Applied Biosystems,美国)上进行扩增,扩增曲线、溶解曲线、标准曲线由定量PCR仪软件自动生成。以GrGAPDH基因为内参(表1),计算根茎叶中GrCMS基因相对表达量。采用比较Ct值的“2-△△Ct”的方法进行定量数据的分析处理。
2 结果与分析
2.1 滇龙胆GrCMS基因的克隆
以滇龙胆cDNA为模板,使用基因特异性引物GrCMSBamHⅠ-F和GrCMSXhoⅠ-R扩增出约1 000 bp的片段(图1)。通过TA克隆方法,获得重组质粒pMD19-GrCMS。
2.2 GrCMS基因的生物信息学分析
利用Genetyx和DNAMAN软件对GrCMS基因ORF序列进行分析,结果显示GrCMS基因(GenBank登录号:KJ917164)ORF全长933 bp,编码310个氨基酸。
使用BLASTp软件对GrCMS蛋白氨基酸序列
进行相似性分析,结果表明滇龙胆GrCMS与长春花CrCMS蛋白序列相似性最高,为78.57%;与褐藻EsCMS蛋白相似性较低,为43.31%。利用DNAMAN软件将GrCMS蛋白与NCBI中相似性较高的序列进行多序列比对分析,结果表明GrCMS蛋白与已知蛋白序列在N端转运肽序列部分相似性较低,而在催化区域相似性很高(图2)。利用MEGA软件将GrCMS蛋白与相似性较高的部分序列和文献已报道的部分序列进行系统发育分析,结果显示滇龙胆GrCMS与长春花(Catharanthusroseus)CrCMS蛋白处于同一进化枝(图3),表明二者的亲缘关系较近。

图1 滇龙胆GrCMS基因的PCR扩增 M. DNA MarkerⅢ;1.GrCMS基因扩增结果Fig.1 PCR amplification of GrCMS gene in G.rigescens M. DNA Marker Ⅲ; 1. PCR result of GrCMS gene

图2 滇龙胆与其它植物CMS的氨基酸序列比对分析 黑色:相似性等于100%;粉红色:75%≤相似性<100%;浅蓝色:50%≤相似性<75%Fig.2 The amino acids sequence alignment of CMS between G.rigescens and other plants Black: Similarity:100%; Pink: 75%≤similarity<100%; Light blue: 50%≤similarity<75%
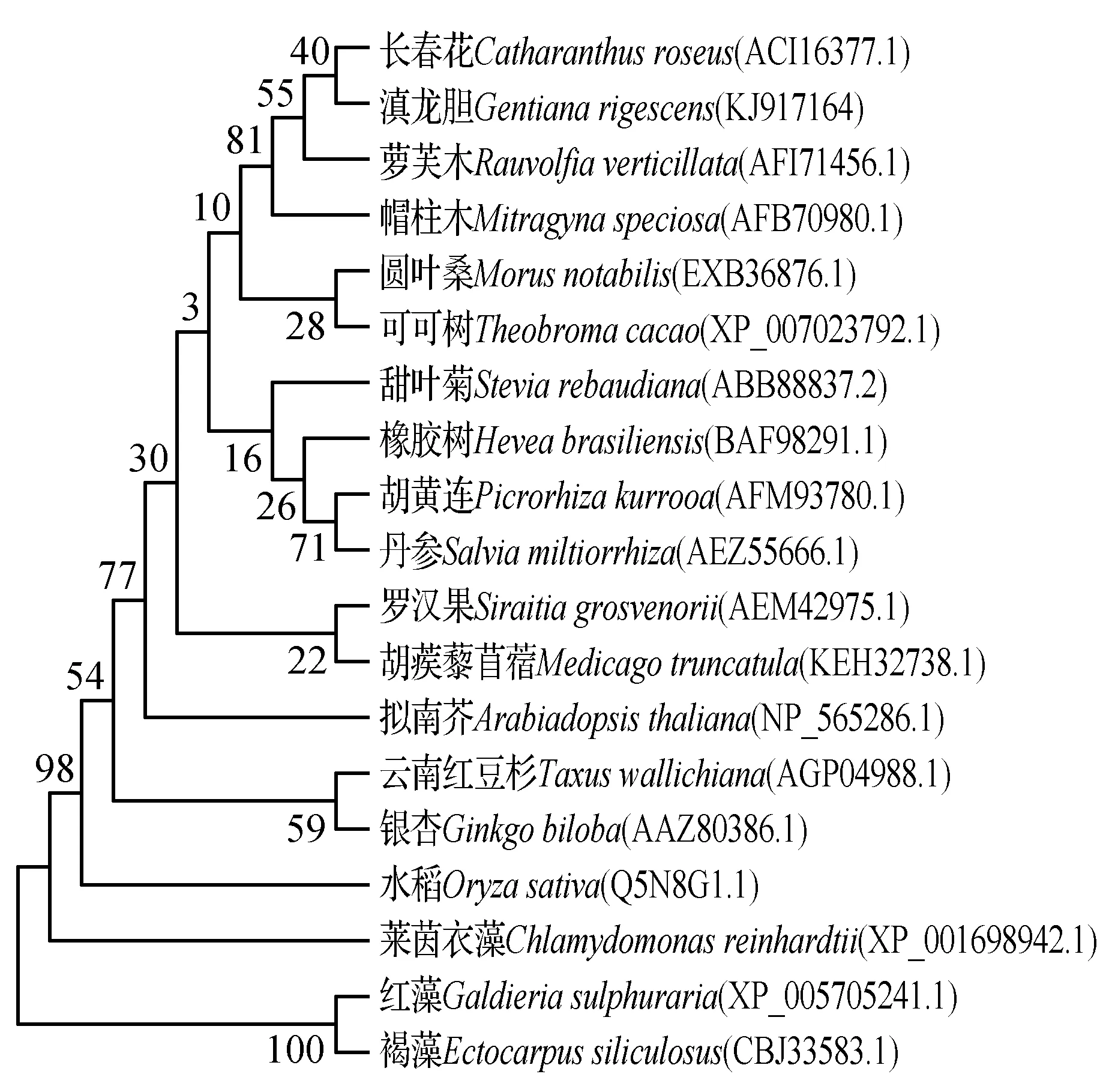
图3 滇龙胆和其它植物CMS蛋白的系统发育分析Fig.3 Phylogenetic tree of CMS G.rigescens and other plants
使用ProtParam软件对GrCMS蛋白进行分析,结果表明GrCMS蛋白单体相对分子质量为34.23 kD,pI为7.68,与曼地亚红豆杉MCT蛋白类似[12];带正电氨基酸残基(Arg+Lys)为38,带负电氨基酸残基(Asp+Glu)为37,化学方程式:C1541H2495N399O460S8。不稳定指数37.49,为稳定蛋白;脂肪指数103.10,总平均疏水性(GRAVY)为-0.053,属亲水蛋白。GrCMS蛋白含20种基本氨基酸,其中亮氨酸(Leu)含量最高,为12.9%;其次是丝氨酸(Ser)和赖氨酸(Lys),分别为11.0%和8.7%;色氨酸(Trp)含量最低,为0.3%。
使用Sspro软件对GrCMS进行二级结构分析,结果表明该蛋白二级结构中α-螺旋(H)占26.45%,无规则卷曲(C)占54.84%,延伸带(E)占18.71%,这与萝芙木RvCMS蛋白基本相同[18]。利用Swiss-Model Workspace软件采用自动模式对GrCMS蛋白三级结构进行预测(图4),该模型是以拟南芥叶绿体2-C-甲基-D-赤藓醇4-磷酸胞苷酰转移酶[4nai.1]为模板,在第87-305氨基酸处建模,序列相似度为81.00%。使用InterPro软件对GrCMS蛋白保守结构域进行预测,结果显示GrCMS蛋白包含两类保守结构域:核苷酸二磷酸糖基转移酶结构域(38-94,95-304,84-304)和2-C-甲基-D-赤藓醇4-磷酸胞苷酰转移酶结构域(83-306,84-304,85-303)。
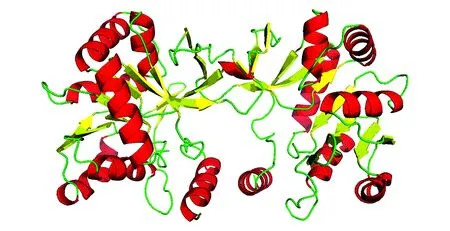
图4 GrCMS蛋白二聚体的三维结构预测 红色.α-螺旋;黄色.β-折叠;绿色.环Fig.4 Prediction of three dimensional structure of GrCMS protein in dimer Red.α-helix; Yellow.β-fold; Green. Loop
采用SignalP 4.1软件对GrCMS蛋白信号肽进行预测,结果未发现信号肽,表明该蛋白为非分泌型蛋白。利用TMHMM2.0软件对GrCMS蛋白跨膜螺旋区进行预测,结果显示GrCMS蛋白不含跨膜螺旋区域(图5),为非膜蛋白。使用WoLF PSORT软件进行亚细胞定位预测,结果表明GrCMS蛋白在叶绿体和线粒体的定位系数分别为11.5和1.5。使用ChloroP 1.1软件对GrCMS蛋白的叶绿体转运肽进行预测,结果显示GrCMS蛋白N末端包含一个66氨基酸的转运肽。
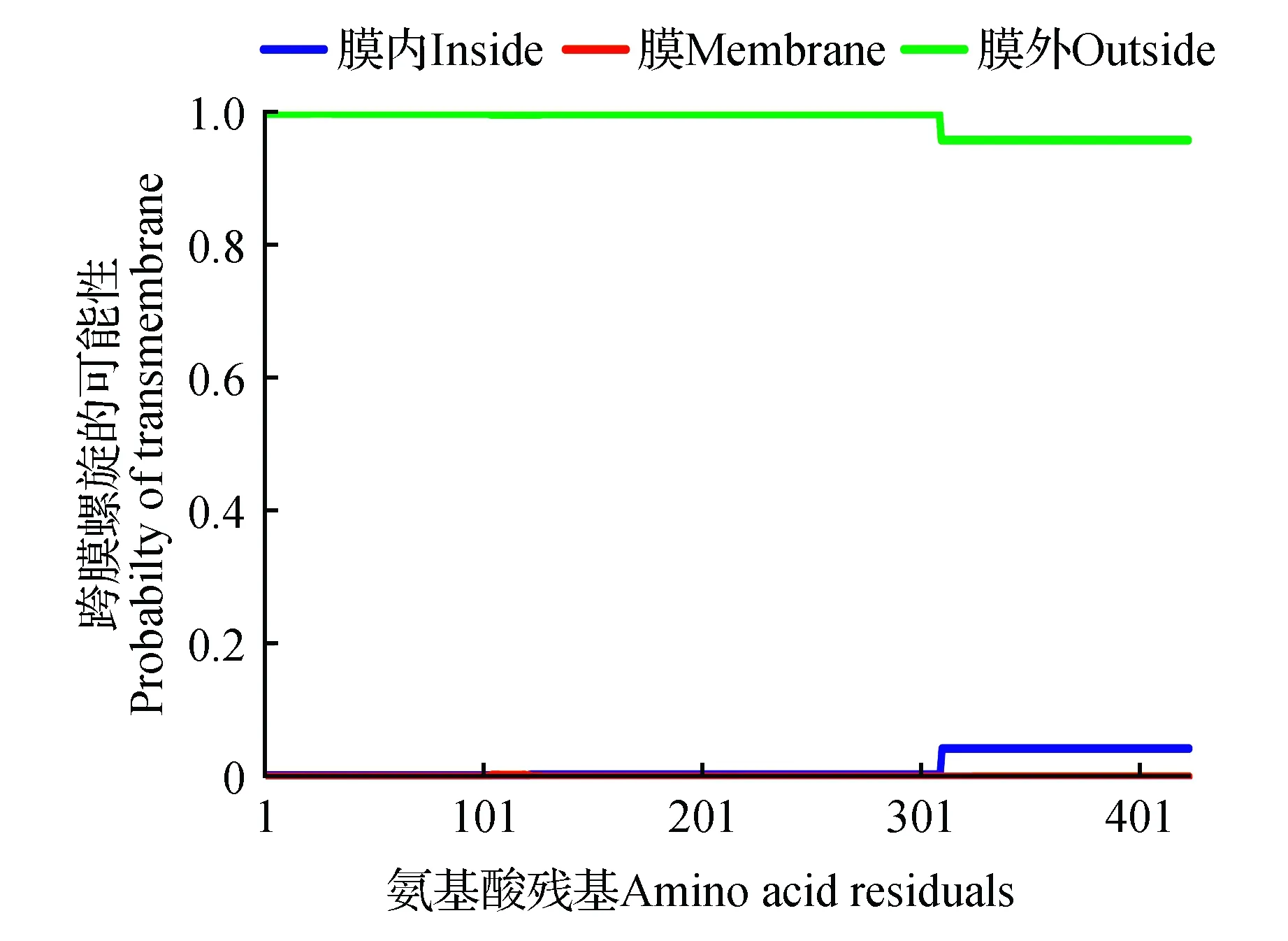
图5 GrCMS蛋白可能跨膜螺旋的检测Fig.5 Detection of putative transmembrane helixes of GrCMS protein
为选择合适的表达菌,使用在线软件对GrCMS基因进行稀有密码子分析,结果显示GrCMS基因中稀有密码子仅占0.96%,并且没有三联或二联稀有密码子连续出现的情况,所以可以选择大肠杆菌Rosetta(DE3)或BL21进行表达。
2.3 GrCMS基因原核表达载体的构建
使用BamHⅠ和XhoⅠ双酶切pGEX-4T-1-GrCMS质粒,能够切出目的片段GrCMS和载体pGEX-4T-1(图6),表明GrCMS基因已成功插入原核表达载体pGEX-4T-1中。
图6 质粒pGEX-4T-1-GrCMS酶切检测 M. DNA Marker Ⅲ;1~2.质粒pGEX-4T-1-GrCMS的BamHⅠ和XhoⅠ双酶切、XhoⅠ单酶切结果;3.质粒对照Fig.6 Detection of plasmid pGEX-4T-1-GrCMS by digestions M. DNA Marker Ⅲ; 1-2. Digestion results of plasmid pGEX-4T-1-GrCMS by BamHⅠ and XhoⅠ, XhoⅠ; 3. Plasmid control
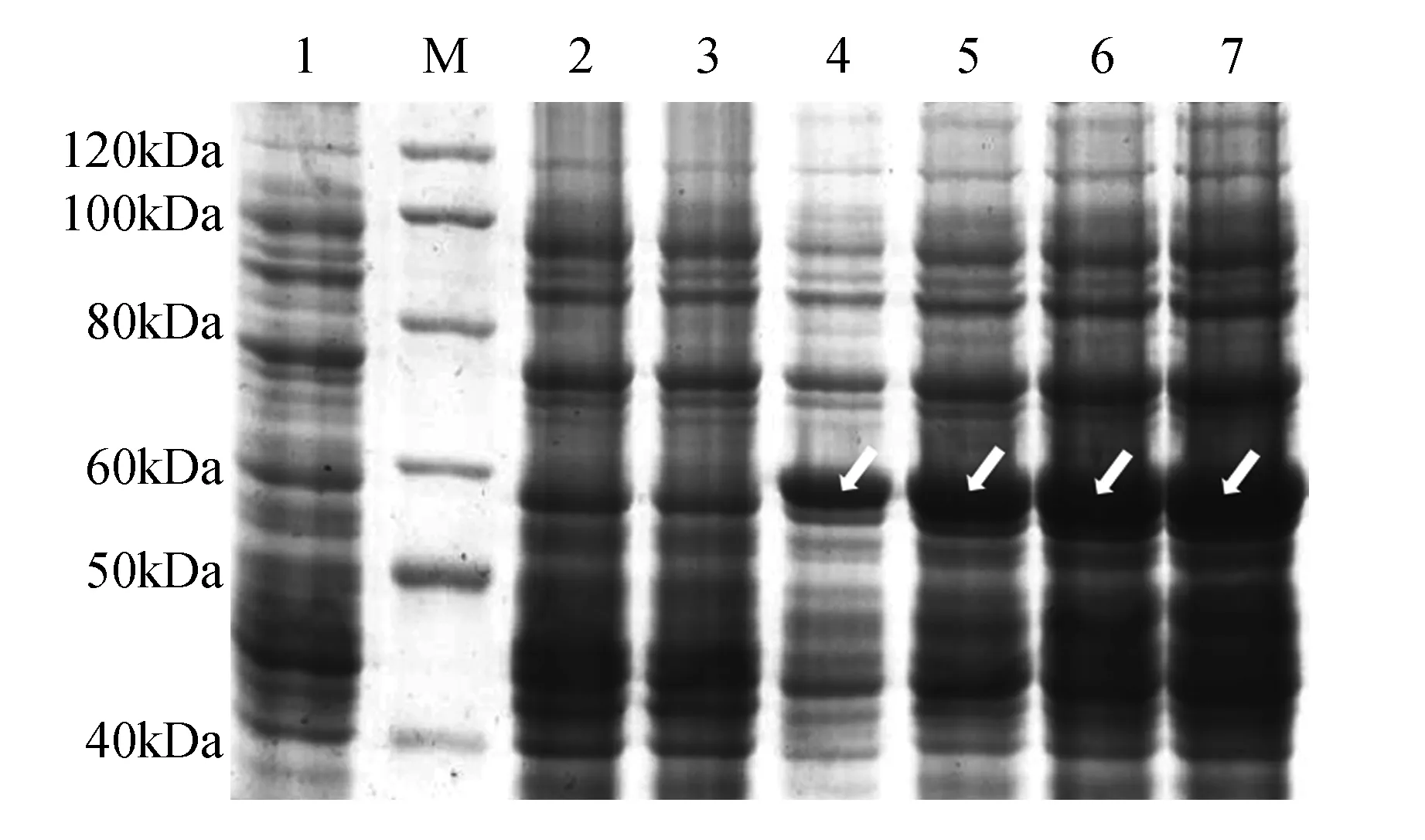
图7 37℃下不同诱导时间对GrCMS蛋白表达量的影响M. ProteinRuler Ⅱ;1~2. 37 ℃、IPTG终浓度为1 mmol·L-1下pGEX-4T-1空载体转化子分别诱导0和8 h的总蛋白;3~6.相同条件下融合表达菌pGEX-4T-1-GrCMS分别诱导0、2、4、6和8 h的总蛋白Fig.7 Effect of different time on the expression of GrCMS protein at 37℃ M. ProteinRuler Ⅱ; 1-2. The expressed product of pGEX-4T-1 transformed bacteria with 1 mmol·L-1 of IPTG induction for 0 and 8 h at 37 ℃; 3-6. The expressed product of pGEX-4T-1-GrCMS transformed bacteria with 1 mmol·L-1 of IPTG induction for 0, 2, 4, 6 and 8 h separately at 37℃
2.4 GrCMS基因的原核表达
将酶切检测正确的pGEX-4T-1-GrCMS重组质粒转化大肠杆菌Rosetta(DE3),然后使用IPTG诱导表达。在37℃、终浓度为1 mmol·L-1IPTG下,分别诱导0、2、4、6和8 h后,提取细菌总蛋白进行SDS-PAGE检测。结果表明,与对照相比,pGEX-4T-1-GrCMS转化菌经IPTG诱导后,在相对分子质量60.23 kD(含GST蛋白,约26 kD)左右有1条蛋白条带,并且其蛋白含量随诱导时间的增加而逐渐增加,表明pGEX-4T-1-GrCMS重组质粒在大肠杆菌Rosetta(DE3)中成功诱导表达出GrCMS蛋白。当温度为37℃、诱导时间为8 h时,蛋白表达量最大(图7),可用于蛋白纯化和酶活分析。
2.5 GrCMS基因的组织表达分析
取三年生滇龙胆的根、茎和叶,通过定量RT-PCR分析GrCMS基因在不同组织中的表达情况。结果表明,GrCMS基因在叶中表达量最高,分别是根和茎中的36.01和29.28倍(图8)。
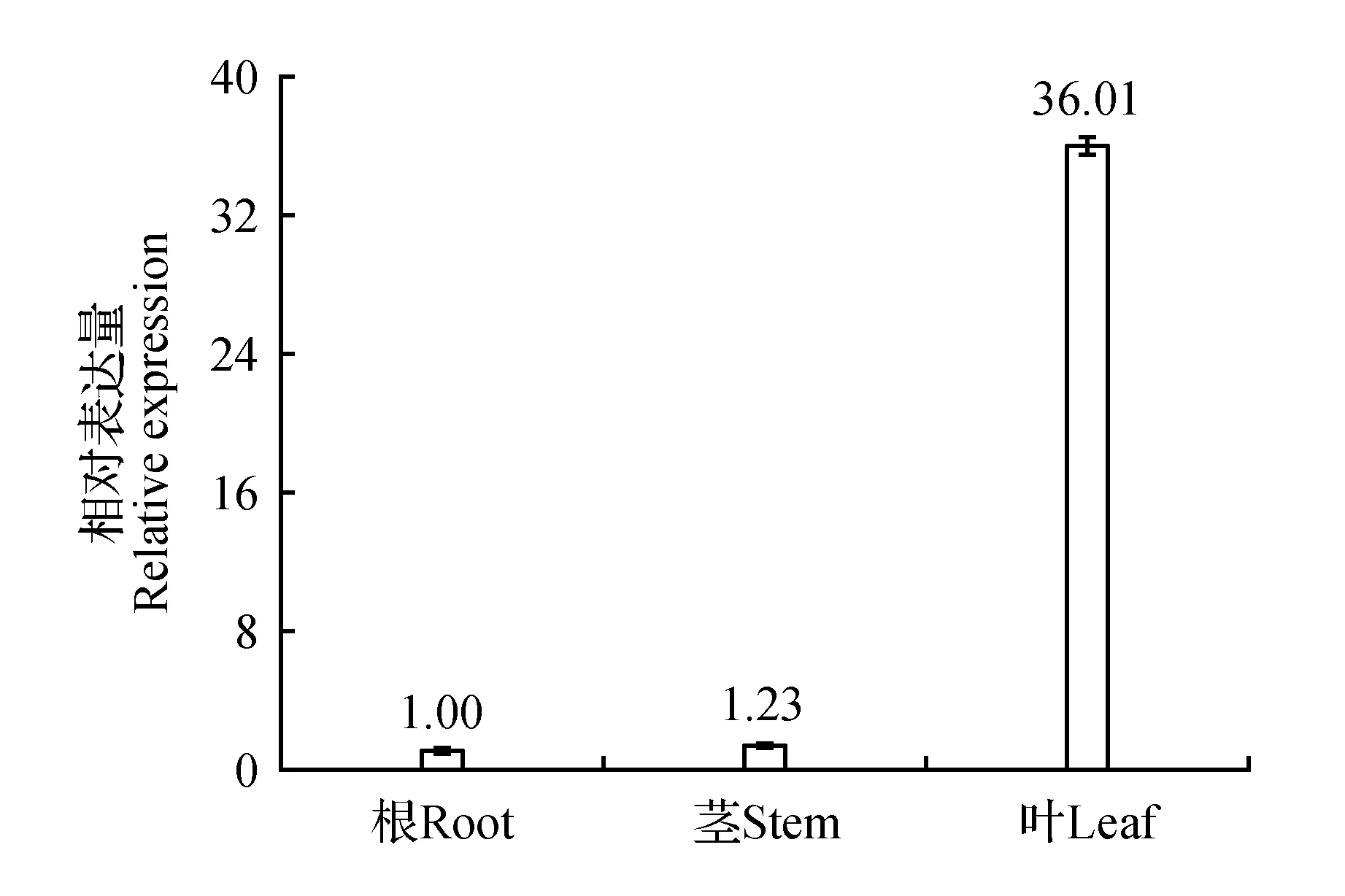
图8 GrCMS基因在根茎叶中的相对表达 以根为参照,设定其中的表达量为1。Fig.8 Relative expression of GrCMS gene in root,stem and leaf Root was taken as the reference,and its expression was set as 1.
3 讨论
MEP途径能够为滇龙胆药效成分龙胆苦苷的生物合成提供前体物质异戊烯基焦磷酸(IPP)。CMS是MEP途径的第三个催化酶,因此滇龙胆中GrCMS基因的表达情况可直接或间接影响龙胆苦苷的生物合成。从进化角度来看,CMS基因起源于衣原体[26]。CMS基因是核编码基因,但其编码蛋白CMS在叶绿体中起作用[27]。在银杏中,GbCMS蛋白定位于叶绿体,是由其N端88个氨基酸的信号肽所决定[13]。在萝芙木中,定位于叶绿体的RvCMS蛋白N端包含67氨基酸的叶绿体转运肽序列[11]。在本研究中,GrCMS蛋白N末端包含一个66氨基酸的转运肽,为GrCMS定位于叶绿体提供证据。
在不同生物中,CMS蛋白的活性形式不同,大部分是以二聚体形式存在的。在萝芙木和杜仲中,RvCMS和EuCMS蛋白都是以同源二聚体的形式存在的[11]。在大肠杆菌中,EcCMS蛋白也是以二聚体形式存在的[17]。在本研究中,GrCMS蛋白三维模型预测结果表明,该蛋白的活性形式为二聚体(图4),这需要通过非变性SDS-PAGE或酵母双杂交等实验进行进一步检测。
在CMS蛋白保守序列中,存在两个赖氨酸保守位点,它们参与Mg2+和CTP与CMS蛋白的结合[11,13]。比对结果表明,在GrCMS蛋白中这两个位点分别为第103和第289位的赖氨酸氨基酸残基。将GrCMS蛋白与土拉弗朗西斯菌(Francisellatularensis)TfCMS蛋白(GenBANK登录号CAJ79964.1)进行比对分析,结果表明GrCMS蛋白的第220位的丝氨酸是潜在的磷酸化位点[8],在CMS蛋白活性中起着重要作用,土拉弗朗西斯菌TfCMS蛋白141位丝氨酸的突变(T141D和T141E)将导致该酶失活[8]。
CMS基因的表达具有组织和时空特异性,并与萜类的生物合成相关联。在丹参中,SmCMS基因参与丹参酮的生物合成和累积,其在根、茎、叶和花中均表达,但主要在叶中表达;因该基因受茉莉酸甲酯的诱导不明显,推测它是一个组成型表达基因[21,28~30],这导致它在大多数植物中不被关注。然而,有研究表明CMS可能是一个限速酶,因为:(1)当底物MEP大量增加时,它并不能迅速完全将其代谢[31];(2)在长春花中,当冷处理导致萜类吲哚碱(TIA)供应不足时,CrCMS基因呈下调表达[31]。在毛果杨(Populustrichocarpa)中,PtCMS基因的转录水平与异戊二烯萜类的散发相关联[32]。在杜仲中,MEP途径基因如EuDXR、EuCMS、EuCMK(4-(5′-焦磷酸胞苷)-2-C-甲基-D-赤藓醇激酶)、EuMDS、EuHDS和EuHDR等主要在叶片中表达[33],这与叶片中杜仲胶的合成相一致。在1月龄的银杏胚胎培养小苗中,可能参与银杏苦内酯生物合成的GbCMS基因在根和叶中的表达量相当[13]。在曼地亚红豆杉中,可能参与紫杉醇生物合成的TmMCT基因主要在根、茎、叶和树皮中表达,在毛根中表达量最高,其次是茎[34]。有趣的是,在罗汉果(Siraitiagrosvenorii)罗汉果苷V生物合成和累积过程(开花后50~70 d)中,MEP途径基因SgDXS、SgDXR和SgCMS均呈上调表达趋势,SgMCS和SgIDS均呈下调表达趋势,而SgCMK和SgHDS的表达几乎检测不到[35]。组织表达特异性检测结果表明,本研究中的GrCMS基因在叶中的表达量远远高于根和茎(图7),这表明滇龙胆MEP途径主要存在于叶片,这与滇龙胆根和叶转录组数据分析结果相一致。事实上,滇龙胆用药部位为根,因为根中龙胆苦苷含量最高[36],因此作者推测MEP途径对龙胆苦苷生物合成的贡献是通过首先在叶片中合成龙胆苦苷,然后在转运到根中的液泡进行累积。
本研究为滇龙胆GrCMS基因功能的解析及龙胆苦苷生物合成途径的阐明奠定基础。
1.金航,张霁,张金渝,等.滇龙胆[M].昆明:云南科技出版社,2013:1-5.
2.Zhang X,Allan A C,Li C,et al.De novo assembly and characterization of the transcriptome of the Chinese medicinal herb,Gentianarigescens[J].International Journal of Molecular Sciences,2015,16(5):11550-11573.
3.Tasheva K,Kosturkova G.Role of biotechnology for protection of endangered medicinal plants,in Environmental biotechnology-New approaches and prospective applications[M].Croatia:InTech,2013:235-238.
4.Hua W,Zheng P,He Y,et al.An insight into the genes involved in secoiridoid biosynthesis inGentianamacrophyllaby RNA-seq[J].Molecular Biology Reports,2014,41(7):4817-4825.
5.Vranova E,Coman D,Gruissem W.Network analysis of the MVA and MEP pathways for isoprenoid synthesis[J].Annual Review of Plant Biology,2013,64:665-700.
6.Hojo M,Tasaka M,Shikanai T.Physiological requirements of the nonmevalonate pathway for photo-acclimation inArabidopsis[J].Plant Biotechnology Journal,2005,22(1):39-45.
7.Hsieh M H,Chang C Y,Hsu S J,et al.Chloroplast localization of methylerythritol 4-phosphate pathway enzymes and regulation of mitochondrial genes inispDandispEalbino mutants inArabidopsis[J].Plant Molecular Biology,2008,66(6):663-673.
8.Tsang A,Seidle H,Jawaid S,et al.Francisellatularensis2-C-methyl-D-erythritol 4-phosphate cytidylyltransferase:kinetic characterization and phosphoregulation[J].PloS One,2011,6(6):e20884.
9.Okada K,Kawaide H,Kuzuyama T,et al.Antisense and chemical suppression of the nonmevalonate pathway affects ent-kaurene biosynthesis inArabidopsis[J].Planta,2002,215(2):339-344.
10.Rohdich F,Wungsintaweekul J,Eisenreich W,et al.Biosynthesis of terpenoids:4-diphosphocytidyl-2C-methyl-D-erythritol synthase ofArabidopsisthaliana[J].Proceedings of the National Academy of Sciences of the United States of America,2000,97(12):6451-6456.
11.Lan X.Molecular cloning and characterization of the gene encoding 2-C-methyl-D-erythritol 4-phosphate cytidyltransferase from hairy roots ofRauvolfiaverticillata[J].Biologia,2013,68(1):91-98.
12.刘万宏.紫杉醇前体合成途径两个关键酶基因克隆和分析[D].重庆:西南大学,2008.
13.Kim S M,Kuzuyama T,Chang Y J,et al.Cloning and functional characterization of 2-C-methyl-D-erythritol 4-phosphate cytidyltransferase(GbMECT) gene fromGinkgobiloba[J].Phytochemistry,2006,67(14):1435-1441.
14.Sando T,Takeno S,Watanabe N,et al.Cloning and characterization of the 2-C-methyl-D-erythritol 4-phosphate(MEP) pathway genes of a natural-rubber producing plant,Heveabrasiliensis[J].Bioscience Biotechnology and Biochemistry,2008,72(11):2903-2917.
15.Yu J,Wang J,Lin W,et al.The genomes of Oryza sativa:a history of duplications[J].PLoS Biology,2005,3(2):e38.
16.刘攀峰.杜仲MEP途径系列基因全长cDNA分离鉴定及序列特征研究[D].北京:中国林业科学研究院,2012.
17.Kemp L E,Bond C S,Hunter W N.Structure of a tetragonal crystal form ofE.coli2-C-methyl-D-erythritol 4-phosphate cytidylyltransferase[J].Acta Crystallographica.Section D:Biological Crystallography,2003,59:607-610.
18.郑月.萝芙木MCT,HDS,SGD基因的克隆与遗传转化体系的建立[D].重庆:西南大学,2011.
19.马丽利,秦白富,常凯,等.萝芙木阿玛碱生物合成基因对乙酰水杨酸的响应[J].西南大学学报,2013,35(4):1-6.
20.Mannen K,Matsumoto T,Takahashi S,et al.Coordinated transcriptional regulation of isopentenyl diphosphate biosynthetic pathway enzymes in plastids by phytochrome-interacting factor 5[J].Biochemical and Biophysical Research Communications,2014,443(2):768-774.
21.Gao W,Sun H X,Xiao H,et al.Combining metabolomics and transcriptomics to characterize tanshinone biosynthesis inSalviamiltiorrhiza[J].BMC Genomics,2014,15:73.
22.Chang K,Chen M,Zeng L,et al.Abscisic acid enhanced ajmalicine biosynthesis in hairy roots ofRauvolfiaverticillataby upregulating expression of the MEP pathway genes[J].Russian Journal of Plant Physiology,2014,61(1):136-140.
23.马丽利,秦白富,常凯,等.萝芙木阿玛碱生物合成基因对乙酰水杨酸的响应[J].西南大学学报:自然科学版,2013,35(4):1-6.
24.He Y M,Zhu S,Ge Y W,et al.The anti-inflammatory secoiridoid glycosides from Gentianae Scabrae Radix:the root and rhizome ofGentianascabra[J].Journal of Natural Medicines,2015,69(3):303-312.
25.Zhao Y,Zhang J,Jin H,et al.Discrimination ofGentianarigescensfrom different origins by fourier transform infrared spectroscopy combined with chemometric methods[J].Journal of AOAC International,2015,98(1):22-26.
26.Lange B M,Rujan T,Martin W,et al.Isoprenoid biosynthesis:the evolution of two ancient and distinct pathways across genomes[J].Proceedings of the National Academy of Sciences of the United States of America,2000,97(24):13172-13177.
27.Ganjewala D,Kumar S,Luthra R.An account of cloned genes of Methyl-erythritol-4-phosphate pathway of isoprenoid biosynthesis in plants[J].Current Issues in Molecular Biology,2009,11(s1):35-45.
28.Ma Y,Yuan L,Wu B,et al.Genome-wide identification and characterization of novel genes involved in terpenoid biosynthesis inSalviamiltiorrhiza[J].Journal of Experimental Botany,2012,63(7):2809-2823.
29.Yang L,Ding G,Lin H,et al.Transcriptome analysis of medicinal plantSalviamiltiorrhizaand identification of genes related to tanshinone biosynthesis[J].PloS One,2013,8(11):e80464.
30.Luo H,Zhu Y,Song J,et al.Transcriptional data mining ofSalviamiltiorrhizain response to methyl jasmonate to examine the mechanism of bioactive compound biosynthesis and regulation[J].Physiologia Plantarum,2014,152(2):241-255.
31.Dutta A,Sen J,Deswal R.Downregulation of terpenoid indole alkaloid biosynthetic pathway by low temperature and cloning of a AP2 type C-repeat binding factor(CBF) fromCatharanthusroseus(L).G.Don[J].Plant Cell Reports,2007,26(10):1869-1878.
32.Wiberley A E,Donohue A R,Westphal M M,et al.Regulation of isoprene emission from poplar leaves throughout a day[J].Plant Cell and Environment,2009,32(7):939-947.
33.刘慧敏,王淋,许靖诗,等.杜仲MEP途径系列基因表达差异的研究[J].中南林业科技大学学报,2014,34(2):26-33.
34.王伟,任肃霞,刘万宏,等.曼地亚红豆杉MEP途径上MECT基因的克隆和分析[A].中国遗传学会第八次代表大会暨学术讨论会论文摘要汇编,2008.
35.Tang Q,Ma X,Mo C,et al.An efficient approach to findingSiraitiagrosvenoriitriterpene biosynthetic genes by RNA-seq and digital gene expression analysis[J].BMC Genomics,2011,12(1):343.
36.杨美权,张金渝,沈涛,等.不同栽培模式对滇龙胆中龙胆苦苷含量的影响[J].江苏农业科学,2011(1):287-289.
CloningandexpressionanalysisofGrCMSgeneinGentianarigescens
ZHANG Xiao-Dong1LI Cai-Xia1WANG Yuan-Zhong2*
(1.College of Resources and Environment,Yuxi Normal University,Yuxi 653100;2.Institute of Medicinal Plants,Yunnan Academy of Agricultural Sciences,Kunming 650223)
2-C-methyl-D-erythritol 4-phosphatecytidyltransferase(CMS, EC 2.7.7.60) is the third enzyme in methylerythritol phosphate(MEP) pathway. The Open Reading Frame(ORF) ofGrCMSgene was cloned by RT-PCR technology from young leaves ofGentianarigescensbased on the transcriptome ofG.rigescensand its prokaryotic and the tissue specific expression analysis were performed. The ORF ofGrCMSgene(accession number: KJ917164) was 933 bp long coding for a protein of 310 amino acids, and the predicted relative molecular weight of GrCMS was 34.23 kD with its theoretical pI of 7.68. The results of GrCMS protein analysis showed that GrCMS which possessed the conserved domains of CMS proteins and may localize in chloroplast was a hydrophilic stable protein without signal peptide, and it was composed of mainly α-helix(26.45%) and random coils(54.84%). By phylogenetic analysis, GrCMS was close to CrCMS ofCatharanthusroseus. By prokaryotic analysis, the recombinant protein ofGrCMSgene inE.coliwas approximately 60.23 kD(containing GST tag protein 26 kD), which was consistent with the anticipated size. By real-time PCR analysis,GrCMSgene was primarily expressed in leaf. Our results will provide reference for further functional researches ofGrCMSgene and the biosynthetic pathway of gentiopicroside.
Gentianarigescens;2-C-methyl-D-erythritol 4-phosphatecytidyltransferase;gene cloning;expression analysis
国家自然科学基金(81260608);云南省教育厅重点项目(2015Z171);科技部“十二五”国家科技支撑计划项目
张晓东(1980—),男,博士,主要从事植物代谢基因工程研究。
2015-09-10
Q786
A
10.7525/j.issn.1673-5102.2016.02.015

