拟南芥CYCD2;1基因植物表达载体的构建及在烟草中的遗传转化分析
代丽娟 郑唐春 刘彩霞 李开隆 曲冠证
(东北林业大学林木遗传育种国家重点实验室,哈尔滨 150040)
* 通信作者:E-mail:quguanzheng@yahoo.com
拟南芥CYCD2;1基因植物表达载体的构建及在烟草中的遗传转化分析
代丽娟 郑唐春 刘彩霞 李开隆 曲冠证*
(东北林业大学林木遗传育种国家重点实验室,哈尔滨 150040)
细胞分裂是生物的基本特征之一,在植物生长发育的过程中,发挥着极其重要的作用,细胞周期蛋白CYCD2;1基因作为一个调控因子,对调节细胞周期具有重要作用。本文以拟南芥细胞周期蛋白(AtCYCD2;1基因)作为研究对象,利用PCR技术从拟南芥花序cDNA扩增出AtCYCD2;1基因,构建植物表达载体(pROKII-AtCYCD2;1)并利用农杆菌介导的叶盘法转化野生型烟草。转基因植株的PCR检测结果表明,AtCYCD2;1基因已经整合到了烟草基因组中。在T2代植株中,通过实时定量荧光PCR检测显示,AtCYCD2;1在mRNA水平也均有表达。过量表达CYCD2;1的转基因烟草在花器官中存在明显表型,与野生型相比主要表现为转基因植株花冠宽度变大,花瓣和萼片长度变长,果实变大,上述结果表明AtCYCD2;1基因影响花的发育。
AtCYCD2;1;周期蛋白;遗传转化;烟草
植物D类周期蛋白(cyclin D,CYCD)控制着细胞周期的进程,在细胞的分裂增殖过程中起重要作用,它是调控有丝分裂的信号。此外,植物D型周期蛋白在G1期优先被分裂素刺激物诱导[1~2]。根据周期蛋白在细胞周期不同阶段发挥的作用,将其分为G1周期蛋白、S周期蛋白和G2周期蛋白[3]。CYCD在G1到S期过渡中起重要作用,故而又被称为G期特异性周期蛋白[4]。CYCD的作用主要是积累发育信号,控制细胞重新进入细胞周期[3,5~6]。同时,周期蛋白作为一种调节亚基,通过与周期蛋白依赖激酶(cyclin-dependent-kinase,CDK)结合并将之激活,并在其它调控因子作用下,通过可逆性的磷酸化作用来控制细胞分裂周期有序地进行[7~8]。研究表明,在植物中过量表达一些周期蛋白,尤其是CYCDs能改变植株的生长和发育[9]。Yu等[10]以烟草、拟南芥为对象,研究了CYCA基因表达被抑制时能导致不育,并抑制叶片外植体形成愈伤组织。CYCB基因的过量表达能促使转基因烟草叶片在不添加任何外源植物生长调节剂的MS培养基上形成不定芽[11]。CYCD的组成型表达使转基因拟南芥叶片在不添加外源细胞分裂素的组织培养条件下进行细胞分裂[12]。此外,利用雌激素诱导CYCD3不仅能影响拟南芥初生根的生长还能诱导初生根对重力的响应[13]。Fujii等[14]也发现利用杨树的PtCYCB1启动子驱动CYCD基因在烟草中表达,不仅能提高维管形成层的细胞分裂还能增加次生木质部的分化。
拟南芥CYCD分为3个亚型,分别是CYCD1、CYCD2、CYCD3[15]。CYCD2最早是在拟南芥中发现的,在G1的早期被激活并受蔗糖调控,对激素不响应,蛋白定位于细胞核,同时能与ICK相互作用共同抑制侧根的形成[6,16]。Boucheron等[17]证明在超量表达拟南芥CYCD2的转基因烟草植株中,从幼苗期到成熟的各个时期,转基因植株生长和地上部分生物量积累速率加快,细胞周期缩短。
在真核生物中,Horsch等[18]采用根癌农杆菌介导转基因技术首次获得了转基因的烟草植株,之后烟草的转基因研究工作取得了一系列重要研究进展。以往对于植物CYCD的功能性研究尚不全面,到目前为止,关于拟南芥周期蛋白基因在烟草中的异源表达研究报道较少。本研究从拟南芥中克隆CYCD2;1,其在拟南芥Tair网站的命名为AT2G22490。通过生物信息学分析,发现该基因全长为1 715 bp,开放读码框为1 089 bp,共编码362个氨基酸,该基因编码蛋白的分子量为40 707.83 Da,蛋白质的等电点为4.96。通过构建植物表达载体,并使其在烟草中表达,观察到转基因烟草发生了显著的的表型变化,且这些表型在以前的转基因拟南芥及烟草中未被发现。本研究不仅对植物周期蛋白CYCD2;1功能进行了新的补充,还丰富了对植物花发育的ABC模型的新的认识。
1 材料与方法
1.1 实验材料
实验材料拟南芥(ArabidopsisthalianaCol-0)、普通烟草(NicotianatabacumL.)由本实验室保存;大肠杆菌Trans1-T1感受态购自北京全式金生物技术有限公司;农杆菌菌株GV3101由本实验室保存。
1.2 主要试剂
PCR相关试剂、DNA marker、限制性内切酶、T4DNA ligase和PrimeScriptTMRT reagent Kit、限制性内切酶SacⅠ和BamHⅠ购自宝生物工程(大连)有限公司;质粒提取和胶回收试剂盒,购自OMEGA公司(美国);植物表达载体pROKII质粒,由山东师范大学张慧教授惠赠;pEasy-T1载体、EasyPure Plant RNA Kit购自北京全式金生物技术有限公司;引物合成及基因测序由哈尔滨博仕生物技术有限公司完成。
1.3 实验方法
1.3.1 拟南芥CYCD2;1基因全长cDNA的克隆
根据NCBI网站所公布的拟南芥CYCD2;1基因mRNA设计引物,分别命名为D2;1-F;D2;1-R。所用引物序列如表1。

表1 实验所用引物列表
用EasyPure Plant RNA Kit试剂盒提取拟南芥花序的总RNA,检测纯度和浓度后,以0.5 μg总RNA为起始材料,采用PrimeScriptTMRT reagent Kit试剂盒进行cDNA合成。以单链cDNA为模板,利用表1中的引物进行PCR扩增。PCR反应体系为25 μL,含2.5 μL 10×Ex PCR Buffer、2.0 μL dNTP、1.0 μL的模版、1.0 μL上游引物(D2;1-F)、1.0 μL下游引物(D2;1-R)、0.25 μL ExTaq(5 U·μL-1)、17.25 μL ddH2O。反应条件为94℃预变性4 min;94℃变性30 s,56℃退火30 s,72℃延伸1 min 20 s,共35 cycles;72℃延伸7 min。扩增完成后,吸取3 μL利用1%琼脂糖凝胶进行电泳检测。
1.3.2 植物表达载体的构建及转化农杆菌
通过表1引物扩增目的片段,连接pEasy-T1载体并转化Trans1-T1,随后挑取单菌落扩大培养,将菌液送哈尔滨博仕生物技术有限公司测序并保存。然后,利用限制性内切酶SacⅠ、BamHⅠ对pEasy-T1-AtCYCD2;1和pROKII质粒进行双酶切,分别回收目的片段,利用T4DNA连接酶进行连接反应,转化大肠杆菌后挑取单菌落扩大培养,以表1中的pROKII通用引物进行PCR检测,将阳性转化子的菌液送哈尔滨博仕生物技术有限公司测序,同时,将重组质粒pROKII-AtCYCD2;1用SacⅠ和BamHⅠ进行双酶切检验,最后采用液氮冻融法将pROKII-AtCYCD2;1质粒转化入农杆菌GV3101感受态细胞中,挑取单克隆经菌液PCR验证转化子。
1.3.3 烟草的遗传转化
参考Horsch等[18]的烟草遗传转化方法,并修改如下:取长势良好,生长大约3周左右的野生型烟草(WT)的叶片,切成1 cm×1 cm小块,在(25±2)℃、16 h·d-1光照下预培养1 d。在无菌操作下,将GV3101(pROKII-AtCYCD2;1)的菌种接种到20 mL含抗生素的液体LB培养基中,28℃,180 r·min-1振荡培养至OD600=0.6~0.8。4 000 r·min-1离心5 min,浓缩菌体,将收集到的菌体用灭菌水稀释至终浓度为OD600=0.2~0.3,然后,将预培养1 d的烟草叶片浸泡到制备好的侵染液中3~7 min,期间轻轻的摇动侵染夜,取出叶片将多余的菌液用无菌滤纸吸干。将侵染过的叶片在不含抗生素的分化培养基上培养,暗培养条件(25±2)℃下共培养2 d。共培养后的叶片用无菌滤纸吸干多余的水分后放于含有相应抗生素的MS分化培养基上(50 mg·L-1卡纳霉素和500 mg·L-1头孢霉素)培养,直至分化出抗性芽。待抗性芽长出叶片后,将其切下放在含有抗生素的分化培养基上进行二次筛选分化。待2次分化的不定芽长到约1.0 cm时,将其切下,放于MS生根培养基上进行生根培养。选择生长健壮的烟草植株,洗去附在烟草根部的培养基,将其移栽到肥沃的土壤中。
1.3.4 转基因植株的PCR检测
为筛选阳性转基因株系,利用CTAB法提取筛选后的T1代转基因烟草株系叶片DNA,同时利用表1中pROKII通用引物进行PCR扩增。反应条件为94℃预变性4 min;94℃变性30 s,54℃退火30 s,72℃延伸1 min 30 s,35 cycles;72℃在延伸7 min,PCR结束后取3 μL反应产物进行1%琼脂糖凝胶电泳分析。
1.3.5 转基因植株的荧光定量PCR检测
利用实时荧光定量PCR验证AtCYCD2;1基因在转录水平的表达,引物如表1所示。反应体系为20 μL;其中2×SYBR Green实时荧光染料混合液10 μL,ROX DyeⅡ 0.4 μL,2 μL cDNA模板,正向引物(D2;1-RT-F),反向引物(D2;1-RT-R)各0.8 μL。以Ntactin基因作为参照,扩增反应条件为:95℃ 30 s;95℃ 5 s,60℃ 35 s,40个循环;95℃ 15 s,60℃ 1 min,95℃ 15 s。每个样品进行3次重复,并通过2-ΔΔCt法进行计算。
1.3.6 过表达AtCYCD2;1烟草植株的表型观察
挑选表达量较高3个转基因株系及对照株系分别移栽至温室,分别对其进行定期的观察,在移栽后60 d后开始开花,1周后进入盛花期,在顶部花序中,随机选取5朵刚刚开放的花,分别测量它们的花瓣宽度、花的长度和花萼,最后对测量的结果利用SPSS 19.0软件进行SNK差异性统计分析。
在移栽入温室后30 d,分别选取3个转基因株系及对照株系的成熟叶片,将叶片下表皮细胞制作成镜检样品,在显微镜下观察并拍照。
选取相同生长条件同期种植的转基因和野生型烟草株系,落花后一周,待形成果实后剥去果皮,并在实体显微镜下对比观察种子细胞的变化情况并进行拍照。再过一周,果实大小已经定性,不再继续生长,测量果实的长度并进行统计分析。
2 结果与分析
2.1 拟南芥CYCD2;1基因全长cDNA的克隆
利用RNA提取试剂盒,从拟南芥花序中成功提取总RNA,经检测浓度及质量均可用于下一步试验。反转录为cDNA作为模板,进行PCR扩增,1%琼脂糖电泳检测表明,条带清晰且和预期大小一致(图1:A)。将目的片段胶回收后与pEasy-T1载体连接,然后转化大肠杆菌Trans1-T1,随机挑取单菌落,用pEasy-T1通用引物进行菌液PCR检测。扩增出1 000 bp左右的特异性条带(图1:B),与预期结果一致,说明AtCYCD2;1基因片段已成功连接到pEasy-T1载体上。将检测的菌液送样测序。测序结果用BioEdit软件进行比对分析,发现目的片段未发生碱基突变,成功克隆AtCYCD2;1基因。
2.2 植物表达载体的构建及验证
将测序正确的pEasy-T1-AtCYCD2;1的菌液提质粒,利用限制性内切酶SacⅠ、BamHⅠ对pEasy-T1-AtCYCD2;1和pROKII的质粒分别进行酶切反应(图2:A),分别回收目的片段。利用T4DNA ligase进行连接反应后,转化大肠杆菌Trans1-T1感受态,挑取单菌落进行PCR检测,获得1 000 bp左右目的条带。然后摇菌提取质粒进行PCR检测(图2:B),同时将重组质粒利用SacⅠ和BamHⅠ双酶切检测,电泳检测结果显示切出1 000 bp左右的目的条带(图2:C),此外将质粒送公司测序。最终结果表明,AtCYCD2;1基因成功整合到植物表达载体pROKII中,未发生碱基突变,至此植物表达载体构建完成。采用液氮冻融法将pROKII-AtCYCD2;1质粒转化到农杆菌GV3101感受态细胞中,随机挑选6个单克隆经菌液PCR验证,结果显示均为阳性转化子(图2:D)

图1 拟南芥AtCYCD2;1基因的克隆及鉴定a.拟南芥AtCYCD2;1基因的克隆(M. DNA marker DL5000; 1. AtCYCD2;1基因PCR产物);B. pEasy-T1-AtCYCD2;1载体在大肠杆菌菌液中PCR检测(M. DNA marker DL5000;1~5. pEasy-T1-AtCYCD2;1载体的PCR产物;6. ddH2O作为阴性对照)Fig.1 The clone and verification of AtCYCD2;1 gene from Arabidopsisa. The cloning of AtCYCD2;1 gene(M. DNA marker DL5000; 1. PCR product of AtCYCD2;1 gene); B. PCR detection of pEasy-T1-AtCYCD2;1 in E.coli(M. DNA marker DL5000; 1-5. PCR products of pEasy-T1-AtCYCD2;1 vector; 6. ddH2O as a negative control)
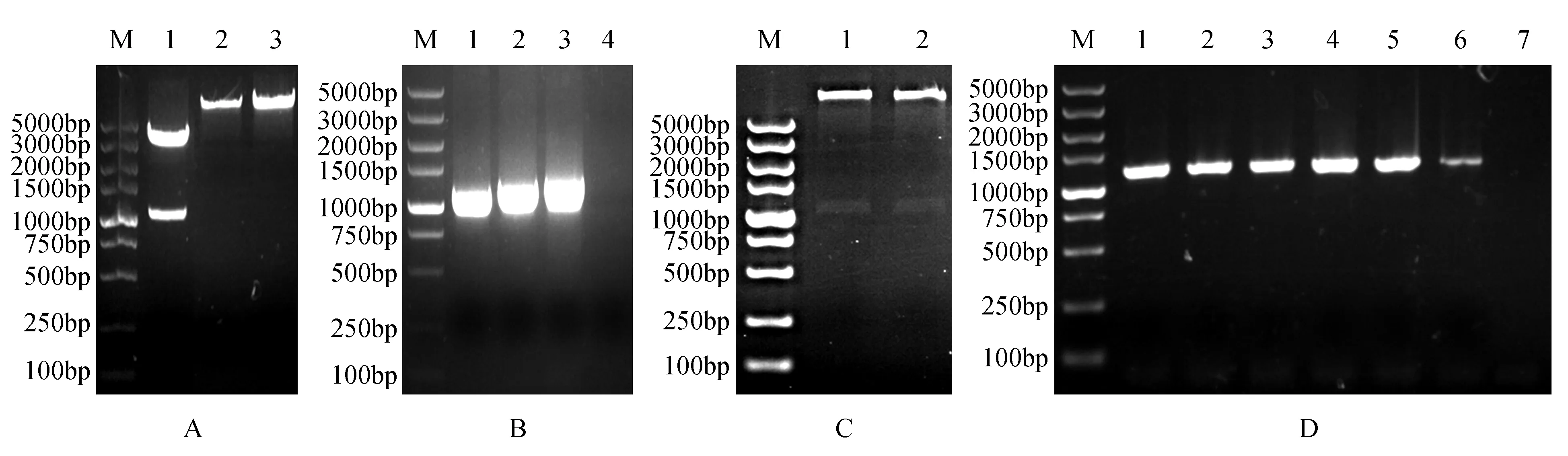
图2 植物表达载体pROKII-AtCYCD2;1的构建及验证a.限制性内切酶酶切产物的电泳结果(M. DNA marker DL5000;1.pEasy-T1-AtCYCD2;1的双酶切条带;2~3.质粒pROKII的双酶条带);B.植物表达载体pROKII-AtCYCD2;1的质粒PCR检测(M. DNA marker DL5000;1~3.pROKII-AtCYCD2;1质粒的PCR产物;4.ddH2O作为阴性对照);C.植物表达载体pROKII-AtCYCD2;1的双酶切鉴定(M. DNA marker DL5000;1~2.重组质粒的双酶切产物);D.农杆菌GV3101转化子的菌液PCR检测(M. DNA marker DL5000;1~6. 6个农杆菌转化子的菌液PCR检测;7.ddH2O作为阴性对照)Fig.2 The construction and verification of plant expression vector pROKII-AtCYCD2;1a. Electrophoretogram of restriction enzymes digestion(M. DNA marker DL5000; 1. Digestion of pEasy-T1-AtCYCD2;1 with SacⅠ and BamHⅠ; 2-3. Digestion of pROKII vector with SacⅠ and BamHⅠ); B. PCR detection of plant expression vector pROKII-AtCYCD2;1(M. DNA marker DL5000; 1-3. PCR products of pROKII-AtCYCD2;1 vector; 4. ddH2O as a negative control); C. The double digestion result of plant expression vector pROKII-AtCYCD2;1(M. DNA marker DL5000; 1-2. Double digestion of recombinant plasmids); D. PCR detection of Agrobacterium-mediated transformation(M. DNA marker DL5000; 1-6. PCR products of transformants in Agrobacterium; 7. ddH2O as a negative control)
2.3 转基因植株的获得及PCR检测
用含有pROKII-AtCYCD2;1农杆菌GV3101侵染烟草叶片,经4~6周的选择培养,从叶片周围的愈伤组织分化,都出现绿色或淡绿色的不定芽(图3:A)。将不定芽分割后培养,继而生成大量从生芽。待抗性芽长出叶片后,将叶片切下放在含有卡纳(50 mg·L-1)抗生素的分生培养基上继代培养,进行2次筛选。将两次分化获得的芽在生根培养基中进行生根定植,获得完整转基因烟草植株(图3:B)。提取T1代转基因生根植株烟草叶片基因组DNA,利用载体pROKII的通用引物进行PCR反应。最终结果表明,所有检测的抗性植株中,除了转基因株系6号外,其余的12个转基因株系均扩增出了大小为1 000左右的片段,与阳性对照大小一致,野生型烟草为模板的反应,未扩增出条带,说明外源基因已经整合入烟草基因组中(图3:D)。进而将检测为阳性的T2代植株栽倒土里,使其继续生长发育(图3:C)。

图3 转基因植株的获得及PCR检测a.选择培养基上形成的抗性芽;B.转基因植株生根苗;C.移栽至土中的转基因植株(CK.野生型植株作为对照;T.转基因植株);D.转基因植株的PCR检测(M. DNA marker DL5000;P.重组质粒作为阳性对照;CK.野生型烟草DNA;1~13. 13个抗性植株的DNAPCR检验;14. ddH2O作为阴性对照)Fig.3 The acquirement and PCR detection of transgenic plantsa. The putative transgenic shoot buds; B. The transgenic seedling for rooting; C. The mature plant in soil(CK. Wild-type plant; T. The transgenic plant with target gene); D. Thirteen transgenic tobaccos were determined by PCR using special primers(M. DNA marker DL5000; P. Positive control; CK. Wild-type tobacco as negative control; 1-13. PCR products of 13 independent transgenic tobacco; 14. ddH2O as a negative control)

图4 转基因植株的qRT-PCR检测 CK.野生型烟草;L1~5/L7~13. 12个AtCYCD2;1转基因烟草植株Fig.4 The qRT-PCR detection of transgenic plants CK. Wild-type tobacco; L1-5/L7-13. Twelve transgenic tobacco plants of AtCYCD2;1
2.4 转基因植株的荧光定量PCR检测
为了研究拟南芥AtCYCD2;1基因在烟草植株中的表达情况,提取烟草叶总RNA,进行荧光定量PCR检测。与野生型烟草比,拟南芥AtCYCD2;1基因转化到烟草植株中均有表达,表达量较高的株系有L1、L2、L4、L5、L8、L9、L10和L13,表达量最高的株系是L4、L5、L8(图4),这3个株系用于下一步的继续分析。
2.5 过表达AtCYCD2;1烟草植株的表型分析
将得到的转基因株系进行不定期观察,在营养生长期,暂未发现可见的性状差异。待植株进入生殖生长期,发现转基因株系与野生型株系相比花冠变大、花瓣变大、萼片及果实变大(图5:A~C),分别选取3株转基因株系L4、L5和L8和3株对照株系(每个株系顶端随机取5朵花),测量它们的花冠宽度、花瓣的长度、萼片及果实的长度,利用SPSS 19.0软件,采用SNK方差齐性检验的方法对其差异显著性进行分析,结果如图6:A~D,转基因株系与野生型株系比,花冠显著变宽、花瓣显著变大、萼片及果实也明显变长。上述结果表明过表达AtCYCD2;1基因影响转基因植株的花器官及果实的发育。

图5 转基因烟草的表型观察a.花朵大小观察;B.花冠大小观察;C.果实大小比较 CK. 野生型对照植株;L4/5/8. 3个不同的转基因烟草株系Fig.5 Phenotype observation of transgenic tobaccoa.Observation of the size of flowers; B.Observation of the size of corolla; C.Comparation of the size of fruits CK. Wild type; L4/5/8: 3 individual transgenic plant

图6 转基因烟草表型的统计分析a.转基因与对照烟草花冠宽度的比较;B.转基因与对照烟草花瓣长度的比较;C.转基因与对照烟草花萼长度的比较;D.转基因与对照烟草果实长度的比较 CK1~3. 3个野生型植株;L4/5/8. 3个不同的转基因烟草株系;柱形图上小写字母不同表示同一根段不同样品间差异达到显著水平(P ≤ 0.05)Fig.6 Statistic analysis phenotype of transgenic tobaccoa.Comparison of the width of corolla between the transgenic and wild type tobacco; B.Comparison of the length of petal between the transgenic and wild type tobacco; C.Comparison of the length of sepal between the transgenic and wild type tobacco; D.Comparison of the length of seed pod between the transgenic and wild type tobacco CK1-3. 3 individual wild-type; L4/5/8. 3 individual transgenic plant. Different lowercase letters on the column diagram showed the significant difference between different samples(P≤0.05)
2.6过表达AtCYCD2;1烟草植株叶片与种子的显微观察
选取3个转基因株系及对照株系的成熟叶片,将叶片下表皮制作成镜检样品,在体式显微镜下观察并拍照,结果(图7:A~B)显示,转基因株系下表皮细胞与对照相比,暂未发现细胞大小具有明显区别。此外选取相同生长条件同期种植的转基因和对照烟草株系,待形成果实后剥掉果皮,并在显微镜下对比观察种子的发育情况及种子上的表皮细胞大小,同时计算种子单位面积的败育率。结果表明:果实发育基本一致,野生型(CK)果实和转基因株系(AtCYCD2;1)果实的单位面积败育率分别为0.1167%和0.5767%,利用SPSS软件进行t检验显示单位面积内种子败育率差异不显著。此外种子的直径差异不大,表皮细胞大小也没有明显的差异(图7:C~F)。

图7 转基因烟草叶片及种子的显微观察 A~B.转基因与对照烟草的叶片下表皮的显微观察;C~D. 转基因与对照烟草发育中果实的显微观察;E~F. C和D图的局部放大图 CK.野生型对照植株(A,C,E);T.转基因烟草株系(B,D,F)Fig.7 Microscopic observation of leaves and seeds from transgenic tobacoo A-B. Microscopic observation of the leaf epidermis; C-D. Observation of the seeds in the development; E-F. Close-up of the image C and D CK. Wild-type(A,C,E); T. Transgenic plant(B,D,F)
3 讨论
植物的生长发育受内外信号的调控,细胞周期蛋白作为重要的体内调控因素,作用举足轻重[3]。在一些细胞周期过量表达的转基因植物中,尤其是CYCDs,能改变植株的生长和发育[12]。CYCD2;1作为重要的细胞周期调控因子,最初由Soni等[6]在拟南芥中克隆并鉴定。Qi等[19]首次提出了在CYCD2;1基因的cDNA和DNA序列转基因株系中存在转录差异,只有形成全长的mRNA,才会使G1期细胞数量增加,同时其过表达能增加CDK/Cyclin的酶活,减小S期和分裂期细胞的大小。此外,在植物的生长和细胞分裂中,ICK的过量表达能够抑制CDK/Cyclin的活性,在拟南芥中过量表达ICK1致使转基因植株细胞变大,这与CYCD过表达植株的表型相反[20]。酵母双杂交显示ICK1与CYCD2存在互作关系,然而35S::ICK1×35S::CYCD2杂交植株在F1代与同一时间段野生型的细胞相比显著地变小,推测CYCD2;1与ICK1的结合后,CYCD2;1的功能尚未被完全抑制,仍能导致植物细胞变小,进而影响植株的生长与发育[21]。最新研究表明,一个静默中心特异表达的wuschel-relatedhomeobox5(WOX5)基因能在根干的静默中心通过抑制CYCD的活性,来启动和位置静默中心的功能[22]。
本实验为探究拟南芥AtCYCD2;1基因异源表达的功能,从拟南芥花cDNA中克隆出AtCYCD2;1基因,将AtCYCD2;1基因转入到烟草后发现了新的表型。与野生型相比,过量表达AtCYCD2;1的转基因烟草的花器官发生明显变化,主要表现为花冠宽度、花瓣和萼片的长度都大于对照植株,同时,转基因烟草的果实也大于野生型烟草。然而转基因植株的叶片下表皮及种子的细胞没有观察到明显的变小趋势。研究表明,大多数的植物D型周期蛋白在分裂旺盛的组织中表达量较高[23]。本实验细胞大小观察的材料均为发育成熟的叶片表皮及成熟的种子,可能取材时间及部位存在误区,这和Qi等[19]发现根尖分裂区细胞明显变小,而成熟叶片表皮细胞差异不大的结果类似。花芽分化是是由营养生长向生殖生长转变的生理和形态标志。花原基上各轮花器的分化顺序,一般为向心分化,即从花托的外周开始,先分化花萼,然后逐渐向心分化花瓣、雄蕊、雌蕊。本实验中花萼、花瓣等明显变大,表明拟南芥AtCYCD2;1在异源调控细胞周期活动以及植物的生殖发育方面具有非常重要的作用。已有研究表明拟南芥AtCYCD2;1是通过与CDK结合形成复合物作用于细胞周期的G1期,从而控制分生组织内的细胞分裂速率[19]。这说明烟草中可能也存在与AtCYCD2;1结合的CDK,拟南芥AtCYCD2;1与烟草NtCDK有可能在植株特定的发育时期,调节控制植株的生长发育,尤其是生殖器官的发育。然而,AtCYCD2;1基因在植物中是通过怎样的方式调控生殖器官发育及果实的形态变化仍需进一步深入的探究,下一步将进行分裂期细胞的形态观察以及G1期速率的测定等一系列实验,以期对AtCYCD2;1基因作用机理进行阐述,挖掘出其潜在的应用价值。
1.Oakenfull E A,Riou-Khamlichi C,Murray J A.Plant D-type cyclins and the control of G1 progression[J].Philos Trans R Soc Lond B Biol Sci,2002,357(1422):749-760.
2.Richard C,Lescot M,Inzé D,et al.Effect of auxin,cytokinin,and sucrose on cell cycle gene expression inArabidopsisthalianacell suspension cultures[J].Plant cell,Tissue and Organ Cult,2002,69(2):167-176.
3.Meijer M,Murray J A.Cell cycle controls and the development of plant form[J].Curr Opin Plant Biol,2001,4(1):44-49.
4.De Veylder L,de Almeida Engler J,Burssens S,et al.A new D-type cyclin ofArabidopsisthalianaexpressed during lateral root primordia formation[J].Planta,1999,208(4):453-462.
5.Dahl M,Meskiene I,Bögre L,et al.The D-Type alfalfa cyclin gene cycMs4 complements G1 cyclin deficient yeast and is induced in the G1 phase of the cell cycle[J].Plant Cell,1995,7(11):1847-1857.
6.Soni R,Carmichael J P,Shah Z H,et al.A family of cyclin D homologs from plants differentially controlled by growth regulators and containing the conserved retinoblastoma protein interaction motif[J].Plant Cell,1995,7(1):85-103.
7.Doonan J,Fobert P.Conserved and novel regulators of the plant cell cycle[J].Curr Opin Cell Biol,1997,9(6):824-830.
8.Tessema M,Lehmann U,Kreipe H.Cell cycle and no end[J].Virchows Arch,2004,444(4):313-323.
9.Jacqmard A,De Veylder L,Segers G,et al.Expression of CKS1At inArabidopsisthalianaindicates a role for the protein in both the mitotic and the endoreduplication cycle[J].Planta,1999,207(4):496-504.
10.Yu Y,Steinmetz A,Meyer D,et al.The tobacco A-type cyclin,Nicta;CYCA3;2,at the nexus of cell division and differentiation[J].Plant Cell,2003,15(12):2763-2777.
11.You X L,Xing X,Wei Z,et al.Analysis of the expression of a CycB gene isolated fromNicotianatabacum[J].Biotechnology & Biotechnological Equipment,2009,23(2):1194-1198.
12.Riou-Khamlichi C,Huntley R,Jacqmard A,et al.Cytokinin activation ofArabidopsiscell division through a D-type cyclin[J].Science,1999,283(5407):1541-1544.
13.李芳,许颖,张姣,等.超量表达细胞D型周期蛋白CYCD3;1影响拟南芥根的发育[J].植物生理学通讯,2008,44(3):431-435.
14.Fujii T,Sato K,Matsui N,et al.Enhancement of secondary xylem cell proliferation byArabidopsiscyclin D overexpression in tobacco plants[J].Plant Cell Rep,2012,31(9):1573-1580.
15.Wianny F,Real F X,Mummery C L,et al.G1-phase regulators,cyclinD1,cyclinD2,and cyclinD3:up-regulation at gastrulation and dynamic expression during neurulation[J].Dev Dyn,1998,212(1):49-62.
16.Riou-Khamlichi C,Menges M,Healy J M,et al.Sugar control of the plant cell cycle:differential regulation ofArabidopsisD-type cyclin gene expression[J].Mol cell Biol,2000,20(13):4513-4521.
17.Boucheron E,Healya J H,Bajon C,et al.Ectopic expression ofArabidopsisCYCD2 andCYCD3 in tobacco has distinct effects on the structural organization of the shoot apical meristem[J].J Exp Bot,2005,56(409):123-134.
18.Horsch R B,Fry J E,Hoffmann N L,et al.A simple and general method for transferring genes into plants[J].Science,1985,227(4691):1229-1231.
19.Qi R,John P C.Expression of genomicAtCYCD2;1 inArabidopsisinduces cell division at smaller cell sizes:implications for the control of plant growth[J].Plant Physiol,2007,144(3):1587-1597.
20.Wang H,Zhou Y,Gilmer S,et al.Expression of the plant cyclin-dependent kinase inhibitor ICK1 affects cell division,plant growth and morphology[J].Planta J,2000,24(5):613-623.
21.Zhou Y,Wang H,Gilmer S,et al.Effects of co-expressing the plant CDK inhibitor ICK1 and D-type cyclin genes on plant growth,cell size and ploidy inArabidopsisthaliana[J].Planta,2003,216(4):604-613.
22.Forzani C,Aichinger E,Sornay E,et al.WOX5 suppresses CYCLIN D activity to establish quiescence at the center of the root stem cell niche[J].Curr Biol,2014,24(16):1939-1944.
23.Cho J W,Park S C,Shin E A,et al.Cyclin D1 and p22ackl play opposite roles in plant growth and development[J].Biochem Biophys Res Commun,2004,324(1):52-57.
ConstructionofPlantExpressionVectorandGeneticTransformationAnalysisofArabidopsisthalianaCYCD2;1GeneinNicotianatabacum
DAI Li-Juan ZHENG Tang-Chun LIU Cai-Xia LI Kai-Long QU Guan-Zheng*
(State Key Laboratory of Tree Genetics and Breeding,Northeast Forestry University,Harbin 150040)
Cell division is one of the basic characteristics of organisms, which plays an extremely important role in the plant growth and development.CYCD2;1, as a regulatory factor, has been identified in regulation of cell cycle. In our study,CYCD2;1 was amplified fromArabidopsisinflorescences cDNA by PCR. Plant overexpression vector (pROKII-AtCYCD2;1) was constructed and transformed into wild-type tobacco byAgrobacterium-mediated leaf disc transformation. The transgenic plants were confirmed by PCR, and the result showedAtCYCD2;1 gene was integrated into tobacco genome. The result of qRT-PCR detection of T2 generation plants showed the mRNA ofAtCYCD2;1 was transcribed in transgenic tobaccos. There were significant differences in the flower between the transgenic and wild type plant, such as the width of the corolla, the lengths of the petal and sepal, and increased volume of seed pod, which suggesting overexpression ofAtCYCD2;1 has an obvious influence on the development of flowers.
AtCYCD2;1;cyclin;genetic transformation;Nicotianatabacum
教育部新世纪优秀人才支持计划项目(NCET-12-0808);国家自然科学基金项目(31370661)资助
代丽娟(1988—),女,硕士研究生,主要从事林木遗传育种研究。
2015-07-29
Q943
A
10.7525/j.issn.1673-5102.2016.02.018

