烟草染色体片段代换系的构建与遗传评价
童治军 焦芳婵 方敦煌 陈学军 吴兴富 曾建敏 谢 贺 张谊寒肖炳光
云南省烟草农业科学研究院 / 烟草行业烟草生物技术育种重点实验室 / 国家烟草基因工程研究中心, 云南昆明 650021
烟草染色体片段代换系的构建与遗传评价
童治军 焦芳婵 方敦煌 陈学军 吴兴富 曾建敏 谢 贺 张谊寒肖炳光*
云南省烟草农业科学研究院 / 烟草行业烟草生物技术育种重点实验室 / 国家烟草基因工程研究中心, 云南昆明 650021
以综合性状优良的烤烟种质 Y3为轮回亲本, 抗烟草黑胫病(0号和 1号生理小种)和赤星病的雪茄烟种质Beinhart 1000-1及优质烤烟品种K326为供体亲本, 连续回交并结合分子标记辅助选择, 构建国内外第一套由256个具有烤烟Y3遗传背景并渐渗有Beinhart 1000-1和K326染色体片段株系代换系群体。该群体携带377个代换片段, 分布于烟草24条连锁群上。每个株系携带1~5个代换片段, 代换片段长度介于0.05~36.88 cM, 平均长度7.75 cM。代换片段重叠累加总长度为2922.57 cM, 是烟草基因组总长度的2.61倍。代换片段覆盖总长度为1114.32 cM, 烟草基因组覆盖率为99.45%。本研究构建的片段代换系可用于烟草基因定位、复杂性状的QTL分析和标记辅助选择育种。
烟草(Nicotiana tabacum L.); 染色体片段代换系; SSR; 分子标记辅助选择
烟草是我国重要的经济作物之一, 其品种的选育虽取得了一定成绩, 但与 K326等国外引进的优良品种相比仍有一定差距, 无法完全满足国内烟叶生产对品种的需求[1]。烟草的产量、品质和抗性等重要育种目标性状绝大部分为多基因控制的数量性状, 遗传方式复杂, 受多基因位点和环境的共同影响, 且数量性状位点(QTL)的鉴定难度较大[2-6]。利用传统的分离群体, 因为数量性状本身的复杂性, 及分离群体遗传背景的复杂性, 很难取得QTL定位的满意结果。染色体片段代换系(chromosome segment substitution lines, CSSL)是在受体的遗传背景中代换入某个或某些供体亲本的染色体片段, 并利用回交和分子标记辅助选择(MAS)技术建立的覆盖作物整个基因组的一系列近等基因系[7-9]。与分离群体相比,其遗传背景简单、群体遗传稳定、QTL定位及遗传效应分析准确, 在番茄[10-12]、油菜[13]、莴苣[14]、大麦[15]、小麦[16]、棉花[17]、黄瓜[18-20]、水稻[21-23]等作物中得到了广泛应用, 同时, 也是QTL的精确定位、挖掘和利用新基因资源、实现分子标记技术和作物育种链接的理想材料[24]。
迄今, 国内外烟草染色体片段代换系的相关研究尚未见报道。虽然烟草基因组测序为构建高密度烟草分子标记遗传图谱奠定了基础[25-28], 但因其遗传基础狭窄, 栽培品种间多态性低[29-33], QTL定位等基础研究相对落后; 目前仅有的少数QTL定位[2-6,34]主要基于初级定位群体, 其结果无法直接应用于育种研究。鉴于此, 本研究利用优质烤烟品种 K326和抗烟草黑胫病(0号和1号生理小种)、赤星病的雪茄烟种质Beinhart 1000-1为供体亲本, 优良烤烟品种Y3为受体亲本, 经多代回交、自交, 并结合SSR标记辅助选择构建一套烟草染色体片段代换系, 对K326和Beinhart 1000-1中优良品质和抗病的QTL (基因)定位和转育、烤烟品种改良及促进烟草分子育种具有重要意义。
1 材料与方法
1.1 供试材料
供试的三份烟草材料均由云南省烟草农业科学研究院提供(表1)。受体亲本Y3是从津巴布韦引进的烤烟种质资源, 该资源生育期适中、株型优良、节距较大、叶数多且宽、鲜烟叶柔软, 但叶片较薄、香气质中等、香气量欠足且易感烟草黑胫病和叶斑病害(如赤星病等)。供体亲本K326香气质好、香气量足、燃烧性强, 是目前世界上种植区域最广、种植面积较大的烤烟品种; 供体亲本 Beinhart 1000-1是叶片肥厚且抗烟草黑胫病0、1号生理小种和烟草赤星病的雪茄烟种质。

表1 用于构建染色体片段代换系的亲本来源及类型Table1 Origin and type of parents used for development of CSSLs
1.2 染色体片段代换系的构建
如图1所示, 2013年在云南省烟草农业科学研究院研和试验基地(云南省玉溪市)温室, 以烤烟种质Y3为受体亲本, 与烤烟品种K326和雪茄烟种质Beinhart 1000-1分别杂交获得F1, 再以Y3为轮回亲本回交, 获得2个分别含 300个单株的回交一代群体。从2014年1月(BC2F1)开始对导入的供体片段筛选。即在前期已构建的两张烟草遗传图谱的24个连锁群上每10~20 cM选取一个标记, 共计100个SSR标记(表2), 对2个群体中的各单株分别进行代换片段的追踪和检测。仅含有 1个代换片段的单株直接自交纯化建立单片段代换系, 而含有多个供体染色体片段( >5个片段)的单株继续回交并结合MAS进行前景和背景筛选。2014年6月, 将从BC2F1挑选出的240个株系(每个群体120个株系)播种组成1200 株BC3F1群体。2014年12月, 从1200个BC3F1株系中筛选出 240个株系并种植成 1200株 BC4F1群体。2015年3月, 利用已构建的2张烟草图谱中共有的416个SSR标记对1200株BC4F1单株进行代换片段的追踪和检测。至2015年12月, 筛选获得256个含有1~5个供体片段的烟草染色体片段代换系并分别自交得到BC4F2群体。2016年2月, 再利用416个标记对2560个BC4F2单株(每个株系随机选10株)进行供体片段的追踪和检测, 直至筛选获得稳定、纯合的烟草染色体(单)片段代换系。
1.3 基因组DNA的提取及代换系基因型的分析
取烟草幼嫩叶片, 提取基因组 DNA参考Maguire等[35]的方法略作修改。参照Tong等[2-3,28]的SSR标记分析及非变性聚丙烯酰胺凝胶电泳检测方法。为了构建烟草染色体片段代换系, 前期利用公共数据库 NCBI上公开的普通烟草基因组序列数据[Nicotiana tabacum (K326), http://www.ncbi.nlm.nih.gov/Traces/wgs/?val=AWOJ01]开发了 13 645对烟草SSR标记[27-28]; 并以K326、Beinhart 1000-1为供体亲本与受体亲本Y3组配的BC1F1为作图群体,构建了2张分别包含626个和562个标记位点的SSR标记遗传图谱(数据尚未公开), 2张图谱中共有SSR标记416个, 且较均匀分布于24个连锁群上(表2)。

图1 烟草CSSLs群体构建程序Fig.1 Procedure for developing CSSLs in tobacco
1.4 代换系的评价
根据已构建的烟草遗传图谱上SSR标记间的遗传距离来估算染色体片段长度, 若标记的相邻基因型相同, 则忽略相邻标记区间的双交换事件, 两标记间的区段为相同的标记基因型; 若标记的相邻基因型不同, 则无多态性的标记与有多态性标记的中点为染色体代换片段的末端, 即认为这 2个标记基因型分别组成这个区间的1/2, 代换片段的长度按已构建的遗传图谱中的遗传距离来计算[36]。
利用MapChat 2.20软件构建全基因组的图示基因型, 直观显示代换片段的位置和大小, 并分别累计来自供体亲本Beinhart 1000-1和K326的染色体片段总长度, 计算其占受体基因组的比例。
2 结果与分析
2.1 SSR标记的选择
以已构建的 2张遗传图谱为基础, 每隔 10~20 cM左右选择1个SSR标记, 共选择了100个SSR标记, 在 BC2F1和 BC3F1世代中进行供体片段的追踪和检测。其中, 第5、第14、第17和第18连锁群上标记最少, 有3个标记。第2、第13、第19和第22连锁群上标记最多, 有11个标记。SSR标记间最小距离为0.76 cM, 最大距离为41.03 cM, 平均距离为11.89 cM。从BC4F1开始, 利用两张图谱中共有的416个标记进行代换片段的检测与筛选。其中, 第 5连锁群上标记最少, 有7个标记; 第2连锁群上标记最多, 有35个标记。SSR标记间最小距离为0.05 cM, 最大距离为36.88 cM, 平均距离为7.75 cM。
2.2 代换片段的遗传评价
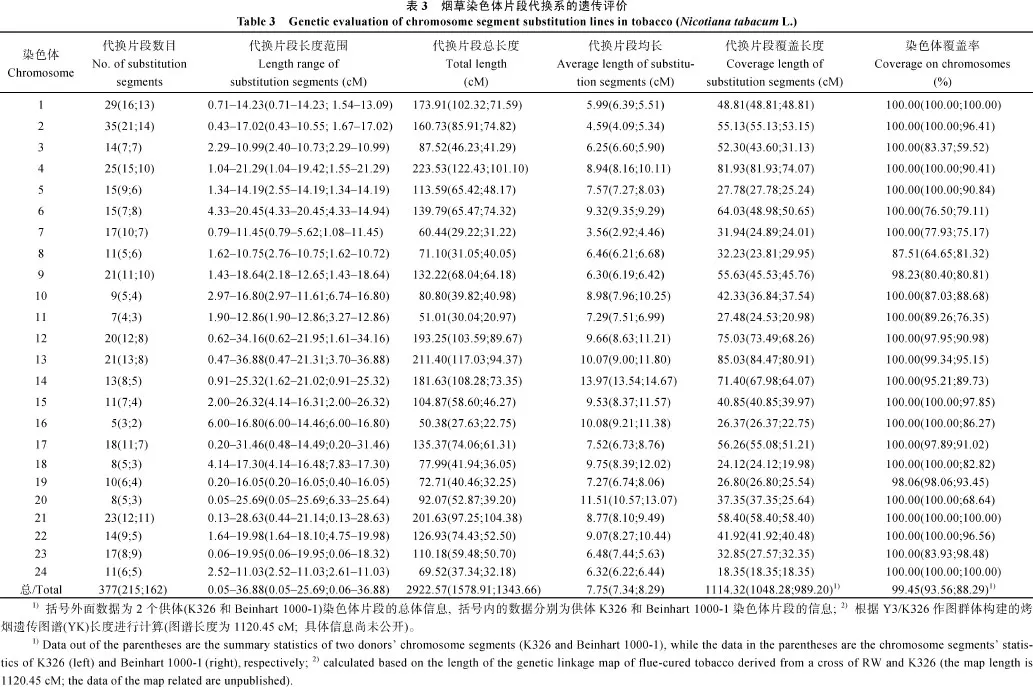
通过3个世代(BC2F1、BC3F1和BC4F1)的分子标记辅助选择, 筛选出由 256个单株组成的一套分别含有烤烟K326和雪茄烟Beinhart 1000-1导入片段的烤烟染色体片段代换系(图2)。其中, 含有 K326片段的代换系有 131个株系, 含有 Beinhart 1000-1片段的代换系有 125个株系。在筛选出的 256份BC4F1单株中, 单片段代换单株有31个, 2~4片段代换单株有183个, 5片段代换单株有42个。其中, 具有烤烟 K326片段的代换系中, 单片段代换单株有17个, 2~4片段代换单株有95个, 5片段代换单株有19个; 具有雪茄烟Beinhart 1000-1片段的代换系中,单片段代换单株有14个, 2~4片段代换单株有88个, 5片段代换单株有23个。
从表3和图2可看出, 烟草基因组导入的377个代换片段总长度为2922.57 cM, 长度范围为0.05~ 36.88 cM, 平均长度为7.75 cM, 最长的代换片段位于第13连锁群上, 最短的代换片段位于第20连锁群上的中下部。其中, 第4连锁群代换片段的总长最大, 为223.53 cM; 第16连锁群代换片段的总长最小, 为50.38 cM。具有烤烟K326片段的代换系中导入的215个代换片段总长度为1578.91 cM, 长度范围为0.05~25.69 cM, 平均长度为7.34 cM。具有雪茄烟Beinhart 1000-1片段的代换系中导入的162个代换片段总长度为1343.66 cM, 长度范围为0.06~36.88 cM,平均长度为8.29 cM。
377个代换片段在烟草24条连锁群上的分布不等, 各连锁群平均导入15~16个片段。其中, 第2连锁群的代换片段数最多, 为35个, 其次是第1连锁群的29个片段; 第16号连锁群代换片段数目最少, 为5个。215个具有烤烟K326片段的代换系中, 第2连锁群的代换片段数最多, 为21个, 其次是第1连锁群的16个片段; 第16连锁群代换片段数目最少, 为 2个。162个具有雪茄烟 Beinhart 1000-1片段的代换系中, 同样是第 2连锁群的代换片段数最多, 为14个, 其次是第1连锁群的13个片段; 第16连锁群代换片段数目最少, 仅有2个。
代换片段在烟草基因组 24条连锁群上覆盖了1114.32 cM 的距离, 覆盖率为 99.45% (1114.32/ 1120.45)。各连锁群覆盖率虽有不同, 但均在87.5%以上。其中, 有21条连锁群上的代换片段重叠后覆盖率为100%, 而3个第8、第9和第19连锁群上分别存在12.49% (4.60 cM)、1.77% (1.00 cM)和1.94% (0.53 cM)的区域未被覆盖(表3)。具有烤烟K326片段的代换系中, 导入的供体片段覆盖烟草基因组长度为1048.28 cM, 覆盖率为93.56%。其中, 有11条连锁群上的代换片段重叠后覆盖率达 100.00%, 剩余的 13条连锁群中的覆盖率范围为 64.65%~ 99.34%。具有雪茄烟Beinhart 1000-1片段的代换系中, 代换片段覆盖烟草基因组长度为989.20 cM, 覆盖率为 88.29%。其中, 代换片段重叠后覆盖第 1、第21和第24连锁群100%, 未能达到全覆盖的21条连锁群上代换片段覆盖率范围为 59.52%~98.48%(表3)。

表2 受体与供体亲本间的烟草SSR标记多态性Table2 Polymorphism between the recipient and donors detected by tobacco SSR markers

(图2 )



图2 256份代换系的代换片段在烟草基因组上的位置Fig.2 Genomic positions of the substituted segment in 256 CSSLs
3 讨论
在染色体片段代换系构建过程中, 亲本选择十分重要, 一般要选择遗传背景差异较大的[7]。已有的研究中的亲本的选择主要分为两类, 一类是选择供体亲本与受体亲本间亲缘关系较远、遗传背景差异较大且双亲(或其中之一)与生产应用品种间存在较大的性状差异, 此类染色体代换系群体较为适用于遗传学研究, 但不易用于育种实践[10-12,14-15,18]。另一类则是供体与受体亲本间亲缘关系较近且双亲均为当前大面积推广应用的主栽品种, 此类代换系群体虽可较容易选择出具有优良代换系株系、并直接供育种实践应用, 但双亲间因亲缘关系较近而不易筛选获得足够量的分子标记, 从而影响代换系群体构建的质量[8-9,21-23]。本研究为获得既有较高质量又易于烤烟育种实践应用的烟草染色体片段代换系,在亲本的选择上兼顾了以下 3点。首先, 选择的亲本材料具较多优点, 没有突出或致命的缺点, 且在主要育种性状上优缺点能形成互补。受体亲本(轮回亲本) Y3是综合性状优良但香气量欠足、易感烟草黑胫病和叶斑病害的烤烟种质, 供体亲本则分别具有优良品质、高抗烟草黑胫病和赤星病。其次, 亲本(或亲本之一)是能适应当地生态条件且综合性状较好的推广品种。本研究的 3个亲本中, 受体亲本Y3经引种试验, 证明其在我国的西南地区(尤其云南)具有较强的适应性且综合性状优良。供体亲本K326是目前世界上种植区域最广、面积较大且深受我国卷烟企业喜好的烤烟品种。供体亲本 Beinhart 1000-1具有较高的烟草黑胫病(0号和1号生理小种)和赤星病抗性。最后, 亲本间的遗传差异较大。本研究所选用的 3份亲本材料的生态类型差异较大,亲缘关系相对较远。从地域上看, 亲本 K326和Beinhart 1000-1来源于美国, 亲本Y3来源于津巴布韦。从烟草类型上看, 亲本Y3和K326属于烤烟, 而亲本Beinhart 1000-1属于雪茄烟(表1)。因此, 亲本间的多态率及共显性多态标记数目均较其他烤烟品种间高(表2)。
由于 CSSLs与其轮回亲本(受体)间只存在代换片段的差异, 而遗传背景与受体亲本一致, 可将复杂性状分解为单个孟德尔因子, 对代换区段中的QTL分析时遗传背景干扰小, 因而受到研究者的重视[22,24]。Eshed和Zamir等[10]最早建立了以栽培番茄为遗传背景、含有野生番茄单片段的代换系群体,该群体含有50个单片段代换系, 可以覆盖野生番茄的全基因组。张桂权等[37]利用优良水稻品种华粳籼74为受体, 以来源于世界各地的26个品种(包括14个籼稻和 12个粳稻)为供体, 通过回交和分子标记辅助选择方法建立了目前世界上规模最大、质量最好的水稻单片段代换系文库。该文库共有1529个染色体单片段代换系(CSSSL), 代换片段的平均长度为18.8 cM, 代换片段总长度达28 700 cM, 相当于约18.8倍的水稻基因组长度。通过对代换片段的基因鉴定和定位, 筛选获得了包括植株形态、稻米品质、产量、抗病性、生育期等重要性状共2000多个优良基因(QTL)。本研究已获得了以烤烟Y3为遗传背景的256个含有1~5个供体片段的烟草染色体片段代换系。其中, 含有K326片段的代换系有131个株系, 含有Beinhart 1000-1片段的代换系有125个株系。获得的代换系中代换片段重叠后总长度为2922.57 cM, 相当于烤烟全基因组总长的2.61倍(本研究中以Y3和K326为作图亲本构建的烤烟SSR标记遗传图谱全长为1120.45 cM), 代换片段覆盖烟草基因组的长度为 1114.32 cM, 总覆盖率高达99.45%。因此, 与其他作物相关研究比较, 本研究构建的烟草CSSLs质量总体上还不高, CSSL所包含株系的数量、受体携带代换片段的数目、代换片段的大小(长度)及代换片段在基因组的覆盖率等方面均不能完全满足烟草育种的要求。究其原因, 可能是: (1)烟草育种过程中, 过度依赖极少数的主体亲本而使得许多非育种目标的多样化性状丢失, 导致烟草(尤其是烤烟)品种间的亲缘关系较近、遗传基础狭窄、遗传多样性降低。(2)烟草基础研究相对薄弱。虽然近些年随着烟草基因组计划的开展, 基础研究在分子水平有了质的提升, 但起步较晚, 与其他作物仍有相当大差距。基于此, 导致烟草CSSL在构建过程中既受材料(亲本)的限制又受手段(研究基础)的制约。目前, 本研究获得的代换系尽管不是覆盖烟草全基因组的单片段代换系, 但正在对BC4F1继续进行代换片段的追踪和检测, 直至获得一整套覆盖烟草全基因组的CSSSLs, 为复杂性状QTL分析及有效转育供体亲本 K326和 Beinhart 1000-1中优质和抗病性状的QTL/基因到其他烤烟品种提供理想材料。
4 结论
以综合性状优良的烤烟种质 Y3为轮回亲本,以抗黑胫病 0号、1号生理小种和抗赤星病的Beinhart 1000-1及优质品种K326为供体亲本, 经杂交、回交、自交, 结合分子标记辅助选择建立了国内外首套烟草染色体片段代换系群体。该群体由256个不同代换系株系组成, 且每个代换系株系中仅含有 1~5个代换片段。通过对 Y3遗传背景中的Beinhart 1000-1和K326染色体导入片段的分析, 筛选染色体单片段代换系, 为复杂性状QTL分析、分子标记辅助选择育种等研究提供材料。
[1] 王元英, 周健.中美主要烟草品种亲源分析与烟草育种.中国烟草学报, 1995, 13(5): 11–22
[2] Tong Z J, Jiao T L, Wang F Q, Li M Y, Len X D, Gao Y L, Li Y P, Xiao B G, Wu W R.Mapping of quantitative trait loci conferring resistance to brown spot in flue-cured tobacco (Nicotiana tabacum L.).Plant Breed, 2012, 131: 335–339
[3] Tong Z J, Jiao F C, Wu X F, Wang F Q, Chen X J, Li X Y, Gao Y L, Zhang Y H, Xiao B G, Wu W R.Mapping of quantitative trait loci underlying six agronomic traits in flue-cured tobacco (Nicotiana tabacum L.).Acta Agron Sin, 2012, 38: 1–9
[4] Nishi T, Tajima T, Noguchi S, Ajisaka H, Negishi H.Identification of DNA markers of tobacco linked to bacterial wilt resistance.Theor Appl Genet, 2003, 106: 765–770
[5] Julio E, Denoyes R B, Verrier J L, de Borne F D.Detection of QTLs linked to leaf and smoke properties in Nicotiana tabacum based on a study of 114 recombinant inbred lines.Mol Breed, 2006, 22: 144–166
[6] Vontimitta V, Lewis R S.Mapping of quantitative trait loci affecting resistance to Phytophthora nicotianae in tobacco (Nicotiana tabacum L.) line Beihart-1000.Mol Breed, 2010, 58: 294–300
[7] 廖长见, 王颖姮, 潘光堂.作物染色体导入系的构建及其应用.分子植物育种, 2007, 5(6): 139–144
Liao C J, Wang Y H, Pan G T.Construction and application of chromosome introgression lines in crops.Mol Plant Breed, 2007, 5(6): 139–144 (in Chinese with English abstract)
颅内静脉窦血栓属于多种因素共同作用引发的罕见颅内静脉系统血管病,病死率可达15%[5-7]。颅内静脉窦血栓早期发病隐匿,少部分患者表现为偏瘫等局灶性体征,临床识别难度较高[8-10]。因此,寻找一种早期有效诊断颅内静脉窦血栓的手段至关重要。
[8] Jena K K, Khush G S, Kochert G.RFLP analysis of rice (Oryza sativa) introgression lines.Theor Appl Genet, 1992, 84: 608–616
[9] Eshed Y, Abied M, Saranga Y, Zamir D.Lycopersicon esculentumlines containing small overlapping introgressions from pennellii.Theor Appl Genet, 1992, 83: 1027–1034
[10] Eshed Y, Zam I R.An introgression line population of Lycopersicon pennellii in the cultivated tomato enables the identification and fine mapping of yield-associated QTL.Genetics, 1995, 14: 1147–1162
[11] Monforte A J, Tanksley S D.Development of a set of near isogenic and backcross recombinant inbred lines containing most of the Lycopersicon hirsutum genome in an L.esculentum genetic background: A tool for gene mapping and gene discovery.Genome, 2000, 43: 803–813
[12] Bernacehi D, Beck-Bunn T, Emmatty D, Eshed Y, Inai S, LoPez J, Petiard V, Sayama H, U’hlig J, Zamir D, Tanksley S.Advanced backcross QTL analysis of tomato: II.Evaluation of near-isogenic lines carrying single-donor introgressions for desirable wild QTL-alleles derived from Lycopersicon hirsutum and L.pimpinellifolium.Theor Appl Genet, 1998, 97: 170–180
[13] Ramsay L D, Jennings D E, Bohuon E J R, Arihur A E, Lydiate D J, Kearsey M J, Marshall D F.The construction of a substitution library of recombinant backcross lines in Brassica oleracea for the precision mapping of quantitative trait loci.Genome, 1996, 39: 558–567
[14] Jeuken M J W, Lindhout P.The development of lettuce backcross inbred lines (BILs) for exploitation of the Laetuca saligna (wild lettuce) germplasm.Thero Appl Genet, 2004, 109: 394–401
[15] Matus L, Corey A, Filiehkin T.Development and characterization of recombinant chromosome substitution lines (RCSLs) using Hordeum velgare subsp.spontaneum as a source of donor alleles in a Hordeum vulgar subsp.velgare background.Genome, 2003, 46: 10l0–1023
[16] Korff M V, Wang H, Leon J.Development of candidate introgression lines using an exotic barley accession (Hordeum vulgar subsp.spontaneous) as donor.Theor Appl Genet, 2004, 109: 1736–1745
[17] 冯长辉, 张胜昔, 王志伟, 王夏青, 李夕梅.棉花染色体单片段导入系的研究进展.湖北农业科学, 2009, 48(12): 24–26
Feng C H, Zhang S X, Wang Z W, Wang X Q, Li X M.Research progress on construction and application of SSILs in cotton.Hubei Agric Sci, 2009, 48(12): 24–26 (in Chinese with English abstract)
[18] 孟佳丽, 娄群峰, 周晓慧, 史建磊, 陈劲枫.黄瓜-酸黄瓜染色体片段导入系群体的构建及果实相关数量性状基因的定位.中国农业科学, 2012, 45: 1558–1567
Meng J L, Lou Q F, Zhou X H, Shi J L, Chen J F.Construction of cucumber-sour cucumber chromosome introgression lines and location of fruit related QTLs.Sci Agric Sin, 2012, 45: 1558–1567 (in Chinese with English abstract)
[19] 林肖剑, 许学文, 钱红梅, 齐晓花, 徐强, 陈学好.黄瓜抗白粉病染色体片段导入系的 SSR鉴定.园艺学报, 2012, 39: 485–492
Lin J X, Xu X W, Qian H M, Qi X H, Xu Q, Chen X H.Analysis of cucumber chromosome segment introgression line with powdery mildew resistance based on SSR markers.Acta Hort Sin, 2012, 39: 485–492 (in Chinese with English abstract)
[20] 史建磊, 娄群峰, 钱春桃, 万红建, 周晓慧, 陈劲枫.黄瓜染色体片段导入系的构建与遗传评价.南京农业大学学报, 2011, 34(1): 20–24
Shi J L, Lou Q F, Qian C T, Wan H J, Zhou X H, Chen J F.Construction and genetic evaluation of chromosome segment introgression lines in cucumber.J Nanjing Agric Univ, 2011, 34(1): 20–24 (in Chinese with English abstract)
[21] 刘冠明, 李文涛, 曾瑞珍, 张泽民, 张桂权.水稻单片段代换系片段的QTL鉴定.遗传学报, 2004, 31: 1395–1400
Liu G M, Li W T, Zeng R Z, Zhang Z M, Zhang G Q.Identification of QTLs on substituted segments in single segment substitution lines of rice.Acta Genet Sin, 2004, 31: 1395–1400 (in Chinese with English abstract)
[22] 何风华, 席章营, 曾瑞珍, Akshay T, 张桂权.利用高代回交和分子标记辅助选择建立水稻单片段代换系.遗传学报, 2005, 32: 825–831
He F H, Xi Z Y, Zeng R Z, Akshay T, Zhang G Q.Developing single segment substitution lines (SSSls) in rice (Oryza sativa L.) using advanced backcrosses and MAS.Acta Genet Sin, 2004, 32: 825–831 (in Chinese with English abstract)
[23] Li Z K, Fu B Y, Gao Y N.Genome-wide introgression lines and their use in genetic and molecular dissection of complex phenotypes in rice (Oryza sativa L.).Plant Mol Biol, 2005, 59: 33–52
[24] 王玉民, 席章营, 尚爱兰, 王帮太.作物单片段代换系的构建及应用.中国农学通报, 2008, 24(3): 67–71
Wang Y M, Xi Z Y, Shang A L, Wang B T.Construction and application of single segment substitution lines in crops.Chin Agric Sci Bull, 2008, 24(3): 67–71 (in Chinese with English abstract)
[25] Bindler, G, der Hoeven V R, Gunduz I, Plieske J, Ganal M, Rossi L, Gadani F, Donini P.A microsatellite marker based linkage map of tobacco.Theor Appl Genet, 2007, 114: 341–349
[26] Bindler, G, Plieske J, Bakaher N, Gunduz I, Ivanov N, der Hoeven R V, Ganal M, Donini P.A high density genetic map of tobacco (Nicotiana tabacum L.) obtained from large scale microsatellite marker development.Theor Appl Genet, 2011, 123: 219–230
[27] Sierro, N, Battey J N D, Ouadi S, Bakaher N, Bovet L, Willig A, Goepfert S, Peitsch M C, Ivanov N V.The tobacco genome sequence and its comparison with those of tomato and potato.Nat.Commun, 2014, 5:3833, doi: 10.1038/ncomms4833
[28] Tong Z J, Yang Z M, Chen X J, Jiao F C, Li X Y, Wu X F, Gao Y L, Xiao B G, Wu W R.Large-scale development of microsatellite markers in Nicotiana tabacum and construction of a genetic map of flue-cured tobacco.Plant Breed, 2012, 131: 674–680
[29] Arslan B, Okunus A.Genetic and geographic polymorphism of cultivated tobaccos (Nicotiana tabacum) in Turkey.Plant Genet, 2006, 42: 667–671
[30] Del Piano L, Abet M C, Sorrentino F, Acanfora E, Cozzolino E, DiMuro A.Genetic variability in Nicotiana tabacum and Nicotiana species as revealed by RAPD procedure.Intl Contribut Tob Res, 2000, 19: 1–15
[31] Moon H S, Nicholson J S, Lewis R S.Use of transferable Nicotiana tabacum L.microsatellite markers for investigating genetic diversity in the genus Nicotiana.Genome, 2008, 51: 547–559
[32] Moon H S, Nicholson J S, Heineman A, Lion K, der Hoeven R V, Hayes A J, Lewis R S.Changes in genetic diversity of U.S.flue-cured tobacco germplasm over seven decades of cultivar development.Crop Sci, 2009, 49: 498–506
[33] Moon H S, Nifong J M, Nicholson J S, Heineman A, Lion K, der Hoeven R V, Hayes A J, Lewis R S.Microsatellite-based analysis of tobacco (Nicotiana tabacum L.) genetic resources.Crop Sci, 2009, 49: 2149–2157
[34] Bai D, Reeleder R, Brandle J E.Identification of two RAPD markers tightly linked with the Nicotiana debneyi gene for resistance to black root rot of tobacco.Theor Appl Genet, 1995, 91: 1184–1189
[35] Maguire T, Collins G, Sedgley M.A modified CTAB DNA extraction procedure for plants belonging to the family Proteaceae.Plant Mol Biol Rep, 1994, 12: 106–109
[36] Yong N D, Tanlalesy S D.Restriction fragment polymorphism maps and the concept of graphical genotypes.Theor Appl Genet, 1989, 77: 95–101
[37] 张桂权, 曾瑞珍, 丁效华, 张泽民, 李文涛.水稻单片段代换系文库的构建及其在分子育种上的应用.见: 方宣钧,黎志康主编.2005植物分子育种国际学术研讨会论文集.北京: 科学出版社, 2005.pp 106–113
Zhang G Q, Zeng R Z, Ding X H, Zhang Z M, Li W T.Construction of a library of single segment substitution lines for rice breeding by design.In: Fang X J, Li Z K, eds.Proceedings of the 2005 International Conference on Plant Molecular Breeding.Beijing: Science Press, 2005.pp 106–113
Construction and Genetic Evaluation of Chromosome Segment Substitution Lines in Tobacco (Nicotiana tabacum L.)
TONG Zhi-Jun, JIAO Fang-Chan, FANG Dun-Huang, CHEN Xue-Jun, WU Xing-Fu, ZENG Jian-Min, XIE He, ZHANG Yi-Han, and XIAO Bing-Guang*
Yunnan Academy of Tobacco Agricultural Sciences / Key Laboratory of Tobacco Biotechnological Breeding / National Tobacco Genetic Engineering Research Center, Kunming 650021, China
A set of chromosome segment substitution lines (CSSLs) of tobacco (Nicotiana tabacum L.) were first developed by molecular marker assisted selection (MAS) and successive backcrossing with Y3, the flue-cured tobacco germplasm with comprehensive traits as the recipient parent, and two common tobacco cultivars Beinhart1000-1 and K326 as the donor parents.The cigar tobacco cultivar Beinhart 1000-1 carries a variety of resistance traits including black shank (race 0 and race 1) and brown spot resistance, while the flue-cured tobacco K326 is a commercial cultivar with high quality.In 256 CSSLs, a total of 377 substituted segments derived from donor Beinhart 1000-1 and K326 with genetic background of Y3 distributed on 24 linkage groups.Each CSSL contained only 1–5 substituted segments and the length of substituted segments ranged from 0.05 to 36.88 cM with an average of 7.75 cM.The total length of the overlapped substituted segments was 2922.57 cM, which was 2.61 times of the whole tobacco genome length.And the CSSLs covered length was 1114.32 cM, with a covered ratio of 99.45% in the recurrent tobacco genome.The CSSLs constructed in this study are excellent genetic materials for gene mapping, QTL analysis of complicated traits, and developing varieties by marker assisted selection in Nicotiana tabacum L.
Tobacco (Nicotiana tabacum L.); Chromosome segment substitution lines (CSSLs); SSR; Molecular marker assisted selection (MAS)
10.3724/SP.J.1006.2016.01609
本项目由中国烟草总公司项目[2014TBB01,110201301006(JY-06)]和中国烟草总公司云南省公司项目(2014YN18, 2013YN01)资助。
This study was supported by China National Tobacco Company [2014TBB01, 110201301006(JY-06)] and Yunnan Tobacco Company (2014YN18, 2013YN01).
*通讯作者(Corresponding author): 肖炳光, E-mail: xiaobg@263.net
联系方式: E-mail: tzj861@163.com
稿日期): 2016-03-09; Accepted(接受日期): 2016-07-11; Published online(
日期): 2016-07-28.
URL: http://www.cnki.net/kcms/detail/11.1809.S.20160728.0816.010.html

