过表达TaPK-R1基因增强了小麦对纹枯病的抗性和耐冻性
罗美英荣 玮魏学宁杨 坤徐惠君禤维言张增艳,*广西大学农学院, 广西南宁 530004;中国农业科学院作物科学研究所 / 农作物基因资源与基因改良国家重大科学工程 / 农业部麦类生物学与遗传育种重点实验室, 北京 0008
过表达TaPK-R1基因增强了小麦对纹枯病的抗性和耐冻性
罗美英1,2荣 玮2魏学宁2杨 坤2徐惠君2禤维言1,*张增艳2,*
1广西大学农学院, 广西南宁 530004;2中国农业科学院作物科学研究所 / 农作物基因资源与基因改良国家重大科学工程 / 农业部麦类生物学与遗传育种重点实验室, 北京 100081
小麦纹枯病菌(Rhizoctonia cerealis)和倒春寒是小麦生产中重要的生物和非生物胁迫因子, 本研究目的是利用转基因技术改良小麦的纹枯病抗性和耐冷性。利用构建的转基因载体pAHC25-MYC-TaPK-R1, 通过基因枪介导法,将小麦AGC蛋白激酶基因TaPK-R1导入春小麦品种扬麦20, 获得TaPK-R1过表达的转基因小麦。对T1至T4代植株进行PCR、RT-PCR、qRT-PCR、Western blot分析, 筛选到3个转基因小麦株系, 外源TaPK-R1基因能够在其植物体内遗传和超量转录, 并翻译成蛋白质。利用致病力不同的R.cerealis菌株R0301和WK207, 分别对3个转基因株系T1至T2代和T3至T4代进行纹枯病抗性鉴定, 发现TaPK-R1过量表达提高了转基因小麦的纹枯病抗性, 3个转基因株系各世代的纹枯病平均病级为1.16~2.11, 病情指数为23.20~42.10, 而对照扬麦20的纹枯病病级为2.55~3.60, 病情指数为51.00~72.00。用-9℃低温处理三叶一心期小麦幼苗24 h, 对照扬麦20的存活率为17%, 3个转基因小麦株系的存活率分别为52%、79%和96%。上述结果表明, TaPK-R1过量表达能显著增强小麦对纹枯病的抗性及对冻害的耐受性, 所获得的3个转基因小麦株系可作为潜在的抗源材料。
小麦; 纹枯病; 蛋白激酶; TaPK-R1; 冻害
纹枯病是我国小麦主产区的主要土传病害, 由腐生型真菌禾谷丝核菌(Rhizoctonia cerealis)侵染引起。禾谷丝核菌能感染小麦的茎、叶鞘, 导致小麦生长所必需的营养物质运输受阻, 影响小麦的品质和产量。在2005—2015年间, 我国每年约有667~800万公顷小麦遭受纹枯病的侵害, 年均经济损失在10亿元以上[1-2]。由于目前缺乏抗源材料, 小麦纹枯病抗性改良难以通过常规育种实现。全球气候变暖导致极端气候频繁出现, 近年来早春“倒春寒”时常发生, 对我国小麦生产造成威胁, 不仅减产, 甚至颗粒无收[3], 因而小麦抗寒性也日益受到重视。利用转基因技术, 创制小麦抗病、耐逆新种质, 一方面为小麦品种改良提供抗源储备, 另一方面也是进行小麦抗生物和非生物逆境机制的重要研究材料。
植物对腐生真菌的防御反应过程复杂, 涉及蛋白激酶激活和多种信号传递等事件[4-5]。蛋白激酶A/蛋白激酶G/蛋白激酶C (AGC蛋白激酶), 是植物蛋白激酶的一个亚家族, 均包括C端的丝氨酸/苏氨酸特异性的激酶催化结构域, 同源于依赖cAMP (环腺苷酸)的蛋白激酶A、依赖cGMP (环鸟苷酸)的蛋白激酶G和磷脂依赖的蛋白激酶C[6]。AGC蛋白激酶参与植物的多种生理过程, 如生长素信号转导过程、蓝光信号转导过程、植物的免疫反应等[7-9]。在拟南芥中, AGC蛋白激酶OXI1是H2O2和纤维素酶激活MPK3和MPK6所必需的, 并参与拟南芥对霜霉病菌(Hyaloperonospora parasitica)和丁香假单胞菌(Pseudomonas syringae)的基础抗性反应[10-11]。本课题组研究发现, TaAGC1在小麦中过表达可上调活性氧清除酶及defensin、TaPIE1等防御基因的表达, 进而提高小麦对纹枯病抗性[12]; 小麦ERF基因TaPIE1的过量表达能显著增强转基因小麦对纹枯病的抗性及对冷害的耐受性[13]。最近, Alexandra等[14]将一个葡萄钙依赖蛋白激酶基因VaCPK20转入拟南芥, VaCPK20过量表达显著增强了转基因拟南芥对低温、干旱的耐性。
本课题组曾克隆出一个受纹枯病菌诱导的小麦AGC蛋白激酶基因TaAGC1, 又名为TaPK-R1[12]。为了深入解析TaPK-R1的生物学功能, 本研究构建了该基因过表达的转基因载体pAHC25-MYC-TaPKR1, 并将其转入推广的春性小麦; 通过转基因分子特征分析、纹枯病抗性和抗冷性鉴定, 明确了TaPK-R1基因过表达能显著增强转基因小麦对纹枯病的抗性及对冻害的耐受性, 筛选出既抗纹枯病又耐冻害的转基因小麦新种质3份。
1 材料与方法
1.1 材料
春小麦品种扬麦20由江苏省农业科学院扬州里下河地区农业科学研究所张伯桥研究员惠赠。禾谷丝核菌R0301是江苏地区小麦纹枯病的主要致病菌株, 由江苏省农业科学院陈怀谷研究员惠赠; 禾谷丝核菌WK207是采自山东泰安的小麦纹枯病强致病菌株, 由山东农业大学植物保护学院于金凤教授惠赠。
1.2 转基因载体pAHC25-MYC-TaPK-R1的构建
利用PCR扩增法, 在小麦AGC蛋白激酶基因TaPK-R1 (GenBank登录号为KJ686386)的ORF完整序列[12]的上、下游分别引入限制酶Spe I和Sac I酶切位点, 用这2个限制酶酶切后, 再与pAHC25-MYC载体[12,15]骨架连接, 将TaPK-R1基因的ORF取代载体pAHC25-MYC中的GUS基因[15], 构建成TaPK-R1过量表达的转化载体pAHC25-MYC-TaPK-R1 (图1)。通过测序分析确定构建的基因表达载体的正确性。在该载体中, TaPK-R1基因的转录受玉米Ubiquitin启动子驱动, 终止由根癌农杆菌胭脂氨酸合成酶基因的3′非转录区(TNOS)控制。
1.3 转基因小麦的获得
按照徐惠君等[16]建立的基因枪轰击小麦幼胚的方法, 采用包裹pAHC25-MYC-TaPK-R1质粒的金粉轰击扬麦20幼胚愈伤组织, 并通过筛选、分化、再生、移栽成苗等步骤, 获得再生小麦植株。从转TaPK-R1基因PCR检测呈阳性的转基因小麦T0代植株上收获T1代种子, 单株播种T1代转基因植株, 依此类推。
1.4 转基因植株中外源基因的分子特征分析
1.4.1 PCR检测 在小麦二叶一心期, 取每株成活再生植株的1个叶片, 采用CTAB法[17]提取基因组DNA。以该基因组DNA为模板, 利用嵌合引物进行目的转基因的PCR鉴定, 上游引物为TaPK-R1基因开放阅读框(ORF)特异的一段序列(TaPK-R1-1584F: 5′-ATGAAGTTGCCGGGATTGC-3′), 下游引物载体TNOS特异的一段序列(TNOS-3214L: 5′-AAAACCC ATCTCATAAATAACG-3′)。以转基因载体pAHC25-MYC-TaPK-R1质粒DNA为阳性对照, 以未转基因受体(扬麦20)的基因组DNA为阴性对照, 预期扩增产物片段为386 bp。反应体系含2×Taq MasterMix(康为世纪) 10 µL, 上、下游引物 (10 µmol L-1)各1 µL, 模板DNA 100 ng, 补ddH2O至20 µL。扩增程序为94℃ 8 min; 94℃ 30 s, 57℃ 30 s, 72℃ 30 s, 33个循环; 72℃, 8 min, 16℃保存。扩增产物经1.2%琼脂糖凝胶电泳分离, ethidium bromide染色。
1.4.2 低温诱导小麦中TaPK-R1转录分析 将受体扬麦20和转基因小麦于-9℃下低温诱导24 h, 从每个株系取5个植株的叶片, 混合后用TRIzol试剂(Invitrogen)提取叶片总RNA, 按cDNA合成试剂盒FastQuant RT kit (含DNA酶, TIANGEN)说明书合成第1链cDNA, 然后进行RT-PCR和qRT-PCR分析。引物为TaPK-R1-QF (5′-ATGAAGTTGCCGGGATTG C-3′)和TaPK-R1-QR (5′-CGGCGAACCAAACAGG-3′), 内参基因为TaActin (TaActin-F: 5′-CACTGGAA TGGTCAAGGCTG-3′; TaActin-R: 5′-CTCCATGTCA TCCCAGTTG-3′)。
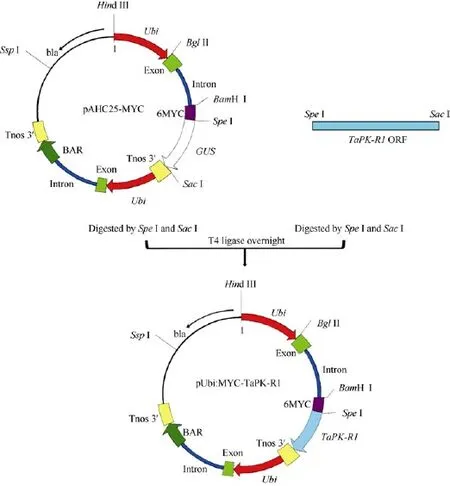
图1 pAHC25-MYC-TaPK-R1表达载体的构建Fig.1 Structure of the plant expression vector pAHC25-MYC-TaPK-R1
RT-PCR扩增体系含2×Taq MasterMix (康为世纪) 12.5 µL, 上、下游引物(10 µmol L-1)各1 µL, 均一化后模板cDNA 1 µL, 补ddH2O至25 µL。扩增程序为94℃ 8 min; 94℃ 30 s, 57℃ 30 s, 72℃ 30 s, 27个循环; 72℃ 8 min, 16℃保存。
在ABI PRISMR7500实时荧光定量PCR仪(ABI,美国)上进行实时qRT-PCR分析, 反应体系25 µL, 按SuperRealPreMix Plus (SYBRGreen, TIANGEN)反应体系, 扩增程序: 95℃预变性15 min; 95℃变性10 s, 57℃退火20 s, 72℃延伸32 s, 40个循环。对每个样品进行3次独立的重复实验, 以受体扬麦20为对照, 用2-ΔΔCT方法[18]计算低温处理转基因小麦中TaPK-R1基因的相对表达量。用Microsoft Excel软件进行t测验(两尾测验), 将P < 0.01视为具有显著性差异。
1.5 转基因植株蛋白质的提取及Western blot分析
选取耐冷的 T4代转基因小麦株系中 PCR阳性的植株, 提取苗期叶片总蛋白, 在液氮中充分研磨小麦叶片, 加入蛋白质提取液混匀。该蛋白提取液含62.5 mmol L-1Tris-HCl (pH 7.4)、10%甘油、0.1% SDS、2 mmol L–1Na2EDTA、1 mmol L–1PMSF (phenylmethanesulfonyl fluoride)和5% β-巯基乙醇。将混合液置冰上10 min, 然后于4℃下13 400 ×g离心 20 min, 上清液即为总蛋白质。将总蛋白进行SDS-PAGE电泳, 再用湿转法转到PVDF膜; 利用丽春红(ponceaux)对转膜后的PVDF膜染色, 以检查转膜是否成功, 再使用 ddH2O将染料洗净; 在封闭液中与稀释3000倍的anti-c-MYC抗体(一抗, 北京全式金生物技术有限公司) 4℃孵育12 h, 用TBST将杂交膜清洗干净后, 与稀释3000倍的Goat Anti-Mouse IgG (H+L)抗体(二抗, 北京全式金生物技术有限公司) 24~26℃孵育 1 h, 化学发光后进行曝光显影, 检测c-MYC-TaPK-R1融合蛋白是否在过表达转基因小麦株系中翻译表达。使用EasySee Western Marker (北京全式金生物技术有限公司)标记显影蛋白分子量。
1.6 转TaPK-R1基因株系的表型鉴定
1.6.1 转基因株系对寒冷逆境的耐受性 采用常规花盆土培法, 种植转基因株系及其受体扬麦 20(对照)各36株, 生长条件为22℃光照14 h, 12℃黑暗10 h。于二叶一心期, 每株取 1个叶片提取基因组DNA, 并以此为模板, 利用 TaPK-R1基因嵌合引物进行 PCR鉴定, 将 PCR检测阳性的转基因株系R1-4、R1-8、R1-9的植株(分别为 25、24、24株)及对照植株于三叶一心期, 移至4℃锻炼12 h, 再移至-6℃锻炼12 h, 最后移至-9℃冰箱中, 每6 h作为一个处理。-9℃处理 24 h, 将过表达转基因小麦株系置正常生长环境中, 观察并记录低温处理后恢复生长的情况, 统计存活率。用 Microsoft Excel对转基因株系和对照进行 t-测验(两尾测验), 在 P<0.01概率水平判断差异显著性。
1.6.2 转基因株系对纹枯病抗性鉴定 采用常规花盆土培法种植, 生长条件为 22℃光照14 h, 12℃黑暗10 h。根据PCR检测结果, 阳性植株用于病级鉴定, 其中 T1代阳性植株共 32株, R1-4、R1-8和R1-9株系分别有9、11和12株; T2代阳性植株共50 株, 3个转基因株系分别有15、18和17株; T3代阳性植株共66株, 上述3个株系依次为21、24和21 株; T4代阳性植株共 73株, 3个转基因株系分别为25、24和24株。受体对照植株数依次为15、20、30和30株。在灭菌的麦粒上培养纹枯病菌, 待麦粒表面长满菌丝后接种。小麦分蘖盛期, 用消毒镊子夹取长满菌丝的麦粒, 放入麦苗根基部, 每株放4~5 粒, 保湿3~5 d[19-20]; 成熟期调查纹枯病抗性, 按照王裕中等[21]介绍的方法和我国农业行业标准NY/T1443.5-2007《小麦抗病虫性评价技术规范》划分病级(严重度), 其中0级为无症状; 1级为叶鞘变褐, 有病斑, 但病菌未侵入茎秆; 2级为病菌侵入茎秆, 病斑环绕茎秆不超过 1/2; 3级为病斑环绕茎秆的1/2~3/4; 4级为病斑环绕茎秆的3/4以上; 5级为出现枯、白穗或整株死亡。按上述标准及蔡士宾等[22]报道的方法计算病情指数。
2 结果与分析
2.1 转TaPK-R1基因小麦的获得及PCR检测
用包裹pAHC25-MYC-TaPK-R1质粒的金粉子弹, 轰击扬麦20幼胚愈伤组织, 共轰击2500个幼胚愈伤组织, 经筛选、分化, 获得80株再生植株, 利用转基因特异性引物进行PCR分析, 检测出T0代转基因小麦PCR阳性植株11株, 转化率为0.44%。
提取转基因小麦T0~T4代植株叶片基因组DNA,对转TaPK-R1基因小麦T0~T4代植株进行PCR检测表明, 11个转基因小麦株系的T0~T4代植株中均能检测到外源TaPK-R1 基因, 说明导入的TaPK-R1基因在这11个转基因小麦株系中能遗传。
从中挑选出对纹枯病抗性较好、来自不同基因枪幼胚的三个转TaPK-R1基因小麦株系(R1-4、R1-8 和R1-9)(图2), 进行转录水平、蛋白表达水平、抗病性与对低温的耐受性等研究。

图2 转TaPK-R1基因小麦的T0至T4代PCR检测图谱Fig.2 PCR analysis of TaPK-R1 transgenic wheat plants in the T0to T4generations
2.2 转基因小麦株系中TaPK-R1的转录分析
以抗病、耐冻害的转 TaPK-R1基因小麦株系(R1-4、R1-8和R1-9) T4代植株及未转基因小麦扬麦20 (受体)叶片RNA为试材, RT-PCR和qRT-PCR分析表明, 这3个转基因小麦株系中TaPK-R1的转录水平均高于未转基因小麦扬麦20 (图3-A), 分别是未转基因小麦扬麦20的6.0、5.5和11.6倍(图3-B)。上述结果说明这3个抗病、耐冻害的转基因小麦株系中TaPK-R1基因超量表达了。

图3 转TaPK-R1基因小麦中TaPK-R1基因转录的RT-RCR(A) 和qRT-PCR(B)分析Fig.3 RT-RCR (A) and qRT-PCR (B) assay on TaPK-R1 transcriptional level in the transgenic lines and its wild-type
2.3 转基因植株的Western blot分析
在pAHC25-MYC-TaPK-R1载体中, TaPK-R1基因上游与6倍c-MYC标签序列相融合, 便于对转基因植株进行Western blot检测分析。提取转基因小麦株系R1-4、R1-8和R1-9阳性植株的叶片蛋白, 与anti-c-MYC抗体进行Western blot分析, 以在蛋白水平检测外源TaPK-R1基因在3个转基因小麦株系中的表达情况。Western blot分析结果表明, 未转基因小麦扬麦20的总蛋白不能与anti-c-MYC抗体产生杂交条带, 而上述3个转TaPK-R1基因小麦株系均产生与anti-c-MYC抗体杂交的条带(图4), 说明c-MYCTaPK-R1基因能够在这3个转基因小麦株系中高水平翻译表达。
2.4 转基因小麦的耐冻性鉴定
种植转基因小麦株系R1-4、R1-8、R1-9及未转基因小麦扬麦20 (对照)各36株, 经TaPK-R1基因嵌合引物PCR扩增检测, 3个株系的阳性株分别为25、24、24株。对阳性株三叶一心期幼苗于-9℃分别处理6、12、18和24 h, 然后恢复生长3 d, 统计存活率。-9℃处理18 h, 3个过表达TaPK-R1转基因小麦株系的存活率为56%、92%和96%, 对照存活率为42%;处理24 h, 3个转基因小麦株系仍有52%、79%、96%的存活率, 而对照的存活率仅为17% (图5), 表明过量表达TaPK-R1基因提高了转基因小麦对寒冷环境的耐受性。

图4 转TaPK-R1基因小麦中c-MYC-TaPK-R1蛋白的Western blot分析Fig.4 Western blot analysis of c-MYC-TaPK-R1 protein in transgenic wheat plants
2.6 转基因小麦的纹枯病抗性鉴定

图5 TaPK-R1基因过表达株系植株对寒冷(-9°C)逆境的适应性Fig.5 Tolerant phenotypes of TaPK-R1 transgenic lines under freezing (-9°C) treatment
用来源不同、致病力不同的禾谷丝核菌强致病株型R0301和WK207, 对转TaPK-R1基因小麦T1和T2代(R0301)、T3和T4代(WK207)植株分别进行纹枯病抗性鉴定。与未转基因小麦扬麦20相比, 3个转TaPK-R1基因株系T1至T4代阳性植株的病级与病情指数均显著降低(表1), 如T1代转基因小麦的平均病级为1.80、2.00和2.11, 病情指数为36.00、40.00和42.20, 而未转基因扬麦20的平均病级为3.60, 病情指数为72.00; T4代转基因小麦的平均病级为1.41、1.35、1.30, 病情指数为28.20、27.00和26.00, 而未转基因小麦受体扬麦20的平均病级为2.55, 病情指数为51.00。

表1 转TaPK-R1基因小麦及受体的纹枯病抗性鉴定Table1 Responses of TaPK-R1 transgenic and recipient wheat lines to R.cerealis
3 讨论
近年来, 纹枯病已发展为我国小麦生产的主要病害。小麦对纹枯病抗性由多个数量基因控制[2,23],加之在小麦育种和生产过程中纹枯病抗性鉴定困难,致使常规育种进展缓慢。因此, 发掘和克隆抗纹枯病重要基因、开展高效的分子育种, 非常重要。综合应用比较转录组学、生物信息学与功能解析等方法, 本课题组发现几个小麦基因参与寄主抗纹枯病反应[12-13,24-26], 其中包括小麦AGC蛋白激酶基因TaAGC1 (TaPK-R1)。极端低温是影响植物生长、发育的环境胁迫因子之一, 导致植物产量降低、品质下降。植物在长期的进化过程中逐渐建立了适应和抗性机制, 通过一系列基因和酶的表达与生理生化变化来适应低温等逆境[27-29]。Xiang等[28]研究表明, 在OsCIPK03过量表达的转基因水稻中, 脯氨酸合成酶基因表达量和脯氨酸含量显著提高, 从而增强了转基因水稻对冷、旱、盐、碱性胁迫的耐受性。Zhu 等[13]研究表明, 小麦ERF基因TaPIE1的过量表达,能显著提高转TaPIE1基因小麦中渗透调节物质含量、活性氧清除酶、防卫与胁迫相关基因表达量, 从而显著提高转基因小麦对纹枯病的抗性及对冷害的耐受性。TaAGC1 (TaPK-R1)正向调控 TaPIE1基因的表达[12], 但TaPK-R1基因能否提高小麦对寒冷的耐受性未见报道。
为进一步研究TaPK-R1基因的生物学功能, 我们创制了TaPK-R1过量表达的转基因小麦, 其中3个转基因小麦株系(R1-4、R1-8和R1-9), 对纹枯病抗性较好, 且来源于不同批次基因枪轰击的小麦幼胚,可能是3个独立株系, 今后有必要用Southern杂交结果进一步证实。对上述3个转基因小麦株系T0至T4代连续PCR检测和转录分析表明, 各株系中转入的TaPK-R1基因能稳定遗传、超量表达; Western杂交分析结果表明, 在上述3个转TaPK-R1基因小麦株系中,转入的TaPK-R1基因可以翻译成表达蛋白。此外, 本研究采用南方和北方致病力不同的2个纹枯病菌(R0301和WK207)进行抗病性鉴定, 对转基因小麦T1至T4代接种鉴定, 结果显示转TaPK-R1基因小麦对不同纹枯病菌的病级(严重度)和病情指数均显著降低, 说明TaPK-R1过量表达显著提高了转基因小麦对来源不同、致病力不同的禾谷丝核菌的抗性, 创制的这3个转基因小麦种质对纹枯病具有广谱抗性,具有一定的应用价值。对T4代转基因小麦进行–9℃低温处理, 结果表明, 过量表达TaPK-R1基因显著提高了转基因小麦对寒冷环境的耐受性。总之, TaPK-R1在小麦防御纹枯病和低温胁迫的响应中具有重要正向调控作用。
另外, –9℃处理24 h测定结果表明, 在未转基因扬麦20叶片组织中的电导率显著高于转TaPK-R1基因小麦株系; 而过量表达的转TaPK-R1基因小麦株系(R1-4、R1-8和R1-9)中游离脯氨酸含量显著提高, 3个株系中分别为291.43、324.76和274.83 μg g-1, 而未转基因扬麦20的游离脯氨酸含量仅为71.19 μg g-1。说明, TaPK-R1基因通过提高植物游离脯氨酸积累量和调控其他生理生化反应来维持细胞质膜的完整性, 从而增强了小麦对低温逆境的耐受性。
4 结论
将TaPK-R1转入春小麦品种扬麦20; 经过分子特征分析与逆境胁迫筛选, 获得了兼抗纹枯病与冻害的转 TaPK-R1基因小麦新材料 3份, 说明TaPK-R1在小麦防御纹枯病和低温胁迫反应中可能具有一定的调控作用。
[1] Chen L, Zhang Z Y, Liang H X, Liu H X, Du L P, Xu H J, Xin Z Y.Overexpression of TiERF1 enhances resistance to sharp eyespot in transgenic wheat.J Exp Bot, 2008, 59: 4195–4204
[2] Chen J, Li G H, Du Z Y, Quan W, Zhang H Y, Che M Z, Wang Z, Zhang Z J.Mapping of QTL conferring resistance to sharp eyespot (Rhizoctonia cerealis) in bread wheat at the adult plant growth stage.Theor Appl Genet, 2013, 126: 2865–2878
[3] 梁宜策, 薛理靠, 张军峰, 王兴志.小麦冻害调查初报.陕西农业科学, 2003, (5): 38–41
Liang Y C, Xue L K, Zhang J F, Wang X Z.The investigation report of freezing injury to wheat.Shaanxi J Agric Sci, 2003, (5): 38–41 (in Chinese with English abstract)
[4] Łaźniewska J, Macioszek V K, Lawrence C B, Kononowicz A K.Fight to death: Arabidopsis thaliana defense response to fungal necrotrophic pathogens.Acta Physiol Plant, 2010, 32: 1–10
[5] Rudd J J, Keon J, Hammond-Kosack K E.The wheat mitogen-activated protein kinases TaMPK3 and TaMPK6 are differentially regulated at multiple levels during compatible disease interactions with Mycosphaerella graminicola.Plant Physiol, 2008, 147: 802–815
[6] Pearce L R, Komander D, Alessi D R.The nuts and bolts of AGC protein kinases.Nat Rev Mol Cell Biol, 2010, 11: 9–22
[7] Ding Z, Galvan-Ampudia C S, Demarsy E, Langowski L, Kleine-Vehn J, Fan Y, Morita M T, Tasaka M, Fankhauser C, Offringa R, Friml J.Light-mediated polarization of the PIN3 auxin transporter for the phototropic response in Arabidopsis.Nat Cell BIol, 2011, 13: 447–452
[8] Robert H S, Offringa R.Regulation of auxin transport polarity by AGC kinases.Curr Opin Plant Biol, 2008, 11: 495–502
[9] Garcia A V, Al-Yousif M, Hirt H.Role of AGC kinases in plant growth and stress responses.Cellul Mol Life Sci, 2012, 69: 3259–3267
[10] Rentel M C, Lecourieux D, Ouaked F, Usher S L, Petersen L, Okamoto H, Knight H, Peck S C, Grierson C S, Hirt H, Knight M R.OXI1 kinase is necessary for oxidative burst-mediated signalling in Arabidopsis.Nature, 2004, 427: 858–861
[11] Petersen L N, Ingle R A, Knight M R, Denby K J.OXI1 protein kinase is required for plant immunity against Pseudomonas syringae in Arabidopsis.J Exp Bot, 2009, 60: 3727–3735
[12] Zhu X L, Kun Y, Wei X N, Zhang Q F, Wei R, Du L P, Ye X G, Qi L, Zhang Z Y.The wheat AGC kinase TaAGC1 is a positive contributor to host resistance to the necrotrophic pathogen Rhizoctonia cerealis.J Exp Bot, 2015, 66: 6591–6603
[13] Zhu X L, Qi L, Liu X, Cai S B, Xu H J, Huang R F, Li J R, Wei X N, Zhang Z Y.The wheat ERF transcription factor TaPIE1 mediates host responses to both the necrotrophic pathogen Rhizoctonia cerealis and freezing stresses.Plant Physiol, 2014, 164: 1499–1514
[14] Alexandra S D, Konstantin V K, Valeriya S K, Olga A A.VaCPK20, a calcium-dependent protein kinase gene of wild grape vine Vitis amurensis Rupr, mediates cold and drought stress tolerance.J Plant Physiol, 2015, 185: 1–12
[15] Christensen A H, Quail P H.Ubiquitin promoter-based vectors for high-level expression of selectable and/or screenable marker genes in monocotyledonous plants.Transgenic Res, 1996, 5: 213–218
[16] 徐惠君, 庞俊兰, 叶兴国, 杜丽璞, 李连城, 辛志勇, 马有志,陈剑平, 陈炯, 程顺和, 吴宏亚.基因枪介导法向小麦导入黄花叶病毒复制酶基因的研究.作物学报, 2001, 27: 688–693
Xu H J, Pang J L, Ye X G, Du L P, Li L C, Xin Z Y, Ma Y Z, Chen J P, Chen J, Cheng S H, Wu H Y.Study on the gene transferring of Nib8 into wheat for its resistance to the Yellow mosaic virus by bombardment.Acta Agron Sin, 2001, 27: 688–694 (in Chinese with English abstract)
[17] Saghai-Maroof M A, Soliman K M, Jorgensen R A, Allard R W.Ribosomal DNA spacer-length polymorphisms in barley: Mendelian inheritance, chromosomal location, and population dynamics.Proc Natl Acad Sci USA, 1984, 81: 8014–8019
[18] Livak K J, Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2–ΔΔCTmethod.Methods, 2001, 25: 402–408
[19] 申芳嫡, 洪彦涛, 杜丽璞, 徐惠君, 马翎健, 张增艳.转细胞凋亡抑制基因OpIAP和p35增强小麦对纹枯病的抗性.作物学报, 2015, 41: 1490–1499
Shen F D, Hong Y T, Du L P, Xu H J, Ma L J, Zhang Z Y.Expression of Apoptosis Inhibitor genes OpIAP and p35 enhances resistance to Rhizoctonia cerealis in transgenic wheat.Acta Agron Sin, 2015, 41: 1490–1499 (in Chinese with English abstract)
[20] 魏学宁, 任丽娟, 张淼, 张巧凤, 刘欣, 周淼平, 马鸿翔, 吴继中, 马翎健, 张增艳.人工合成抗纹枯病小麦新种植的鉴定.植物遗传资源学报, 2015, 16: 373–378
Wei X N, Ren L J, Zhang M, Zhang Q F, Liu X, Zhou M P, Ma H X, Wu J Z, Ma L J, Zhang Z Y.Identification of synthetic wheat accession with resistance to wheat sharp eyespot.J Plant Genet Resour, 2015, 16: 373–378 (in Chinese with English abstract)
[21] 王裕中, 吴志凤, 史建荣, 陈怀谷, 邵伯坤.小麦纹枯病流行规律研究.江苏农业科学, 1993, (麦类纹枯病专辑): 48–53
Wang Y Z, Wu Z F, Shi J R, Chen H G, Shao B K.Epidemic law research of wheat sharp eyespot.Jiangsu Agric Sci, 1993, (special issue of wheat sharp eyesport): 48–53 (in Chinese with English abstract)
[22] 蔡士宾, 任丽娟, 颜伟, 吴纪中, 陈怀谷, 吴小有, 张仙义.小麦抗纹枯病种质创新及QTL定位的初步研究.中国农业科学, 2006, 39: 928–934
Cai S B, Ren L J, Yan W, Wu J Z, Chen H G, Wu X Y, Zhang X Y.Germplasm development and mapping of resistance to sharp eyespot (Rhizoctonia cerealis) in wheat.Sci Agric Sin, 2006, 39: 928–934 (in Chinese with English abstract)
[23] 刘颖, 张巧凤, 付必胜, 蔡士宾, 蒋彦婕, 张志良, 邓渊钰, 吴纪中, 戴廷波.小麦纹枯病抗源的遗传多样性及抗性基因位点SSR标记分析.作物学报, 2015, 41: 1671–1681
Liu Y, Zhang Q F, Fu B S, Cai S B, Jiang Y J, Zhang Z L, Deng Y Y, Wu J Z, Dai T B.Genetic diversity of wheat germplasm resistant to sharp eyespot and genotyping of resistance loci using SSR markers.Acta Agron Sin, 2015, 41: 1671–1681 (in Chinese with English abstract)
[24] Liu B Y, Lu Y, Xin Z Y, Zhang Z Y.Identification and antifungal assay of a wheat b-1,3-glucanase.Biotechnol Lett, 2009, 31: 1005–1010
[25] 周淼平, 周小青, 张增艳, 董娜, 马鸿翔, 姚金保.TaPIMP1过量表达提高转基因小麦纹枯病抗性的研究.核农学报, 2011, 25: 421–426
Zhou M P, Zhou X Q, Zhang Z Y, Dong N, Ma H X, Yao J B.Over-expression of TaPIMP1 enhanced resistance to wheat sharp eyespot in transgenic wheat.J Nucl Agric Sci, 2011, 25: 421–426 (in Chinese with English abstract)
[26] Wei X N, Shen F D, Hong Y T, Rong W, Du L P, Liu X, Xu H J, Ma L J, Zhang Z Y.The wheat calcium-dependent protein kinase TaCPK7-D positively regulates host resistance to sharp eyespot disease.Mol Plant Pathogen, 2016, online.doi: 10.1111/ mpp12360
[27] Liu S T, Liu S W, Wang M, Wei T T, Meng C, Wang M, Xia G M.A wheat similar to RCD-ONE gene enhances seedling growth and abiotic stress resistance by modulating redox homeostasis and maintaining genomic integrity.Plant Cell, 2014, 26: 164–180
[28] Xiang Y, Huang Y, Xiong L.Characterization of stress-responsive CIPK genes in rice for stress tolerance improvement.Plant Physiol, 2007, 44: 1416–1428
[29] Cai G, Wang G, Wang L, Pan J, Liu Y, Li D.ZmMKK1, a novel group A mitogen-activated protein kinase gene in maize, conferred chilling stress tolerance and was involved in pathogen defense in transgenic tobacco.Plant Sci, 2014, 214: 57–73
TaPK-R1 Overexpressing Transgenic Wheat Lines Enhance Resistance to Sharp Eyespot and Freezing Stress
LUO Mei-Ying1,2, RONG Wei2, WEI Xue-Ning2, YANG Kun2, XU Hui-Jun2, XUAN Wei-Yan1,*, and ZHANG Zeng-Yan2,*
1Agricultural College of Guangxi University, Nanning 530004, China;2The National Key Facility for Crop Gene Resources and Genetic Improvement / Key Laboratory of Biology and Genetic Improvement of Triticeae Crops, Ministry of Agriculture / Institute of Crop Science, Chinese Academy of Agricultural Sciences, Beijing 100081, China
Sharp eyespot caused by Rhizoctonia cerealis is a soil-borne disease and freezing stress is one of the major abiotic stresses in wheat production.The object of this study was to improve wheat resistance to sharp eyespot and freezing using transgenic technique.The transformation vector pAHC25-MYC-TaPK-R1 expressing the wheat AGC protein kinase gene TaPK-R1 was constructed and transformed into the spring wheat Chinese cultivar Yangmai 20 through particle bombardment.The transformed T1to T4plants were subjected to PCR, RT-PCR, qRT-PCR, and Western blot analyses.Three transgenic wheat lines were generated and screened, in which the introduced TaPK-R1 transgene was inherited and expressed in higher level.After inoculation with R.cerealis virulent-isolate R0301 or WK207, these three TaPK-R1-overexpressing transgenic wheat lines displayed significant improved resistance to sharp eyespot.The infection types of these 3 transgenic lines in T1to T4generations were 1.16–2.11, and their disease indices were 23.20–42.10.At the same time, the infection types and disease indexes of the non-transformed wheat Yangmai 20 were 2.55–3.60 and 51.00–72.00, respectively.The three-leaf wheat seedlings were treated with-9°C for 24 hours.Freezing tolerances of the three transgenic lines were dramatically improved, whose survival rates were 52%, 79%, and 96%, respectively, and significantly higher (P < 0.01) than that of the non-transformed Yangmai 20 (survival rate of 17%).Our results indicate that resistance/tolerance to sharp eyespot and freezing stress could be significantly enhanced in TaPK-R1overexpressing transgenic wheat.The three transgenic lines may serve as potential resource in wheat breeding aiming at resistance improvement to sharp eyespot and freezing stress.
Wheat; Sharp eyespot; Protein kinase; TaPK-R1; Freezing; Enhanced resistance
10.3724/SP.J.1006.2016.01601
本研究由国家自然科学基金项目(31271799)资助。
This study was supported by the National Natural Science Foundation of China (31271799).
*通讯作者(Corresponding authors): 禤维言: E-mail: xuanweiyan_1@163.com; 张增艳, E-mail: zhangzengyan@caas.cn
联系方式: E-mail: luo_meiying@yeah.net, Tel: 13687719647
稿日期): 2016-03-09; Accepted(接受日期): 2016-07-11; Published online(
日期): 2016-08-11.
URL: http://www.cnki.net/kcms/detail/11.1809.S.20160811.0820.008.html

