心脏营养素-1促进脐带间充质干细胞诱导分化为心肌样细胞时心肌α-actin、β-MHC、GATA4和Nkx2-5基因的表达
徐敏,宁险峰,锡洪敏,高宏,李自普
心脏营养素-1促进脐带间充质干细胞诱导分化为心肌样细胞时心肌α-actin、β-MHC、GATA4和Nkx2-5基因的表达
徐敏,宁险峰,锡洪敏,高宏,李自普
目的 探讨心脏营养素-1(CT-1)促进经 5-氮杂胞苷(5-aza)诱导的脐带间充质干细胞(UCMSCs)分化为心肌样细胞时心肌 α-actin、β-MHC、GATA4、Nkx2-5 基因的表达。
方法 分离、纯化 UCMSCs,第 4 代 UCMSCs 分别以普通培养基(A 组)和含 0.1 nmol/L CT-1 培养基(B 组)培养;经 5-aza 诱导的第 4 代 UCMSCs 分别以普通培养基(C 组)、含不同浓度 CT-1 培养基 D 组(D1组0.01 nmol/L、D2组 0.1 nmol/L、D3组 1.0 nmol/L)培养。应用荧光定量 PCR 检测各基因的表达。
结果 UCMSCs 培养 2 ~ 3 d 后细胞贴壁,逐渐由圆形变为长纤维样;经 5-aza 诱导分化后可见心肌样细胞,但未见自发性搏动。RT-PCR 检测显示 B 组和 C 组 α-actin、β-MHC、GATA4 和 Nkx2-5基因的表达较 A 组均无明显增加;α-actin、GATA4 和 Nkx2-5基因在 D 组较 A 组表达明显增加,其中 α-actin 基因在 D2组表达最高,GATA4基因在 D1组表达最高,Nkx2-5 基因在 D3组表达最高,而 β-MHC 基因在 D 组表达未见增加。
结论 CT-1 可明显促进 5-aza 诱导的 UCMSCs 分化为心肌样细胞,且心肌样细胞 α-actin、GATA4、Nkx2-5 的基因表达与 CT-1 的浓度有关。
间质细胞; 心肌细胞,心脏; 心脏营养素-1; 阿扎胞苷
www.cmbp.net.cn 中国医药生物技术, 2016, 11(5):420-425
间充质干细胞(mesenchymal stem cells,MSCs)分化成心肌样细胞的潜能已在动物模型和体外实验中得到证实[1-3],国内已有使用骨髓干细胞成功移植治疗扩张型心肌病的报道,发现可明显改善患者心功能及心肌重塑[4]。国外亦有报道,在动物实验模型中自体移植骨髓干细胞可明显改善左室功能[5]。Nartprayut 等[6]比较了骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMMSCs)与脐带间充质干细胞(umbilical cord mesenchymal stem cells,UCMSCs)分化为心肌样细胞的潜能,发现所有心肌特异性表面标记在 UCMSCs 组表达均明显增加,而仅有部分心肌特异性表面标记在BMMSCs 组表达增加,提示 UCMSCs 分化为心肌样细胞的潜能较 BMMSCs 强。因此,能否应用诱导后的 UCMSCs 修复受损心肌成为目前国内外干细胞领域研究的热点问题之一[6-8]。目前的研究显示诱导后的 UCMSCs 转化为心肌样细胞的效率较低[9],如何高效促进 UCMSCs 分化为心肌样细胞成为当前研究的重点和难点。
心脏营养素-1(cardiotrophin-1,CT-1),属于白介素-6 家族新成员,在心脏发育中有重要的作用,尤其对心肌肥大的诱导作用最强[10];在缺血性心脏病患者血清中 CT-1 升高,在体外 CT-1 可促进胚胎干细胞向心肌细胞分化[11],引起心肌细胞增生肥大和肌小节形成,诱导体外培养心肌细胞肥厚[12]。国内已有 CT-1 促进大鼠 BMMSCs 诱导分化为心肌样细胞的研究[11],但 CT-1 是否可促进UCMSCs 分化为心肌细胞尚不清楚。我们的前期研究发现 UCMSCs 可自发分化为少量心肌样细胞,CT-1 可明显促进 5-氮胞苷(5-azacytidine,5-aza)诱导 UCMSCs 分化为心肌样细胞,且以浓度0.01 mmol/L 时促进作用最明显,但具体机制不清。本实验通过实时定量 PCR 检测 CT-1 促进 5-aza诱导 UCMSCs 分化为心肌样细胞时心肌特异性基因 α-肌动蛋白(α-actin)、β-肌凝蛋白重链(β-myosin heavy chain,β-MHC)、GATA4 和 Nkx2-5的表达情况,旨在探讨 CT-1 促进增加 5-aza 诱导UCMSCs 分化为心肌样细胞的分子机制。
1 材料与方法
1.1 材料
1.1.1 试剂和材料 无污染的健康足月儿脐带来自青岛大学附属医院产科,均签署知情同意书。5-氮胞苷购自美国 Sigma 公司;CT-1 购自美国Invitrogen 公司;10% 胎牛血清、1% 青链霉素的DMEM 培养基购自美国 Hyclone 公司。
1.1.2 仪器 梯度 PCR 仪为德国 Eppendorf 公司产品;逆转录试剂盒(PrimeScript RT-PCR Kit)和荧光定量 PCR 扩增试剂盒(SYBR Premix EX TAqTMII)均为宝生物工程大连有限公司产品;Light Cycler RT-PCR 扩增仪 Rotor-Gene3000 为上海天呈科技有限公司产品;倒置相差显微镜为日本尼康公司产品;超微量分光光度计 K5500 为北京凯奥公司产品。
1.2 方法
1.2.1 UCMSCs 分离与培养 取无污染的健康足月儿脐带用无菌磷酸盐缓冲液(PBS)反复冲洗,去除残留血液,无菌条件下用剪刀将脐带组织剪成直径 1 ~ 2 mm 的组织块,放入离心管中,经 0.1%胶原酶 II 和 0.25% 胰蛋白酶于 37 ℃消化后以1200 r/min 过滤离心 10 min,收集离心沉淀细胞。将收集到的细胞按 106个/cm2接种于包被好的T25 培养瓶中,加入含 10% 胎牛血清和 1% 青链霉素的 DMEM 培养基,置于含有 5% CO2、37 ℃饱和湿度培养箱中培养,待细胞 80% 融合后用已消毒的 PBS 溶液冲洗瓶底,加入 0.125% 胰蛋白酶溶液(含 l% 依地酸钠钙)消化,当细胞从培养瓶底脱落下来后,用血清终止胰蛋白酶作用;将消化下来的细胞制成单细胞悬液,1200 r/min 离心5 min 后将收集的细胞重悬于 DMEM 培养基中,按 1∶3 比例传代接种至 2 个新的包被好的 T25培养瓶中,置于含有 5% CO2、37 ℃ 饱和湿度培养箱中培养。每日于倒置相差显微镜下观察细胞生长,记录并拍照。
1.2.2 试验分组和诱导分化 取第 4 代UCMSCs 分 6 组:A 组(培养基 + UCMSCs),B组(培养基 + UCMSCs + 0.1 nmol/L CT-1),C 组(培养基 + UCMSCs + 10 μmol/L 5-aza),D1组(培养基 + UCMSCs + 10 μmol/L 5-aza+ 0.01 nmol/L CT-1),D2组(培养基 + UCMSCs + 10 μmol/L 5-aza + 0.1 nmol/L CT-1),D3组(培养基 + UCMSCs + 10 μmol/L 5-aza + 1.0 nmol/L CT-1)。2 μg/支 CT-1 用 10% 胎牛血清分别稀释到不同浓度。
诱导分化过程如下:第 4 代 UCMSCs 按照1 × 104个/cm2接种 6 孔培养板,加入 DMEM 培养基和 10% 胎牛血清(FBS)培养,待细胞融合到 60% ~ 70%,弃去培养基,用 L-DMEM 洗涤细胞 2 次后根据实验分组分别加入不同浓度的诱导剂和 CT-1,孵育 24 h 后去除培养基,用 L-DMEM洗涤细胞 2 次后,改用 10% FBS 普通培养基培养,每 3 天做一次半量换液,待细胞融合 80% 左右后,按照 1 × 104个/cm2传代。诱导后第 28 天,获取细胞做后续实验。诱导期间分别于诱导分化前和诱导分化后 24 h、48 h、1 周、2 周、3 周、4 周于倒置相差显微镜下观察细胞生长,记录并拍照。1.2.3 总 RNA 提取和 cDNA 合成 收集细胞,以 1200 r/min 离心 5 min,去除上清液,沉淀中加入 1 ml Trizol,反复吹打,吸出所有裂解液置于 1.5 ml Microtube 管中,室温下静置 5 min;加200 μl 氯仿,剧烈振荡 15 s,室温下静置 3 min;4 ℃ 下,以 1200 r/min 离心 15 min;吸取上清液400 μl 至 1.5 ml Microtube 管中,加 50 μl 异丙醇混匀,室温下静置 15 min;再次 4 ℃ 1200 r/min 离心 15 min;弃上清,加乙醇洗涤后 4 ℃ 1200 r/min离心 5 min;弃上清,于空气中晾干 RNA 10 min;加 50 μl 焦碳酸二乙酯(DEPC)水溶解 RNA,-80℃ 保存待用。
选择完整性良好的 RNA 样本,按逆转录试剂盒(PrimeScript RT-PCR Kit)说明书合成 cDNA。在 Microtube 管中配制 10 μl 反应体系:dNTP Mixture 1 μl,Oligo dT Prime 1 μl,Template RNA 2 μl,RNase Free H2O 6 μl。在梯度 PCR 仪上进行变性、退火反应:65 ℃ 5 min,4 ℃ 30 s。将该Microtube 管离心 30 s 使混合液聚集于 Microtube管底部。在上述 Microtube 管中配置 20 μl 反应体系:上述变性、退火后反应液 10 μl,5 × PrimeScript Buffer 4 μl,RNase Inhibitor 0.5 μl,PrimeScript RTase 0.5 μl,RNase Free H2O 5 μl。在 PCR 仪上进行逆转录反应:42 ℃ 30 min,95 ℃ 5 min,4 ℃ 1 min。用超微量分光光度计 K5500 测定所得 DNA A260/A280比值在 1.6 ~ 1.9,将合成的 cDNA -20 ℃保存待用。

表 1 各目的基因及内参基因的 PCR 引物Table 1 The PCR primers of target genes and reference gene
1.2.4 实时荧光定量 PCR PCR 引物由上海生工生物工程有限公司合成,见表 1。将各引物离心30 s 后按引物合成报告单配制成 100 μmol/L 的贮存液,用蒸馏水稀释 20 倍,配制成 5 μmol/L 的贮存液,-20 ℃ 保存待用。按照荧光定量 PCR 扩增试剂盒说明书进行基因 α-actin、β-MHC、GATA4和 Nkx2-5 定量 PCR 扩增。A、B、C、D1、D2、D3组获得的 cDNA 作为 PCR 扩增的 DNA 模板,分别与目的基因和内参基因的 PCR 引物进行PCR 扩增,具体步骤如下:在 Microtube 管中配制 20 μl 反应体系:SYBR Premix EX TAqTMII(2 ×)10 μl,PCR Forward Primer(10 μmol/L)0.8 μl,PCR Reverse Primer(10 μmol/L)0.8 μl,DNA模板 2 μl,dH2O 6.4 μl,在 PCR 仪上进行 RT-PCR反应,经过 95 ℃ 预变性 5 min,98 ℃ 变性 10 s,54 ~ 62 ℃ 退火 30 s,72 ℃ 延伸 30 s,重复 40 ~45 个循环,72 ℃ 延伸 10 min。在 real-time PCR反应的指数期,设定荧光信号阈值,该阈值是以PCR 反应前 15 个循环的荧光信号作为荧光本底信号;Ct(Cycle threshold)值为每个反应管内的荧光信号达到设定阈值时所经历的循环数,将 Ct 值作为样本表达量标准,每个标本重复 3 次,Ct 值取平均值;使用 2-△△Ct法[13]计算各组相关基因的表达量:△△Ct =(Cttarget- Ctref)实验组-(Cttarget-Ctref)对照组,Cttarget:目的基因的 Ct 值;Ctref:内参基因的 Ct 值。
1.3 统计学处理
2 结果
2.1 UCMSCs 形态
新鲜分离的脐带间充质干细胞在培养 2 ~ 3 d后,培养瓶底即出现散在的贴壁细胞,形态以圆形为主,随培养时间延长,细胞形态变得不均一,1 周后多数呈圆形、梭形、纤维样或者多角形(图 1A)。传代后的细胞密度渐分布均匀,细胞生长也均匀一致,多数沿胞体长轴呈单层的旋涡状或辐射状,细胞变大,梭形为主(图 1B)。消化传代后,细胞3 ~ 4 h 内迅速贴附瓶壁,2 ~ 3 d 后细胞可达到80% ~ 90% 融合程度。每次传代,细胞数扩增 2 ~3 倍。细胞传代过程中,细胞的形态及增殖能力无明显改变。

图 1 脐带间充质干细胞形态(A:原代细胞培养 1 周,呈圆形、梭形、纤维样或者多角形;B:细胞传至第 4 代,细胞生长均匀一致,多数沿胞体长轴呈单层的旋涡状或辐射状,细胞变大,以梭形为主)Figure 1 The morphology of umbilical cord mesenchymal stem cells (A: Culture primary cell for 1 week, round, fusiform,polygonal or fiber shaped; B: Cells spread to the fourth generation. Cell growth is uniform and look like a single vortex or radial along the long axis of the cell body. The cells become large, spindle shaped)

图2 诱导分化后的脐带间充质干细胞形态(A:1 w,细胞数目较前增多,形态以长梭形为主;B:2 w,细胞变成多角形,胞体增大;C:3 w,部分细胞发生空泡样改变,可见细胞间有融合,排列方向渐趋向一致;D:3 w 后,细胞形态和排列方向变得不规则)(× 100)Figure 2 The morphology of umbilical cord mesenchymal stem cells after differentiation (A: 1 w, the number of cells is increased,and the morphology is dominated by long spindle shape; B: 2 w, cells become polygonal and bigger; C: 3 w, some of the cells have the vacuole, and there is a convergence between the cells. The direction of their arrangement is consistent; D: After 3 w, cell morphology and cell arrangement direction all become irregular) (× 100)
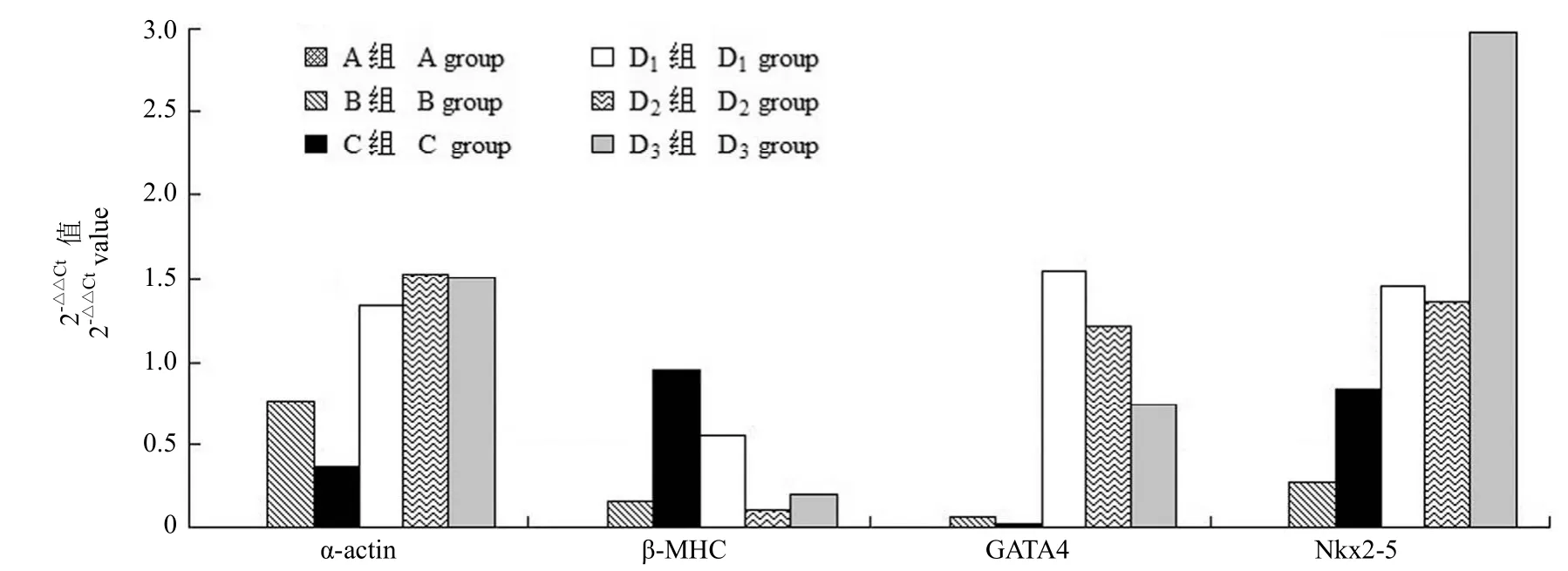
图3 基因 α-actin、β-MHC、GATA4 和 Nkx2-5在各实验组中的 2-△△Ct值Figure 3 2-△△Ctof α-actin, β-MHC, GATA4, Nkx2-5 gene in each group
2.2 诱导分化后 UCMSCs 的形态
诱导后 1 周内细胞增长速度无明显减慢,细胞数目增多,形态以长梭形为主(图 2A),UCMSCs诱导 2 周后细胞增生速度减慢,形态发生变化,由原来的长梭状变成多角形,胞体增大(图 2B),3 周后细胞体积继续增大,部分细胞发生空泡样改变,细胞间可见融合,形成细胞集落,相邻集落细胞之间出现连接,排列方向渐趋向一致(图 2C);继续传代培养,细胞增殖能力减慢,形态变得不规则,排列方向不一致(图 2D)。在诱导分化过程中,未发现有明显的心肌肌管形成,亦未观察到可自发跳动的心肌细胞。
2.3 目的基因的表达
基因 α-actin、β-MHC、GATA4 和 Nkx2-5 与其内参基因在 A、B、C、D1、D2、D3组中的 RT-PCR基因扩增曲线呈 S 型,有明显的指数扩增期、线性期及平台期,曲线起峰 Ct 值 10 ~ 25,所有曲线走型光滑,显示扩增效果理想。
基因 α-actin、β-MHC、GATA4 和 Nkx2-5在单纯加入 0.1 nmol/L CT-1 的 B 组和单纯加入10 µmol/L 5-aza 的 C 组较 A 组均无明显表达;除 β-MHC 基因外,α-actin、GATA4 和 Nkx2-5基因在同时加入不同浓度 CT-1 和 10 µmol/L 5-aza的 D 组较 A 组表达明显增加,其中 α-actin 基因在 D2组的表达最明显,GATA4 基因在 D1组的表达最明显,Nkx2-5 基因在 D3组的表达最明显(图 3)。
3 讨论
有关干细胞的心肌再生治疗已经经历了大量实验室研究和临床实践,目前研究和应用最多的是BMMSCs,然而,BMMSCs 的获取具有创伤性,并且供者的年龄影响其分化能力。近些年来,具有来源丰富、无伦理问题、低免疫原性和多向分化潜能等优势的 UCMSCs 引起人们的关注;Nartprayut等[6]发现在分化为心肌样细胞潜能方面 UCMSCs优于 BMMSCs。5-aza 是常用的促间充质干细胞分化为心肌细胞的诱导分化剂,但诱导分化率不高;Chen 等[11]联合应用 5-aza 和 CT-1 促 BMMSCs诱导分化为心肌细胞,分化率较单纯应用 5-aza 明显增高;Monserrat 等[10]发现 CT-1 与心肌肥大的严重程度密切相关;我们的前期研究结果证实未进行诱导分化的 UCMSCs 可自发表达少量心肌细胞特异性标志物,加入 CT-1 后,UCMSCs 分化为心肌样细胞的数量明显增加。本实验通过实时定量PCR 检测心肌特异性基因的表达情况,以进一步了解 CT-1 促进 5-aza 诱导 UCMSCs 分化为心肌样细胞的机制。
本实验显示基因 α-actin、GATA4 和 Nkx2-5在单独加入 CT-1 的 B 组和单独加入 5-aza 的C 组均无明显表达,而在同时加入 0.1 μmol/L CT-1和 10 μmol/L 5-aza 的 D 组较空白对照组 A 组表达明显增加,提示 α-actin、GATA4 和 Nkx2-5基因参与了心肌细胞的形成和发育,与上述文献报道一致。本实验最终结果证实目的基因在 D 组明显表达,与既往文献报道相符,但各目的基因之间对 CT-1 敏感的浓度存在差异,考虑各目的基因的具体作用机制及表达方式尚未完全明确,亦考虑不同的浓度可能会影响各基因的表达量,尚待验证。
心肌肌动蛋白(α-actin)是心肌肌小节中细肌丝的重要组成部分,并通过作用于相邻的肌小节和心肌细胞使心肌收缩同步[14]。不同研究组分别在心肌致密化不全和扩张型心肌病的患者中发现了基因 α-actin 突变[15-16];Jiang 等[17]发现在心衰患者中 α-actin 表达较对照组明显下调,并证实与心肌细胞凋亡有密切关系。因此,基因 α-actin 在心肌细胞的形成、发育过程中具有十分重要的作用。GATA4 作为一种心肌转录因子,表达于心肌细胞发育的各个阶段,并通过调控心肌某些基因的转录活性参与心脏形成的整个过程,如心房利钠因子、肌钙蛋白、β-MHC 等[18],并在扩张型心肌病的患者中发现了基因 GATA4 突变[19],Brody 等[20]在扩张型心肌病小鼠模型中进一步发现致病基因GATA4 的一个全新靶点基因 Lrrc10。基因 Nkx2-5作为特异性心肌转录因子,同样也参与了心脏发生、发育的整个过程,尤其是心脏传导系统[21],在胚胎时期 Nkx2-5 的缺失会导致死胎或心脏畸形[22],在先天性心脏病的患者中也发现了基因 Nkx2-5突变[23],上述内容证明基因 α-actin、GATA4 和Nkx2-5 均参与了心脏的起源、发育及病变过程。本实验结果显示,目的基因在实验组中表达明显增加,进一步证实了 CT-1 促进脐带间充质干细胞诱导分化为心肌样细胞。
我们也注意到加入 CT-1 后,目的基因β-MHC 表达未见明显增加,与文献报道不符;推测可能原因有:①本实验体外诱导分化的条件与文献报道不完全相同;②目的基因 β-MHC 的扩增曲线虽可见明显的指数期,线性期及平台期,扩增曲线走型光滑,但其曲线起峰 Ct 值在 25 ~ 30 之间,起峰较晚,因此可能存在循环数不够而造成表达下降;③选择的引物特异性不高。
[1] Kruglyakov PV, Sokolova IB, Zin'kova NN,et al. In vitro and in vivo differentiation of mesenchymal stem cells in the cardiomyocyte direction. Bull Exp Biol Med, 2006, 142(4):503-506.
[2] Hattan N, Kawaguchi H, ando K, et al. Purified cardiomyocytes from bone marrow mesenchymal stem cells produce stable intracardiac grafts in mice. Cardiovasc Res, 2005, 65(2):334-344.
[3] Shim WS, Jiang S, Wong P, et al. Ex vivo differentiation of human adult bone marrow stem cells into cardiomyocyte-like cells. Biochem Biophys Res Commun, 2004, 324(2):481-488.
[4] Zhang ZL, Wang MH, Peng JT, et al. Intracoronary transplantation of autologous bone marrow stem cells in treating dilated cardiomyopathy. Pract Clin Med, 2005, 6(12):23-25, 28. (in Chinese)张智亮, 王梦洪, 彭景添, 等. 自体骨髓干细胞冠状动脉内移植治疗扩张型心肌病. 实用临床医学, 2005, 6(12):23-25, 28.
[5] Chen Y, Liu W, Li W, et al. Autologous bone marrow mesenchymal cell transplantation improves left ventricular function in a rabbit model of dilated cardiomyopathy. Exp Mol Pathol, 2010, 88(2):311-315.
[6] Nartprayut K, U-Pratya Y, Kheolamai P, et al. Cardiomyocyte differentiation of perinatally‑derived mesenchymal stem cells. Mol Med Rep, 2013, 7(5):1465-1469.
[7] Zhang Y, Chu Y, Shen W, et al. Effect of 5-azacytidine induction duration on differentiation of human first-trimester fetal mesenchymal stem cells towards cardiomyocyte-like cells. Interact Cardiovasc Thorac Surg, 2009, 9(6):943-946.
[8] Martin-Rendon E, Sweeney D, Lu F, et al. 5-Azacytidine-treated human mesenchymal stem/progenitor cells derived from umbilical cord, cord blood and bone marrow do not generate cardiomyocytes in vitro at high frequencies. Vox Sang, 2008, 95(2):137-148.
[9] Ma N, Ding F, Zhang J, et al. Myocardial structural protein expression in umbilical cord blood mesenchymal stem cells after myogenic induction. Cell Biol Int, 2013, 37(9):899-904.
[10] Monserrat L, López B, González A, et al. Cardiotrophin-1 plasma levels are associated with the severity of hypertrophy in hypertrophic cardiomyopathy. Eur Heart J, 2011, 32(2):177-183.
[11] Chen XY, Zeng Z, Zhou B, et al. Effects of cardiotrophin-1 on differentiation and maturation of rat bone marrow mesenchymal stem cells induced with 5-azacytidine in vitro. Int J Cardiol, 2010, 143(2):171-177.
[12] Ateghang B, Wartenberg M, Gassmann M, et a1. Regulation ofcardiotrophin-1 expression in mouse embryonic stem cells by HIF-lalpha and intracellular reactive oxygen species. J Cell Sci, 2006,119(Pt 6):1043-1052.
[13] Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods, 2001, 25(4):402-408.
[14] Frade AF, Teixeira PC, Ianni BM, et al. Polymorphism in the alpha cardiac muscle actin 1 gene is associated to susceptibility to chronic inflammatory cardiomyopathy. PLoS One, 2013, 8(12):e83446.
[15] McNally E, Dellefave L. Sarcomere mutations in cardiogenesis and ventricular noncompaction. Trends Cardiovasc Med, 2009, 19(1):17-21.
[16] Olson TM, Michels VV, Thibodeau SN, et al. Actin mutations in dilated cardiomyopathy, a heritable form of heart failure. Science,1998, 280(5364):750-752.
[17] Jiang HK, Qiu GR, Li-Ling J, et al. Reduced ACTC1 expression might play a role in the onset of congenital heart disease by inducing cardiomyocyte apoptosis. Circ J, 2010, 74(11):2410-2418.
[18] Pikkarainen S, Tokola H, Kerkelä R, et al. GATA transcription factors in the developing and adult heart. Cardiovasc Res, 2004, 63(2):196-207.
[19] Li RG, Li L, Qiu XB, et al. GATA4 loss-of-function mutation underlies familial dilated cardiomyopathy. Biochem Biophys Res Commun, 2013, 439(4): 591-596.
[20] Brody MJ, Cho E, Mysliwiec MR, et al. Lrrc10 is a novel cardiac-specific target gene of Nkx2-5 and GATA4. J Mol Cell Cardiol, 2013, 62:237-246.
[21] Moskowitz IP, Kim JB, Moore ML, et al. A molecular pathway including Id2, Tbx5 and Nkx2-5 required for cardiac conduction system development. Cell, 2007, 129(7):1365-1376.
[22] Terada R, Warren S, Lu JT, et al. Ablation of Nkx2-5 at mid-embryonic stage results in premature lethality and cardiac malformation. Cardiovasc Res, 2011, 91(2):289-299.
[23] Costa MW, Guo G, Wolstein O, et al. Functional characterization of a novel mutation in NKX2-5 associated with congenital heart disease and adult-onset cardiomyopathy. Circ Cardiovasc Genet, 2013, 6(3):238-247.
Objective To investigate the express of α-actin, β-MHC, GATA4, Nkx2-5 gene which are effected by cardiotrophin-1 (CT-1) on differentiation of umbilical cord mesenchymal stem cells (UCMSCs) in vitro with 5-azacytidine (5-aza).
Methods The UCMSCs isolated and purified from umbilical cord were divided into several groups respectively as ordinary culture medium of UCMSCs (Group A), culture medium with 0.1 nmo1/L CT-1 (Group B), ordinary culture medium including 10 μmol/L 5-aza only (Group C), culture medium combined with different concentration of CT-1 and 10 μmol/L 5-aza (Group D). The group D includes three subgroups based on the concentration of CT-1: D10.01 nmol/L CT-1, D20.1 nmo1/L CT-1, D31.0 nmo1/L CT-1. The fluorescent quantitation PCR was used to detect the expression levels of the α-actin, β-MHC, GATA4, Nkx2-5 gene.
Results After culture for 2 or 3 days, UCMSCs adhereed to the wall, and gradually became from spherical to long fiber-like. Differentiated UCMSCs treated with 5-aza and CT-1 distinctly showed morphological characteristics of myocyte-like cells, yet spontaneous contraction of few cells wasn't observed. There was no significant expression level of target genes in group B, C as compared with control group A. The expression levels of α-actin, GATA4, Nkx2-5 in group D were much higher than that in control group A, and each of them was sequentially highest in group D2, D1and D3, respectively. However, there was no significant expression level of β-MHC between group D and control group A.
Conclusions The phenomenon of UCMSCs differentiating into cardiomyocyte-like cells can be promoted by CT-1. The expression levels of α-actin, GATA4, Nkx2-5 are associated with the concentration of CT-1.
Author Affiliations: Department of Cardiorenal Pediatrics (XU Min, LI Zi-pu), Vasculocardiology Department (NING Xian-feng),Neonatal Department (XI Hong-min), Stem Cell Center (GAO Hong), Affiliated Hospital of Qingdao University, Qingdao 266003,China
www.cmbp.net.cn Chin Med Biotechnol, 2016, 11(5):420-425
The expression of α-actin, β-MHC, GATA4, Nkx2-5 gene during the process of umbilical cord mesenchymal stem cells differentiating into cardiomyocyte-like cells promoted by cardiotrophin-1
XU Min, NING Xian-feng, XI Hong-min, GAO Hong, LI Zi-pu
Mesenchymal stem cells; Myocytes, cardiac; Cardiotrophin-1; Azacitidine
LI Zi-pu, Email: 13370871121@163.com
10.3969/j.issn.1673-713X.2016.05.006
青岛市科技支撑计划(10-3-4-3-15-jch)
266003 青岛大学附属医院心肾免疫儿科(徐敏、李自普),心血管内科(宁险峰),新生儿科(锡洪敏),干细胞中心(高宏)
李自普,Email:13370871121@163.com
2016-04-18

