miR-17-92在急性肝脏损伤中的功能和作用
王若素,高慧英,赛岩,崔春萍
miR-17-92在急性肝脏损伤中的功能和作用
王若素,高慧英,赛岩,崔春萍
目的 利用体外细胞模型和基因敲低模型评价 miR-17-92在急性肝脏损伤中的作用。
方法 利用慢病毒 LV-miR-17-92 感染正常人肝细胞系L02,获得稳定过表达 miR-17-92 肝脏 L02 细胞,利用四氯化碳模拟肝细胞损失,MTS 法检测 miR-17-92 高表达L02 细胞和对照细胞的存活率。利用 Alb-cre 转基因小鼠和 miR-17-92-loxp 转基因小鼠杂交,获得肝脏组织特异的miR-17-92 基因敲低小鼠。利用四氯化碳和伴刀豆球蛋白A,分别建立两种急性小鼠肝损伤模型。取肝脏组织进行 HE染色,眼球取血检测谷丙转氨酶、谷草转氨酶,进而评价miR-17-92 在急性肝脏损伤中的功能和作用。
结果 Q-PCR 结果显示慢病毒感染显著提高了 L02 细胞中 miR-17-92 的表达。MTS 结果显示四氯化碳处理明显抑制了 L02 细胞的生长,而与对照组相比,miR-17-92 过表达提高了四氯化碳处理后细胞的存活率(P < 0.05)。基因组PCR 结果和肝脏 Q-PCR 分析均显示肝脏特异 miR-17-92基因敲低小鼠肝脏中 miR-17-92 的表达显著降低。小鼠腹腔四氯化碳给药能够显著诱导野生型小鼠肝脏 miR-17-92的水平,而基因敲低小鼠中 miR-17-92 表达无明显变化。在四氯化碳和伴刀豆球蛋白 A 肝脏损伤模型中,与对照组相比,miR-17-92 肝脏特异性敲低小鼠的肝脏病理学损伤明显加重,提示 miR-17-92 可能参与了急性肝损伤的修复过程。
结论 肝脏损伤能够诱导 miR-17-92 表达增加,而miR-17-92 过表达对四氯化碳诱导的肝细胞损伤具有保护作用,miR-17-92 敲除则加重了四氯化碳和伴刀豆球蛋白 A诱导的急性肝损伤。因此,miR-17-92 在急性肝脏损伤中起保护作用。
miR-17-92; 肝损伤; Alb-cre-loxp 系统;CCl4; 伴刀豆球蛋白 A
www.cmbp.net.cn 中国医药生物技术, 2016, 11(5):407-414
我国是病毒性肝炎高发国家,目前约有 3000万的慢性乙肝患者以及 1.2 亿乙肝病毒携带者,每年因肝炎引起的急性肝衰竭和肝硬化死亡的人数超过 30 万。此外,随着生活水平的提高,因肥胖、营养过剩、饮酒以及药物所引起的肝损伤发生率也高达 26% ~ 34%[1]。因此,探索急性肝脏损伤及修复的分子机制,寻找新的药物靶标,对于发展新的急性肝脏病治疗药物十分重要。微 RNAs(miRNAs)是一类由 21 ~ 25 个核苷酸组成的小段非编码 RNA,约占人类总基因的 3%,能够通过与靶基因 mRNA 的 3' 非翻译区或 mRNA 序列结合,进而导致 mRNA 的降解或抑制 mRNA翻译的方式,调控靶基因的表达,从而参与多种生命过程[2]。已有的研究显示,相当多的 miRNA 参与了不同因素诱导的肝脏损伤[3],如 miR-122 作为一个在肝脏中表达丰度较高的 miRNA,肝脏细胞受损后,表达水平显著提高,并分泌到血液中,常被作为一个急性肝脏损伤的标志物[4]。miR-33、miR-103、miR-104 和 miR-370 也被报道参与了肝脏脂代谢和糖代谢的过程,进而在肝脏损伤修复过程中发挥作用[5]。
miR-17-92 基因簇是一个高度保守的基因簇,编码 miR-17-5p、miR-17-3p、miR-18a、miR-19a、miR-20a、miR-19b-1 和 miR-92-1 七个 miRNAs,有 miR-106a-363 和 miR-106b-25 基因簇两个旁系同源体。miR-17-92 基因簇是目前研究最多的miRNA 簇,研究发现 miR-17-92 基因簇在机体正常生长发育、免疫调节、心血管疾病和衰老等过程中发挥非常重要的作用[6],并且有许多研究表明,miRNA 及其旁系同源体在不同肿瘤中表现原癌基因特性[7],例如 B 细胞淋巴瘤、急性骨髓性白血病、成视网膜细胞瘤、胰腺癌、乳腺癌等。miR-17-92 在肝脏疾病中的报道还不多,仅有 miR-17-92 缺失导致 p21 和 PTEN 蛋白表达升高,抑制肝脏再生[8]。
此研究中,我们构建了 miR-17-92 肝脏特异性敲低小鼠,利用四氯化碳(CCl4)和伴刀豆球蛋白A(ConA)肝损伤模型,评价 miR-17-92 对急性肝脏损伤的影响。
1 材料与方法
1.1 材料
miR-17-92-loxp 转基因小鼠(STOCK Mir17-92tm1.1Tyj/J)和 Alb-cre 转基因小鼠[B6.Cg-Tg(Alb-cre)21Mgn/J]购自美国 Jackson Lab;C57BL/6J 小鼠购自北京维通利华实验动物技术有限公司;人正常肝脏细胞系 L02 购自中国科学院上海细胞库。胎牛血清(FBS)、胰酶、RPMI 1640 培养液等购自美国 Hyclone 公司。ConA IV购自美国 Sigma 公司;CCl4、橄榄油为国产试剂。Cell Proliferation Assay(MTS)购自美国 Promega公司;血液组织细胞基因组提取试剂盒和 Taq PCR Master Mix 购自天根生化科技(北京)有限公司。Trizol 购自美国 Invitrogen 公司;Taqman MicroRNA Reverse Transcription Kit 购自美国 ABI公司;miR-17-92 探针由 Applied Biosystems 合成;PCR 引物由北京奥科鼎盛公司合成,引物序列见表 1。
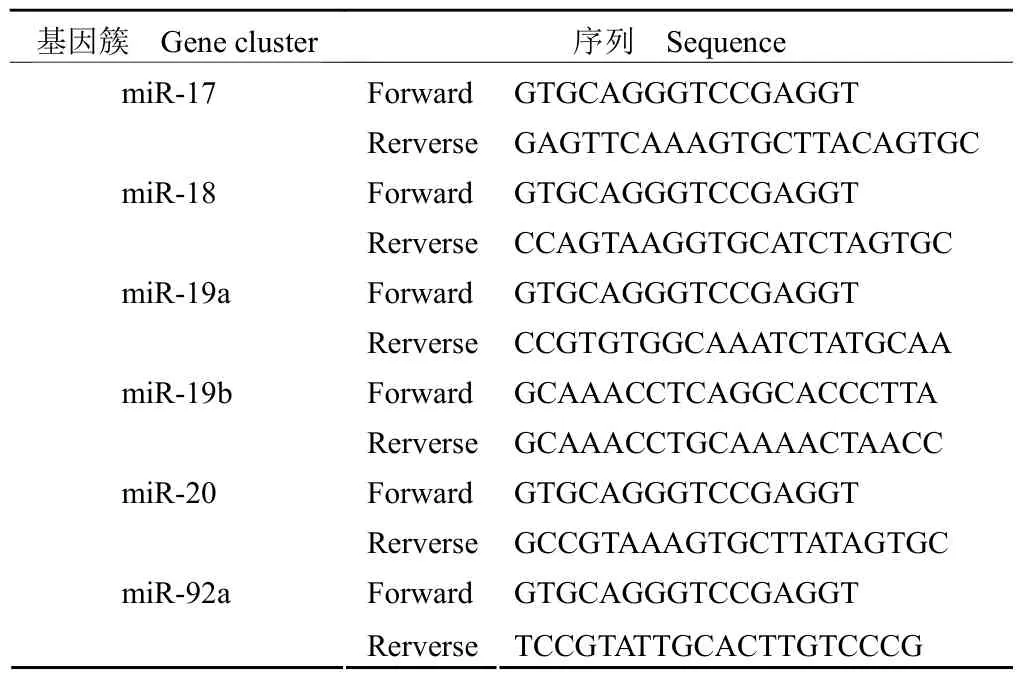
表 1 miR-17-92 基因簇序列Table 1 miR-17-92 gene cluster sequence
1.2 方法
1.2.1 miR-17-92 稳定高表达 L02 细胞的建立和鉴定 感染前一天,按每孔 4 × 105个细胞接种L02 细胞至六孔板中,37 ℃、5% CO2、饱和水汽条件下培养过夜后,按照 10 MOI 的量加入慢病毒LV-pcDH-miR-17-92 及对照慢病毒 LV-pcDH-CMV(慢病毒均由本实验室自行包装),常规培养 4 ~6 h 后更换新鲜培养基,继续培养 48 h。消化传代感染后的 L02-17-92OE 和 L02-NTC 细胞,待25 cm2细胞培养瓶中细胞密度合适时,提取细胞总RNA,反转录,Taqman Q-PCR 检测 miR-17-92 的表达。
1.2.2 CCl4肝细胞损伤模型的建立 取对数生长期 L02-17-92OE 和 L02-NTC 细胞,按 3 × 103个/100 μl 接种于 96 孔细胞培养板,设置不加细胞的培养基空白对照,常规培养 24 h 后,加入不同浓度 CCl4(5、10、15、20、25 mmol/L),设置只加培养基的正常对照组,12 h 更换为每孔 20 μl MTS 和 100 μl DMEM 继续培养,1 ~ 2 h 后用酶联免疫检测仪在 490 nm 波长下测定各孔吸光度(A),按照以下公式计算细胞存活率:

1.2.3 miR-17-92 肝脏特异性敲低小鼠建立 利用 miR-17-92 基因突变小鼠和 Alb-cre 转基因小鼠,根据 Jackson Lab 的饲养繁殖和鉴定方法,将两个品系小鼠进行杂交,于 F1 代得到杂合子小鼠,继续进行交配,于 F2 代得到 miR-17-92肝脏特异性突变小鼠。处死小鼠,取肝脏,固定,送北京雪邦生物技术公司,蜡块包埋,切片,HE染色。
1.2.4 miR-17-92 肝脏特异性突变小鼠基因型鉴定 剪鼠尾 0.5 cm,根据血液组织细胞基因组提取试剂盒提取小鼠总 DNA,PCR 扩增,琼脂糖凝胶电泳验证小鼠基因型。
1.2.5 miR-17-92 效率鉴定 处死小鼠,取肝脏100 mg,用液氮冷冻后研磨,加入 1 ml Trizol,混匀,按照 RNA 提取步骤提取小鼠肝脏 RNA,反转录,Taqman Q-PCR 检测 miR-17-92 的表达。
1.2.6 ConA 肝损伤模型建立 取相同周龄雄性miR-17-92 肝组织特异性敲低小鼠和野生型(WT)C57BL/6J 小鼠各 6 只,小鼠按 15 mg/kg 的量尾静脉注射 2.5 mg/ml ConA 生理盐水混合液,常规饲养 24 h 后,眼球取血,血清送北京北方生物技术研究所检测血浆谷丙转氨酶(ALT)、谷草转氨酶(AST)。处死小鼠,取肝脏,固定,送北京雪邦生物技术公司,蜡块包埋,切片,HE 染色。
1.2.7 CCl4肝损伤模型建立 取相同周龄雄性 miR-17-92 肝组织特异性敲低小鼠和野生型C57BL/6J 小鼠各 6 只,造模前禁食水 12 h,40% CCl4的橄榄油混合液,按照 2 ml/kg 体重的量灌胃小鼠,灌胃后继续禁食水 4 h,常规饲养 24 h 后,眼球取血,血清送北京北方生物技术研究所检测血浆 ALT、AST。处死小鼠,取肝脏,固定,送北京雪邦生物技术公司,蜡块包埋,切片,HE 染色,另外取 100 mg 肝脏检测 miR-17-92 表达。
1.2.8 肝细胞损伤分级 根据文献[9],将肝细胞损伤分为五级并计分:①G0 期,汇管区及周围无炎症,肝小叶内无炎症,得分 0;②G1 期,汇管区炎症,肝细胞变性,有少量坏死,得分 1;③G2期,汇管区及周围轻度碎屑坏死,肝细胞变性,出现点、灶状坏死,出现嗜酸小体,得分 2;④G3 期,汇管区及周围中度碎屑坏死,肝细胞变性、坏死,融合或出现桥接坏死,得分 3;⑤G4 期,汇管区及周围重度碎屑坏死,广泛的桥接坏死,累及多个肝小叶,得分 4。
1.3 统计学处理
2 结果
2.1 稳定过表达 miR-17-92 的 L02 人正常肝细胞(miR-17-92OE)的建立

图1 慢病毒感染后荧光显微镜下 GFP 的表达Figure 1 The expression of GFP after lentivirus injected under fluorescence microscope
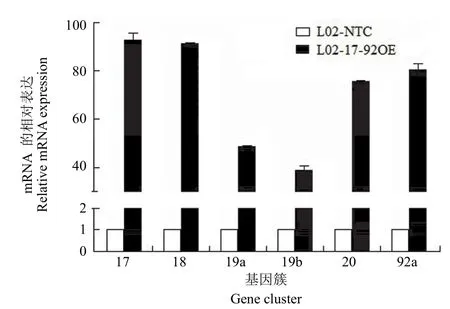
图2 慢病毒感染后 L02-17-92OE 细胞与 L02-NTC 细胞中 miR-17-92 的表达Figure 2 The expression of miR-17-92 after lentivirus injected in L02-17-92OE and L02-NTC

图3 不同浓度 CCl4处理后 L02-17-92OE 细胞和L02-NTC 细胞的存活率Figure 3 The survival rate of L02-17-92OE and L02-NTC after exposed on different concentrations of CCl4

图4 miR-17-92-loxp(A)和 Alb-cre(B)基因型Figure 4 Genotype of miR-17-92-loxp (A) and Alb-cre (B)
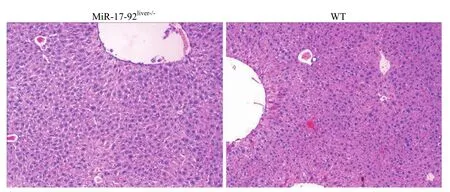
图5 miR-17-92liver-/-小鼠与野生型小鼠肝脏 HE 染色(100 倍光镜下)Figure 5 The liver HE staining of miR-17-92liver-/-mice and WT mice (under × 100 light microscope)
用制备的慢病毒 LV-pcDH-miR-17-92 和对照病毒 LV-pcDH-CMV-GFP 分别感染 L02 细胞,常规培养两周后,荧光显微镜下观察细胞中 GFP 的表达,由图 1 可见,感染慢病毒后,细胞中有明显GFP 的表达。同时,收集细胞,Trizol 法提取细胞总 RNA,Taqman Q-PCR 法检测细胞中 miR-17-92的表达。图 2 结果显示,L02-miR-17-92OE 细胞中 miR-17-92 基因簇 6 个成员表达均比对照细胞L02-NTC 增加 10 倍以上。
2.2 miR-17-92 过表达提高 CCl4损伤下肝细胞存活率
常规培养 L02-miR-17-92OE 细胞和 L02-NTC细胞中加入不同浓度[10]的 CCl4(5、10、15、20、25 mmol/L)培养 12 h,利用 MTS 法检测细胞的存活率。图 3 结果显示,不同浓度 CCl4处理后,细胞数量显著减少,但 L02-miR-17-92OE 细胞的存活率明显高于 L02-NTC 对照细胞(P < 0.05)。
2.3 肝组织特异 miR-17-92 基因敲低小鼠建立
miR-17-92 和 Alb-cre 转基因小鼠提取鼠尾基因组 DNA,利用 PCR 分别鉴定。结果如图 4所示,miR-17-92 基因突变纯合子小鼠(STOCK Mir17-92tm1.1Tyj/J)的 loxp 基因条带位于 289 bp处,野生型的基因条带位于 255 bp 处。Alb-cre 转基因纯合子小鼠[B6.Cg-Tg(Alb-cre)21Mgn/J]基因条带位于 100 bp 处,野生型的基因条带位于390 bp 处。两种转基因小鼠杂交后的第一代均为Alb-cre-miR-17-92 杂合子。杂交后第二代中miR-17-92 基因突变纯合子同时 Alb-cre 转基因纯合子小鼠即为实验所需的 miR-17-92 肝组织特异性敲低小鼠(miR-17-92liver-/-)。肝组织 HE 染色显示,miR-17-92 肝组织特异性敲低小鼠的肝组织结构与野生型小鼠无差别(图 5),但是 Q-PCR 结果显示,miR-17-92 肝组织特异性敲低小鼠肝脏中miR-17-92 各成员的表达均低于野生型小鼠,且表达量均低于 40%(图 6)。
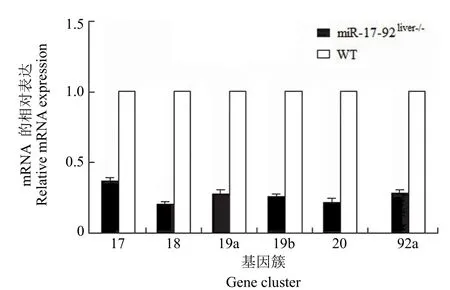
图6 miR-17-92liver-/-小鼠与野生型小鼠肝脏 miR-17-92的表达Figure 6 The expression of miR-17-92 in liver of miR-17-92liver-/-mice and WT mice

图7 miR-17-92liver-/-小鼠与野生型小鼠 CCl4处理前后肝脏 miR-17-92 的表达Figure 7 The expression of miR-17-92 in liver of miR-17-92liver-/-mice and WT mice after exposed on CCl4
2.4 CCl4处理后肝脏中 miR-17-92 表达上调
为了检测肝脏损伤后 miR-17-92 表达变化,在腹腔注射 CCl4后 24 h,提取小鼠肝组织总 RNA,检测 miR-17-92 表达,结果如图 7 所示, WT 小鼠在 CCl4处理后,肝组织 miR-17-92 的表达明显上升(P < 0.05),而 miR-17-92liver-/-小鼠相对于CCl4处理前,miR-17-92 表达稍有上调,但无明显差异。
2.5 miR-17-92 在 CCl4肝脏损伤中的作用
在 CCl4引起的肝脏损伤中,miR-17-92liver-/-组的肝指数 55.79 ± 0.23 高于 WT 小鼠的肝指数3.60 ± 0.44,提示 miR-17-92liver-/-组小鼠肝脏的肿胀程度和炎细胞浸润程度高于 WT 组。在 CCl4引起的肝脏损伤中,miR-17-92liver-/-组的血清 ALT为(2862 ± 392.39)U/L,AST 为(1051.17 ± 791.30)U/L,WT 组的血清 ALT 为(1701.5 ± 239.93)U/L,AST 为(674.83 ± 120.05)U/L,miR-17-92liver-/-组均高于 WT 组(P < 0.05),如图 8 所示。在肝脏组织 HE 染色中(图 9),miR-17-92liver-/-组肝细胞坏死广泛而严重,肝细胞索解离,肝细胞溶解,出现弥漫性大片坏死,桥接坏死,肝小叶及汇管区大量炎细胞浸润。肝小叶中央出现肝细胞坏死,小片嗜酸性变性的肝细胞团残留在小叶周边,溶解坏死的肝细胞结构消失,残留网状支架。WT 组镜下,可见汇管区及中央静脉周围大量炎细胞浸润,肝腺泡 I 区肝细胞呈水样变性和脂肪样变性,可见肝细胞片状坏死,肝窦充血、出血,但肝组织结构仍可见。按照标准肝组织损伤评分标准,miR-17-92liver-/-组得分 2.8 ± 0.35,WT 得分 0.9 ± 0.2,表示同样条件下,miR-17-92liver-/-组肝脏损伤程度重于 WT组(P < 0.05)。

图8 CCl4对 miR-17-92liver-/-小鼠与野生型小鼠血清ALT、AST 的影响Figure 8 The effect of CCl4on serum ALT、AST of miR-17-92liver-/-mice and WT mice
2.6 miR-17-92 在 ConA 肝脏损伤中的作用
在 ConA 诱导的肝脏损伤中,miR-17-92liver-/-组的肝指数 4.71 ± 0.16,高于 WT 组的肝指数2.11 ± 0.35,miR-17-92liver-/-组的血清 ALT 为(11298.17 ± 1727.09)U/L,AST 为(11641 ± 1528.28)U/L,WT 组的血清 ALT 为(8399.50 ± 1700.95)U/L,AST 为(8886.83 ± 1922.56)U/L,miR-17-92liver-/-组均高于 WT 组(P < 0.05)(图 10)。在肝脏组织 HE 染色中, miR-17-92liver-/-组肝实质细胞间大量 T 淋巴细胞浸润,在汇管区尤为明显,肝窦内红细胞弥漫性淤积,肝细胞出现脂肪性变,且可见凋亡小体,点、灶状坏死区大量淋巴细胞、中性粒细胞浸润,而在 WT 组(图 11),肝组织除少量淋巴细胞浸润外,无明显异常。按照标准肝损伤组织评分标准,miR-17-92liver-/-组得分1.9 ± 0.39,WT 得分 0.2 ± 0.11,表示在 ConA 引起的肝损伤中,miR-17-92liver-/-组肝脏损伤程度重于 WT 组(P < 0.05)。

图9 CCl4对 miR-17-92liver-/-小鼠与野生型小鼠肝脏组织病理学影响Figure 9 The effect of CCl4on liver tissue pathology of miR-17-92liver-/-mice and WT mice

图10 ConA 对 miR-17-92liver-/-小鼠与野生型小鼠血清ALT、AST 的影响Figure 10 The effect of ConA on serum ALT、AST of miR-17-92liver-/-mice and WT mice
3 讨论
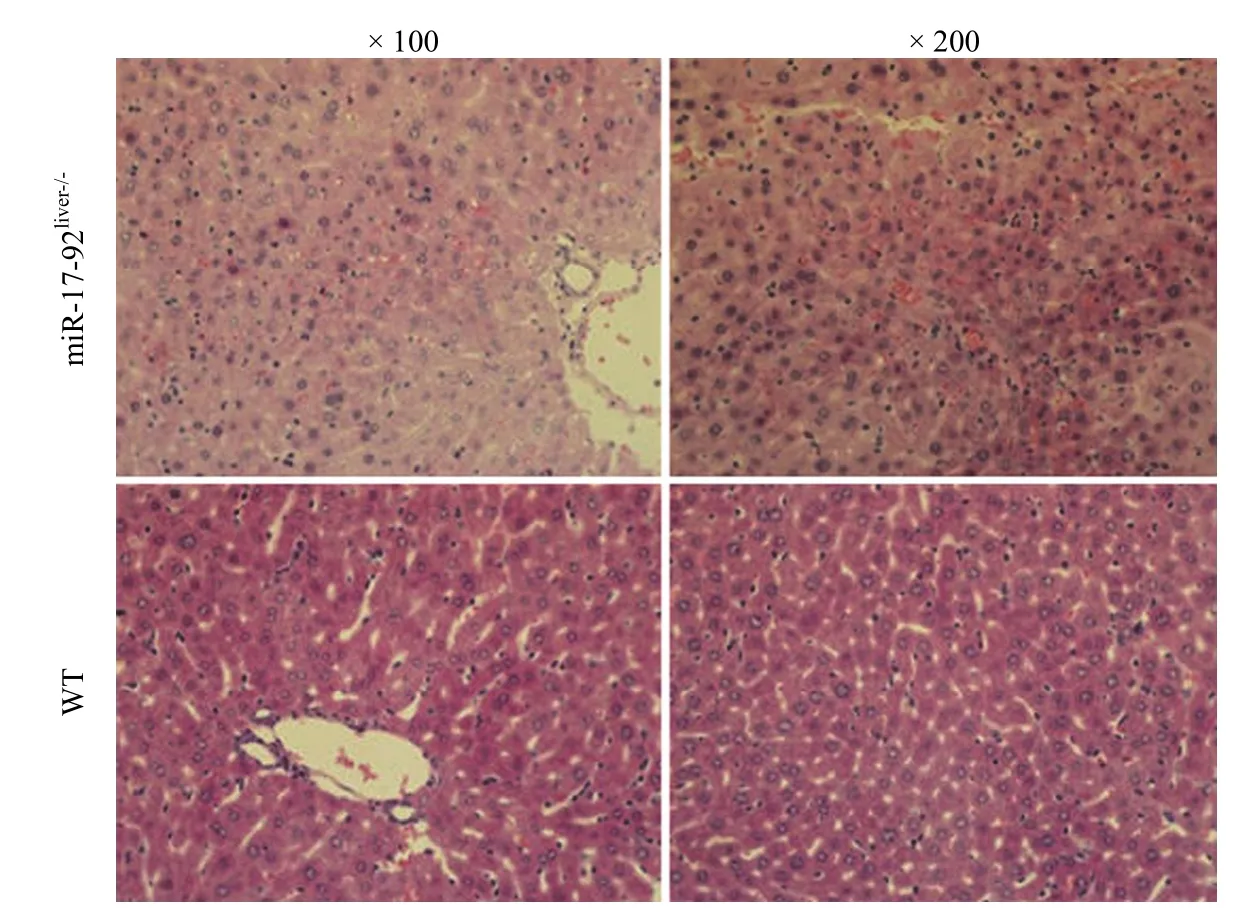
图11 ConA 对 miR-17-92liver-/-小鼠与野生型小鼠肝脏组织病理学影响Figure 11 The effect of ConA on liver tissue pathology of miR-17-92liver-/-mice and WT mice
肝脏作为生物体物质代谢的重要器官,在分解代谢有毒有害物质的同时,易受到各种因素影响而引起损伤。而且许多肝脏疾病在肝脏损伤的基础发生、发展,长期的肝脏损伤最终可能导致肝纤维化,甚至肝癌。所以需要探究肝脏损伤中的调控机制,为肝脏损伤的治疗提供新思路。CCl4是最常用的诱导肝脏损伤的化学试剂。CCl4致肝脏损伤的机制,目前认为与细胞色素 P450-2E1(Cyp2E1)参与的过氧化反应相关[5]。我们首先利用 CCl4诱导的急性肝损伤模型评价了 miR-17-92 缺失对肝脏损伤修复的影响。肝指数指肝脏重量与总体重的比值,在肝脏损伤中可以反映出肝组织充血肿胀程度和炎性细胞浸润程度[11]。AST 和 ALT 是肝功能检测中的重要指标,反映各种原因引起的肝脏损伤程度。在该研究中,我们发现 miR-17-92 参与了急性肝脏损伤的过程,miR-17-92 敲除可能促进了 CCl4和 ConA 对肝脏的损伤,而 miR-17-92 高表达可能保护肝脏减轻了损伤程度。
对于急性肝脏损伤,已有的研究显示 miR-122在肝脏损伤早期表达显著上升,可能作为一个表征肝脏急性损伤的标志物[12]。miR-26a 能够增强肝脏细胞自噬,保护乙醇诱导的肝脏损伤[7]。但对于miR-17-92 在肝病中的作用,目前报道还很少。
基因敲除小鼠是研究基因功能的较好的模式动物。有研究显示,miR-17-92 缺失小鼠,因严重心肺发育不全,导致出生后死亡[13]。因此,我们利用 Alb-cre 和 miR-17-92 loxp 转基因小鼠杂交,获得了肝脏组织特异的 miR-17-92 敲低小鼠miR-17-92liver-/-,同时,我们利用慢病毒建立了稳定高表达 miR-17-92 的肝脏 L02 细胞,从正反两方面评价 miR-17-92 在肝脏损伤中的作用。已知的miR-17-92 的靶基因有 PTEN 和 E2Fs[8,14]。PTEN参与化学通路的传导,可以把信号传导给细胞,使细胞停止分裂导致细胞凋亡。miR-17-92 可以通过调控 PTEN 的表达,调控细胞分裂周期。miR-17-92基因簇也可以通过调控 E2Fs 家族参与细胞周期,调控细胞的凋亡。
综上,本研究显示 miR-17-92 在体内外模型中都表现出对肝脏损伤的保护作用,可能为肝脏损伤的防护和治疗提供了新的靶点,但保护调控分子机制仍待进一步研究发现。
[1] Fan JG. Epidemiology of alcoholic and nonalcoholic fatty liver disease in China. J Gastroenterol Hepatol, 2013, 28 Suppl 1:11-17.
[2] Lucas K, Raikhel AS. Insect microRNAs: biogenesis, expression profiling and biological functions. Insect Biochem Mol Biol, 2013,43(1):24-38.
[3] McGill MR, Jaeschke H. MicroRNAs as signaling mediators and biomarkers of drug-and chemical-induced liver injury. J Clin Med,2015, 4(5):1063-1078.
[4] Wang XW, Heegaard NH, Orum H. MicroRNA in liver disease. Gastroenterology, 2012, 142(7):1431-1443.
[5] Szabo G, Bala S. MicroRNAs in liver disease. Nat Rev Gastroenterol Hepatol, 2013, 10(9):542-552.
[6] Tan W, Li Y, Lim SG, et al. MiR-106b-25/miR-17-92 clusters:polycistrons with oncogenic roles in hepatocellular carcinoma. World J Gastroenterol, 2014, 20(20):5962-5972.
[7] Malaguarnera M, Di Rosa M, Nicoletti F, et al. Molecular mechanisms involved in NAFLD progression. J Mol Med (Berl), 2009, 87(7):679-695.
[8] Zhou Y, Zhang L, Ji H, et al. MiR-17~92 ablation impairs liver regeneration in an estrogen-dependent manner. J Cell Mol Med, 2016,20(5):939-948.
[9] Wang TL, Liu X, Zhou YP, et al. A semiquantitative scoring system for assessment of hepatic inflammation and fibrosis in chronic viral hepatitis. Chin J Hepatol, 1998, 6(4):195-197. (in Chinese)王泰龄, 刘霞, 周元平, 等. 慢性肝炎炎症活动度及纤维化程度计分方案. 中华肝脏病杂志, 1998, 6(4):195-197.
[10] Liang DM, Hu ZX, Luo M, et al. Evaluation of acute liver injury in mice model with different does of CCl4. Chongqing Med, 2014,43(1):18-20. (in Chinese)梁道明, 胡智兴, 罗敏, 等. 不同剂量CCl4急性肝损伤模型的评价. 重庆医学, 2014, 43(1):18-20.
[11] van Haaften G, Agami R. Tumorigenicity of the miR-17-92 cluster distilled. Genes Dev, 2010, 24(1):1-4.
[12] Vliegenthart AD, Shaffer JM, Clarke JI, et al. Comprehensive microRNA profiling in acetaminophen toxicity identifies novel circulating biomarkers for human liver and kidney injury. Sci Rep,2015, 5:15501.
[13] Mogilyansky E, Rigoutsos I. The miR-17/92 cluster: a comprehensive update on its genomics, genetics, functions and increasingly important and numerous roles in health and disease. Cell Death Differ, 2013,20(12):1603-1614.
[14] O'Donnell KA, Wentzel EA, Zeller KI, et al. c-Myc-regulated microRNAs modulate E2F1 expression. Nature, 2005, 435(7043):839-843.
Objective To evaluate the effect of miR-17-92 on liver injury by establishing in vitro cell model and gene-knockout mice model.
Methods Human liver cell L02 was infected by lentivirus LV-miR-17-92 and then lentivirus-mediated miR-17-92 stable overexpression human liver cells were harvested. Liver cell injury was simulated by CCl4. Cell livability was detected using MTS method. The hepatocyte-specific miR-17-92 knockout mice were generated by hybriding the Alb-cre transgenic mice and miR-17-92-loxp transgenic mice. Two type of acute liver injuries in mice were induced with CCl4and ConA. Liver tissue was stained by HE staining. ALT and AST were detected in blood serum through eye ball removing. At last, the function and effect of miR-17-92 on liver injury was evaluated.
Results Q-PCR test showed that the infection of lentivirus improved the expression of miR-17-92 in L02 cells. MTS test showed that CCl4suppressed the growth of L02 cells and miR-17-92 overexpression increased the survival rate of L02 cells injured by CCl4(P < 0.05) as compare with control. Both genome PCR test and liver tissue Q-PCR analysis demonstrated that the miR-17-92 expression of hepatocyte-specific miR-17-92 knockout mice was observably suppressed. Enterocoelia injection of CCl4remarkably increased the expression level of miR-17-92 in liver, but the change was not obvious in hepatocyte-specific miR-17-92 knockout mice. In liver injury models, the liver pathological injury of hepatocyte-specific miR-17-92 knockout mice was more potent than that of the control, suggesting that miR-17-92 probably participated in the repair of acute liver injury.
Conclusion Liver injury increases the miR-17-92 expression level and overexpression of miR-17-92 protects the liver cells from CCl4injury. The ablation of miR-17-92 aggravates the injury caused by CCl4and ConA. Therefore, miR-17-92 plays a positive role of protecting the liver from injury.
Author Affiliation: Beijing Institute of Radiation Medicine, Academy of Military Medical Sciences, 100850 Beijing, China
www.cmbp.net.cn Chin Med Biotechnol, 2016, 11(5):407-414
The function and role of miR-17-92 on acute liver injury
WANG Ruo-su, GAO Hui-ying, SAI Yan, CUI Chun-ping
miR-17-92; Liver injury; Alb-cre-loxp system; CCl4; Concanavalin A
CUI Chun-ping, Email: cui_chunping2000@aliyun.com
10.3969/j.issn.1673-713X.2016.05.004
100850 北京,中国人民解放军军事医学科学院放射与辐射医学研究所
崔春萍,Email:cui_chunping2000@aliyun.com
2016-04-08

