结构态亚铁羟基化合物原位矿物转化除砷性能研究
邵彬彬,关一奕,吴德礼
(同济大学污染控制与资源化研究国家重点实验室,上海 200092)
结构态亚铁羟基化合物原位矿物转化除砷性能研究
邵彬彬,关一奕,吴德礼
(同济大学污染控制与资源化研究国家重点实验室,上海200092)
纳米零价铁表面的结构态亚铁具有高反应活性和吸附性能,为了避免纳米零价铁在除砷过程中的钝化作用,合成了结构态亚铁羟基化合物(ferrous hydroxy complex,FHC)用于砷的去除。在中碱性条件下(pH=7.0~11.0),比较了FHC、O2-FHC及重金属(Ni2+、Zn2+)-FHC体系除砷性能。实验结果表明:FHC去除As(Ⅲ)和As(V)的最适pH分别为9.0和7.0左右,吸附过程符合Langmuir模型,最大吸附容量分别为349.54 mg/g和 537.85 mg/g。在O2-FHC和Ni2+、Zn2+-FHC体系中,FHC转化形成了纤铁矿和层状双金属体系,在转化过程中, Fe(Ⅱ)/Fe(Ⅲ)、Fe(Ⅱ)/M混合体系与砷溶液混合时促进电子转移导致一系列吸附、沉淀反应的进行,表现出更高的除砷效率,除砷机理以专性吸附和共沉淀为主。该研究为含砷工业废水处理提供了新技术,也为FHC矿物转化用于控制砷的迁移提供了理论基础。
亚铁羟基化合物;砷; 矿物转化;吸附
地表水和地下水中砷污染是重要的环境焦点问题,也是环境修复的难点。砷污染的来源有环境中含砷矿物的还原溶解和自然风化等自然过程,以及矿山开采、金属冶炼、使用含砷化学物质以及生产加工等人为过程,砷化合物有剧毒, 具有致癌性,对人类健康造成严重危害[1]。目前,对于砷污染水的治理方法主要有铁、铝、镁盐混凝沉淀法、石灰法、硫化法、吸附法、膜分离法、离子交换法、生物法等[2~4],但是,这些方法还存在诸多的问题,例如需要较大的化学试剂量、大型的设备、处理效率低、处理后的废物易造成二次污染等。在吸附技术中,铁基材料由于具有巨大的比表面积、充足的吸附位点和较强的稳定性等优点而得到了广泛的关注。以纳米零价铁(nano-zerovalent iron, nZVI)作为吸附剂的除砷技术已经得到大量的实验研究。通过深入的机理研究发现,nZVI去除水中金属时主要有两个过程:(1)铁核表面腐蚀产生结构态Fe(Ⅱ)、Fe(Ⅱ)-Fe(Ⅲ)以及Fe(Ⅲ)活性物质,形成核壳结构;(2)这些活性物质对金属离子进行吸附和共沉淀,表面的污染物再进一步发生电化学反应。但是,随着反应的进行,nZVI表面堆积的Fe(Ⅲ)氧化物阻碍了电子转移和内层Fe0的腐蚀,发生了钝化作用,从而影响了活性物质的产生和及后续砷的去除[5]。为了促进腐蚀反应的进行,Sun等[6]提出采用施加弱磁场的方法促进ZVI的腐蚀以及As的去除。Guo等[7]使用氧化剂(NaClO,KMnO4以及H2O2)与ZVI联合的方法提高腐蚀速率和As去除率。这些研究给我们一个启示:由于nZVI核壳结构中壳层活性物质Fe(Ⅱ)及其氧化转化生成的Fe(Ⅱ)-Fe(Ⅲ)、Fe(Ⅲ)起到除砷关键作用,所以,制备结构态亚铁羟基化合物(ferrous hydroxy complex,FHC)代替nZVI/ZVI或许是避免钝化作用、简化除砷手段并提高除砷效率的有效途径。
结构态亚铁是指进入含铁矿物晶格或者新鲜沉淀在含铁矿物表面而形成的活性Fe(Ⅱ)物种,FHC是结构态亚铁的一种,具有较高的还原活性(Eθ= -0.65 ~ -0.34 V),可以高效地还原硝酸盐[8]、卤代有机物[9]和染料[10]等污染物。在弱碱性环境中,FHC易于氧化转化。目前关于FHC及其矿物转化过程吸附去除废水中As的研究还未见报道。本研究采用共沉淀法制备了具有高反应活性的FHC,考察FHC在中碱性条件下除砷效果,并引入氧气达到强化除砷效果的目的。同时研究了共存重金属对FHC除砷的影响,使FHC成为一种高效价廉、适应面广的除砷吸附剂。
1 试验材料与方法
1.1主要材料
七水合硫酸亚铁(FeSO4·7H2O)、氢氧化钠(NaOH)、硫酸镍(NiSO4·6H2O)、硫酸锌(ZnSO4)等主要试剂均为分析纯,购于上海国药集团化学试剂有限公司;砷酸钠(Na2HAsO4·7H2O)、亚砷酸钠(NaAsO2)均为分析纯,购于Sigma-Aldrich;实验用水均为超纯水。
1.2方法
1.2.1储备液的配制
称取1.73g NaAsO2和4.16g Na2HAsO4·7H2O,分别用去氧超纯水溶解后转入1000 mL容量瓶中,稀释至标线,摇匀,浓度为1 g/L,置于冰箱中冷藏(4℃),此时配制的溶液作为As(Ⅲ)和As(V)的储备液。按照该方法继续配制了1 g/L 的Ni2+,Zn2+溶液。后续实验所用的不同浓度的溶液均由储备液稀释而成(现配现用)。
1.2.2FHC的配制
称取一定量的FeSO4·7H2O,溶于一定体积的去氧超纯水中溶解,并用去氧超纯水稀释至100mL。根据Fe(Ⅱ)与OH-的比例(从2∶1到1∶4)计算应加入的无氧氢氧化钠溶液(5 mol/L)体积,搅拌均匀备用。由此得到0.1M的FHC(2∶1)、FHC(1∶1)、FHC(1∶2)、FHC(1∶3)、FHC(1∶4)体系。本实验所用的是FHC(1∶2)。
1.2.3除As实验
首先用高纯氮吹脱As溶液溶解氧0.5 h左右。取配制好的FHC加入上述As(Ⅲ)/As(V)溶液中,使用1 M NaOH或者1 M H2SO4调初始pH,在氮气保护下搅拌反应,由于FHC在酸性环境中易于溶解,因此实验所选用的pH环境为7.0~11.0,在反应过程中不调节pH。当研究溶解氧、纤铁矿(lepidocrocite, Lp)对FHC除砷的影响时,反应在敞口下进行,FHC、Lp的投加量(以铁计)、反应初始pH与无氧环境除砷实验相同。在As溶液中,加入不同体积的Ni2+,Zn2+溶液,研究共存重金属对FHC除砷的影响。反应不同时间后取样,使用电感耦合等离子发射光谱仪(Agilent,720ES)分析总砷浓度。反应后的溶液离心得到最终产物,用超纯水清洗3次,经过冷冻干燥、研磨得到的粉末用于X射线粉末衍射仪(Bruker,D8 Advance,德国)分析。
1.2.4产物中As形态分布
采用文献中报道的连续浸提法[11-12]将除砷产物中的四种形态的砷分离出来:可交换态、专性吸附态、无定型和弱结晶氧化铁结合态、结晶铁氧化物结合态。不同形态砷以及分离方法如下。
(Ⅰ)可交换态:向反应产物加入一定体积0.5 M的(NH4)2SO4,常温下反应4 h,离心得到沉淀,上清液用于测试分离出来砷的浓度。
(Ⅱ)专性吸附态:向(Ⅰ)中沉淀加入一定体积 0.5 M (NH)4H2PO4,常温下反应16 h,得到专性吸附态的砷;
(Ⅲ)无定型和弱结晶氧化铁结合态:向(Ⅱ)中沉淀加入一定体积0.2 M 草酸铵(pH=3.0),于常温下避光反应4 h,分离与无定型和弱结晶铁氧化物结合的砷;
(Ⅳ)结晶铁氧化物结合态:向(Ⅲ)中沉淀加入一定体积0.2 M 草酸铵和0.1 M抗坏血酸混合溶液,于80℃条件下反应1 h,分离得到结晶铁氧化物结合态砷。
2 结果与讨论
2.1无氧条件下FHC对As吸附性能
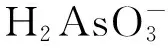
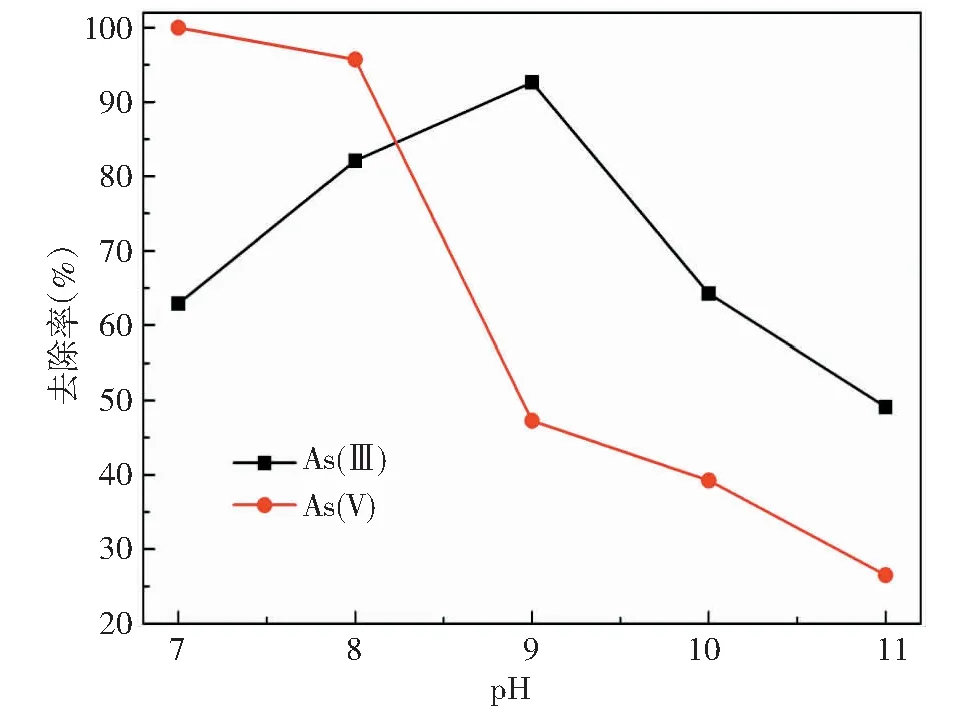
(FHC投加量0.5 g/L;初始As浓度30 mg/L;反应时间1 h)图1 无氧条件下pH对FHC除砷性能的影响Fig.1 The effect of solution pH on As removal by FHC under anoxic conditions
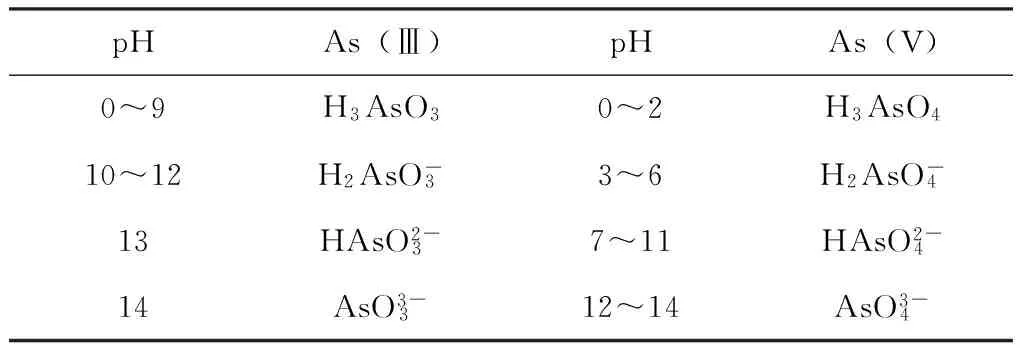
pHAs(Ⅲ)pHAs(V)0~9H3AsO30~2H3AsO410~12H2AsO-33~6H2AsO-413HAsO2-37~11HAsO2-414AsO3-312~14AsO3-4
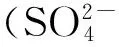
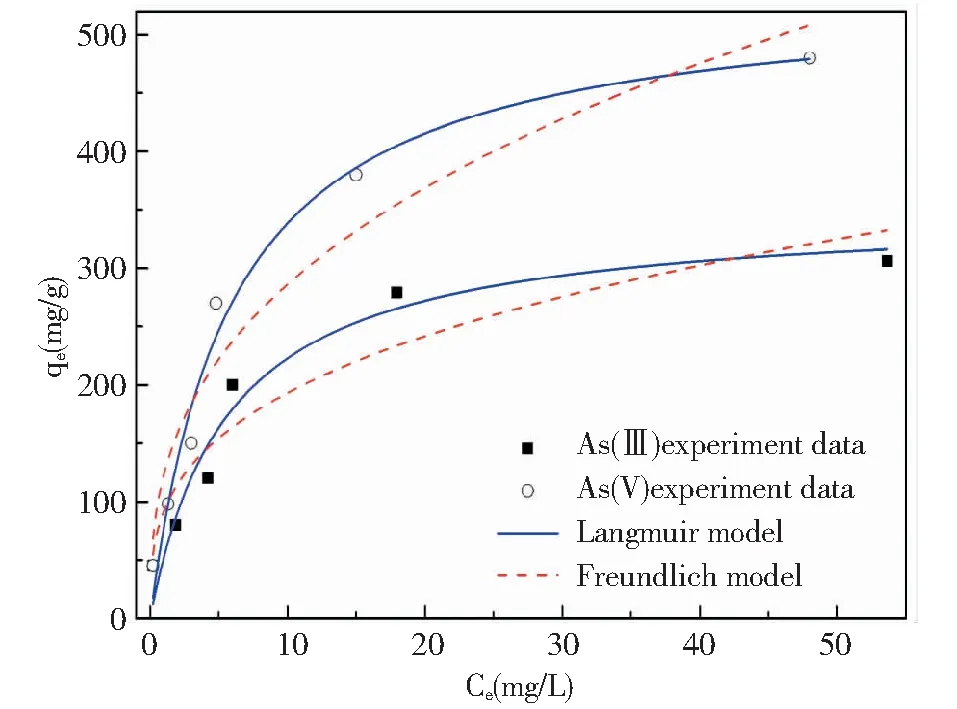
(FHC投加量为0.5 g-Fe/L;As(Ⅲ)和As(V)初始浓度范围分别为10~200和10~300 mg/L;As(Ⅲ)和As(V)溶液初始pH分别是9.0±0.2和7.0±0.2;T=25 ℃)图2 FHC去除As的吸附等温曲线Fig.2 Isotherms for As adsorption on FHC
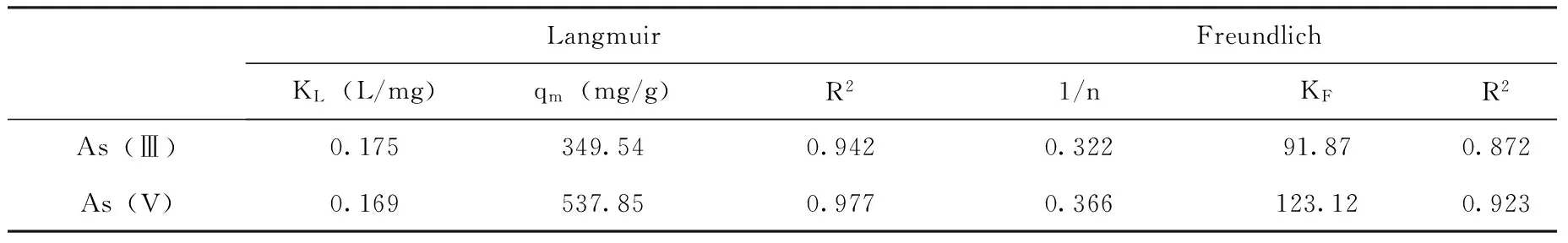
LangmuirFreundlichKL(L/mg)qm(mg/g)R21/nKFR2As(Ⅲ)0.175349.540.9420.32291.870.872As(V)0.169537.850.9770.366123.120.923
2.2FHC矿物转化后除砷性能
由于FHC具有很强的还原性,在应用FHC吸附除砷过程中Fe(Ⅱ)很容易被空气中的氧气氧化形成铁氧化物。同时,在实际废水中往往有多种重金属共存,研究溶液中DO以及共存重金属对FHC处理效果的影响,对于吸附除砷技术具有重要的指导意义。
从图3中可以看出,有氧环境比无氧环境更加有利于FHC吸附As的进行,这一现象对于As(Ⅲ)尤为明显。由图5的XRD图可以看出,FHC氧化后的转化产物为纤铁矿(Lp),因此合成并使用Lp作为吸附剂并与O2-FHC、FHC吸附除砷效果比较,结果发现Lp除砷效果远远不如O2-FHC。这说明在有氧条件下发生的FHC向Lp的矿物转化过程对吸附剂的除砷性能起到至关重要的作用。
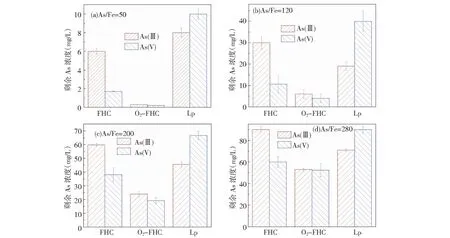
(初始pH为8.0±0.2;FHC投加量为0.3 g/L;初始砷浓度:a=20 mg/L,b=50 mg/L;c=80 mg/L;d=110 mg/L)图3 FHC、O2-FHC及氧化产物Lp在不同初始As浓度时除砷的比较Fig.3 As removal by FHC, O2-FHC and Lp at various initial As concentrations
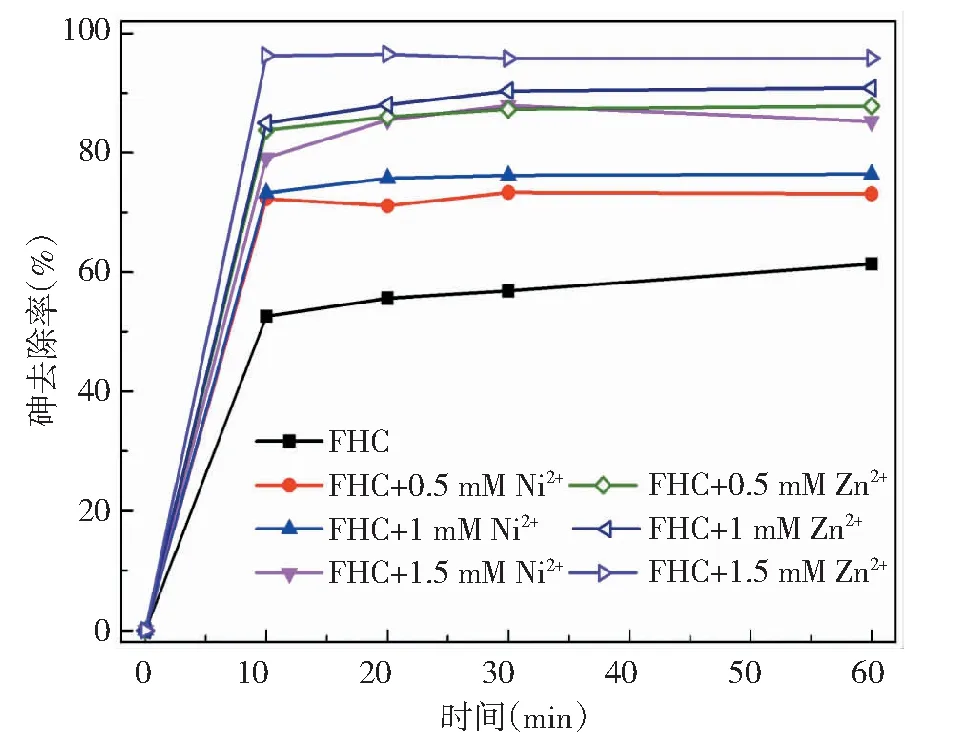
(初始As(Ⅲ)为15 mg/L;FHC投加量0.2 g/L;初始pH=8.0±0.2) 图4 不同浓度的Ni2+和Zn2+对FHC除As(Ⅲ)的影响 Fig.4 Effect of Ni2+ and Zn2+ on As(Ⅲ) removal by FHC
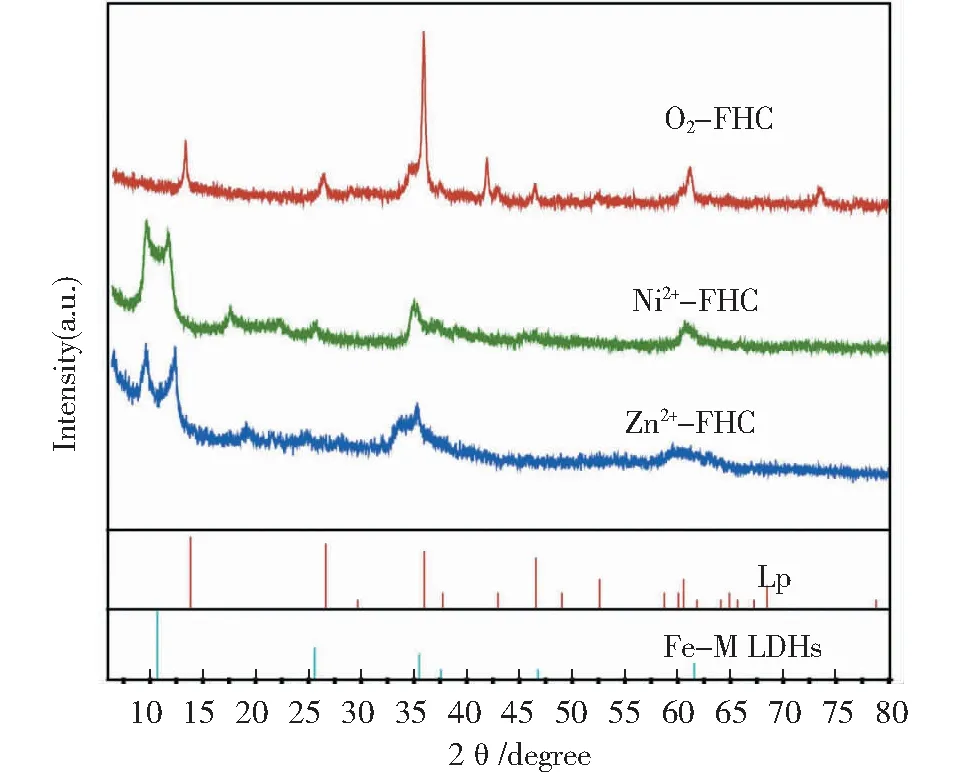
图5 O2/Ni2+/Zn2+-FHC样品的XRD图谱 Fig.5 XRD pattern of O2/Ni2+/Zn2+-FHC samples
图4表示Ni2+、Zn2+与As共存时对FHC除As效率的影响。随着Ni2+或Zn2+含量不断增大,As(Ⅲ)的去除率也逐渐增加,相对来讲Zn2+的作用比Ni2+更明显。虽然FHC与Ni2+或Zn2+不易发生氧化还原反应,但是Ni2+或Zn2+能通过改变FHC的结构使其发生转化。图5表示了FHC与Ni2+,Zn2+反应产物的X射线衍射(X-ray diffraction, XRD)图谱,该类产物的特征峰与文献中[20]层状Fe-Ni双金属化合物(layered double hydroxides, LDHs)的特征峰位置相同。这表明FHC与Ni2+或Zn2+反应后可能转化形成了具有LDHs结构的化合物,该类化合物有巨大的比表面积,有利于对As的吸附去除。
2.3FHC, O2/Ni2+/Zn2+-FHC和Lp除砷机理比较
矿物转化过程中As的去除机理可能有表面吸附络合、共沉淀以及晶格取代。通过不同机理去除的砷在产物中以不同的形态分布[11]。比如,以外层非专性吸附的方式吸附到矿物表面的砷称作可离子交换态砷;以内层专性吸附的方式吸附到矿物表面表示专性吸附态砷;与无定型或弱结晶铁氧化物结合的砷主要以共沉淀方式去除;与结晶铁氧化物结合的砷以共沉淀和进入晶格结构中与铁氧化物共生的方式被去除。本节研究了除砷产物中砷的形态分布,比较FHC、FHC-O2/Ni2+/Zn2+、Lp除砷机理,从而分析FHC转化除砷效率提高的原因。结果如图6所示,除了溶液中剩余的砷(F1),产物中的砷可分为四种形态,分别是F2:可交换态;F3:专性吸附态;F4:与无定型或弱结晶铁氧化物结合;F5:与结晶铁氧化物结合。由结果可知,F3和F4占主要部分,即除砷机理以专性吸附和沉淀作用为主,外层非专性吸附和晶格取代的作用较少。且矿物转化后产物中不同形态砷的分布发生了明显的变化,表明除砷机理也有明显区别。在无氧条件下,FHC除砷产物中F2占~10%,而O2-FHC除砷产物中该部分砷含量降低为~4.32%,说明矿物转化过程中以外层非专性吸附的砷含量减少。但是矿物转化除砷产物中F3所占比例由无氧条件下的~7.6%大幅增加为有氧时的~46.8%,这一结果说明矿物转化过程中更多的砷以共沉淀的方式被去除,Guo等[21]研究发现,菱铁矿在有氧条件下氧化为针铁矿,并且对As(Ⅲ)/As(V)的最大饱和吸附量是无氧时菱铁矿和针铁矿的10倍左右,这是因为Fe(Ⅱ)转化为Fe(Ⅱ)/Fe(Ⅲ)混合体系,与砷溶液混合时易发生电子转移导致一系列吸附、沉淀反应的进行。此外,矿物转化过程中F5的含量为~5%,而单纯的吸附过程中该部分砷含量几乎为0,这一现象可解释为可能有少部分砷与矿物共生进入了晶格结构中。一般来讲砷往往吸附在表面,但在矿物转化的过程中,如Fe(VI)水解转化[22]、赤铁矿转化[23],砷会进入矿物晶格结构中,从而有利于总砷的去除。
当Ni2+或Zn2+与As(Ⅲ)共存时,FHC除As产物中的As主要以三种形态存在,即可交换态,专性吸附态以及与Fe-Ni或Fe-Zn双金属体系共沉淀的As,从砷的分布可以发现,主要除砷机理与O2-FHC相同。但是与O2-FHC体系不同的是,产物并没有形成结晶较好的铁氧化物,这与Fe-Ni和Fe-Zn体系中不存在氧化还原反应相关。从砷含量分布可以看出,Fe-Ni或Fe-Zn双金属体系以专性吸附和共沉淀的方式去除溶液中的砷,与其它层状双金属化合物如绿锈的除砷机理类似[15]。
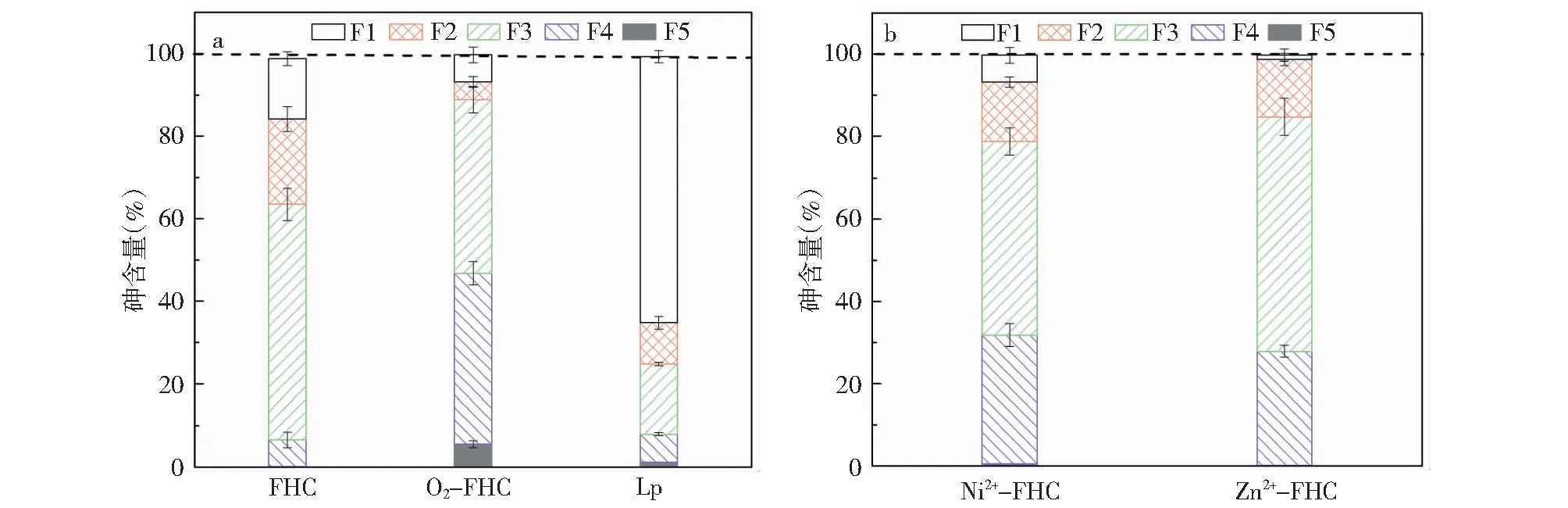
(初始As(Ⅲ)为15 mg/L;FHC投加量0.2 g/L;初始pH为8.0±0.2;Ni2+=Zn2+=2 mM)图6 FHC、O2-FHC、Lp以及Ni2+/Zn2+-FHC除砷后产物中砷的形态分布Fig.6 Arsenic distribution on solid products of FHC, O2-FHC, Lp and Ni2+/Zn2+-FHC
3 结 论
3.1FHC主要通过吸附的方式去除溶液中的As,吸附过程符合Langmuir吸附模型,As(Ⅲ)和As(V)的最大吸附容量分别为349.54 mg/g和 537.85 mg/g。远高于其它含结构态亚铁的吸附剂。
3.2FHC的矿物转化提高了As去除率,溶解氧和共存重金属(Ni2+,Zn2+)都能引起FHC的转化,前者和FHC发生氧化还原反应,后者和FHC形成LDH化合物,具有巨大比表面积,从而利于去除溶液中的As。
3.3Fe(Ⅱ)转化为Fe(Ⅱ)/Fe(Ⅲ)混合体系,与砷溶液混合时易发生电子转移导致一系列吸附、沉淀反应的进行,矿物转化除砷机理以专性吸附和共沉淀为主。和铁氧化物Lp相比,去除的砷更难从固相中转移,这对控制砷的迁移有重要的环境意义。
[1]Monique B, F F H. Arsenic-a Review. Part I: Occurrence, Toxicity, Speciation, Mobility[J]. Acta hydrochim. hydrobiol., 2003, 31: 9-18.
[2]Mondal P, Bhowmick S, Chatterjee D, Figoli A, Van der Bruggen B. Remediation of inorganic arsenic in groundwater for safe water supply: a critical assessment of technological solutions[J]. Chemosphere, 2013, 92(2): 157-170.
[3]Jain C K, Singh R D. Technological options for the removal of arsenic with special reference to South East Asia[J]. J Environ Manage, 2012, 107: 1-18.
[4]Yuan T, Luo Q-F, Hu J-Y, Ong S-L, Ng W-J. A Study on Arsenic Removal from Household Drinking Water[J]. Journal of Environmental Science and Health, Part A, 2003, 38(9): 1731-1744.
[5]Yan W, Ramos MAV, Koel BE, Zhang W-x. As(Ⅲ) Sequestration by Iron Nanoparticles: Study of Solid-Phase Redox Transformations with X-ray Photoelectron Spectroscopy[J]. The Journal of Physical Chemistry C, 2012, 116(9): 5303-5311.
[6]Sun Y, Guan X, Wang J, Meng X, Xu C, Zhou G. Effect of weak magnetic field on arsenate and arsenite removal from water by zerovalent iron: an XAFS investigation[J]. Environmental science & technology, 2014, 48(12): 6850-6858.
[7]Guo X, Yang Z, Dong H, Guan X, Ren Q, Lv Xetal. Simple combination of oxidants with zero-valent-iron (ZVI) achieved very rapid and highly efficient removal of heavy metals from water[J]. Water research, 2016, 88: 671-680.
[8]Wu D L, Shao B B, Fu M Y, Luo C, Liu Z G. Denitrification of nitrite by ferrous hydroxy complex: Effects on nitrous oxide and ammonium formation[J]. Chemical Engineering Journal, 2015, 279: 149-155.
[9]Wu D L, Shao B B, Feng Y, Ma L M. Effects of Cu2+, Ag+, and Pd2+on the reductive debromination of 2,5-dibromoaniline by the ferrous hydroxy complex[J]. Environmental technology, 2014, 36(5-8): 901-908.
[10]冯勇,吴德礼,马鲁铭. 亚铁羟基络合物还原转化水溶性偶氮染料[J]. 环境工程学报, 2012, 6(3): 793-798.
[11]Wenzel W W, Kirchbaumer N, Prohaska T, Stingeder G, Lombi E, Adriano D C. Arsenic fractionation in soils using an improved sequential extraction procedure[J]. Analytica Chimica Acta, 2001, 436: 309-323.
[12]Handley K M, McBeth J M, Charnock J M, Vaughan D J, Wincott P L, Polya D A,etal. Effect of iron redox transformations on arsenic solid-phase associations in an arsenic-rich[J], ferruginous hydrothermal sediment. Geochimica et Cosmochimica Acta, 2013, 102: 124-142.
[13]Mondal P, Balomajumder C, Mohanty B. A laboratory study for the treatment of arsenic, iron, and manganese bearing ground water using Fe3+impregnated activated carbon: effects of shaking time, pH and temperature[J]. Journal of hazardous materials, 2007, 144(1-2): 420-426.
[14]Kartinen E O, Martin J C J. An overview of arsenic removal processes[J]. Desalination, 1995, 103: 79-88.
[15]Jonsson J, Sherman D M. Sorption of As(Ⅲ) and As(V) to siderite, green rust (fougerite) and magnetite: Implications for arsenic release in anoxic groundwaters[J]. Chemical Geology, 2008, 255: 173-181.
[16]Guo H, Li Y, Zhao K. Arsenate removal from aqueous solution using synthetic siderite[J]. Journal of hazardous materials, 2010, 176(1-3): 174-180.
[17]Guo H, Li Y, Zhao K, Ren Y, Wei C. Removal of arsenite from water by synthetic siderite: behaviors and mechanisms[J]. Journal of hazardous materials, 2011, 186(2-3): 1847-1854.
[18]Guo H, Stuben D, Berner Z. Adsorption of arsenic(Ⅲ) and arsenic(V) from groundwater using natural siderite as the adsorbent[J]. Journal of colloid and interface science, 2007, 315(1): 47-53.
[19]Yean S, Cong L, Yavuz C T, Mayo J T, Yu W W, Kan AT, et al. Effect of magnetite particle size on adsorption and desorption of arsenite and arsenate[J]. Journal of Materials Research, 2011, 20(12): 3255-3264.
[20]Iwasaki T, Yoshii H, Nakamura H, Watano S. Simple and rapid synthesis of Ni-Fe layered double hydroxide by a new mechanochemical method[J]. Applied Clay Science, 2012, 58: 120-124.
[21]Guo H, Ren Y, Liu Q, Zhao K, Li Y. Enhancement of arsenic adsorption during mineral transformation from siderite to goethite: mechanism and application[J]. Environmental science & technology, 2013, 47(2): 1009-1016.
[22]Prucek R, Tucek J, Kolarik J, Filip J, Marusak Z, Sharma VK, et al. Ferrate(VI)-induced arsenite and arsenate removal by in situ structural incorporation into magnetic iron(Ⅲ) oxide nanoparticles[J]. Environmental science & technology, 2013, 47(7): 3283-3292.
Arsenic Removal from Water by Structural Ferrous Hydroxy Complex during in Situ Mineral Transformation:Performance and Mechanisms
SHAO Bin-bin, GUAN Yi-yi, WU De-li
(StateKeyLaboratoryofPollutionControl&ResourcesReuse,Shanghai200092,China)
Structural Fe(Ⅱ) on the shell of nano-zerovalent iron are reactive sites for arsenic adsorption. Preparation of well-controlled structural ferrous hydroxy complex (FHC) might be an effective way to avoid the passivation and enhance As removal. As removal by FHC, O2-FHC and Ni2+/Zn2+-FHC was investigated at pH of 7.0~11.0. Results showed that the optimum pH conditions for As(Ⅲ) and As(V) sequestration were ~9.0 and ~7.0, with adsorption capacity estimated from Langmuir isotherm at 25℃ of 349.54 mg/g and 537.85 mg/g for As(Ⅲ) and As(V), respectively. In the presence of O2and heavy metal ions (Ni2+, Zn2+), mineral transformation of FHC was observed, with the formation of lepidocrocite and layered double hydroxides. During the mineral transformation, electron transfer, adsorption and precipitation was promoted by Fe(Ⅱ)/Fe(Ⅲ) and Fe(Ⅱ)/M systems, which showed higher performance for As removal. Special adsorption and coprecipitation were main responsible for As removal during the transformation, and the process of coprecipitation was enhanced. This study provides a new technology to treat As-containing wastewater,as well as a theoretical basis for the immobilization of As during mineral transformation of FHC.
Ferrous hydroxyl complex; arsenic; mineral transformation; adsorption
2016-06-27
国家自然科学基金 (41572211)
邵彬彬(1990-),男,江苏徐州人,2016年毕业于同济大学环境工程专业,主要研究方向为重金属工业废水处理。
吴德礼,wudeli@tongji.edu.cn。
X703.1
A
1001-3644(2016)05-0013-07

