神经调节蛋白1对体外循环心脏停搏大鼠的心肌保护作用研究
罗志方,江美兰,李章红,李文通
·论著·
神经调节蛋白1对体外循环心脏停搏大鼠的心肌保护作用研究
罗志方,江美兰,李章红,李文通
目的探讨神经调节蛋白1(NRG-1)对体外循环(CPB)心脏停搏大鼠的心肌保护作用。方法选取成年健康雄性SD大鼠30只,随机分为正常对照组、模型组、NRG-1预处理组,每组10只。B、C组大鼠参照文献建立CPB模型,NRG-1预处理组大鼠在CPB心脏停搏前30 min腹腔注射NRG-1,正常对照组大鼠置于恒温干净环境中正常喂养。比较3组大鼠血清肌酸激酶同工酶(CK-MB)、乳酸脱氢酶(LDH)、丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)水平及血浆内皮素(ET)、血栓素A2(TXA2)、前列环素(PGI2)水平。结果模型组和NRG-1预处理组大鼠血清CK-MB、LDH、MDA水平及血浆ET、TXA2水平高于正常对照组,血清SOD、GSH-Px水平及血浆PGI2水平低于正常对照组(P<0.05);NRG-1预处理组大鼠血清CK-MB、LDH、MDA水平及血浆ET、TXA2水平及低于模型组,血清SOD、GSH-Px水平及血浆PGI2水平高于模型组(P<0.05)。结论CPB可引起心脏停搏大鼠心肌损伤,NRG-1对CPB心脏停搏大鼠具有一定心肌保护作用。
体外循环;心脏停搏;神经调节蛋白1;心肌;模型,动物
罗志方,江美兰,李章红,等.神经调节蛋白1对体外循环心脏停搏大鼠的心肌保护作用研究[J].实用心脑肺血管病杂志,2016,24(9):55-58.[www.syxnf.net]
LUO Z F,JIANG M L,LI Z H,et al.Myocardial protective effect of neuregulin 1 in rats with cardiac arrest under cardiopulmonary bypass[J].Practical Journal of Cardiac Cerebral Pneumal and Vascular Disease,2016,24(9):55-58.
体外循环又称心肺转流(CPB),是一种将回心静脉血引流出来,经氧合器氧化后再回输到动脉系统进行组织灌注以维持呼吸循环功能的过程。目前,中等程度低温CPB及间断灌注冷心脏停搏液一直是心内科手术过程中进行心肌保护的主要方法,但低温CPB所产生的一系列不良反应以及心脏停搏复搏后的再灌注损伤一直是影响心脏外科手术进一步进展和效果的难题,因此不断摸索心肌保护方法是当前临床心脏外科研究的重点之一。
神经调节蛋白-1(NRG-1)是一种由心脏内皮细胞分泌的重要信号蛋白。NRG-1与表皮生长因子受体(ErbB)的结合具有高度选择性,与酪氨酸激酶受体(ErbB4)结合可诱导产生表皮生长因子受体2(ErbB2)/ErbB4异源二聚体,进而产生一系列生物学效应。现代研究表明,NRG-1/ErbB信号通路与心脏结构形成、心功能维持、心力衰竭的发生发展密切相关[1]。本研究通过建立深低温CPB心脏停搏大鼠模型,旨在探讨NRG-1对大鼠的心肌保护作用,为NRG-1在CPB心脏手术中的应用提供参考,现报道如下。
1 材料与方法
1.1实验材料
1.1.1实验动物选取成年健康雄性SD大鼠30只,月龄2.5~4.5个月,体质量450~550 g,由赣南医学院动物中心提供,动物合格证号:赣实动质字SCXK2008-006;饲养条件:相对恒温干净环境,同一饲料不同笼喂养。术前禁饮禁食10 h,按照赣南医学院动物伦理委员会要求处理大鼠。将所有大鼠随机分为正常对照组、模型组、NRG-1预处理组,每组10只。正常对照组大鼠平均月龄(3.5±0.5)个月,平均体质量(480±30)g;模型组大鼠平均月龄(3.5±0.8)个月,平均体质量(500±20)g;NRG-1预处理组大鼠平均月龄(3.5±0.6)个月,平均体质量(500±30)g。3组大鼠月龄(F=0.366)、体质量(F=1.542)比较,差异无统计学意义(P>0.05),具有可比性。
1.1.2实验试剂2%戊巴比妥钠注射液由宜昌市永诺药业有限公司生产,规格:10 ml/支;NRG-1由上海康朗生物科技有限公司生产,规格:10 μg/支。
1.2实验方法
1.2.1正常对照组正常对照组大鼠置于相对恒温干净环境中,同一饲料笼养观察。
1.2.2模型组参照宋丹丹等[2]研究报道建立大鼠CPB模型并进行一定程度的改良:采用2%戊巴比妥钠溶液50 mg/kg腹腔注射行全身麻醉,然后将监护仪连接至大鼠的左股动脉,回流静脉血通过16G套管经右颈外静脉置入右心房后转流到储血罐,经恒流蠕动泵输送到大鼠专属膜式氧合器进行氧合,再将氧合后的动脉血注入尾动脉,开始时转速为40 ml·kg-1·min-1,逐渐增至100 ml·kg-1·min-1,并维持此转速60 min。其中,血液降温即将储血罐或各引流管道放入冰水混合物中,体表和头部则采取冰袋降温,持续30 min,在此期间将血流量逐渐减至30 ml·kg-1·min-1,一般肛温降至16~18 ℃。当大鼠出现深低温CPB心脏停搏症状,监护仪显示出一条直线时,则将转流泵逐渐减低转速至停机,关闭转流泵,夹闭各引流管。CPB 30 min,血细胞比容(HCT)维持在20%~23%。30 min后开始转流、升温,将储血罐和引流管道放入变温水箱中,使其温度缓慢升至37 ℃,同时进行体表复温(用四盏200 W灯泡直接照射),在升温的同时逐步提高转流量,并时刻监测大鼠的动脉压等生命体征,使用热血仪及加温灯泡对其进行复温,升温时大鼠心脏自主复搏,复温至37 ℃且CPB辅助维持60 min后停止转流。模型建立完成后先拔除右心房静脉插管,降低动脉灌注流量,待大鼠血压恢复至实验前水平后拔除尾动脉插管,继而拔除左股动脉监测插管,继续观察大鼠生命体征,60 min后将大鼠处死并留取其心脏组织和血液送检。
1.2.3NRG-1预处理组NRG-1预处理组大鼠在建立CPB心脏停搏前30 min腹腔注射NRG-1 5 μg/kg。模型建立及心脏停搏、复搏方法同模型组。
1.3观察指标采用全自动生化分析仪检测3组大鼠血清肌酸激酶同工酶(CK-MB)及乳酸脱氢酶(LDH)水平;采用光电比色法检测3组大鼠血清丙二醛(MDA)、超氧化物歧化酶(SOD)及谷胱甘肽过氧化物酶(GSH-Px)水平;采用放射免疫法检测大鼠血浆内皮素(ET)、血栓素A2(TXA2)及前列环素(PGI2)水平。
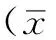
2 结果
模型组和NRG-1预处理组大鼠血清CK-MB、LDH、MDA水平及血浆ET、TXA2水平高于正常对照组,血清SOD、GSH-Px水平及血浆PGI2水平低于正常对照组,差异有统计学意义(P<0.05);NRG-1预处理组大鼠血清CK-MB、LDH、MDA水平及血浆ET、TXA2水平低于模型组,血清SOD、GSH-Px水平及血浆PGI2水平高于模型组,差异有统计学意义(P<0.05,见表1)。

表1 3组大鼠观察指标比较±s)
注:CK-MB=肌酸激酶同工酶,LDH=乳酸脱氢酶,SOD=超氧化物歧化酶,MDA=丙二醛,GSH-Px=谷胱甘肽过氧化物酶,ET=内皮素,TXA2=血栓素A2,PGI2=前列环素;与正常对照组比较,aP<0.05;与模型组比较,bP<0.05
3 讨论
NRG-1是一种由心脏内皮细胞分泌的重要信号蛋白,其可结合心肌细胞表面ErbB4,诱导产生ErbB2/ErbB4异源二聚体。NRG-1与ErbB家族的结合具有高度选择性,其首先以高亲和力的方式与心肌细胞膜上的ErbB4结合(在较高浓度时可与ErhB3结合),诱导受体构象变化形成ErbB2/ErbB4(ErbB3)异源二聚体,继而激活酪氨酸激酶,引起受体C末端酪氨酸磷酸化和反式酪氨酸磷酸化,为下游信号转导分子提供结合位点,结合的蛋白可能是接头蛋白、激酶或磷酸化的酪氨酸,继而启动细胞内信号级联系统,包括NRG-1/ErbB信号系统、心脏型肌球蛋白轻链激酶(cMLCK)/肌球蛋白轻链(MLC-2v)信号系统、磷脂酰肌醇3-激酶(PI3K)/苏氨酸蛋白激酶(AkT)信号系统、细胞外调节蛋白激酶(ErK)信号系统和黏着斑激酶(FAK)信号系统等,进而发挥促进生长和保护心肌细胞的作用[3]。NRG-1/ErbB信号系统作用有精细的步骤,研究表明,存在NRG-1/ErbB信号系统缺陷的心肌细胞可通过抑制副交感神经活性而增强交感神经活性,这一机制可能有益于了解为何该信号系统被抑制时心力衰竭发生的危险性会增加[4]。近年渐有证据表明,NRG-1可通过结合酪氨酸激酶受体而发挥抗炎、调节细胞生长、抑制细胞凋亡、促进血管新生等多重效应,具有广泛的心血管保护作用[5]。NRG-1的多重生物学效应在心脏微血管与心肌细胞间的信号转导过程中具有重要作用[6],加之其可调控RISK通路和JAK/STAT通路,可满足全面激活内源性心肌保护机制的多靶点多效应要求;又有Ⅱ期临床试验证实,NRG-1可改善慢性心力衰竭患者的心功能,临床运用安全且耐受性好[7]。采用NRG-1干预治疗可同时触发多种机制达到预防心肌缺血再灌注损伤的目的,因此,NRG-1是一种有潜力的心肌保护因子[8]。有研究结果显示,造模前给予rhNRG-1对心肌梗死大鼠心率无明显作用,但可减少大鼠心肌梗死面积,同时降低心肌Toll样受体4(TLR4)的mRNA表达水平。因此,初步推测NRG-1可通过下调心肌TLR4的表达来抑制其下游炎性因子的进一步激活,从而减轻炎性反应、保护缺血心肌、减少心肌梗死面积[9]。近年来关于NRG-1的实验研究发现,大鼠建立急性心肌梗死模型24 h后,其梗死区心肌TLR4 mRNA表达水平增加[10-11]。
研究CPB造成各脏器损伤的机制以及保护措施的关键在于建立接近临床的CPB动物模型。理想的大鼠CPB模型应该是操作简便、无血预充、主动脉顺行灌注、全流量、可控性强和存活时间长,建立一个尽可能接近于现代临床的实验模型[12]。宋丹丹等[2]首次成功建立了无血预充CPB心脏停搏大鼠模型。以往研究大鼠心脏停搏复搏CPB模型多是离体实验,多数选择离体心脏Langendo-rf模型[13-14],但该模型最大的问题是与临床实际差距太大,且研究范围有限。GOURLAY等[15]建立的大鼠CPB模型无心脏停搏复搏,持续并行循环,研究CPB期间并无心脏停搏造成的心肌损伤。而本实验中建立的是无血预充深低温心脏停搏CPB大鼠模型,其心脏停搏复搏过程接近临床,完全无血预充,可排除异体血液对机体造成的损伤,避免异体血预充对动物实验的影响。本实验的改良之处如下:(1)采用直接深低温诱发心室颤动心脏停搏技术改进大鼠心脏停搏CPB模型,可有效避免复杂的插管操作,比较安全;(2)采用自制冰毯降温、中心降温并将循环管道置入冰水混合物中;(3)复温时体表升温使用4盏100 W的灯泡直接照射加温,中心复温采用将储血罐和引流循环管道没入变温水箱中加温。但目前在深低温CPB技术中仍缺乏完全有效的温度控制,还需进一步改进。
CPB可暂时替代心肺脏器,既能保证心脏大血管手术的正常开展,又可保证其他重要脏器的基本供血,但其自身固有的不良反应及心脏停搏复搏后引起的心肌损伤一直影响着心脏外科的发展。心肌缺血再灌注损伤时,氧自由基生成增多,氧自由基的清除能力降低,从而造成心肌组织中的氧自由基大量蓄积,引起心肌组织的严重损伤。CK-MB是诊断心肌受损的一种特异性酶学指标;LDH是一种糖酵解酶,可催化乳酸脱氢生成丙酮酸;ET存在于血管内皮及各组织和细胞中,是调节心血管功能的重要因子,对维持基础血管张力与心血管系统稳态具有重要作用;TXA2是一种常用血管收缩剂,可激活血小板,是治愈组织损伤和炎症的常用药,但也会导致心绞痛。因此,在心肌受损时血清CK-MB、LDH水平及血浆ET、TXA2水平均会明显升高。SOD是广泛存在于动、植物体内的一种金属酶,其可催化超氧阴离子等自由基发生歧化反应,消除过剩的氧自由基及其衍生物,保护细胞免受损伤,心肌损伤时其水平会明显降低;MDA是膜脂质过氧化物质,其水平高低间接反映了机体细胞受氧自由基攻击的严重程度,SOD与MDA联合检测可反映组织细胞的氧化损伤程度;GSH-Px是机体内广泛存在的一种重要的过氧化物分解酶;心肌缺血再灌注损伤时,动脉血管内皮功能受损,严重影响冠状动脉血管内皮细胞的PGI2合成,因此在心肌损伤时,血浆PGI2水平会明显降低。本研究结果显示,模型组和NRG-1预处理组大鼠血清CK-MB、LDH、MDA水平及血浆ET、TXA2水平高于正常对照组,血清SOD、GSH-Px水平及血浆PGI2水平低于正常对照组,证实CPB已对大鼠心肌造成损伤;NRG-1预处理组大鼠血清CK-MB、LDH、MDA水平及血浆ET、TXA2水平低于模型组,血清SOD、GSH-Px水平及血浆PGI2水平高于模型组,表明大鼠应用NRG-1预处理后可明显减轻CPB对其造成的心肌损伤。因此,本实验初步证实NRG-1对CPB心脏停搏大鼠具有一定的心肌保护作用。
综上所述,CPB可引起心脏停搏大鼠心肌损伤,而NRG-1对CPB心脏停搏大鼠有一定心肌保护作用。由于本实验中心为医学院科研中心,基础条件有限,建立大鼠CPB心脏停搏模型与临床实际还有差距,如何建立理想的贴近临床CPB心脏停搏大鼠模型将是今后实验的重点;同时由于无电子显微镜,无法观察应用NRG-1后大鼠心脏的细微结构变化,其具体作用还需要进一步探讨。
作者贡献:罗志方进行实验设计与实施、资料收集整理、撰写论文、成文并对文章负责;罗志方、李章红、李文通进行实验实施、评估、资料收集;罗志方、江美兰进行质量控制及审校。
本文无利益冲突。
[1]PENTASSUGLIA L,SAWYER D B.The role of Neuregulin-1beta/ErbB signaling in the heart[J].Exp Cell Res,2009,315(4):627-637.
[2]宋丹丹,高光洁,孙莹杰,等.大鼠无血预充体外循环伴心脏停跳模型的建立[J].中国体外循环杂志,2009,7(4):232-235.
[3]CITRI A,SKARIA K B,YARDEN Y.The deaf and the dumb:the biology of ErbB-2 and ErbB-3[J].Exp Cell Res,2003,284(1):54-65.
[4]OKOSHI K,NAKAYAMA M,YAN X,et al.Neuregulins regulate cardiac parasympathetic activity:muscarinic modulation of beta-adrenergic activity in myocytes from mice with neuregulin-1 gene deletion[J].Circulation,2004,110(6):713-717.
[5] HEDHLI N,KALINOWSKI A,SRUSSELL K.Cardiovascular effects of neuregulin-1/ErbB signaling:role in vascular signaling and angiogenesis[J].Curr Pharm Des,2014,20(30):4899-4905.
[6] PARODI E M,KUHN B.Signalling between microvascular endothelium and cardiomyocytes through neuregulin[J].Cardiovasc Res,2014,102(2):194-204.
[7]JABBOUR A,HAYWARD C S,KEOGH A M,et al.Parenteral administration of recombinant humam neuregulin-1 to patients with stable chronic heart failure produces favourable acute and chronic haemodynamic responses[J].Eur J Heart Fail,2011,13(1):83-92.
[8]周芹,王龙.神经调节蛋白对心肌缺血再灌注损伤保护作用的研究进展[J].疑难病杂志,2015,14(8):876-879.
[9]周芹,王晞,王龙,等.神经调节蛋白1对大鼠缺血心肌的保护作用[J].山西医科大学学报,2015,46(9):837-840.
[10]张云,王阶,郭丽丽,等.活血安心方减轻急性心肌梗死大鼠心肌缺血损伤的实验研究[J].中国中西医结合杂志,2012,32(7):939-943.
[11] SORAYA H,CLANACHAN A S,RAMESHRAD M,et al.Chronic treatment with metformin suppresses toll-like receptor 4 signaling and attenuates left ventricular dysfunction following myocardial infarction[J].Eur J Pharmacol,2014,737:77-84.
[12]徐宁.大鼠体外循环模型建立的研究进展[J].中国体外循环杂志,2013,11(1):57-60.
[13]LI S,LIN J,LENEHAN E,et al.Myocardial protection of warm cardioplegic induction on the isolated perfused rat heart model[J].J Extra Corpor Technol,2004,36(1):58-65.
[14]DOBSON G P,JONES M W.Adenosine and lidocaine:a new concept in nondepolarizing surgical myocardial arrest,protection,and preservation[J].J Thorac Cardiovasc Surg,2004,127(3):794-805.
[15]GOURLAY T,BALLAUX P K,DRAPER E R,et al.Early experience with a new technique and technology designed for the study of pulsatile cardiopulmonary bypass in the rat[J].Perfusion,2002,17(3):191-198.
(本文编辑:李越娜)
Myocardial Protective Effect of Neuregulin 1 in Rats with Cardiac Arrest under Cardiopulmonary Bypass
LUOZhi-fang,JIANGMei-lan,LIZhang-hong,LIWen-tong.
TheFirstAffiliatedHospitalofGannanMedicalCollege,Ganzhou341000,China
JIANGMei-lan,GanzhouHealthSchool,Ganzhou341000,China;E-mail:896728154@qq.com
Objective To investigate the myocardial protective effect of neuregulin 1(NRG-1)in rats with cardiac arrest under cardiopulmonary bypass(CPB).MethodsA total of 30 healthy adult male SD rats were selected and randomly divided into A group,B group and C group,each of 10 rats.Of B group and C group,CPB model was prepared according to the reported literatures,meanwhile rats of C group were given intraperitoneal injection of NRG-1 before 30 minutes of cardiac arrest;rats of A group were normally fed in constant temperature and clean environment.Serum levels of CK-MB,LDH,MDA,SOD and GSH-Px,plasma levels of ET,TXA2and PGI2were compared among the three groups.ResultsSerum levels of CK-MB,LDH and MDA,plasma levels of ET and TXA2of B group and C group were statistically significantly higher than those of A group,while serum levels of SOD and GSH-Px,plasma PGI2level of B group and C group were statistically significantly lower than those of A group(P<0.05);serum levels of CK-MB,LDH and MDA,plasma levels of ET and TXA2of C group were statistically significantly lower than those of B group,while serum levels of SOD and GSH-Px,plasma PGI2level of C group were statistically significantly lower than those of B group(P<0.05).ConclusionCPB may cause myocardial damage in rats with cardiac arrest,while NRG-1 has certain myocardial protective effect in rats with cardiac arrest under CPB.
Extracorporeal circulation;Heart arrest;Neuregulin-1;Myocardium;Models,animal
江西省教育厅科学技术研究项目(14689)
341000江西省赣州市,赣南医学院第一附属医院(罗志方,李章红,李文通);赣州卫生学校(江美兰)
江美兰,341000江西省赣州市,赣州卫生学校;
E-mail:896728154@qq.com
R 541.78
A
10.3969/j.issn.1008-5971.2016.09.014
2016-06-08;
2016-08-22)

