响应面法优化玉米黄粉蛋白水解工艺
张 淼,张美莉,狄寅禘,卢 宇
(内蒙古农业大学食品科学与工程学院,内蒙古呼和浩特 010018)
响应面法优化玉米黄粉蛋白水解工艺
张淼,张美莉*,狄寅禘,卢宇
(内蒙古农业大学食品科学与工程学院,内蒙古呼和浩特 010018)
采用碱性蛋白酶制备高水解度的玉米蛋白酶解物,以水解度为考察指标,设计单因素及响应面实验,优化其水解工艺条件。实验结果表明:最佳水解工艺条件为底物浓度23 g/L,加酶量(E/S)3.5%,酶解温度49.7 ℃,酶解时间4 h,pH为9.0,在此条件下,水解度可达到27.18%。
玉米黄粉,蛋白质,碱性蛋白酶,水解度,响应面法
玉米蛋白粉工厂俗称“黄粉”,是湿法生产玉米淀粉的副产品,其蛋白质含量一般在60%左右,是一种优质的蛋白质资源。但玉米黄粉气味独特、口感粗糙、水溶性差、氨基酸组成不均衡,极大的限制了其在食品工业中的应用,目前我国主要将其用于饲料或自然排放,造成了蛋白资源的极大浪费和环境污染[1]。
为了提高玉米黄粉的附加值和完善玉米加工产业链,不少国内外学者已经开始研究水解玉米黄粉制备生物活性肽[2],它不仅有比蛋白质更好的消化吸收性,还具有促进免疫、调节激素、抗菌、抗病毒、降血压和降血脂等生理机能[3]。而在所有的水解方法中,酶法水解因其可控而温和的反应条件、较高的产品质量及大规模的商业可用性被认为是最合适的方法[4-6]。
未经处理的玉米黄粉中含有黄色素,且残余淀粉颗粒与玉米蛋白质紧密结合[7],不利于蛋白质的提取,因此玉米黄粉需进行脱色、脱淀粉处理后再进行玉米蛋白的提取。玉米蛋白是高度多样化的蛋白质,成分包括白蛋白、球蛋白、谷蛋白和醇溶蛋白[8],其中68%以上是醇溶蛋白,22%是谷蛋白,另有1.2%的球蛋白和极少量白蛋白[9]。本研究以预处理玉米黄粉中提取得到的玉米蛋白为原料,采用碱性蛋白酶制备高水解度玉米蛋白酶解物,并确定最优水解条件包括底物浓度、酶浓度、温度、时间和pH,为后续研究高水解度玉米蛋白酶解物经体外消化后所得消化产物的抗氧化性提供理论依据。
1 材料与方法
1.1材料与仪器
玉米黄粉(蛋白含量57.24%)山东福洋生物科技有限公司;α-淀粉酶(3900 U/g)北京澳博星生物技术有限责任公司;糖化酶(10 WU/g)北京中生瑞泰科技有限公司;碱性蛋白酶(20 WU/g)北京博奥拓达科技有限公司。
DKB-501A型超级恒温水槽上海森信实验仪器有限公司;SHZ-88-1水浴恒温振荡器上海雅荣生化设备仪器有限公司;PB-10酸度计美国赛多利斯公司;TV-1漩涡混合器北京北德科学器材有限公司;3-18K高速冷冻离心机德国Sigma公司;T6新世纪紫外可见分光光度计北京普析通用仪器有限责任公司;FD-2冷冻干燥机北京博医康实验仪器公司。
1.2实验方法
1.2.1玉米黄粉的预处理参照孙强[7,10]等的方法并做适当改进,玉米黄粉粉碎,过40目筛,以料液比1∶10(W/V)加入无水乙醇,70 ℃水浴振荡萃取2 h脱色,离心(6000 r/min,20 min),倾去上清液,沉淀干燥。重复操作两次,脱色完成。将脱色玉米黄粉以料液比1∶3(W/V)加入超纯水,90 ℃糊化1 h后,调节pH5.5,60 ℃,加入2%(E/S)的α-淀粉酶,反应至碘实验不产生蓝色,调节pH至4.8,45 ℃,加入3%(E/S)的糖化酶,水解4 h,沸水浴灭酶30 min,离心(6000 r/min,20 min),倾去上清液,沉淀干燥,得预处理玉米黄粉。
1.2.2玉米蛋白的提取参照崔立平[11]的方法并做适当改进,将预处理玉米黄粉以料液比1∶16(W/V)加入超纯水,用1 mol/L NaOH调节pH至11.0,静置15 min,用1 mol/L NaOH调节pH至11.0,65 ℃水浴振荡2 h,离心(6000 r/min,20 min)取上清液,用1 mol/L HCl调节pH至4.0,静置15 min,离心(6000 r/min,20 min),倾去上清液,沉淀用超纯水洗涤2次,调节pH至7.0,冷冻干燥,得玉米蛋白。
1.2.3玉米蛋白酶解物制备将玉米蛋白制成均匀的悬浊液,用1 mol/L的NaOH调节至适当pH,加入一定量的碱性蛋白酶,于恒温水浴中进行水解,并保持pH恒定,水解若干小时后调节pH至7.0,并迅速沸水浴中灭酶15 min,冷却后离心(6000 r/min,20 min),取上清液即为玉米蛋白酶解物。
1.2.4水解度(DH)的测定采用茚三酮法[12]。
式中:h-水解后每克蛋白质被裂解的肽键毫摩尔数,mmol/g;htot-每克原料蛋白质的肽键毫摩尔数,mmol/g;玉米蛋白htot为7.35 mmol/g;c-水解液中游离氨基浓度,μmol/mL;ρ-水解液中蛋白质质量浓度,mg/mL;m-每克原料蛋白质的游离氨基的毫摩尔数,0.06426 mmol/g。
1.2.5不同因素对水解度的影响
1.2.5.1底物浓度对水解度的影响在pH9.0、加酶量(E/S)2%、酶解温度50 ℃条件下水解4 h,测定不同底物浓度(10、30、50、70、90 g/L)下的水解度,3次平行实验,取平均值,以水解度为考察指标,做水解度随底物浓度变化曲线。
1.2.5.2pH对水解度的影响在底物浓度30 g/L、加酶量(E/S)2%、酶解温度50 ℃条件下水解4 h,测定不同pH(8.0、8.5、9.0、9.5、10.0)下的水解度,3次平行实验,取平均值,以水解度为考察指标,做水解度随pH变化曲线。
1.2.5.3加酶量对水解度的影响在底物浓度30 g/L、在pH9.0、酶解温度50 ℃条件下水解4 h,测定不同加酶量(E/S)(1%、2%、3%、4%、5%)下的水解度,3次平行实验,取平均值,以水解度为考察指标,做水解度随加酶量变化曲线。
1.2.5.4酶解温度对水解度的影响在底物浓度30 g/L、pH9.0、加酶量(E/S)2%条件下水解4 h,测定不同酶解温度(40、45、50、55、60 ℃)下的水解度,3次平行实验,取平均值,以水解度为考察指标,做水解度随酶解温度变化曲线。
1.2.5.5酶解时间对水解度的影响在底物浓度30 g/L、pH9.0、加酶量(E/S)2%、酶解温度50 ℃条件下水解,测定不同酶解时间(3.0、3.5、4.0、4.5、5.0 h)下的水解度,3次平行实验,取平均值,以水解度为考察指标,做水解度随酶解时间变化曲线。
1.2.6响应面优化设计在单因素实验基础上,选取加酶量、酶解温度、底物浓度3个因素为自变量,水解度为响应值,根据Box-Behnken中心组合设计原理设计3因素3水平实验,其中-1、0、1代表各因素的低、中、高水平,实验因素水平编码表见表1。

表1 因素水平及编码
1.3数据处理
本研究采用Excel和Design Expert 8.0软件完成数据的处理及分析。
2 结果与分析
2.1单因素实验结果
2.1.1底物浓度对水解度的影响由图1可知,当底物浓度为30 g/L时,水解度达到最大,底物浓度超过30 g/L时,水解度随底物浓度增高反而减小,其原因可能是底物浓度增大后,蛋白不能充分浸润,进而影响了酶对蛋白的作用[13],故选取30 g/L的底物浓度为最佳。

图1 底物浓度对水解度的影响Fig.1 Effect of substrate concentration on degree of hydrolysis
2.1.2pH对水解度的影响由图2可知,当pH为9时,水解度达到最大,pH超过9时,水解度随pH增高反而减小,故选取pH9.0为最佳。pH的改变能影响酶活性中心上必需基团的解离程度,同时影响底物和辅酶的解离程度,从而影响酶分子对底物分子的结合和催化作用[14]。

图2 pH对水解度的影响Fig.2 Effect of pH on degree of hydrolysis
2.1.3加酶量对水解度的影响由图3可知,水解度随加酶量的增高而持续增大,当加酶量低于3%时,水解度迅速增大,而加酶量高于3%时,水解度增大幅度很小。这可能因为底物浓度一定的情况下,加酶量未使底物饱和时,酶浓度越大,对肽段的切割作用越大,水解度越大;当加酶量增加到一定值时,反应体系内酶过量,底物被酶所饱和,底物上可供酶所切割的位点有限,再增加酶量,水解度也不会有更大的变化[15]。因此从经济角度考虑,选择3%的加酶量为最佳。

图3 加酶量对水解度的影响Fig.3 Effect of proteases dosage on degree of hydrolysis
2.1.4酶解温度对水解度的影响由图4可知,当温度为50 ℃时,水解度达到最大,温度超过50 ℃时,水解度随温度升高反而减小,这是因为酶分子吸收了过多的能量,引起维持酶分子结构的次级键解体,导致蛋白质空间结构发生改变,使得酶活力减弱[14],故选取温度50 ℃为最佳。

图4 酶解温度对水解度的影响Fig.4 Effect of hydrolysis temperature on degree of hydrolysis
2.1.5酶解时间对水解度的影响由图5可知,水解度随时间的增长而持续增大,当时间小于4 h时,水解度迅速增大,而时间大于4 h时,水解度增大幅度很小,这是因为随着产物的增加,酶可作用的肽键逐渐减少,酶催化反应达到平衡状态,酶活力受到抑制[16]。因此从效率角度考虑,选择时间4 h为最佳。
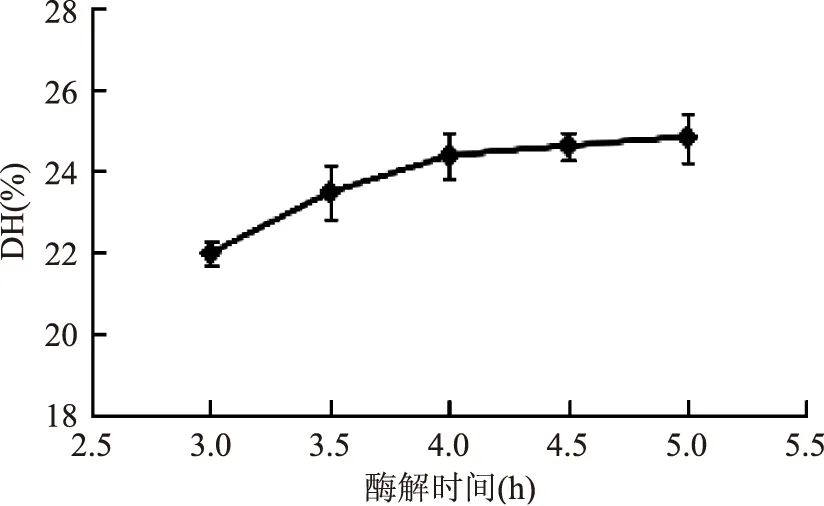
图5 酶解时间对水解度的影响Fig.5 Effect of hydrolysis time on degree of hydrolysis
2.2响应面实验结果与分析
2.2.1响应面实验结果与方差分析根据单因素实验结果,选取A加酶量,B酶解温度,C底物浓度进行3因素3水平的响应面分析实验,实验设计及结果见表2。

表2 响应面实验设计及结果
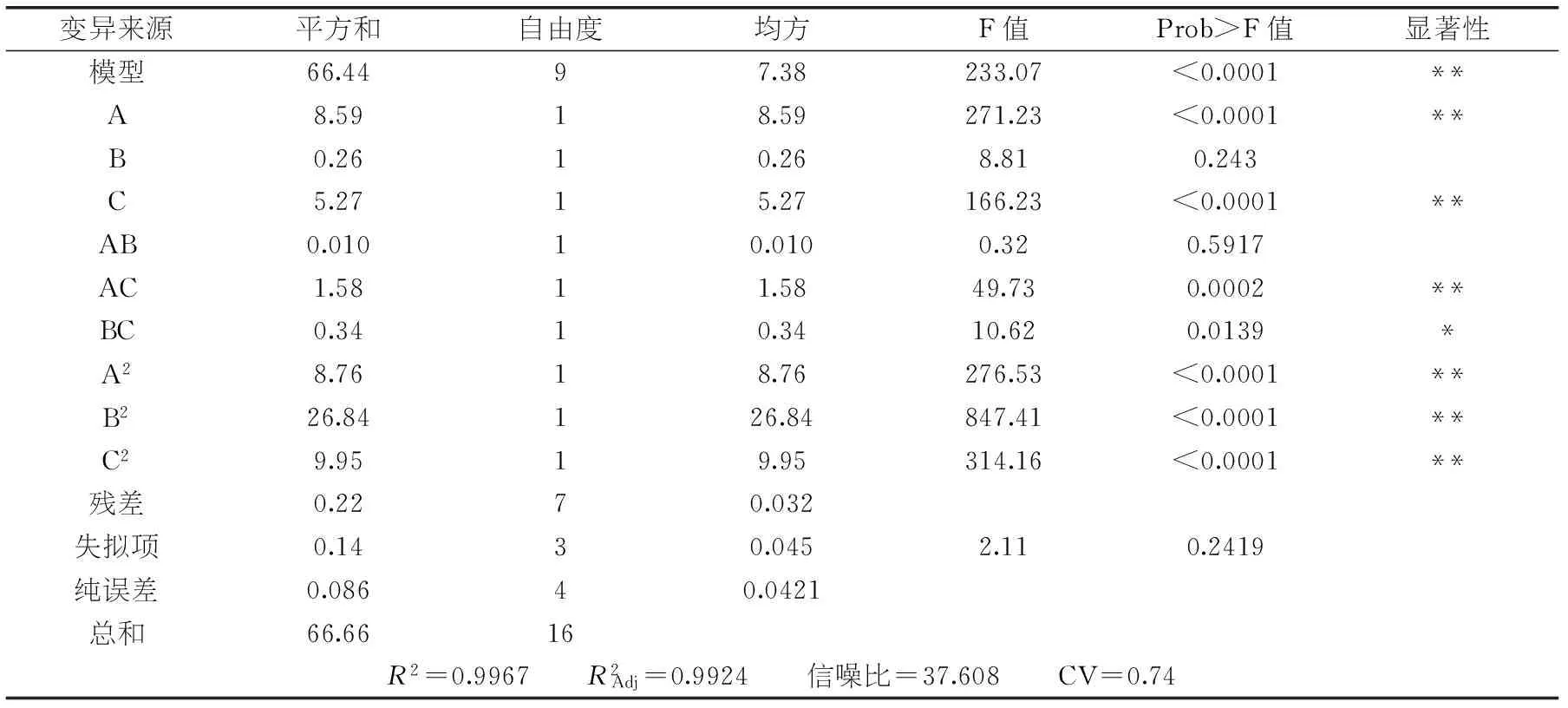
表3 回归模型方差分析
注:*表示差异显著(p<0.05);**表示差异极显著(p<0.01)。
根据表2的实验数据,利用Design Expert 8.0软件对数据进行回归分析,拟合后得到水解度(Y)与加酶量(A),酶解温度(B)和底物浓度(C)的二次多项回归方程为:
Y=+26.67+1.04A-0.18B-0.81C-0.050AB-0.63AC+0.29BC-1.44A2-2.52B2-1.54C2
回归方程的方差分析见表3。由表3可知,模型(p<0.0001)极显著,失拟项(p=0.2419>0.05)不显著,R2=0.9967,表明该模型相关性好,预测值与实际值拟合度良好。各因素对水解度影响的先后顺序为:加酶量>底物浓度>酶解温度。一次项A和C影响极显著,B影响不显著,表明加酶量和底物浓度对水解度影响都很大。交互项中AC影响极显著,BC影响显著,AB影响不显著,表明加酶量与底物浓度、温度与底物浓度都存在交互作用,由此可知各因素对水解度的影响并不是简单的线性关系[17]。二次项A2、B2和C2影响均极显著。

图6 各因素两两间交互作用对水解度影响的响应曲面图Fig.6 Response surface plots of variable parameters on degree of hydrolysis
2.2.2响应曲面分析在回归模型方差分析的基础上,根据回归方程,利用Design Expert 8.0软件得到具有显著和极显著交互作用的任意两因素响应曲面图和等高线图,如图6所示。等高线的形状可以反映出交互效应的强弱,椭圆形表示两因素交互作用显著,而圆形与之相反[18]。另外,同一等高线图中,等高线密度大的因素对响应值的影响大于等高线密度小的因素。由图6可以看出,底物浓度与加酶量对水解度影响极显著,当酶解温度固定为50 ℃,底物浓度在23 g/L左右,加酶量(E/S)在3.45%左右时水解度达到最大值;当加酶量(E/S)在3%时,水解度受酶解温度和底物浓度交互作用影响较大,在一定范围内水解度随着酶解温度和底物浓度的升高而增大,当酶解温度在49.75 ℃左右,底物浓度在24 g/L左右,水解度达到极值,但随着酶解温度和底物浓度的逐渐升高,水解度反而减小。
2.2.3验证实验利用Design Expert 8.0软件,对所建立的数学模型进行参数最优化分析,得到优化水解工艺条件为:加酶量(E/S)3.44%,酶解温度49.7 ℃,底物浓度22.8 g/L,理论水解度为27.05%。为方便实际操作,修正加酶量为3.5%,底物浓度为23 g/L,酶解温度保持不变,在酶解时间4 h、pH9.0下重复进行3次平行实验,实际测得平均水解度为27.18%,与理论值相差约0.50%。因此,各工艺参数合理可靠,具有实际应用价值。
3 结论
本研究通过单因素实验确定碱性蛋白酶水解玉米蛋白的初始水解条件为底物浓度30 g/L,pH9.0,加酶量(E/S)3%,酶解温度50 ℃,酶解时间4 h。在此基础上,进行响应面分析实验,确定各因素对水解度影响的先后顺序为:加酶量>底物浓度>酶解温度,并得到最佳水解工艺条件:加酶量(E/S)3.5%,酶解温度49.7 ℃,底物浓度23 g/L,酶解时间4 h,pH9.0,在此条件下测得水解度可达到27.18%。通过回归方程的方差分析可知,该模型对实验拟合度较高,应用该模型优化水解工艺条件可靠。
[1]刘振春,董源,王朝晖. 碱性蛋白酶水解玉米蛋白工艺条件的研究[J]. 食品科学,2008,29(11):130-133.
[2]刘金伟,楚杰,史建国,等. 玉米蛋白粉预处理及碱性蛋白酶水解的研究[J]. 农业机械,2011(29):100-102.
[3]张美莉,侯文娟,杨立风,等. 植物蛋白源生物活性肽的研究进展[J].中国食物与营养,2010(11):33-36.[4]DinakarPanyam,Arun Kilara. Enhancing the functionality of food proteins by enzymatic modification[J]. Trends in Food Science and Technology,1996,7(4):120-125.
[5]A Clemente. Enzymatic protein hydrolysates in human nutrition[J]. Trends in Food Science and Technology,2000,11(7):254-262.
[6]Aoife L McCarthy,Yvonne C O Callaghan,Nora M O Brien. Protein hydrolysates from agricultural crops-bioactivity and potential for functional food Development[J]. Agriculture,2013,3(1):112-130.
[7]权文吉. 酸性蛋白酶水解玉米蛋白粉的研究[D]. 大连:大连理工大学,2007.
[8]Kequan Zhou,Shi Sun,Corene Canning. Production and functional characterisation of antioxidative hydrolysates from corn protein via enzymatic hydrolysis and ultrafiltration[J]. Food Chemistry,2012,135:1192-1197.
[9]吴亚梅,陈健,李维锋. 玉米蛋白粉深加工应用的新进展[J]. 现代食品科技,2007,23(4):97-100.
[10]孙强,黄纪念,宋国辉,等. 玉米黄色素萃取工艺优化研究[J]. 中国食物与营养,2011,17(12):57-59.
[11]崔立平. 玉米胚芽油生产副产物—玉米胚芽粕中蛋白质提取的研究[D]. 济南:山东轻工业学院,2012.
[12]赵新淮,冯志彪. 蛋白质水解物水解度的测定[J]. 食品科学,1994,11:65-67.
[13]钱方,邓岩,王凤翼,等. 碱性内切蛋白酶水解大豆蛋白的研究[J]. 大连轻工业学院学报,2000,19(1):40-44.
[14]郑明洋,王元秀,张桂香,等. 响应面法优化玉米黄粉蛋白的酶解工艺[J]. 食品科学,2012,33(4):71-76.
[15]吴瑶,侯俊财,曹秋阁. 不同大豆蛋白源和蛋白酶对蛋白水解度的影响[J].食品工业,2014,35(2):154-157.
[16]云霞,朱蓓薇,吴海涛,等. 玉米黄粉蛋白酶解过程的研究及产物分析[J]. 食品科学,2003,24(5):75-78.
[17]刘振春,耿存花,孙慧娟,等. 响应面优化超声波-微波协同提取高粱醇溶蛋白工艺[J]. 食品科学,2014,35(4):21-25.
[18]李超. 绿茶茶多酚的微胶囊化及其释放性能研究[J]. 食品工业,2014,35(11):59-63.
Optimization of hydrolysis technology of corn gluten meal by response surface methodology
ZHANG Miao,ZHANG Mei-li*,DI Yin-di,LU Yu
(College of Food Science and Engineering,Inner Mongolia Agricultural University,Huhhot 010018,China)
The corn polypeptide with high degree of hydrolysis(DH)was prepared by alkaline protease,with corn protein as raw material and degree of hydrolysis as detecting index by mono-factor analysis and response surface methodology. The results showed that under the optimal conditions:substrate concentration 23 g/L,proteases dosage 3.5%,hydrolysis temperature 49.7 ℃,hydrolysis time 4 h and pH 9.0,the degree of hydrolysis was 27.18%.
corn gluten meal;protein;alkaline protease;degree of hydrolysis;response surface methodology
2016-02-19
张淼(1990-),女,硕士研究生,研究方向:特色农产品加工,E-mail:miaomiao10010@126.com。
张美莉(1966-),女,博士,教授,研究方向:植物生物活性成分的分离提取,E-mail:zhangmeili22@sina.com。
内蒙古自然科学基金(2013MS1221)。
TS201.3
A
1002-0306(2016)16-0201-05
10.13386/j.issn1002-0306.2016.16.031

