降解β-胡萝卜素双加氧酶的分离纯化及其部分酶学性质
郑坚强,侯建光,2,时锦锦,赵 楠,彭新榜,司俊玲
(1.郑州轻工业学院食品与生物工程学院,河南郑州 450002;2.河南仰韶酒业有限公司,河南渑池 472400)
降解β-胡萝卜素双加氧酶的分离纯化及其部分酶学性质
郑坚强1,侯建光1,2,时锦锦1,赵楠1,彭新榜1,司俊玲1
(1.郑州轻工业学院食品与生物工程学院,河南郑州 450002;2.河南仰韶酒业有限公司,河南渑池 472400)
研究了西方许旺酵母菌发酵产生双加氧酶的分离纯化及其酶学特性,并利用该酶降解β-胡萝卜素生成香味物质。通过摇瓶发酵,并对粗酶液进行硫酸铵梯度沉淀、半透膜透析、DEAE-Sepharose离子交换和Sephadax G-100凝胶过滤等处理,得到转化β-胡萝卜素生成香气物质的双加氧酶。实验结果表明,西方许旺酵母菌发酵产生的双加氧酶被纯化了36.43倍,酶活力回收率为21.0%,分子量为55.0 ku。酶的最适温度为40 ℃,最适pH为8.5;金属离子对降解β-胡萝卜素双加氧酶活力的影响为:Fe2+>Mg2+>K+>Na+>Mn2+>Cu2+>Ca2+>Zn2+>Ag+。Fe2+和Mg2+能明显增强酶活力,而Zn2+和Ag+能抑制酶活力;SDS和胃酶抑素对酶活力有显著抑制作用。降解β-胡萝卜素双加氧酶的Km=8.24×10-4mol/L,Vmax=2.16×10-4mol/(min·mg)。
西方许旺酵母,双加氧酶,分离纯化,酶学性质
类胡萝卜素是链状或环状含有8个异戊间二烯单位、四萜烯类头尾连接而成的多异戊间二烯化合物,是一类不溶于水的色素,存在于植物和有光合作用的细菌中,在光合作用过程中起辅助色素的作用,其中β-胡萝卜素和番茄红素是常见的类胡萝卜素[1-2]。类胡萝卜素经过降解可以产生β-紫罗兰酮、二氢猕猴桃内酯和β-环柠檬醛等化合物,这些化合物具有花香和果香的风味[3-5],阈值低,呈现花香味的β-紫罗酮和β-大马酮的特征阈值在水中分别为0.007 g/L和0.009 g/L[6],是潜在高效的风味化合物[7-9],因此,在香精香料行业引起了极大的关注。其中,β-紫罗兰酮香料的添加可增加食品的风味;β-大马酮,β-二氢大马酮和β-紫罗兰酮等化合物对玫瑰精油中的香味起主要作用。目前,在香精香料的行业,研究热点是通过真菌等微生物以及添加酶使类胡萝卜素降解,利用生物技术生产这类挥发性化合物[10]。
近几年,已经开展了降解类胡萝卜素生成香气物质的双加氧酶相关研究。文献中提取制备方案不同,得到的双加氧酶产物各异。Peter Fleischmanna等[11]通过裂解杨桃皮胡萝卜素得到了分子量为12~98 ku较纯的酶。Zorn H等[6]发现食用菌类Pleurotus eryngii上有降解β-胡萝卜素生成单一、倍半、三倍和四萜烯等产物的过氧化物酶。Manuela S等[12]对担子菌Marasmiusscorodonius(大蒜蘑菇)进行培养,分离纯化得到了高效降解β-胡萝卜素的胞外酶MsP1和MsP2。Thomas B等[13]研究发现烟曲霉中植物抗毒素中的类胡萝卜素裂解氧化酶能够断裂类胡萝卜素中Cα-Cβ的双键,并对该氧化酶进行了纯化和定性分析。双加氧酶来源广泛,其中由微生物产生的氧化酶(双加氧酶)可裂解β-胡萝卜素生成β-紫罗兰酮等香味物质化合物。不同微生物产生的双加氧酶的组成不同,造成双加氧酶对底物作用的效果不一,导致酶解效率不同,致使香味物质产量差别大。因此,只有得到纯酶,才能研究酶解类胡萝卜素生成香味物质降解机制、分析双加氧酶分子结构。本实验以一株具有潜在应用价值的西方许旺酵母菌(Schwanniomycesoccidentalis)为研究对象,对其发酵粗酶液进行硫酸铵梯度沉淀、半透膜透析、DEAE-Sepharose离子交换和Sephadax G-100凝胶过滤等处理,以得到转化β-胡萝卜素生成香气物质的双加氧酶,同时对双加氧酶的酶学性质进行研究,为该酶在香精香料工业中的应用进行前期探索工作。
1 材料与方法
1.1材料与仪器
西方许旺酵母(Schwanniomycesoccidentalis)由本实验室分离鉴定;DEAE SePharose FastFlowAmersham Bioseienees公司;Sephadax G-100Amersham Bioseienees公司;BCA、低分子量标准蛋白上海生物化学研究所;其余试剂均为国产分析纯;发酵培养基10 g/L葡萄糖、11 g/L蛋白胨、5 g/L酵母粉、琼脂粉20 g/L、0.2 g/L FeSO4、0.45 g/L MgSO4·7H2O、3.0 g/L NaNO3、0.5 g/L KCl,121 ℃,灭菌20 min。
AKTA FPLC层析系统DEAE Sepharose Fast Flow离子交换,GE Healthcare公司;Sephadax G-100凝胶过滤柱GE Healthcare公司;TU-1800PC型紫外可见分光光度计北京普析通用仪器有限公司;水浴恒温振荡器深圳天南海北有限公司;MicroCL17型冷冻高速离心机美国热电公司;电热鼓风干燥箱上海阳光实验仪器有限公司;Gel Doe 1000型凝胶成像仪美国Bio-RAD公司;Veriti 96-Well Thermal Cycler型荧光定量PCR仪美国Applied Systems公司;LyoLab3000型冻干机Thermo Fisher Heto公司;超低温冰箱SANYO公司;HH-B11-500型电热恒温培养箱上海市跃进医疗器械一厂;PHS-3C型精密酸度计上海大普仪器有限公司;HZQ-F160恒温振荡培养箱太仓市实验设备厂;电泳仪Alllersham Bioseienees公司;电泳槽Amersham Bioseienees公司等。
1.2实验方法
1.2.1发酵液的制备将西方许旺酵母菌(Schwanniomycesoccidentalis)在培养基中活化两次(避光,28 ℃,培养48 h),使菌体生长达到对数生长期,接入150 mL液体种子培养基中,28 ℃振荡培养72 h,按5%的接种量接入盛有5 L发酵培养基的发酵罐中培养5 d(避光,28 ℃,160 r/min)。反应结束后,使用布氏漏斗过滤发酵液,离心(10000 r/min,20 min)取上清液,滤纸过滤,收集滤液。
1.2.2硫酸铵分级沉淀过滤后的发酵液,在1000 r/min下离心10 min后得粗酶液,向粗酶液中分别加硫酸铵粉末至浓度为20%、30%、40%、50%、60%、70%、80%和90%。4 ℃下静置过夜后,在10000 r/min,4 ℃条件下离心20 min,取上清液测定酶活力,以酶活力为指标来确定硫酸铵的饱和浓度。
1.2.3透析将盐析所得的粗酶加入预先处理好的透析袋中,粗酶液占透析袋的2/3,空气排净,两端封闭,放入磷酸缓冲溶液(pH7.4)中在4 ℃下透析,每隔6 h更换缓冲溶液一次,透析24~48 h,同时检测脱盐情况,直至外界溶液的pH、电导率与平衡缓冲液一致为止。
1.2.4DEAE Sepharose Fast Flow离子交换层析
1.2.4.1DEAE Sepharose Fast Flow离子交换洗脱pH的选择在pH3~10范围内,采用Pharmacia的Test-tube实验法初步确定等电点未知蛋白质进行阴离子交换所选择的缓冲体系pH。吸取3 mL经该低温透析脱盐的酶液于相应pH的缓冲液中,作用15 min后,分别吸取上清液测定酶活力。
1.2.4.2DEAE Sepharose Fast Flow离子交换层析首先DEAE-Sepharose-F.F.离子交换柱(1.0 cm×20 cm)用含有0.5 mol/L NaCl缓冲溶液平衡,以3.0 mL/min的速度洗脱3个柱体积,直至流出液的pH与缓冲液相同。然后将经过透析后的酶液上样于预装好的DEAE-Sepharose-F.F.离子交换柱,然后在4 ℃温度下,用0.5 mol/L的NaCl盐溶液以2.0 mL/min流速进行线性洗脱。自动分步收集仪每3 mL收集一管洗脱液,同时采用考马斯亮兰法在280 nm和450 nm处分别检测每管洗脱液的蛋白含量及酶活力,并收集具有酶活力的组分。将收集的酶液透析后4 ℃保存备用[14]。
1.2.5Sephadax G-100凝胶过滤离子交换得到的组分经离心(10000 r/min)20 min后,上样到预先用0.2 mol/L NaCl、pH6.5的0.04 mol/L Na2HPO4-KH2PO4缓冲液平衡的Sephadax G-100层析柱(1.6 cm×70 cm)上,用同样的缓冲液洗脱,洗脱流速为1.0 mL/min,按3 mL/管收集。同时检测每管洗脱液的蛋白含量及酶活力,并收集具有酶活力的组分,于4 ℃保存。
1.2.6酶活力测定取5 mL酶液(提前在37 ℃水浴中保温)并加入500 μLβ-胡萝卜素储备液,加入光程1 cm的玻璃比色皿中,以未加β-胡萝卜素储备液的粗酶液作对照,立刻在450 nm处测其吸光值,测完后立即在37 ℃避光水浴,每隔1 min测定一次吸光度。酶活力单位定义:在37 ℃,pH6.5,每分钟降解1 μmolβ-胡萝卜素所需的酶量为一个单位。
降解率=(原有β-胡萝卜素含量-现有β-胡萝卜素含量)/原有β-胡萝卜素含量
酶活力=(C0-Ct)×(5.0+0.5)/5.0×t
其中:C0-初始β-胡萝卜素含量(μmol/L);Ct-t min后β-胡萝卜素含量(μmol/L);t-为时间(min)。
1.2.7蛋白质浓度测定采用考马斯亮兰法检测[15]。
1.2.8SDS-聚丙烯酰胺凝胶电泳酶纯度的鉴定:采用SDS-聚丙烯酞胺凝胶电泳(SDS-PAGE)方法进行[16]。
降解β-胡萝卜素双加氧酶分子量的测定:采用SDS-PAGE电泳检测降解β-胡萝卜素双加氧酶分子量。将样品及已知分子量的标准蛋白进行SDS-PAGE电泳。以分子量标准蛋白为标准,5%浓缩胶,电压80 V下电泳约30 min后,样品进入分离胶,于12.5%分离胶中120 V电压下电泳约3 h。电泳完毕后,经染色、脱色,扫描得图片,根据纯酶样品和标准蛋白的SDS-PAGE电泳图测定样品和标准蛋白的相对迁移率Rf值,得出纯酶的分子量大小[17]。
1.2.9降解β-胡萝卜素双加氧酶酶学性质研究
1.2.9.1温度对降解β-胡萝卜素双加氧酶活力的影响量取1 mL 0.01%的β-类胡萝卜素溶液于试管中,加入0.5 mL缓冲液摇匀,在25~60 ℃的恒温水浴锅中预热5 min,再加入稀释酶液各1 mL,反应60 min,测定酶活力。将稀释酶液置于30~60 ℃不同温度下的恒温水浴锅中,每隔60 min,立即测定残余酶活力。
1.2.9.2pH对降解β-胡萝卜素双加氧酶活力的影响配制缓冲液有NaHPO4-柠檬酸缓冲液(pH2.6~7.6)、硼砂-硼酸缓冲液(pH7.4~8.0)和甘氨酸-氢氧化钠缓冲液(pH8.6~10.6)。将浓缩后纯酶液分别用0.05 mol/L的不同缓冲液稀释,置于4 ℃保存60 min,测定酶活力,分析pH对蛋白酶稳定性的影响。将酶分别在不同pH的缓冲液中,4 ℃下放置5 h,取1 mL酶液加入1 mLβ-类胡萝卜素溶液,调节反应体系的pH,测定酶活力。
1.2.9.3金属离子对降解β-胡萝卜素双加氧酶活力的影响在最适温度40 ℃,最适pH8.5,反应15 min,β-类胡萝卜素底物浓度1.0×10-4g/L的反应体系中,分别加入终浓度为1 mmol/L和5 mmol/L的Fe2+、Mg2+、K+、Na+、Mn2+、Cu2+、Ca2+、Zn2+和Ag+9种金属盐离子,于4 ℃下,混合后放置60 min,测定不同离子对酶活力的影响。空白对照组为加同等体积蒸馏水的双加氧酶液,以空白组酶活力为100%,研究金属离子对相对酶活力的影响。
1.2.9.4蛋白抑制剂对降解β-胡萝卜素双加氧酶的酶活力影响将乙二胺四乙酸(EDTA)、十二烷基硫酸钠(SDS)、碘乙酰胺、PMSH以及胃酶抑素等蛋白抑制剂分别以1 mmol/L和5 mmol/L的浓度(除胃酶抑素浓度为0.0025、0.001 mmol/L)与纯化蛋白酶混合,4 ℃放置60 min,测定剩余酶活力。加同等体积蒸馏水的双加氧酶酶液为对照,根据酶的活性,研究蛋白抑制剂对酶活力的影响。
1.2.9.5降解β-类胡萝卜素的双加氧酶酶促反应动力学经反复预实验,调节反应底物β-类胡萝卜素的浓度为0.3×10-4~6×10-4g/L,按1.2.6方法测定酶活力。根据Lineweaver-Burk作图法,求出酶的米氏常数Km和最大反应速度Vmax。
1.3数据处理
采用SPSS13.0软件处理;Duncan’s多重比较。处理是在相同浓度下进行差异显著性比较。
2 结果与讨论
2.1粗酶硫酸铵分级沉淀
硫酸铵分级沉淀降解β-类胡萝卜素双加氧酶粗酶变化情况,如图1所示。
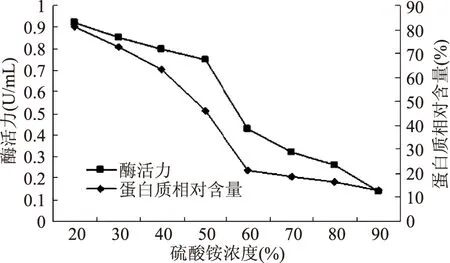
图1 硫酸铵沉淀上清液酶活力及蛋白质相对含量变化曲线Fig.1 Effect of ammonium sulphate content on the dioxygenase activity and proteincontent of filtrate after precipitation
由图1可见,在硫酸铵浓度为20%~50%时,降解β-胡萝卜素双加氧酶沉淀较慢,这一饱和范围内酶蛋白损失不大;在硫酸铵浓度为60%~90%时,β-胡萝卜素裂解双加氧酶沉淀迅速,可以认为此时已基本完全沉淀。硫酸铵浓度为50%时,上清液中β-胡萝卜素双加氧酶酶活力为0.78U/mL;而浓度为60%时,酶活力为0.42 U/mL,继续提高硫酸铵浓度到70%时,上清液中酶活力为0.31 U/mL,而继续提高硫酸铵浓度达90%时,上清液中酶活力为0.13 U/mL,明显低于硫酸铵浓度60%时上清液的酶活力。因此,实验选用60%浓度硫酸铵进行沉淀。
2.2DEAE Sepharose Fast Flow离子交换洗脱液pH的选择
采用不同pH离子交换洗脱液进行洗脱,确定离子交换的最佳pH。实验结果见图2。

图2 降解β-胡萝卜素双加氧酶DEAE Sepharose F.F.离子交换洗脱液pH确定Fig.2 pH selection of elution bufferfor dioxygenase on DEAE Sepharose F.F.
通过控制洗脱缓冲液的pH大于蛋白质的等电点,而使目的蛋白带上阴离子,再通过增加离子强度的方法将其洗脱下来,达到阴离子交换的目的。从图2可以看出,上清液酶活力呈逐渐下降趋势,pH≥6.5时,上清液中只含有少量的降解β-胡萝卜素双加氧酶,大部分酶蛋白因带上阴离子被DEAE Sepharose F.F.凝胶所吸附。故选择pH6.5的缓冲体系作为裂解β-胡萝卜素双加氧酶纯化所用的洗脱液。
2.3DEAE Sepharose Fast Flow阴离子交换柱层析
将硫酸铵分级沉淀后的酶液,经过透析后,取酶液5 mL上样,采用DEAE Sephaorse F.F.层析柱对降解β-类胡萝卜素双加氧酶酶液进行分离,结果如图3所示。

图3 降解β-胡萝卜素双加氧酶的DEAE-Sepharose-F.F层析图Fig.3 Chromatogram of dioxygenasefrom Schwanniomyces occidentalis on the DEAE-Sepharose F.F column
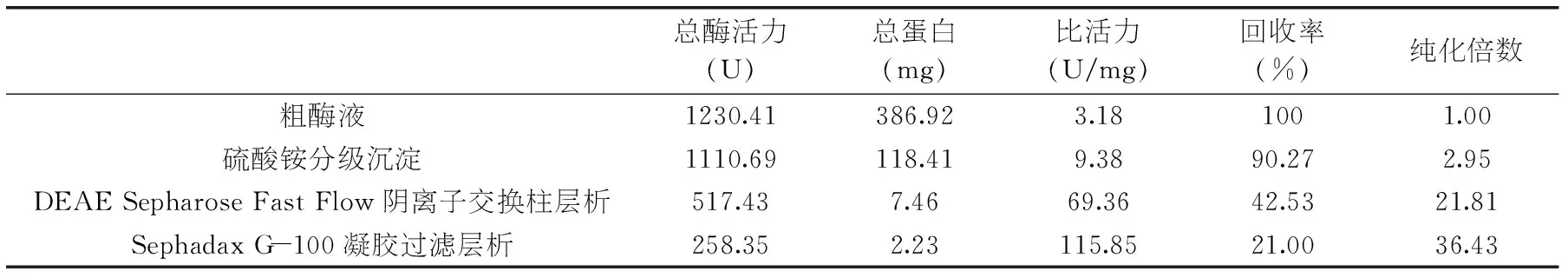
表1 降解β-胡萝卜素双加氧酶各部分的纯化结果
由图3中可看出,在整个洗脱阶段出现了两个大小不等的蛋白质峰。检测洗脱液各管的酶活力,结果显示第4到10管酶活力较高,并收集第4到第10管洗脱组分,进行下一步过滤提纯。
2.4Sephadax G-100凝胶过滤层析
由图4结果可知18~63管在280 nm处有蛋白峰。收集有酶活性的21~31号管,测定峰尖酶活力1.13 U/mL即为目的组分,收集22~25管洗脱液,再上进行透析,于-50 ℃冻干成酶粉,做电泳检测备用。
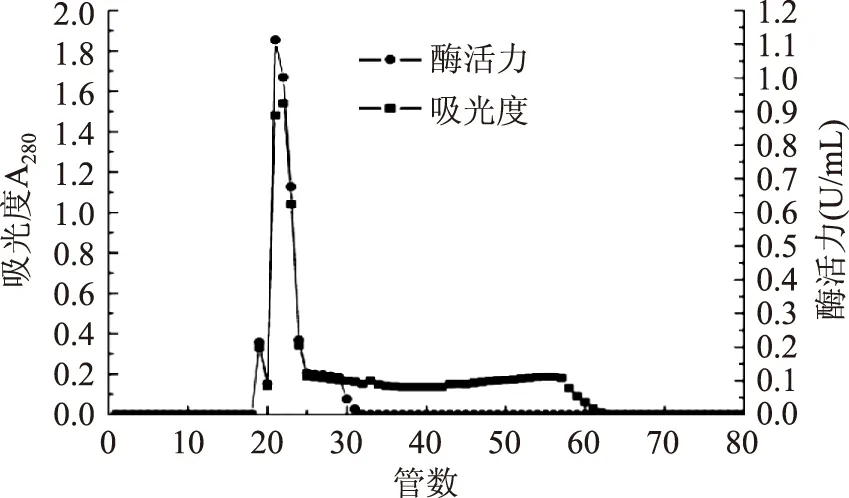
图4 裂解β-胡萝卜素双加氧酶的Sephadax G-100凝胶色谱图Fig.4 Chromatogram of dioxygenase from Schwanniomyces occidentalis on Sephadax G-100 column
经DEAE-Sephaorse-F.F.层析纯化的酶液通过葡聚糖凝胶层析柱,各个组分由于分子量不相同在凝胶柱上受到的阻滞作用不同,而在层析柱中以不同的速度移动,大分子蛋白质及一些蛋白复合物则被阻挡在外。根据蛋白质分子大小不同,利用分级分离而达到纯化的目的。从图4可以看出,在整个洗脱过程中,出现了一个明显的蛋白峰,说明洗脱效果好,并进一步说明,采用Sephadax G-100层析柱可除去经DEAE-Sephaorse-F.F.层析纯化的酶液中的大部分杂蛋白。
2.5双加氧酶纯化过程中总蛋白及酶活力的变化情况
从表1可以看出,在分离纯化过程中双加氧酶被纯化了36.43倍,酶活力回收率为21.00%。在降解β-胡萝卜素双加氧酶的纯化过程中,经硫酸铵分级沉淀以及DEAE-Sepharose F.F.柱层析和Sephadax G-100柱层析后的逐级分离后,双加氧酶的酶液得到了纯化,效果较好。
从表1看出,酶活力回收率(21.0%)较低,造成酶产率不高的原因是在各步分离纯化的过程中,不可避免的有一部分酶活力的损失。此外酶是一种生物活性分子,酶液中蛋白组分多,相互之间可能发生作用也是造成不稳定的因素。DEAE Sepharose Fast Flow阴离子交换柱层析纯化过程中,有待进一步研究冲洗溶质缓冲溶液的pH,调节电荷间的相互作用,平衡杂蛋白离子与结合能力,使杂蛋白吸附在离子交换层析柱上;尤其是在Sephadax G-100凝胶过滤层析纯化期间,在截留大分子杂质的过程中,大分子也携带一部分酶截留在层析柱中网状结构上,从而造成酶蛋白的损失。在层析纯化的过程中,应将检测有活性的酶液管全部收集,最大限度减少酶蛋白的损失,但是这样操作,会造成杂蛋白含量增加,导致酶蛋白纯化难度增加。
2.6SDS-PAGE电泳结果
从图5的SDS-PAGE电泳可以看出,经过纯化后,得到的降解β-类胡萝卜素双加氧酶的电泳图谱,电泳结果表明纯化后的样品只有一条带,达到电泳纯水平。根据纯酶与标准蛋白的相对迁移率Rf值的对比可知,降解β-胡萝卜素双加氧酶的分子质量约为55.0 ku。Peter Fleischmanna等从杨桃皮上分离并经纯化得到的降解胡萝卜素酶的分子量为50.0 ku[11]。由于降解菌株和实验材料不同,得到的降解β-胡萝卜素双加氧酶的分子量有所不同。
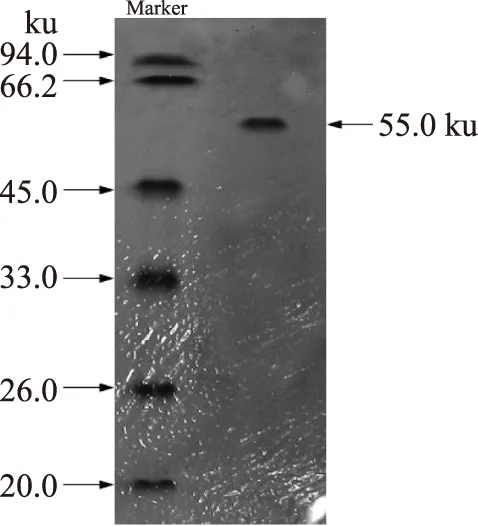
图5 降解β-胡萝卜素双加氧酶SDS-PAGEFig.5 SDS-PAGE of dioxygenase purifiedfrom of Schwanniomyces occidentalis
2.7降解β-胡萝卜素双加氧酶酶学特性
2.7.1温度对降解β-胡萝卜素双加氧酶的影响温度对降解β-胡萝卜素双加氧酶结果,见图6所示。
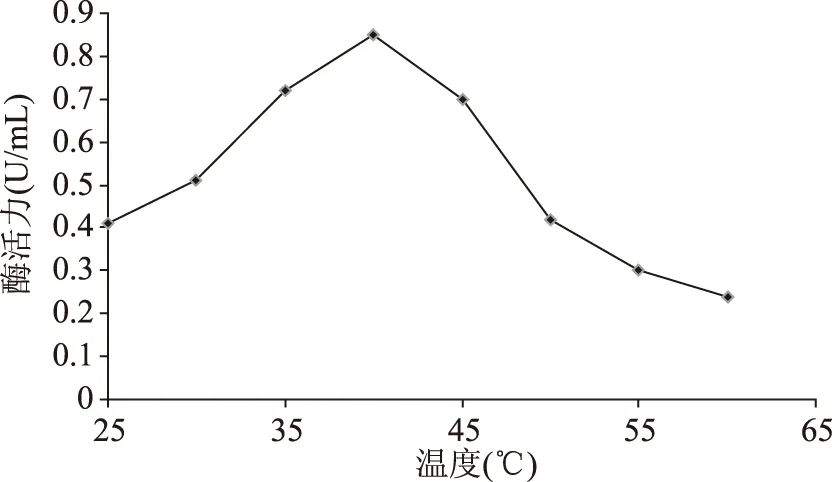
图6 酶的最适温度Fig.6 Optimum temperature of the enzyme
从图6可知,在25~40 ℃范围内,双加氧酶酶活力随温度升高而增加;而在40~60 ℃,酶活力随温度升高则迅速减小。由此可确定在实验研究范围内,双加氧酶的最适温度为40 ℃,此时酶活力为0.86 U/mL。当温度大于40 ℃,酶活力迅速下降,50 ℃以上时,酶活力下降不明显。
2.7.2pH对降解β-胡萝卜素双加氧酶的影响酶的活性部位与底物的接近和结合情况,是通过酶液pH影响酶蛋白的构象,以及酶与底物的电荷性质而达到的。酶作为一种两性电解质,在不同的pH条件下其分子的活性基团会以不同的解离状态存在,通常只有一种解离状态最适合酶促反应进行。从图7可知,裂解β-胡萝卜素双加氧酶在pH8.0~9.0范围内较稳定,酶活力为0.98 U/mL,当pH低于8.0时或高于9.0时,酶活力迅速降低。从图7得知双加氧酶最适pH为8.5。该实验结果与从Averrhoa carambola水果表皮中分离纯化的降解类胡萝卜素双加氧酶的最佳pH8.5结论一致[11]。

图7 酶的最适pH Fig.7 Optimum pH of the enzyme
2.7.3金属离子对降解β-胡萝卜素双加氧酶的影响由表2可知,降解β-胡萝卜素双加氧酶对金属离子很敏感。Fe2+对重组酶的活性有轻度的激活作用,浓度为5 mmol/L时,酶活力可提高29%左右,1 mmol/L时,提高15%;Mg2+、K+、Na+、Mn2+和Cu2+对酶均有激活作用,其中Mg2+、K+和Na+使酶活力提高15%。而Zn2+和Ag+对酶有抑制作用,Ag+的抑制作用最强烈,使酶活力降低15%。

表2 金属离子对酶活力的影响
2.7.4抑制剂对降解β-胡萝卜素双加氧酶的影响从表3中可以看出,在浓度为5.0 mmol/L时,碘乙酰胺对酶活力没有显著影响;而PMSH、EDTA和SDS对酶活力有显著抑制作用,且抑制作用依次增强。在浓度为1.0 mmol/L时,PMSH和EDTA对酶活力没有显著影响;碘乙酰胺和SDS对酶活力有显著抑制作用,且抑制作用依次。胃酶抑素无论何种浓度,都对酶活力有显著抑制作用。胃酶抑素明显抑制纯化酶的活性,表现化纯化的酸性蛋白酶活性中心含有天冬氨酸残基,属天冬氨酸蛋白酶类。
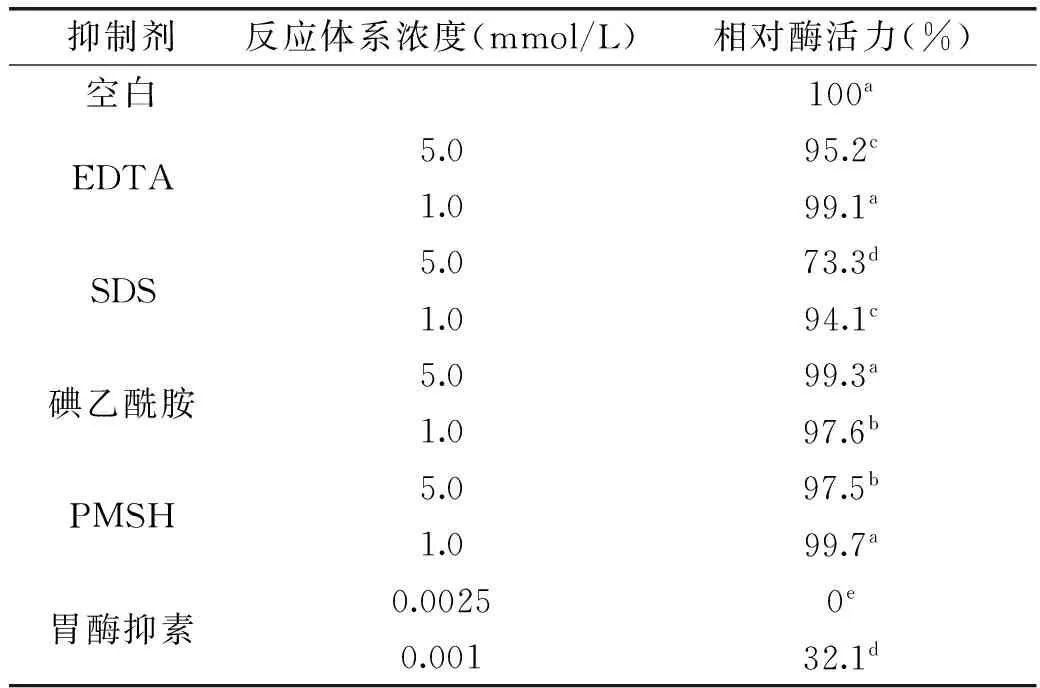
表3 蛋白抑制剂对纯化的重组酶活力影响
注:同列不同字母代表差异显著(p<0.05)。
2.7.5酶促反应动力学方程实验中,在37 ℃条件下,测定双加氧酶酶活力。按照Lineweaver-Burk作图法,经计算,得到降解β-类胡萝卜素双加氧酶的Km=8.24×10-4mol/L,Vmax=2.16×10-4mol/(min·mg)。
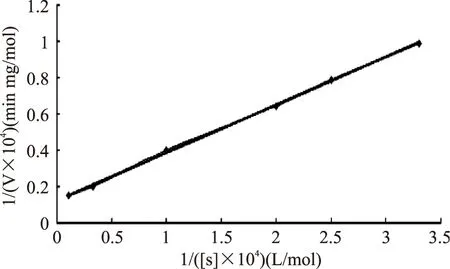
图8 双加氧酶的酶动力学参数Fig.8 Enzyme kinetics data of dioxygenase
3 结论
降解β-胡萝卜素双加氧酶粗酶液经过滤,硫酸铵分级沉淀,DEAE-Sepharose F.F.柱层析和Sephadax G-100柱层析后纯化后,双加氧酶被纯化了36.43倍,酶活力回收率为21.00%,并得到了电泳纯的双加氧酶。该酶分子量为55.0 ku左右,最适温度为40 ℃,最适pH为8.5。该双加氧酶的酶学性质研究结果表明,Fe2+和Mg2+能增强酶活性,而Zn2+和Ag+能抑制酶活性;在5.0 mmol/L下,碘乙酰胺对纯化的重组酶活力没有显著影响,而PMSH、EDTA和SDS对纯化的重组酶活力有显著抑制作用。在1.0 mmol/L下,PMSH和EDTA对酶活力没有显著影响;碘乙酰胺和SDS对酶活力有显著抑制作用。胃酶抑素在考察浓度范围内,均对酶活力有显著抑制作用。本研究为双加氧酶的工业应用,进行了初步探索,积累了相关研究基础。
[1]王贵元.类胡萝卜素的自然分布与特性[J].现代农业,2007,3:20-21.
[2]Abby J C,Christopher I C,Eleanore T W,et al.Carotenoids[J].Advances in Botanical Research,2011,58:1-36.
[3]Gatfield I L.Enzymatic and microbial generation of favours[J].World Ingred,1996,40: 31-35.
[5]Christiane F,Matthias S,Susanne B,et al.Metabolism of carotenoid degradation in leaves of Camellia sinensis-Functional and biochemical modifications[J].Journal of Food Composition and Analysis,2011,24(6):821-825.
[5]Daniela Z,Vlada B U,Stephan L.Studies on the enantioselective oxidation ofβ-ionone with a wholeE.colisystem expressing cytochrome P450 monooxygenase BM3[J].Journal of Molecular Catalysis B: Enzymatic,2012,84:62-64.
[6]Zorn H,Langhoff S,Scheibner M,et al.Cleavage ofβ,β-carotene to flavor compounds by fungi[J].Appl Microbiol Biotechnol,2003,62:331-336.
[7]Condurso C,Verzera A,Dima G,et al.Effects of different rootstocks on aroma volatile compounds and carotenoid content of melon fruits[J].Scientia Horticulturae,2012,148(4):9-16.
[8]Maria M M.Carotenoid breakdown products the norisoprenoids in wine aroma [J].Archives of Biochemistry and Biophysics,2009,483(2):236-245.
[9]Dionísio A P,Carvalho D S D,Pastore G M.Biotransformation of carotenoids into aroma compounds:screening using solid phase microextraction[J].New Biotechnology,2009,25:237.
[10]Baldermann S,Naim M,Fleischmann P.Enzymatic carotenoid degradation and aroma formation in nectarines(Prunuspersica)[J].Food Research International,2005,38(8-9): 833-836.
[11]Peter F,Naoharu W,Peter W.Enzymatic carotenoid cleavage in star fruit(Averrhoacarambola)[J].Phytochemistry,2003,63:131-137.
[12]Manuela S,Bärbel H,Kateryna Z,et al.Novel peroxidases of Marasmius scorodonius degradeβ-carotene[J].Appl Microbiol Biotechnol,2008,77:1241-1250.
[13]Thomas B,Daniel S,Carmen L M,et al.Cleavage of resveratrol in fungi: Characterization of the enzyme Rco1 from Ustilago maydis[J].Fungal Genetics and Biology,2011,48(2):132-143.
[14]汤鸣强. 黑曲霉SL2-Ⅲ产果胶酯酶的纯化与性质[J]. 食品与发酵工业,2010,36(1):39-43.
[15]汪家政,范明.蛋白质技术手册[D].北京:科学出版社,2000.
[16]马林,崔成哲,袁有贵,等.烟碱脱氢酶的纯化及性质研究[J].工业微生物,2007,37(8):41-44.
[17]苏东海,苏东民,杨国伟,等.白腐菌TP21漆酶分离纯化及其部分酶学特性的研究[J].河南工业大学学报(自然科学版),2008,29(5):54-57.
Purification and characterization of dioxygenase fromSchwanniomycesoccidentalisto biodegradeβ-carotene
ZHENG Jian-qiang1,HOU Jian-guang1,2,SHI Jin-jin1,ZHAO Nan1,PENG Xin-bang1,SI Jun-ling1
(1.School of Food and Bioengineering,Zhengzhou University of Light Industry,Zhengzhou 450002,China;2.Henan Yangshao Liquor Limited Company,Mianchi 472400,China)
The purification and enzymological characteristics of dioxygenase were studied and the enzyme was used to digest theβ-carotene to produce flavor materials. The dioxygenase was produced by liquid fermentation,ammonium sulphate precipitation,membrane dialysis,DEAE-Sepharose fast flow ion exchange chromatography and gel filtration chromatography(G-100). The results were concluded that the purity of the dioxygenase produced bySchwanniomycesoccidentaliswas increased for 36.43 times,the recovery of the enzymatic activity was 21% and its molecular mass was 55.0 ku. The optimal temperature and pH for the purified dioxygenase were 40℃ and 8.5 repectively. The effect of metal ions on dioxygenase activity was with the following order: Fe2+>Mg2+>K+>Na+>Mn2+>Cu2+>Ca2+>Zn2+>Ag+.Fe2+and Mg2+had a strongpositive effect on the enzyme,however Zn2+and Ag+had a negative influence on the enzyme. The purified dioxygenase was inhibited by SDS and pepstatin. Dynamic studies demonstrated that the Kmand Vmaxof the enzyme was 8.24×10-4mol/L and 2.16×10-4mol/(min·mg)respectively.
Schwanniomycesoccidentalis;dioxygenase;isolation and purification;enzymological characteristics
2015-12-22
郑坚强(1976-),男,博士,副教授,主要从事食品生物技术方面的研究,E-mail:jqzheng76@126.com。
国家自然科学基金资助项目(31571778);河南省高等学校重点科研项目计划(15A550007)。
TS201.3
A
1002-0306(2016)16-0195-06
10.13386/j.issn1002-0306.2016.16.030

