超声波辅助酶法提取草鱼皮胶原蛋白及其纯化
王金梅,包建强
(上海海洋大学食品学院,上海水产品加工及贮藏工程技术研究中心,上海 201306)
超声波辅助酶法提取草鱼皮胶原蛋白及其纯化
王金梅,包建强*
(上海海洋大学食品学院,上海水产品加工及贮藏工程技术研究中心,上海 201306)
本文研究了超声波辅助提取草鱼皮胶原蛋白的工艺。以超声功率、超声时间和酶解时间为实验因素,胶原蛋白提取率为响应值,利用Box-Behnken设计实验及响应面法分析实验,确定其最佳提取工艺条件。结果显示:最佳工艺条件为超声功率310 W,超声时间10 min,酶解时间29 h,此时胶原蛋白提取率达到68.67%,与模型理论预测值(68.80%)较为相近,相对误差仅为0.189%。通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳图谱(SDS-PAGE)和傅里叶红外光谱(FTIR)谱图,对比超声波作用下与无超声波作用的胶原蛋白发现,超声波对胶原蛋白结构无明显影响。
超声波,草鱼皮,胶原蛋白,凝胶电泳,傅里叶红外光谱
我国是水产大国,2014年淡水鱼总产量达2770万吨,占鱼类年产量的73%之多[1]。近年来水产品加工业快速发展,鱼类产品加工中产生了大量的废料,60%~70%的鱼体部分成了加工副产品[2]。由于大量的鱼类废料(鱼皮、鱼鳞、鱼骨等)未经处理被随意丢弃,不仅造成生物资源的浪费,还造成严重的环境污染,鱼产品加工废料的生物价值和开发利用引起人们广泛关注。加工副产品中的鱼皮占很大比例,而研究发现草鱼皮胶原蛋白的量占粗蛋白的88.07%,表明鱼皮中胶原蛋白含量丰富[3]。
近年来超声波在成分提取方面应用广泛,如从鳕鱼皮[4]、大鲵鱼皮[5]、深海红鱼[6]及猪皮[7]、牛蹄筋[8]中提取胶原蛋白,胶原蛋白提取率提高效果显著,但缺乏对提取得到的胶原蛋白的结构进行鉴定研究。杨萌萌[8]等利用超声波辅助胃蛋白酶法提取牛蹄筋胶原蛋白,最优提取条件为超声功率366 W,超声时间7.4 min,提取率提高了10.69%。王希等[4]研究了鳕鱼皮提取胶原蛋白最佳条件:超声波辅助提取时间3.5 h、酶解时间7.5 h,胶原蛋白提取率达33.75%。王林等[6]研究了深海红鱼的超声提取最优工艺,功率505 W,超声时间15 min、提取时间18 h,在此条件下,胶原蛋白提取率(93.6%)与传统提取方法无显著性差异,但提取时间缩短了30 h。
值得注意的是,水产品胶原蛋白提取不同于一般动物,水产品胶原蛋白变性温度较低,胶原蛋白特有的三级螺旋结构更容易被破坏,而三级螺旋结构是胶原蛋白具有生物功能的重要指标。本文实验超声波辅助提取草鱼皮胶原蛋白,优化实验过程中严格控制超声波工作时间间隔以降低温度,并对提取得到的胶原蛋白结构进行鉴定,为胶原蛋白类生物功能性材料的开发利用提供了理论参考。
1 材料与方法
1.1材料与仪器
新鲜草鱼鱼皮南浔新雅农产品(浙江)开发有限公司,实验室-50 ℃冷冻保藏;羟脯氨酸南京建成生物工程研究所;胃蛋白酶(3000 U/g)、氢氧化钠、正丁醇、乙酸、Tris碱分析纯,国药集团试剂有限公司。
UV-18OOPC型紫外可见分光光度计上海美谱达仪器有限公司;KjeltecTM2300自动凯氏定氮仪福斯华科贸有限公司;FOSS消化炉丹麦福斯公司;SZF-06脂肪测定仪上海新嘉电子有限公司;PYRAMID TX陶瓷纤维马弗炉北京皮尔美特科技有限公司;J-26XP冷冻离心机贝克曼库尔特;Nicolet iS5傅里叶变换红外光谱仪赛默飞世尔科技分子光谱;XO-SM100超声波微波组合反应系统先欧仪器(南京)制造有限公司。
1.2基本成分分析方法
水分含量测定采用直接干燥法(GB/T 5009.3-2010);蛋白质含量测定采用凯氏定氮法(GB/T 5009.5-2010),转化系数取6.25;脂肪含量测定采用索氏抽提法(GB/T5009.6-2003);灰分含量测定采用灼烧恒重法(GB/T5009.4-2010);总糖含量测定采用苯酚-硫酸法(GB/T5009.8-2008)。
1.3草鱼皮胶原蛋白的提取
1.3.1胶原蛋白提取纯化鱼皮室温流水解冻,刮掉鱼皮表面残留鱼肉及表面水分,剪碎称重,氢氧化钠浸泡除去杂蛋白,水洗至中性,正丁醇浸泡除脂,水洗,加0.5 mol/L乙酸,料液比1∶15,一定功率下超声处理一定时间,再加4%的酶进行一定时间的酶解,离心(10000×g,10 min)取上清液,加Tris调节pH至中性,加入氯化钠进行盐析,离心(10000×g,30 min)取沉淀,加乙酸复溶,低浓度乙酸中透析,冷冻干燥得胶原蛋白样品[8]。
1.3.2羟脯氨酸标准曲线绘制参考Woessner[9]的比色法。酶解液中提取率计算公式如下:
式中:X为胶原蛋白提取率,ω为酶解液中羟脯氨酸的质量,9.09为羟脯氨酸转换系数。
1.3.3单因素实验本实验草鱼皮经过脱脂处理后进行超声波辅助下的酶溶液提取,首先通过预实验确定酶解过程中的两个重要因素,酶用量(8%)和样品的料液比(1∶10),然后进行超声波处理,从中涉及到三个因素,超声功率、超声时间和酶解时间。分别设定三个单因素的水平为:超声时间10 min,酶解时间25 h,超声功率100、200、300、400和500 W;超声功率300 W,酶解时间25 h,超声时间分别为2、5、10、15和20 min;超声功率300 W,超声时间10 min,酶解时间分别为10、15、20、25和30 h。实验重复3次,数据取均值。
1.3.4响应面设计实验应用Box-Behnken模型,以超声功率、超声时间和酶解时间为自变量,胶原蛋白得率为响应值设计实验。响应面因素水平见表1。

表1 响应面因素水平表
1.4聚丙稀铣胺凝胶电泳(SDS-PAGE)
SDS-PAGE参照Matmaroh[10]等人的方法。胶原蛋白分离采用8%的SDS/聚丙烯酰胺凝胶、Tris-HCl/甘氨酸电泳缓冲系统。胶原蛋白溶于去离子水(1 mg/mL)后,与上样缓冲液(0.5 mol/L Tris-HCl,4%SDS,20%甘油,含或不含10%DTT,pH6.8)以1∶1(V/V)混合,沸水浴5 min。样品冷却后,加入4%聚丙烯酰胺凝胶(浓缩胶)梳孔,冰浴电泳120 V。电泳结束后,凝胶用0.05%考马斯亮蓝R-250染色,用含15%甲醇和10%乙酸的脱色液脱去背景色。
1.5傅里叶红外光谱分析
在干燥的条件下,取冻干的胶原蛋白样品,把样品放置在ATR台上,红外光谱仪对样品进行红外扫描。单点反射ATR附件,设置光谱分辨率4 cm-1,测量范围4000~650 cm-1,扫描信号累加16次。
1.6数据处理
用Design-expert V8.0.6软件进行数据分析。
2 结果与分析
2.1基本成分分析
草鱼皮基本组分含量见表2,所测数据均是占鱼皮湿重的比例。由表2可知,草鱼皮中蛋白含量较高,但仍含有部分粗脂肪,所以在提取草鱼皮胶原蛋白前首先进行脱脂预处理,以获得高提取率和较高纯度的胶原蛋白。

表2 草鱼鱼皮的基本成分
2.2单因素实验结果及分析
2.2.1超声功率对胶原蛋白提取率的影响图1所示,胶原蛋白的提取率随超声功率的增加先升高后缓慢下降,且在300 W时提取率达到最高,超过300 W后胶原提取率逐渐下降,超声作用过程中在样品周围进行降温处理,但图1显示超声波功率过大后产生的高温对胶原蛋白会有一定作用,这跟水产品胶原蛋白变性温度一般都比较低有关,超过300 W后超声波能量过大产生高温,对胶原蛋白的结构造成破坏,为获得最高提取率实验选择单因素超声功率为300 W。

图1 超声功率对提取率的影响Fig.1 Effects of ultrasonic rate on extraction of collagen
2.2.2超声时间对胶原蛋白提取率的影响图2显示,胶原蛋白的提取率随超声时间延长先升高后下降,在超声10 min时达到最大值,说明此时样品细胞基本完全破裂,样品与试剂充分结合,超声波作用达最大值。超声时间超过10 min后,超声波空化效应产生的热量对胶原蛋白造成破坏,胶原蛋白的提取率反而下降,说明超声波的热效应相对鱼皮胶原蛋白作用明显,应注意控制超声波时间,实验选定时间为10 min。

图2 超声时间对提取率的影响Fig.2 Effects of ultrasonic time on extraction of collagen
2.2.3酶解时间对胶原蛋白提取率的影响由图3可知,超声处理后的鱼皮胶原蛋白随酶解时间的变化较大,在25 h之前随时间延长,胶原蛋白提取率升高的相对明显,酶解时间达到25 h之后,胶原蛋白提取率变化趋于平缓,这说明在酶解时间25 h之前,胶原蛋白与胃蛋白酶的反应并不完全,25 h后趋于饱和,为提高提取效率故选取酶解时间为25 h。
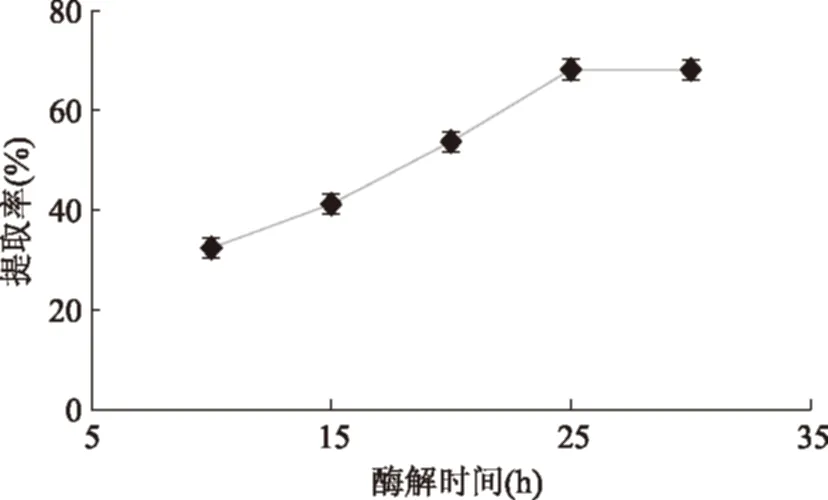
图3 酶解时间对提取率的影响Fig.3 Effects of enzyme time on extraction of collagen
2.3响应面实验结果与优化
在单因素实验的基础上,以胶原蛋白提取率为响应值,利用Design Expert 8.0.6设计实验,实验结果如表3。

表3 实验方案的设计及结果
根据表3中的数据使用Design-Expert软件进行多元回归拟合分析,得到模型的拟合曲线方程:Y=66.87+1.13X1+2.42X2+4.31X3+0.34X1X2-0.86X1X3-2.51X2X3-2.42X12-3.36X22-2.46X32。
同时对模型进行了回归系数和方差分析的显著性检验,分析和检验结果见表4。
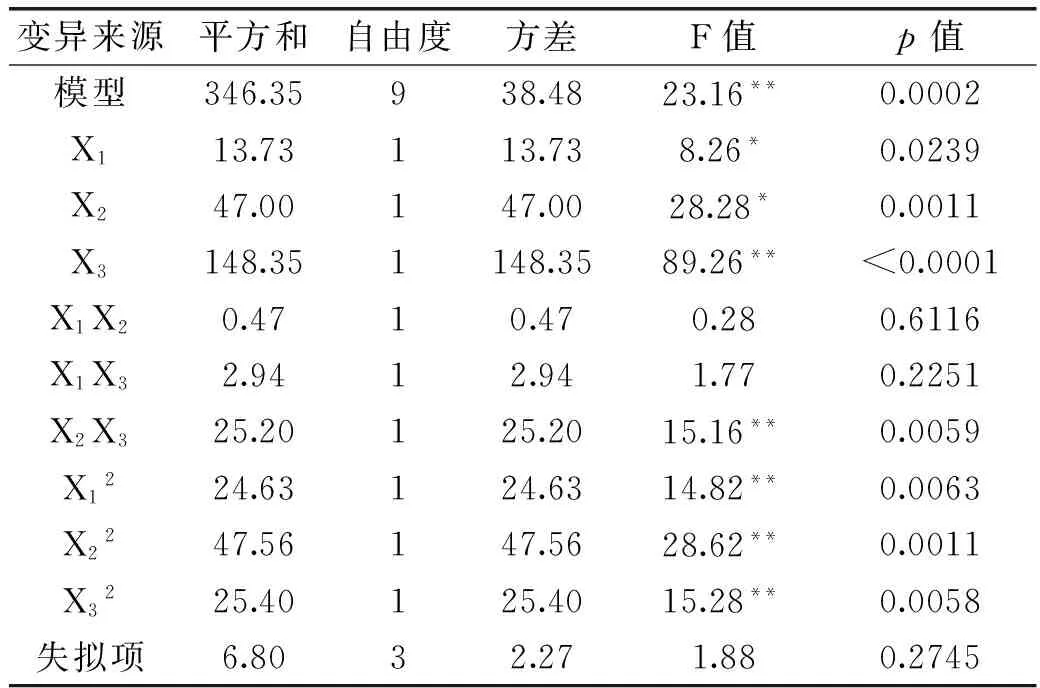
表4 回归模型的方差分析及系数的显著性检验
注:p<0.05,差异显著,*;p<0.01,差异极显著,**。
根据表4方差分析数据显示,该模型p=0.0002,小于0.01,表现为该模型的回归方程极显著。失拟项p>0.05,不显著,表明实验误差较小,此模型对本实验拟合较好。表4中还显示了各因素对草鱼皮中胶原蛋白提取率影响的主次顺序为:X3>X2>X1,即酶解时间>超声时间>超声功率。单因素一次项X1、X2对实验结果影响显著,一次项X3和二次项X12、X22、X32对实验结果影响极显著,各因素交互项中X2X3极显著,X1X2、X1X3不显著,即超声时间与酶解时间的交互作用对提取率的影响极显著,超声功率和酶解时间、超声功率和超声时间交互作用不显著。
比较图4~图6响应曲面图,通过曲面坡度的陡峭度及等高线的形状可以较直观的反映两因素交互作用程度。图6中响应面坡度较陡,说明酶解时间和超声时间的交互作用较强,当条件变化时响应面值差异较大。故由图4~图6可知,酶解时间和超声时间的交互作用显著,超声功率和酶解时间、超声功率和超声时间交互作用不显著,这与方差分析结果一致。
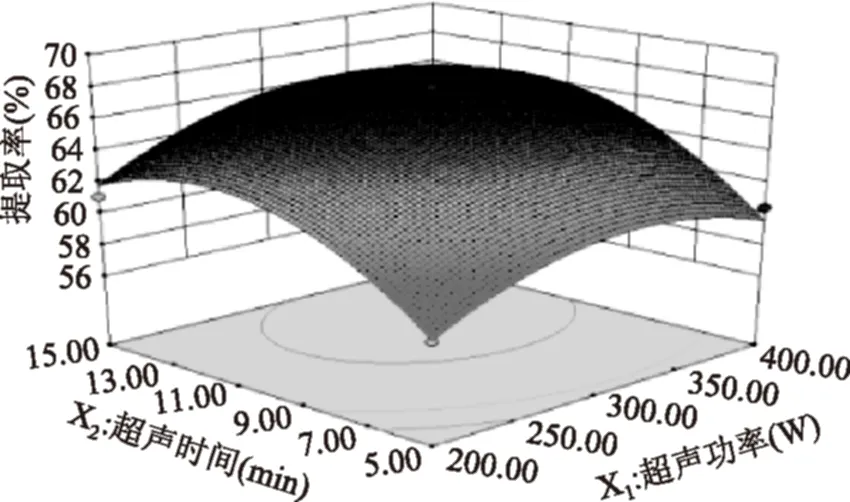
图4 超声时间和超声功率交互作用Fig.4 Effects of ultrasonic time and ultrasonic rate on extraction of collagen

图5 酶解时间和超声功率交互作用Fig.5 Effects of enzyme time and ultrasonic rate on extraction of collagen
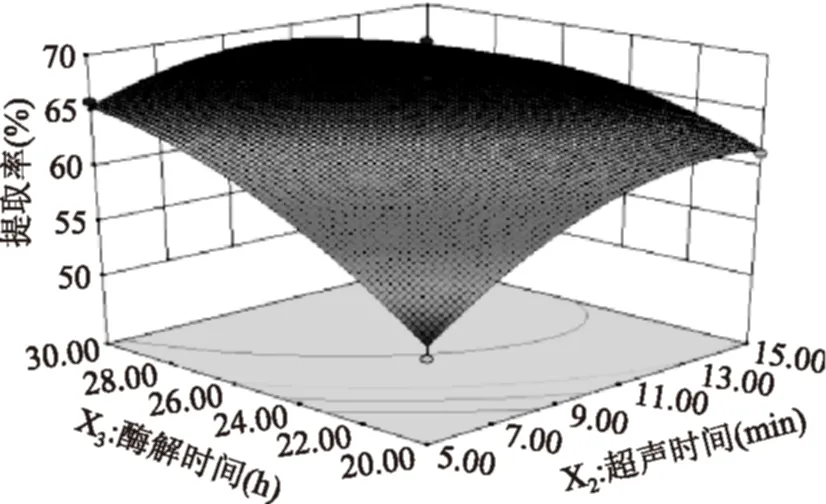
图6 酶解时间和超声时间交互作用Fig.6 Effects of enzyme time and ultrasonic time on extraction of collagen
通过响应面法优化,酶法提取得到草鱼皮胶原蛋白最优可操作的工艺条件:超声功率312.97 W,超声时间10.29 min,酶解时间29.12 h,此时胶原蛋白提取率理论值为68.80%。考虑到实际生产中的需要,上述工艺条件进行略微调整,最终确定实际最优的提取工艺:超声功率310 W,超声时间10 min,酶解时间29 h,并在此最优条件下对其进行3次验证实验,以考察模型的可靠性,结果表明:在实际的最优工艺条件下,超声波辅助提取下的胶原蛋白提取率达到68.67%,实际操作中的数值与实验设计中的理论数值(68.80%)相对误差仅为0.189%,其结果较为接近,提取工艺得到合理优化。
2.4凝胶电泳
超声波辅助提取与未经超声波处理所得的胶原蛋白SDS-PAGE电泳图如图7所示,所得胶原蛋白与标准Ⅰ型胶原蛋白条带基本一致,均存在两条不同的α链,是由α1和α2组成,其中从光密度来看α1和α2的比率为2∶1,因此胶原蛋白的组成应该为(α1)2α2,这种结构符合真骨鱼胶原含有两条[11-12]或者三条[13]不同的链,根据与Marker对比,可以确定为Ⅰ型胶原蛋白,图中另一条带为β,是两条肽链的二聚体,符合鱼皮Ⅰ型胶原结构,且图中电泳条带清晰无杂带出现,说明超声波辅助酶法提取胶原蛋白纯度较高。总之,图中2、3和4、5条带对比发现,相同浓度样品经超声波处理和未经超声波处理所得条带位置和条带密度均大致相同,表明超声波辅助提取没有破坏胶原蛋白的结构。
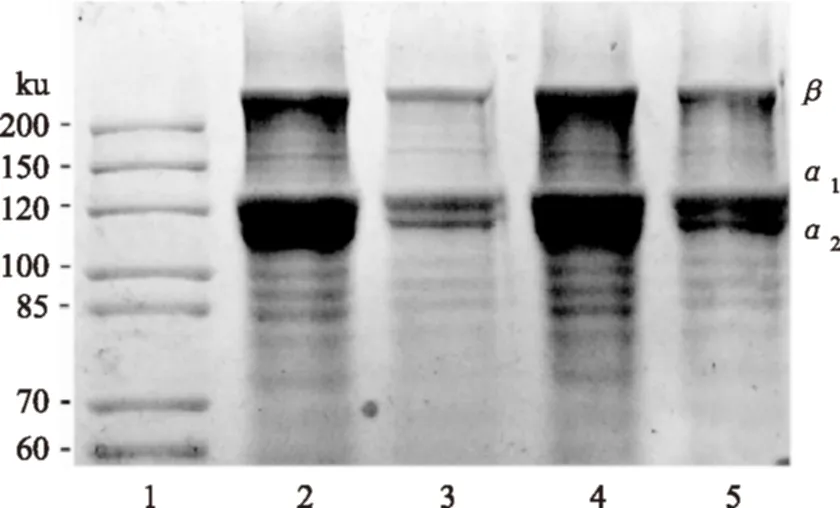
图7 PSC SDS-PAGE图Fig.7 SDS-PAGE patterns of PSC from grass carp skin注:1-高分子蛋白Marker;2、3-未经过超声波处理所得PSC(2、3分别为1、0.5 mg/mL);4、5-经超声波处理所得PSC(4、5分别为1、0.5 mg/mL)。
2.5傅里叶红外光谱
如图8所示,图中两条分别为经超声波处理和未经超声波处理的胶原的红外光谱图,两个样品都含有酰胺A、B和酰胺Ⅰ、Ⅱ、Ⅲ吸收峰,均为胶原蛋白的特征吸收峰,且图中各吸收峰位置相差不大,说明在提取胶原蛋白过程中有无超声波作用不会对胶原蛋白的结构产生影响。其中酰胺Ⅰ、Ⅱ、Ⅲ经常被作为鉴定胶原二级结构的特征峰,可以反映胶原的肽链骨架结构[14],胶原蛋白的酰胺I出现在1629 cm-1,表示了C=O的伸缩振动[15],该峰和蛋白质的二级结构有关,胶原蛋白的酰胺Ⅱ出现在1546 cm-1处,这是由N-H的弯曲振动和C-N的伸缩振动引起的,有研究证明,图中显示的酶溶性胶原蛋白(PSC)的酰胺在1236 cm-1处,该波数同1450 cm-1的比值大约为1,表明了三级螺旋结构的存在[16],由此证明超声波辅助提取同无超声波辅助的酶法提取一样,不会破坏胶原蛋白的三级螺旋结构。
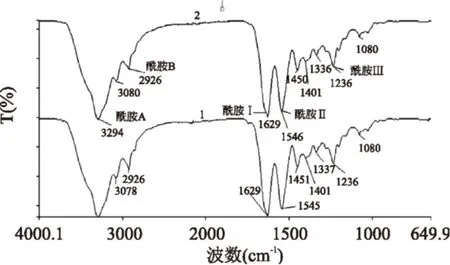
图8 PSC傅里叶红外吸收光谱Fig.8 FTIR spectra of PSC from grass carp skin注:1-未经过超声波处理所得PSC红外光谱;2-经超声波处理所得PSC红外光谱。
3 结论
本实验研究分析了超声波辅助法提取胶原蛋白具体条件,通过响应面设计实验并分析获得最佳工艺参数:超声波功率310 W,超声波时间10 min,酶解时间29 h,此条件下胶原蛋白提取率为68.67%。实验还通过对比经超声波处理和未经超声波处理下酶法提取得到的胶原蛋白的理化性质,分别由凝胶电泳图谱和傅里叶红外光谱确定超声波处理不会对胶原蛋白的结构造成影响。总之,响应面法设计实验获得了超声波辅助法下提取草鱼皮胶原蛋白提取率达到68.67%,大大提高了胶原蛋白提取率,优于传统的酶提法,超声波处理下的胶原蛋白仍然具有完整的三级螺旋结构,这为超声波在胶原蛋白的提取工艺中的应用提供了有力的理论支持,为胶原蛋白的工业化生产提供了理论依据,以及更好地利用资源做出贡献。
[1]农业部渔业局编制. 中国渔业统计年鉴[M]. 中国农业出版社,2015.
[2]熊善柏. 湖北省淡水鱼加工业现状、问题与发展方向[J]. 科学养鱼,2014(9):14-16.
[3]王艳. 草鱼皮胶原蛋白的提取、性质研究及膜性能表征
[D]. 天津:天津科技大学,2013:26-28.
[4]王希,钟耀广,市川寿. 响应面优化超声波快速提取鳕鱼皮中胶原蛋白的工艺研究[J].东北农业大学学报,2014,45(7):117-123.
[5]李莉,顾赛麒,王锡昌,等. 响应面法优化酶法提取大鲵皮胶原蛋白工艺[J]. 中国水产科学,2013,20(4):876-883.
[6]王林,梁秋芳,王振斌,等. 深海红鱼胶原蛋白的超声波辅助提取及其理化特性[J]. 食品研究与开发,2014,35(9):18-22.
[7]张玲,芮汉明. 超声波介入鲜猪皮的脱脂工艺研究[J]. 现代食品科技,2006,22(3):99-101.
[8]杨萌萌,郭兆斌,余群力,等. 超声波辅助法提取胶原蛋白工艺研究[J]. 甘肃农业大学学报,2013,48(3):121-126.
[9]Woessner JF. The determination of hydroxyproline in tissue and protein samples containing small proportions of this iminoacid[J]. Archives of Biochemistry and Biophysics,1961,93:440.
[10]MatmarohK,BenjakulS,ProdpranT,et al. Characteristics of acid soluble collagen and pepsin soluble collagen from scale of spotted golden goatfish(Parupeneusheptacanthus)[J]. Food Chemistry,2011,129:1179-1186.
[11]Nagai,Takeshi,Araki,et al. Collagen of the skin of ocellatepuffer fish(Takifugurubripes)[J]. Food Chemistry,2002,78:137-177.
[12]Kimura S,OhnoY,MiyauchiY,et al. Fish skin type I collagen:wide distribution of anα3subunit in teleosts[J]. Comparative Biochemistry and Physiology,1987,88(1):27-34.
[13]AOAC. Official methods of analysis of the association of official analytical chemists[M]. 15th ed. Arlington,Washington DC,USA:Association of Official Analytical Chemists,1990.
[14]LI H,LIU B L,GAO L Z,et al. Studies on bullfrog skin collagen[J].Food Chemistry,2004,84(1):65-69.
[15]ZHU B,DONG X,ZHOU D,et al. Physicochemical properties and radical scavenging capacities of pepsin-solubilized collagen from seacucumberStichopusjaponicus[J]. Food Hydrocolloids,2012,28(1):182-188.
[16]GuzziPlepis AMD,Goissis G,Das-Gupta DK. Dielectric and pyroelectric characterization of anionic and nativecollagen[J]. Polymer Engineering and Science,1996,36(24):2932-2938.
Study on ultrasonic-assisted solvent extraction and purification of pepsin-soluble collagen from grass carp skin
WANG Jin-mei,BAO Jian-qiang*
(College of Food Science and Technology,Shanghai Ocean University,Shanghai 201306,China)
Ultrasonic-assisted solvent extraction and purification pepsin-soluble collagen from grass carp skin was investigated in this paper.Ultrasonic rate,ultrasonic time and enzyme extraction time were chosen as influencing factors.The extraction rate of collagen was selected as response value.The mathematical model was established by Box-Behnken central composite design. The analysis method was response surface methodology(RSM).The final optimum conditions were:ultrasonic rate 310 W,ultrasonic time 10 min and enzyme extraction time 29 h,extraction rate of collagen was 68.67%,it’s nearly to the model 68.8%,relative tolerance was 0.189%.SDS-PAGE and FTIR showed that ultrasonic-assisted extraction hadno obvious effect on collagen structure.
ultrasonic-assisted extraction;grass carp skin;collagen;SDS-PAGE;FTIR
2016-03-11
王金梅(1990-),女,硕士研究生,研究方向:食品科学,E-mail:wjmytu@163.com。
包建强(1963-),男,教授,研究方向:食品冷冻,E-mail:baojq@shou.edu.cn。
水产动物遗传育种中心上海市协同创新中心(ZF1206);上海市科委工程中心建设(11DZ2280300)。
TS254.9
A
1002-0306(2016)18-0236-05
10.13386/j.issn1002-0306.2016.18.036

