LX-2与HK-2细胞共培养模型的建立及对其细胞转分化的影响*
王耀光,曽又佳,周慧杰
(1.天津中医药大学第一附属医院,天津 300193,2.深圳市中医院,深圳 5180333;3.天津中医药大学,天津 300193)
LX-2与HK-2细胞共培养模型的建立及对其细胞转分化的影响*
王耀光1,曽又佳2,周慧杰3
(1.天津中医药大学第一附属医院,天津 300193,2.深圳市中医院,深圳 5180333;3.天津中医药大学,天津 300193)
[目的]建立人肝星状细胞(LX-2)与人肾小管上皮细胞(HK-2)共培养体系的理论模型,研究LX-2对HK-2转分化的影响。[方法]以Transwell小室建立体外LX-2细胞和HK-2细胞间接共培养体系。应用细胞免疫组织化学法检测HK-2细胞平滑肌肌动蛋白(α-SMA)表达;用酶联免疫吸附法(ELISA法)检测各组细胞培养液中转化生长因子-β1(TGF-β1)的含量;逆转录-聚合酶链反应法(RT-PCR法)检测HK-2细胞TβRⅠmRNA、TβRⅡmRNA、Smad2 mRNA、Smad3 mRNA、Smad7 mRNA的表达。[结果]除了空白组,形态学上其他两组均可看到HK-2细胞胞浆染棕黄色,不同数量细胞由立方铺路石样转变为梭形长条状,细胞肥大;HK-2细胞高表达α-SMA(P<0.01);HK-2细胞上清液中TGF-β1含量明显高于空白组(P<0.01);HK-2细胞TβRⅠ、Smad2、Smad3基因表达明显上调,而TβRⅡ、Smad7基因表达明显下调。[结论]Transwell共培养法可诱导HK-2细胞转分化,其机制可能与TGF-β1/ Smad信号通路有关。
肾小管上皮细胞转分化;Transwell小室;LX-2细胞;HK-2细胞;细胞共培养
DOI:10.11656/j.issn.1673-9043.2016.05.09
肾小管上皮细胞间充质细胞转分化(TEMT)是肾小管间质纤维化发生和发展的重要机制[1],多种生长因子、细胞因子和细胞外因素等可以通过不同的方式参与肾小管上皮细胞转分化的调节[2-5]。在各种针对终末期肾脏病的细胞信号转导途径研究中,以转化生长因子β/Smad通路最为关注[6],而且TEMT也主要与TGF-β/Smad有关[7]。一种器官纤维化发生机制的研究结果,可能也适用于其他器官纤维化[8-9];对一种器官纤维化的有效治疗方法,对阻止其他器官纤维化也可能是有益的[10]。基于临床观察的乙型肝炎病毒相关性肾炎患者同时存在肝、肾纤维化(硬化)的病理改变[11-12]和“肝肾同源”理论,提出“肝肾纤维化共同通路”假说,并建立人肝星状细胞(LX-2)与人肾小管上皮细胞(HK-2)共培养体系的理论模型,模拟体内内分泌状态,观察LX-2对HK-2转分化的影响。
1 材料与方法
1.1 材料 LX-2,由上海中医药大学肝病研究所提供;HK-2,由中国医学科学院细胞中心提供;DMEM/ F12培养基购自美国Gibco公司;特级胎牛血清购自Hyclone公司;青链霉素(双抗)购自Gibco公司;胰蛋白酶,乙二胺四乙酸(EDTA)购自美国Sigma公司;鼠抗人平滑肌肌动蛋白(α-SMA)免疫组化试剂盒为武汉博士德有限公司产品;氯化钾(KCl)、氯化钠(NaCl)、十二水磷酸氢二钠(Na2HPO4·12H2O)、磷酸二氢钾(KH2PO4)、碳酸氢钠(NaHCO3)等无机试剂均为分析纯(天津化学试剂厂);磷酸盐缓冲液(PBS)粉剂,购自天津厚普生物科技有限公司;重组人转化生长因子-β1(TGF-β1)购自美国Peprotech公司;PCR扩增仪(480Kin-Elmer,Branchburg,NJ);核酸蛋白分析仪:BECKMAN,DU530 DNA/RNA Protein Analyzer;ABI®7300实时荧光定量系统(Applied Biosystems,美国);Trnzol总RNA提取试剂盒购自天根生化科技(北京)有限公司;PCR引物由上海生物工程技术服务有限公司合成,序列见表1。

表1 引物序列
1.2 方法
1.2.1 细胞培养 按照说明配制DMEM/F12培养液、D-hanks液、PBS缓冲液和消化液。用含10%胎牛血清及1%100 KU/L青霉素、100 mg/L链霉素(双抗)的DMEM/F12培养基传代培养,接种密度:5×107个/L,培养条件为37℃,5%CO2,隔天换液,细胞覆盖75 cm2培养瓶瓶底壁80%底面积时按1∶3传代。
1.2.2 Transwell小室建立 HK-2及LX-2长至覆盖75 cm2培养瓶瓶底壁80%底面积时,倒出瓶内旧培养液,加入D-hanks液3 mL,轻轻摇动至流遍所有细胞表面,倒出,向瓶内加入5 mL消化液(0.25%胰蛋白酶和0.04%EDTA等体积配制),轻轻摇动培养瓶,使消化液流遍所有细胞表面,倒置显微镜下观察。细胞胞质回缩,细胞间隙增大时,予30 μL胎牛血清终止消化。用弯头吸管,吸取瓶内培养液,反复轻轻吹打瓶壁细胞,细胞脱壁后形成细胞悬液,吸出至50 mL离心管,离心800 r/min,5 min。去除上清,加入5 mL培养基,吹打混匀,计数。调整细胞密度为5×107个/L,HK-2以每孔1.2 mL细胞悬液量均匀接种于Transwell12孔板下层,同时将LX-2以每孔1 mL细胞悬液量均匀接种在Transwell小室中,空白组则用等密度接种HK-2细胞。培养条件为37℃,5%CO2,共同培养48 h,取下层细胞进行实验。
1.2.3 实验分组 Transwell小室 LX-2细胞与HK-2细胞共培养组;空白对照组:HK-2细胞正常换液;阳性对照组:10μg/L重组人TGF-β1刺激HK-2。
1.2.4 HK-2细胞形态改变 倒置显微镜下观察HK-2细胞形态改变。
1.2.5 免疫细胞化学 检测HK-2细胞α-SMA蛋白的表达。采用SABC法:PBS洗涤5 min×2次;4%多聚甲醛固定20 min;PBS振洗3 min×5次;含1% H2O2的PBS室温下浸泡30min;PBS洗涤3min×3次;滴加5%BSA封闭液,室温20 min;甩去多余液体;滴加一抗,阴性对照片用PBS代替,4℃过夜;PBS洗涤3 min×3次;滴加生物素化山羊抗小鼠IgG,室温下30 min;PBS洗涤2 min×3次;滴加试剂SABC,室温30 min,PBS洗5 min×4次;DAB显色:现配H2O 1 mL+A/B/C各1滴,混匀。室温显色:2~5 min,镜下控制。冲洗DAB后,苏木素复染核,乙醇逐级脱水,中性树胶封片,显微镜下观察结果,在400×倍显微镜下随机选4个视野拍照,计算每100个细胞的阳性细胞数。
1.2.6 TGF-β1含量的检测 收集各组HK-2培养细胞上清液0.5 mL,进行TGF-β1含量的检测。
1.2.7 RT-PCR检测各样本基因表达 将细胞种在12孔板里,按实验分组处理细胞,用Trnzol法提取细胞总RNA,核酸蛋白分析仪260 nm测定RNA浓度和纯度。在Real Time PCR仪上检测各样本基因表达,用ABI®7300实时荧光定量系统进行分析,根据Ct值,以空白作为标准,计算各组基因表达为空白的倍数,以此倍数作统计。计算公式:表达倍数=2-[(Ct用药目的基因-Ct用药内参基因-Ct对照组目的基因-Ct对照组内参基因)]
1.3 统计方法 实验数据使用SPSS18.0统计软件分析,计量资料采用均数±标准差(±s)表示,两组间比较采用两独立样本t检验,多组间比较采用单因素方差分析,组间两两比较采用Dunnett's T3法,P<0.05为差异有统计学意义。
2 结果
2.1 倒置显微镜下观察 不同数量HK-2细胞由立方铺路石样转变呈现梭形长条状,细胞肥大,而空白对照组仍呈现立方铺路石样。见图1。
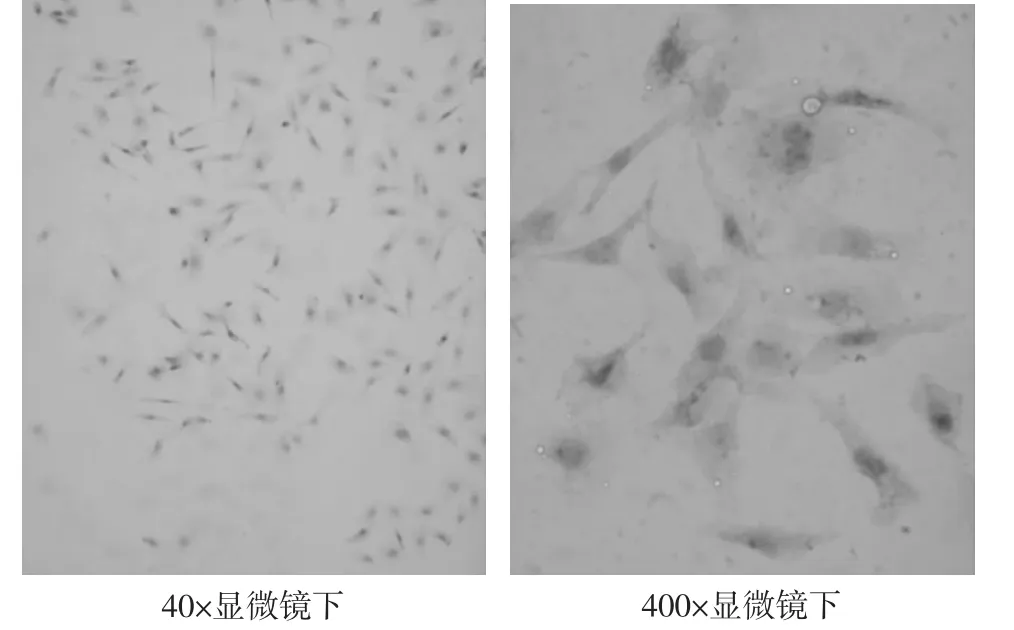
图1 Transwell共培养法免疫组化图
2.2 各组HK-2细胞α-SMA蛋白表达 见表2。经SPSS软件统计分析,共培养组HK-2细胞高表达α-SMA(P<0.01)。
表2 HK-2细胞表达α-SMA情况(±s) 个

表2 HK-2细胞表达α-SMA情况(±s) 个
注:与空白对照组比较,**P<0.01。
组别 n 每100个细胞中阳性细胞数共培养组 3 43.67±1.53**空白对照组 3 1.70±0.95阳性对照组 3 60.70±4.32**
2.3 各组细胞上清液TGF-β1含量比较 见表3。经SPSS统计软件显示,共培养组下层HK-2细胞上清液中TGF-β1含量明显高于空白对照组。
表3 下层细胞培养液中TGF-β1浓度(±s) ng/L

表3 下层细胞培养液中TGF-β1浓度(±s) ng/L
注:与空白对照组比较,**P<0.01。
组别 n 细胞上清液TGF-β1量共培养组 3 156.17±3.51**空白对照组 3 15.34±0.44阳性对照组 3 446.30±1.05**
2.4 各样本基因表达情况 见表4。SPSS统计软件分析,共培养组各目的基因与空白对照组相比均有显著性差异。TβRⅠ、Smad2、Smad3基因表达均明显上调,而TβRⅡ、Smad7基因则是下调效应。
表4 各目的基因表达倍量(±s)

表4 各目的基因表达倍量(±s)
注:与空白对照组比较,**P<0.01。
?
3 讨论
Transwell小室共培养为间接共培养,共培养体系中一者对另者的影响是通过本身分泌的细胞因子起作用的,这种分泌不用两者接触。两者之间铺一层soft agar,使两者不发生直接接触,但可以使被分泌的细胞因子通过。其主要利用了可溶性细胞因子等成分的作用(可扩散性)。肝星状细胞的活化与增殖是肝纤维化发生的中心环节[13-14],是肝脏细胞外基质的主要来源,为肝纤维化形成的细胞学基础。其在Matrigel等基质中呈静止状态,但在无任何包被的塑料培养皿中可自发性活化,与体内肝损伤后的活化过程相似,其体外培养细胞具有很好的慢性肝病的模型意义,故采用LX-2与HK-2细胞间接共培养,以研究LX-2对HK-2细胞转分化的影响。
本实验共培养中的HK-2细胞,形态由立方铺路石样转变为成纤维细胞样的梭形长条状,且肌成纤维细胞标志物α-SMA高表达(P<0.01);HK-2细胞上清液中TGF-β1含量明显高于空白组(P<0.01)。结果证实LX-2细胞可诱导HK-2细胞表型转化,这可能是肝纤维化引发肾纤维化的机制之一,具体信号传导通路可能与TGFβ1/Smad信号通路有关。
TGF-β必须活化并与其效应细胞上的受体结合才能发挥作用,它首先在细胞外与TβRⅢ形成复合物,将TGF-β传递给TβRⅡ,或TGF-β直接与TβRⅡ结合,随后活性TβRⅡ的蛋白激酶使Ⅰ型受体磷酸化,后者直接使TGF-β的信号通道蛋白Smad2、3 MH2结构域的 SSXS基序磷酸化,与Smad4形成异源寡聚体复合物,该复合物转移到胞核调节相应靶基因转录,在细胞水平介导TGF-β的生物学效应。抑制型Smad6、7是细胞中TβRⅠ型受体丝氨酸/苏氨酸激酶的拮抗蛋白,能牢固地与TβRⅠ型受体结合,抑制Smad2、3磷酸化,完全阻断TGF-β的信号转导,抑制活化Smad复合物在核内移动,减少Ⅰ型胶原合成,在TGF-β信号转导中构成负反馈。研究证实,Smad7能抑制TGF-β依赖的上皮细胞-肌纤维母细胞转分化。
为证实该通路在此共培养体系中的作用,笔者应用RT-PCR法检测了Transwell共培养模型中HK-2细胞TβRⅠmRNA、TβRⅡmRNA、Smad2mRNA、Smad3mRNA、Smad7mRNA的表达。实验结果显示TβRⅠ、Smad2、Smad3基因表达均明显上调,而TβRⅡ、Smad7基因则是下调效应。表明在该培养体系中TGFβ1/Smad信号通路是存在的,肾小管上皮细胞是趋向纤维化方向发展的,其机制可能与TGFβ1/Smad信号通路有关。故推测此通路可能是肝纤维化导致肾纤维化的一个发病机制之一。
从中医理论上讲,肝纤维化引发肾纤维化的病理基础在于“肝肾同源”。“肝肾同源”理论揭示了同属下焦的肝肾两脏在生理、病理上存在相互滋生、相互影响的密切关系。两者在发病学上具有同源性,即同源于肝肾两脏具有相同的疾病易感性,除了中医临床中见到的肝阴虚常与肾阴虚相兼存在,现代医学中也找到了肝肾两脏同病的例证,如部分乙型肝炎病毒相关性肾炎患者在肝硬化的同时亦有不同程度的肾小球硬化,甚至出现肾小管间质的纤维化[15]。故治疗中也可以依据“肝肾同源”理论,做到“肝病治肾”、“肾病治肝”、“肝肾同治”。
综上所述,Transwell小室建立LX-2细胞及HK-2细胞间接共培养模型,能成功诱导HK-2细胞表型转化,且模型与机体实际作用形式相吻合,具有良好的可行性。同时该实验也证实,TGFβ/Smad通路可能是肝纤维化导致肾纤维化的重要发病机制之一,也为“肝肾同源”理论中共同疾病易感性学说提供了依据。
[1]Strutz F,Caron R,Tomaszewski J.Transdiferentiation:a new concept in renal fibrogenesis[J].J AM Soc Nephrol,1994(5): 819-826.
[2]陈慰峰.医学免疫学[M].北京:人民卫生出版社,2004:45-52.
[3]骆抗先.乙型肝炎基础和临床[M].第3版.北京:人民卫生出版社,2006:571.
[4]Fan JM,Ng YY,Hill PA,et al.Transforming growth factorbeta regulates tubular epithelial-myofibroblast transdifferentiation in vitro[J].Kidney Int,1999,56(4):1455-1467.
[5]Abbate M,Ioja C,Rottoli D,et al.Proximal tubular cells promote fibrogenesis by TGF-β1-mediated induction of peritubular myofibroblasts[J].Kidney Int,2002,61(6):2066-2077.
[6]Sommer M,Gerth J,Stein G,et al.Transdifferentiation of endothelial tubular epithelial cells into myfibroblastlike cells under in vitro con Ditions:Amorphologicalanalysis[J].CellsTissues Organs,2005,180(4):204-214.
[7]Wang QL,Tao YY,Yuan JL,et al.Salvianolic acid B prevents epithelial-to-mesenchymal transition through the TGF-β1signal transduction pathway in vivo and in vitro[J].BMC Cell Biology,2010,11(1):31.
[8]胡志峰,李 忻,何 燕,等.DMN诱导的肝纤维化模型伴肾损害的实验观察[J].中国中医基础医学杂志,2010,16(4): 291-294.
[9]王洪霞.扶正化瘀胶囊治疗慢性乙型肝炎肝纤维化临床观察[J].天津中医药大学学报,2010,29(3):132-133.
[10]Border WA,Noble NA.Evidence that TGF-β should be a therapeutic target in diabetic nephropathy[J].Kidney Int,1998,54(4):1390-1391.
[11]唐 阁,郭 卉.瘀血阻络型慢性乙型肝炎患者胶原四项与病理分期的相关性研究[J].天津中医药大学学报,2013,32(1):14-16.
[12]苏金玲,姜希娟,宋星星,等.ILK、TNFα在酒精性肝纤维化大鼠肝组织中的表达及五田保肝液的干预作用[J].天津中医药大学学报,2012,31(1):20-22.
[13]Sato M,Suzuki S,Senoo H.Hepatic stellate cell:U niquecharacteristics in cell biology and phenotype[J].Cell Struct Funct,2003,28(2):105-112.
[14]Friedm an SL.Mechanism s of hepatic fibro genesis[J].Gastroenterology,2008,134(6):1655-1669.
[15]王耀光.“肝肾同源”论初探[J].中医杂志,2008,49(1):5-7.
LX-2 and HK-2 cell co-culture model and the influence of its cells
WANG Yao-guang1,ZENG You-jia2,ZHOU Hui-jie3
(1.First Teaching Hospital of Tianjin University of Traditional Chinese Medicine,Tianjin 300193,China;2.Shenzhen City Hospital of traditional Chinese medicine,Shenzhen 518033,China;3.Tianjin University of Traditional Chinese Medicine,Tianjin 300193,China)
[Objective]To establish human hepatic stellate cells(LX-2)and renal tubular epithelial cells(HK-2)co-culture system theory model,research LX-2 cells influence on transdifferentiation of HK-2 cells.[Methods]By Transwell Chambers establish human hepatic stellate cells in vitro(LX-2 cells)and human renal tubular epithelial cells(HK)-2 cells indirectly co-culture system.By cellular immune histochemical method to detect α-SMA of HK-2 cells;With ELISA method to detect the TGF-beta 1 in cell cultures of the content;By RT-PCR method to detect of T beta RⅠmRNA,T beta RⅡmRNA,Smad2 mRNA,Smad3 mRNA and Smad7 mRNA expression of HK-2 cell.[Results]Except the blank group,the two other groups on morphology can see HK-2 dye cell cytoplasm tan,different number of cells from cubic paving stone sample into spindle long strips,cell hypertrophy;HK-2 high expression of α-SMA cells(P<0.01);TGF-beta 1 content in the HK-2 cells supernatant fluid was obviously higher than blank group (P<0.01).TβRⅠ,Smad2 and Smad3 gene expression increase obviously,while TβRⅡ,Smad7 gene expression significantly lowered in HK-2 cells.[Conclusion]Transwell culture method can be induced to HK-2 cell transdifferentiation,its mechanism may be related to the TGF beta 1/Smad signaling pathways.
renal tubular epithelial cell trans-differentiation;Transwell;LX-2 cell;HK-2 cell;cell co-culture
R285.5
A
1673-9043(2016)05-0318-04
2016-04-25)
天津市教委课题项目(20070307)。
王耀光(1963-),男,博士,主任医师,教授,博士研究生导师,研究方向为中医、中西医结合治疗肾病综合征,乙型肝炎病毒相关性肾炎的临床与实验研究,慢性肾功能衰竭的临床与实验研究等。

