手术导航设备关键技术分析和展望
马龙飞 范真诚 姜炜鹏 廖洪恩 清华大学医学院生物医学工程系 (北京 100084)
手术导航设备关键技术分析和展望
马龙飞范真诚姜炜鹏廖洪恩清华大学医学院生物医学工程系(北京100084)
内容提要: 微创手术以其创伤性小、恢复期短、安全高效等优势已成为现代医学发展最快的领域之一。在微创手术中,手术导航设备得以广泛应用,用于制定术前计划、实时引导诊断和治疗,显著提高了手术效率、精度与安全性。本文综合分析了手术导航设备的影像来源、定位和显示等主要组成部分,以及注册和多模态影像融合等关键技术,并对手术导航设备的发展现状和趋势做了讨论。
手术导航微创手术设备分析
0.引言
随着融合新型诊断设备(CT、MRI、DSA等)的计算机辅助技术和机器人技术的发展,微创手术由于创伤小、并发症少、术后恢复快等优点,成为现代医学发展最快的领域之一。其中,手术导航设备在微创手术中被广泛应用,可用于引导医生进行手术训练、制定手术计划、实时导航手术器械和减少病人创伤。
手术导航设备广泛应用于神经外科、骨科、耳鼻喉科、心脏介入和胸腹介入等领域[1~3]。国外手术导航设备的典型产品有美国 Medtronic 公司的Stealthstation手术导航系统[4],BrainLab 公司的颅脑导航和脊柱导航系统[5]和德国Stryker公司的Stryke 手术导航系统[6]等。国内已经推向市场的手术导航设备主要有安科公司的神经外科手术导航系统和骨科手术导航系统[7],复旦大学数字医学研究中心的神经外科手术导航系统[8],天智航公司的骨科机器人导航定位系统和神经外科导航系统[9]等。
手术导航设备具有广阔的应用前景。BCCResearch的报告显示:全球手术导航系统市场到2018年预计可达6.319亿美元[10]。目前我国的大多数手术导航市场被国外设备占据,国产设备难以抗衡,导航设备普遍价格昂贵,因此难以得到广泛的普及,进而导致导航手术开展率不高。我国手术导航市场潜力巨大,自主研制国产手术导航设备具有重大的意义。本文综合讨论了国内外导航设备的技术与应用,并对主要组成部分以及关键技术做了分析,以期为加快我国具有自主知识产权的国产导航设备相关产业的发展提供参考依据。
1.手术导航设备组成和关键技术点
1.1手术导航设备组成
(1)影像来源
手术导航设备的影像来源可分为CT、MRI、PET等术前影像,术中X线透视、超声、术中MRI、内窥镜等术中影像[1,11~14]。
基于术前影像的导航系统,需要进行术前计划和术中注册跟踪。典型的术前CT导航系统可用于骨科、脊柱外科导航,典型的术前MRI导航系统可用于神经外科导航。
C型臂X线透视手术导航系统无需术前-术中配准,可实时呈现图像解剖结构,获得手术器械相对病人的空间位置关系,医生可以据此推测手术器械的行进路径,是近年来的研究热点。
超声可实时成像,安全方便,且费用低廉,目前常用于超声引导下的腰椎穿刺术、颅脑外伤手术、冠脉动脉搭桥术等操作。但超声需要改进穿透深度和成像分辨率,和其他导航技术结合可以进一步改进导航精度。
术中MRI可实时监测术中解剖结构的位移,能够彻底解决现有术前影像导航系统的术中影像漂移的问题。但其造价昂贵,需要专用的手术室且需要手术器械和设备具有磁相容性。
内窥镜广泛应用于微创外科,医生可在内镜可视化图像引导下执行取活检、取结石、缝合等操作。导航系统也可以与内窥镜系统结合,在术前图像中显示内窥镜远端的探头位置和走向,如电磁导航支气管镜。
(2)定位方式
手术导航设备的定位方式主要有机械定位、电磁定位、超声波定位和光学定位[15]。
机械定位法具有技术成熟、定位精度高等优点,但存在自由运动有限、系统体积大、无法跟踪移动物体等缺点。目前,机械定位中的框架机械立体定向仪仍广泛应用于神外穿刺、定向放疗等高精度微创手术中。
电磁定位无光路遮挡问题,广泛应用于体内器械追踪,但其工作范围小,且易受铁磁性材料干扰,对环境要求苛刻。
超声波定位基于超声测距原理。其具有价格便宜、校准方便的优点,但定位精度易受环境噪声影响,精度差。
光学定位可使用可见光或红外光进行定位,分为主动式和被动式两种定位方式,其定位精度高,体积小,可同时跟踪多个目标,是目前应用最广泛的导航方式,但其在术中容易被遮挡,应用受到部分限制。
(3)显示方式
手术导航设备的显示方式主要有二维平面显示和三维立体显示。
目前传统手术导航设备多基于二维显示器进行导航,并且显示器经常被放置在远离手术区域的位置,这种设置需要额外的步骤匹配显示器中的导航信息和病人真实的解剖结构,干扰正常的手术操作,存在手眼一致性问题。此外,为医生提供医疗信息的大部分医学影像显示为二维断层图像,医生不得不在他们的脑海中重建三维信息,并且重建信息可能会因人而异。三维增强现实(AR)技术能够解决手眼一致性问题,并且为外科医生提供了纵向视差,现已成为研究热点。
增强现实手术导航设备主要包括三种显示方法,视频显示、透视显示和投影显示。视频显示也叫监视器显示,经常应用于内窥镜或机器人手术。真实的手术区域和虚拟的3D重建图像同时显示在同一个屏幕上[16]。如果图像显示在头盔上或眼镜上,则称这种设备为头戴式显示器(HMD)。这种方法的优点是所有外科医生和助手都只分享一个视点。真实场景和虚拟重建图像通过电子设备采集和显示,很容易同步二者的分辨率和亮度。缺点是由摄像机带来的受限的分辨率和视野。
投影显示是直接投影术前结构影像到皮肤表面,但此方法目前只能投射二维影像,存在深度估计偏差,从而影响操作安全[17]。
透视显示可让医生同时看到病人器官和重建图像,提供比视频显示更大的手术视野。以立体全像裸眼3D技术为基础,利用半透半反镜将三维重建的虚拟器官覆盖在真实器官上,为外科医生提供一种身临其境的可视化手术环境,相关研究已通过模型实验[18]。
1.2手术导航设备关键技术点
基于手术导航设备的手术流程,如图1所示,手术导航原理,如图2所示。手术导航精度是手术导航设备最重要的性能指标,其关键技术点有注册技术和多模影像融合。术前数据与术中数据的注册是图像引导外科中的关键技术,它将术前数据(病人术前影像或由这些影像获取的解剖结构模型和手术规划)和术中数据(病人图像,手术器械位置,跟踪系统等)统一到同一坐标系下[19]。多模影像融合的意义是综合不同模态影像的优势,产生包含有更多价值信息的多源融合图像。
(1)注册技术
注册技术可分为术中注册和自动注册两大类[20]。术中注册依赖于解剖标志点,表面轮廓或术前植入基准标记物,采用基于特征点注册或表面注册的方法。其中,基于特征点的配准方法是在病人身上贴标记点或直接提取内部特征,其配准结果受特征点提取精度的影响。而表面配准方法是通过建立术前表面模型点云与术中采集的对应的病人组织表面点云之间的匹配关系完成配准。
自动注册方法是通过在术中实时获取2D/3D透视图像完成病人的自动注册,仅需在透视设备上固定跟踪标记物和在病人特定解剖结构上固定参考架。C型臂和O型臂X线透视手术导航都应用自动注册技术,通过实时获取手术器械相对病人的空间位置关系,推测其行进路径。
目前上述注册方法常用于骨科等刚性器官的配准,但针对心脏等软组织器官的配准方式需要考虑呼吸运动,软组织变形等因素,是研究的热点,但目前尚没有成熟应用于临床。
术中组织移位会导致结构性影像与真实位置偏差,影响导航精度,术中超声可用于纠正影像漂移误差,术中MRI导航也可以解决这一问题[21]。
(2)多模态影像融合
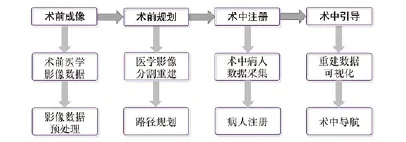
图1. 基于手术导航设备的手术流程
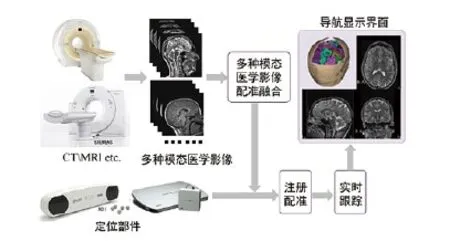
图2. 手术导航基本原理
不同模态的影像数据结合在一起便于从医学特性上更加精确、全面地分析目标组织。这涉及到医学图像配准技术。医学图像配准技术已经由2D/2D平面图像的配准延伸到2D/3D的配准,3D/3D的配准。3D扫描体数据和2D图像的配准可用于手术规划、临床诊断等领域,例如,术前CT/MRI和术中X线的配准既保证了配准精度又能达到术中即时应用的要求。不同模态的影像数据的3D/3D配准(如3D-MR/CT或CT/PET配准)也便于精准诊断。3D点云配准方法“最近点迭代(Iterative Closest Point,ICP)法”等常被广泛应用于3D医学图像的配准中。
2.选用手术导航设备时应考虑的因素
面对多种类型的手术导航设备,如何根据需要选择性能更为合适的设备是使用者关注的方面。在有效选择手术导航设备的过程中主要依靠两种现实需求进行判断:应用场合与实现效果。
2.1临床应用场合
在临床手术导航中,手术导航设备常用于脑神经外科和骨科等术中组织结构变形少的部位。当然,在肝脏外科、心脏外科等会发生较大变形的手术中也有进一步的应用。针对于不同类型的手术,需要选择对应的手术导航设备。例如,对体表或浅层组织器官进行定位导航时,可以采用光学定位导航设备(包括基于红外的光学定位导航设备和基于可见光的光学定位导航设备);对深部组织器官进行定位导航时,可以采用不容易被遮挡的磁定位导航设备或超声引导设备。临床手术的应用环境与定位精度要求也各有不同,根据实际临床应用的环境,权衡选择具有不同定位精度的手术导航设备。
2.2实现效果
根据需要实现的效果可以选择不同的手术导航设备。传统手术导航显示装置主要利用二维显示屏幕与定位追踪装置,能够满足基本的导航需求。若需要观察更为直观的三维立体医学信息,则可以选择裸眼三维显示器等[22]。若想获得增强现实的显示效果,则可以选择头戴式增强现实装置、投影式增强现实装置或基于立体全像技术的增强现实装置[22,24]。
3.现状与发展趋势
3.1手术导航现状分析
目前手术导航也存在一些问题,影响其临床应用与推广。而这些问题,也是手术导航将来的改进与发展趋势。
导航设备的注册配准过程多采用刚性变化,且在术前影像与术中病人配准后,用术前影像辅助判断术中组织状态。这一方式对形变组织关注较少,因此,会引导医生错误判断大型变形的组织结构。考虑术中组织变形,考虑非刚性配准算法,并利用术中影像对术前影像数据进行变形,能够准确显示术中组织结构信息,进而辅助医生进行准确观察。
三维医学影像的自动化分割程度与精确度有待提升。目前,常用的分割软件包括3D Slicer、 Mimics等以及研究提出的多种分割算法,虽然能够进行分割与处理,但分割效果尚未达到高自动化与高精度。因此,开发高精度实时影像分割算法也亟待解决。
针对于增强现实导航装置,例如,投影增强显示装置、空间透视融合导航装置,其显示精度与融合精度依旧存在误差。因此,需要开发高精度增强影像显示算法与准确空间融合算法。
目前商业导航系统常用光学定位法和电磁定位法。光学定位法虽然定位精度高,但存在遮挡问题,电磁定位虽然可以解决遮挡问题,但定位精度偏低且容易受到干扰。因此,如何实现高精度无遮挡的稳定定位是亟待解决的问题。
3.2手术导航发展趋势
手术导航设备在临床手术中具有重要应用,在未来发展中将围绕高精度配准融合、多模态融合、三维影像导航和增强现实、多种导航技术结合和手术机器人导航等方向展开。
多种模态的影像融合将会融合丰富的解剖结构信息和生理病理信息,高精度的术前术中数据准确配准与精确融合显示能够准确地显示关键区域的空间位置信息,三维影像导航显示能够显示医学影像的三维空间信息。而增强显示导航的发展将会有效解决手眼协调问题,有效辅助医生进行直观观察与操作。
此外,为改进现有导航的不足,多种导航技术相结合可提升导航精度,改善遮挡问题,并通过降低操作难度改善医生的学习曲线。局部高精度图像(如光学相干断层成像(OCT)/荧光)成像精度可以达到亚毫米级,可用于组织的精确诊断,但其成像范围有限,全局空间采集图像(CT/ MRI)虽然可以提供大范围的导航空间,但存在大空间尺度和高细节精度难以兼顾问题,所以将全局采集图像范围大的优势和局部图像精度高的优势进行结合,建立大范围高细节分辨率的术中实时诊断与导航系统,具有重要的临床意义。
手术导航设备能够有效辅助医生进行治疗。将手术导航技术和机器人技术相结合是一个重要的发展方向,可以使手术操作更加精确,实现精准微创诊疗,同时也可以遥控机器人进行外科手术,实现远程化医疗。
4.总结
手术导航设备能够辅助医生确定关键部位或结构的空间位置,准确了解解剖结构信息,进而保证手术精度与安全,目前在微创手术中具有重要的作用。随着医学图像处理技术、分子影像技术、三维显示技术和机器人技术等的发展,针对大变形组织的导航、融合多模态图像的高精度导航、全局/局部高精度导航、体内/体外导航、术中影像引导的高精度诊断和治疗、增强现实导航和机器人手术导航等将得到逐步发展,广泛应用于临床,带来广阔的应用前景。
致谢:
感谢国家自然科学基金(81427803,61361160417,81271735),北京市科委《生命科学领域前沿技术》专项(Z151100003915079),以及科技支撑计划项目(2015BAI01B03)等基金和项目的支持。
[1] Cleary K, Peters T M. Image-guided interventions∶ technology review and clinical applications.[J]. Annual Review of Biomedical Engineering, 2010, 12(1)∶119-42.
[2] Dan E A, Dua M M, Barrese J C, et al. Image-guided surgery[J]. Current Problems in Surgery, 2015, 52(12)∶476-520.
[3] Saeed M, Hetts S W, English J, et al. MR fluoroscopy in vascular and cardiac interventions (review)[J]. International Journal of Cardiovascular Imaging, 2012, 28(1)∶117-37.
[4] http∶//www.medtronic.com/
[5] https∶//www.brainlab.com/
[6] http∶//www.stryker.com/
[7] http∶//cn.anke.com/
[8] http∶//www.digi-medical.com.cn/
[9] http∶//www.tinavi.com/
[10] http∶//www.bccresearch.com/
[11] Navab N, Heining S M, Traub J. Camera augmented mobile C-arm (CAMC)∶ calibration, accuracy study, and clinical applications.[J]. IEEE Transactions on Medical Imaging, 2010, 29(7)∶1412-23.
[12] Oğuzkurt L, Gürel K, Eker E, et al. Ultrasound-guided puncture of the femoral artery for total percutaneous aortic aneurysm repair.[J]. Diagnostic & Interventional Radiology, 2012, 18(1)∶92-5.
[13] Daniel Thomas Ginat MD MS, Brooke Swearingen M D, William Curry M D, et al. 3 Tesla intraoperative MRI for brain tumor surgery[J]. Journal of Magnetic Resonance Imaging, 2014, 39(6)∶1357-1365.
[14] Weiser T S, Hyman K, Yun J, et al. Electromagnetic Navigational Bronchoscopy∶ A Surgeon's Perspective[J]. Annals of Thoracic Surgery, 2008, 85(2)∶S797-801.
[15] 沈轶. 高精度手术导航的研究与应用[D]. 上海交通大学, 2012.
[16] Marescaux J, Rubino F, Arenas M, et al. Augmented-reality-assisted laparoscopic adrenalectomy.[J]. Jama the Journal of the American Medical Association, 2004, 292(18)∶2214-5.
[17] Volonté F, Pugin F, Bucher P, et al. Augmented reality and image overlay navigation with OsiriX in laparoscopic and robotic surgery∶ not only a matter of fashion[J]. Journal of Hepato-Biliary-Pancreatic Sciences, 2011, 18(4)∶506-509.
[18] Liao H, Inomata T, Sakuma I, et al. 3-D augmented reality for MRI-guided surgery using integral videography autostereoscopic image overlay.[J]. IEEE transactions on bio-medical engineering, 2010, 57(6)∶1476 - 1486.
[19] Markelj P, Tomaževič D, Likar B, et al. A review of 3D/2D registration methods for image-guided interventions[J]. Medical Image Analysis, 2012, 16(3)∶642-61.
[20] Tjardes T, Shafzadeh S, Rixen D, et al. Image-guided spine surgery∶ state of the art and future directions[J]. European Spine Journal, 2009, 19(1)∶25-45.
[21] Fisher T, Hamed A, Vartholomeos P, et al. Intraoperative magnetic resonance imaging-conditional robotic devices for therapy and diagnosis.[J]. Proceedings of the Institution of Mechanical Engineers Part H Journal of Engineering in Medicine, 2014, 228(3)∶303-318.
[22] Liao H, Iwahara M, Hata N, Dohi T. High-quality integral videography using a multiprojector, Optics Express, Vol. 12 No. 6,pp. 1067-1076, 2004.
[23] Liao H, Nakajima S, Iwahara M, et al. Development of Real-Time 3D Navigation System for Intra-operative Information by Integral Videography; Journal of Japan Society of Computer Aided Surgery, Vol. 2 No. 4, pp245-252, 2000.
[24] Liao H, Inomata T, Sakuma I, and Dohi T. 3-D Augmented Reality for MRI-guided Surgery using Integral Videography Autostereoscopic Image Overlay, IEEE Transactions on Biomedical Engineering, Vol. 57, No. 6, pp. 1476-1486, 2010.
Analysis on Surgical Navigation System
MA Long-feiFAN Zhen-chengJIANG Wei-pengLIAO Hong-enDepartment of Biomedical Engineering, School of Medicine, Tsinghua University(Beijing100084)
Minimally invasive surgery has become one of the fastest developing areas in the feld of modern medicine with the advantages of small trauma, short recovery time and safety. Surgical navigation devices are widely used in minimally invasive surgery for preoperative planning, real-time guidance of diagnosis and treatment. They signifcantly improve the effciency, accuracy and safety of the operation. In this paper, we introduce the main components of surgical navigation system including the source of medical image, tracking system and visualization interface, and important technologies containing registration and multi-modality fusion. We also discuss the current situation and the development trend of surgical navigation system.
surgery navigation,minimally invasive surgery,device analysis
1006-6586(2016)09-0001-05
TP39
A
2016-06-23

