丁二酸、1,10-菲啰啉构筑稀土配合物的合成、表征及与DNA作用的光谱学研究
李小芳, 冯小强*, 杨 声 , 朱元成
(1. 天水师范学院 化工学院, 甘肃 天水 741001; 2. 定西师专 化学系, 甘肃 定西 743000)
丁二酸、1,10-菲啰啉构筑稀土配合物的合成、表征及与DNA作用的光谱学研究
李小芳1, 冯小强1*, 杨声2, 朱元成1
(1. 天水师范学院 化工学院, 甘肃 天水741001;2. 定西师专 化学系, 甘肃 定西743000)
首次合成丁二酸-1,10-菲啰啉稀土配合物,并运用光谱法研究配合物与DNA之间的作用机制,为新型抗癌药物的设计开发提供依据。以1,10-菲啰啉(phen)和丁二酸(SA)为配体构筑了3种稀土(La3+,Nd3+,Eu3+)配合物,采用元素分析、红外和紫外光谱及热重分析对配合物性质进行表征测试,确定其化学组成为 (RE)2(SA) (phen) ·2H2O (RE=La,Nd,Eu)。同时,通过光谱法探讨了这3种配合物分别与DNA作用的机理以及稀土离子种类对作用强度的影响。配合物与DNA作用时,可观察到较明显的吸收峰红移和较大的减色效应现象,同时,中性红(NR)荧光竞争实验发现配合物都能不同程度地猝灭NR -DNA体系的荧光。这3种配合物对DNA均具有较强的插入作用,作用强度为:La(Ⅲ)>Nd(Ⅲ)>Eu (Ⅲ)。计算了DNA与配合物的结合比、结合常数及一些热力学参数,得出DNA 与Eu配合物、Nd配合物、La配合物的结合比分别为4∶1,2∶1和8∶1,ΔrGmӨ<0、ΔrSmӨ>0,表明这3种配合物与DNA之间的反应均能够自发进行,且作用是熵驱动的。
丁二酸; 1,10-菲啰啉; 稀土; DNA; 相互作用
1 引 言
诸多防癌、治癌药物与DNA之间存在嵌插作用而发挥药理作用,探讨药物小分子与DNA之间的作用机理,对阐释药物分子如何发挥活性有着重要的意义,同时也为设计、筛选高效抗癌药物提供有价值的参考和导向[1-2]。
自从顺铂类抗癌药物成功应用于临床后,金属配合物与DNA之间的作用机制以及抗癌活性引起了国内外学者的广泛关注。如国内的河南科技学院学者[3]发现,水杨酸类稀土配合物对西(甜)瓜果斑病菌、甘薯软腐病菌、柑橘青霉病菌的抑菌效果均高于5-氨基水杨酸。西北师范大学的学者[4]发现,稀土离子、配体姜黄素、稀土-姜黄素-1,10-菲啰啉三元配合物对人肝癌细胞HepG2生长都具有一定的抑制作用,其中Nd配合物对癌细胞的抑制作用始终最强,这与Nd配合物和DNA之间存在强的嵌插作用有关。此外,他们还发现稀土-全反式维甲酸-精氨酸三元配合物对人肝癌细胞HepG2、人肺癌细胞A549和人宫颈癌细胞Hela的抑制效果明显优于稀土硝酸盐和配体[5];配合物与药物靶分子DNA以嵌入方式相互作用,推测配合物抗肿瘤活性的起效与这种嵌入DNA双螺旋结构的作用方式有关。湘南学院的学者[6]发现,水杨酸对红酵母没有抑菌效果,8-羟基喹啉抑菌能力强。当抑菌作用不明显的稀土(RE=Pr、Gd、Er) 离子与水杨酸、8-羟基喹啉形成三元配合物后,对红酵母的抑菌能力明显得到增强,可应用于有害红酵母的生物防治。宁夏大学学者[7]发现,2,7-二(苄胺酰乙氧基)萘与稀土(Y,La,Eu,Tb)苦味酸盐的配合物以插入方式与ct-DNA发生配合作用,其作用强度为: La(Ⅲ)>Tb(Ⅲ)>Y(Ⅲ)>Eu(Ⅲ)。国外学者Shahriar Ghammamy采用MTT法研究发现,三唑甲亚胺衍生物的铜配合物和锌配合物对肠癌细胞HT-29和742都具有很好的抑制效果,抑制率均在90%以上,可成为一类新型抗癌药物[8]。Ali Akbar Jamali发现桑色素金属配合物的抗肿瘤活性远强于桑色素本身[9]。Adam等学者在硒金属存在下,合成的脂肪酸、癸二酸的贵金属(Ag+,Au3+,Pd4+)配合物对常见细菌和真菌具有很好的抑制作用,并通过台盼蓝染色法发现配合物对埃利希腹水癌细胞具有细胞毒活性[10]。
但是,目前以稀土(La3+,Nd3+,Eu3+)、1,10-菲啰啉(phen)和丁二酸(SA)为原料构筑三元配合物以及配合物与DNA相互作用的研究尚未见报道。基于羧酸丰富的配位点、1,10-菲啰啉的共平面结构、稀土离子独特的杀菌、抗癌、低毒等特性,本文首次构筑了丁二酸-1,10-菲啰啉稀土三元配合物,光谱法研究了配合物与鲱鱼精DNA之间的作用机理,并分析了不同稀土中心与DNA作用的差异,该研究为新型抗癌药物的设计开发提供了依据。
2 实 验
2.1材料与仪器
LaCl3,NdCl3和EuCl3(甘肃稀土新材料有限公司)。RF-5301PC荧光光谱仪(日本岛津公司);UV-2450紫外可见光谱仪(日本岛津公司)。
2.2配合物的合成
在圆底烧瓶中加入0.6 g SA,用30 mL乙醇溶解后调节pH至6.5。取0.3 g 1,10-菲啰啉,加入到含SA溶液的圆底烧瓶中,并于60 ℃搅拌回流30 min。而后,继续加入溶解于乙醇的5 mmol 稀土氯化物,发现马上有沉淀产生,继续回流反应8 h。反应结束后将沉淀抽滤,并依次用95%乙醇、丙酮洗涤数次,直至滤液中无Cl-1为止。沉淀干燥至恒重,得到丁二酸-1,10-菲啰啉稀土配合物。
2.3配合物与鲱鱼精DNA的作用
紫外光谱和荧光光谱具体实验过程见文献报道[11]。
3 结果与讨论
3.1配合物的表征
SA-phen-稀土(La3+,Nd3+,Eu3+)配合物分别为深橙色、深黄色、橙色粉末状固体,产率均在80%左右,较易溶于N,N-二甲基甲酰胺(DMF)和二甲亚砜(DMSO),难溶于水。采用EDTA络合法测定稀土离子含量,结合元素分析数据,测得La配合物的实验值(%):La,45.16;C,31.94;H,2.91;N,4.62。计算值(%):La,45.72;C,31.58;H,2.96;N,4.61。Nd配合物的实验值(%):Nd,46.94;C,31.28;H,2.85;N,4.64。计算值(%):Nd,46.6;C,31.07;H,2.91;N,4.53。Eu配合物的实验值(%):Eu,47.88;C,30.37;H,2.95;N,4.51。计算值(%):Eu,47.95;C,30.28;H,2.84;N,4.42。
2种配体及3种配合物用DMSO溶解后紫外吸收光谱数据如表1所示。配体phen在324 nm和270 nm产生2个吸收峰,配体SA在251 nm和273 nm处出现2个特征吸收峰。但是,两个配体与稀土离子发生配位后,配合物除了出现配体的一些特征峰外,还在310 nm和380 nm附近产生新的吸收峰,明显不是两种配体各自吸收光谱的简单叠加,表明两个配体与稀土离子配位成键形成了新的配合物[12]。

为了研究配合物的热稳定性,在氮气气氛下,以10 ℃·min-1的加热速度,在室温~1 000 ℃范围内对配合物进行热重测试。可以发现,随着温度的升高,这3类稀土配合物发生失重,且失重曲线较为相似,均可观察到4个失重阶段,说明配合物具有相似结构,TG数据如表3所示。以La配合物的热分解过程为例,见图1,可以看出室温~200 ℃出现第一个失重台阶,失重率4.4%,是2个结晶水的失去;200~350 ℃出现第二个失重台阶,失重率6.2%,属于丁二酸分子的氧化放出二氧化碳过程;350~600 ℃出现第三个失重台阶,失重率23.8%,该过程是一分子phen的失去;600~1 000 ℃出现第四个失重台阶,失重率11.9%,属于丁二酸分子骨架的最终氧化分解。 当温度持续升高到1 000 ℃时,热重曲线趋于平缓,质量仍有53.7%的剩余,最终分解产物认为是稀土氧化物,经过计算与理论值基本相符(理论剩余52.6%)。结合元素分析数据、红外光谱和热重分析测试结果可以推测配合物的化学组成为(RE)2(SA) (phen)·2H2O (RE=La,Nd,Eu)。

表1 紫外光谱数据

表2 配体及其配合物的主要红外光谱数据

表3 配合物的TG数据
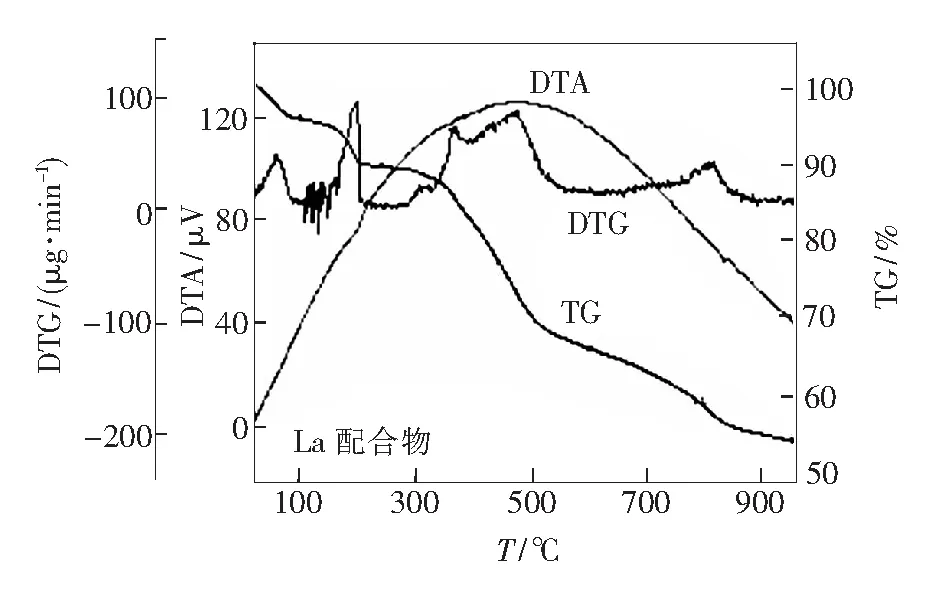
图1 La配合物的热重分析曲线
3.2配合物与DNA的作用方式
3.2.1紫外光谱法
在样品池和参比池中分别加入等体积的配合物和DMSO,依次用DNA分别滴定样品池和参比池中的溶液,作用5 min后扫描紫外吸收光谱。如
图2所示,单独的DNA在197 nm和260 nm处存在紫外吸收。在同一浓度的3种稀土配合物中,随着DNA溶液的滴加,3种稀土配合物的特征吸收峰强度均有不同程度的降低,峰位也有红移现象。当在相同浓度的3种稀土配合物中分别加入浓度为0.972×10-4mol/L的DNA时,La配合物原位于380 nm和263.5 nm处的吸收峰分别红移了11 nm和3.0 nm,对应的吸光强度分别减色64%和62.6%,而在320 nm处吸收峰的位置没有发生变化;Nd配合物原位于385 nm和264 nm处的吸收峰分别红移了4 nm和3.5 nm,对应的吸光强度分别减色23%和39.5%;Eu配合物原位于380.5 nm和264.5 nm处的吸收峰均红移了2 nm,对应的吸光强度分别减色11.2%和22.9%。根据文献报道,当小分子中加入DNA后,若引起其吸收光谱减色效应和红移现象,说明小分子与DNA发生嵌插作用[14]。从图2紫外吸收光谱的变化可判断3种稀土配合物以嵌入方式与鲱鱼精DNA发生相互作用。此外,峰位红移的大小和吸光强度下降程度反映了小分子与DNA之间结合能力的强弱,一般而言,小分子的峰位红移越大,吸光强度下降越大,则与DNA的作用能力越强。从以上分析可以看出,在相同浓度的配合物中滴加同浓度的DNA时,La配合物的吸收峰峰位红移最大,强度下降最多,Nd配合物次之,Eu配合物最弱,说明这3种配合物与DNA间的作用能力顺序为:La(Ⅲ)>Nd(Ⅲ)>Eu (Ⅲ)。

图2 DNA加入前后配合物的紫外吸收光谱。(a) La;(b) Nd;(c) Eu;(d) DNA。
以DNA的浓度对272 nm的吸光度作图,如图3所示。从图中可以看出,DNA与配合物的结合比分别是:n(DNA)∶n(Eu配合物)= 4∶1,n(DNA)∶n(Nd配合物)=2∶1,n(DNA)∶n(La配合物)=8∶1。计算得到La配合物-DNA复合物的表观摩尔吸光系数ε为1.63×104L/(mol·cm),Eu配合物-DNA复合物的表观摩尔吸光系数ε为2.84×104L/(mol·cm),Nd配合物-DNA复合物的表观摩尔吸光系数ε为9.88×104L/(mol·cm)。为了定量地比较配合物与DNA的结合力,以1/(A0-A)-1/CDNA作图[15],见图4,利用配合物的最强吸收峰的强度变化,计算出在298 K和308 K下3种稀土配合物与DNA的结合常数,并计算出相应的热力学参数,如表4所示。结合常数反映了配合物与DNA之间的结合能力,从表4数据可以看出La配合物与DNA之间的结合能力最大,Nd配合物次之,Eu配合物最弱,这与以上分析结果相一致。结构相似、配体相同的3种稀土配合物与DNA之间的结合能力存在差异,这主要与稀土离子的种类有关。此外,热力学参数ΔrGmӨ<0、ΔrSmӨ>0,说明这3种稀土配合物与DNA之间的作用自发进行,且主要是熵驱动的[16]。

图3 摩尔比图。 (a) La;(b) Nd;(c) Eu。

图4 双倒数曲线
3.2.2荧光光谱法
近年来研究发现,无毒的NR以嵌插作用与DNA结合后能使体系的荧光明显增强,因此NR广泛应用于光谱探针[17]。一旦外来小分子与DNA之间也存在嵌插作用时,小分子和NR与DNA之间存在竞争作用,这样会使得具有荧光的NR从DNA的双螺旋结构中游离出来,此时体系的荧光强度便会明显降低[18]。因此,可以利用荧光猝灭实验研究稀土配合物与DNA之间的作用机制。我们在1 cm×1 cm石英比色皿中加入2.2 mL浓度为1.3×10-3mol/L的DNA和0.2 mL浓度为1.3×10-5mol/L的NR混合,作用5 min后,测得体系在593 nm处有很强的荧光发射。用配合物逐渐滴定DNA-NR体系,每次加入5 μL,因此可忽略体积效应。发现在593 nm处的荧光减弱,且加入的配合物的量越多,荧光降低的程度越大,如图5所示。这是因为配合物和DNA之间发生作用,使得与配合物结合的DNA结构变得松散,原本插入在DNA碱基对之间的NR游离出来,导致体系的荧光强度降低。这说明NR和稀土配合物在与DNA结合的过程中存在竞争,因此可进一步确定配合物与DNA之间存在嵌插作用。此外,DNA-NR体系中加入配合物前后,荧光强度的降低程度也反映出配合物与DNA作用的强弱,即配合物使DNA-NR体系荧光强度下降越大,说明配合物与DNA之间的结合能力越强[19]。从图5可以明显看出,加入La配合物后,DNA-NR体系荧光强度下降最大,Nd配合物次之,Eu配合物最弱,这与紫外光谱法的研究结论一致。

表4 配合物与DNA作用的结合常数及热力学参数

1~10:配合物的浓度依次为0,0.90,1.81,2.71,
图5配合物加入前后DNA-NR体系的荧光光谱。(a) La;(b) Nd;(c) Eu。
Fig.5Fluorescence spectra of DNA-NR addition complex before and after. (a) La. (b) Nd. (c) Eu.
4 结 论
合成了3种新型的三元稀土配合物,确定配合物的化学组成为 (RE)2(SA) (phen) ·2H2O (RE=La,Nd,Eu)。运用光谱手段研究了这3种稀土配合物与鲱鱼精DNA的相互作用机理。结果显示:这3种稀土配合物的最大吸收峰在DNA加入后均出现减色效应和峰位红移现象。通过摩尔比法可知DNA 与Eu配合物、Nd配合物、La配合物的结合比分别为4∶1、2∶1和8∶1。根据双倒数公式计算得出298 K和308 K下3种稀土配合物与DNA的结合常数以及相应的热力学参数。结果表明:3种稀土配合物对DNA均具有较强的插入作用,而熵驱动使这种作用能自发进行,且作用强度为:La(Ⅲ)>Nd(Ⅲ)>Eu(Ⅲ)。因此,配合物(RE)2(SA)(phen)·2H2O是一类潜在的新型抗癌抗肿瘤药物,其体外抑菌、抗肿瘤等生物活性有待进一步研究。
[1] WANG Q, HUANG M, HUANG Y,etal.. Synthesis, characterization, DNA interaction, and antitumor activities of mixed-ligand metal complexes of kaempferol and 1,10-phenanthroline/2,2’-bipyridine [J].Med.Chem.Res., 2014, 23:2659-2666
[2] HUANG Q W, LIU S G, LI G B,etal.. Crystal structure and antitumor activities of the dichloride 2,6- bis(1-phenylbenzimidazol-2-yl) pyridine copper(Ⅱ) complex [J].J.Struct.Chem., 2015, 56(3):458-462.
[3] 刘起丽,张建新,田雪亮,等. 水杨酸类稀土配合物对三种植物病原菌的抑制作用研究 [J].稀土, 2014, 35(1):35-38.
LIU Q L, ZHANG J X, TIAN X L,etal.. Study on the inhibition effect of rare earth complexes with salicylic acids on three phytopathogens[J].Chin.RareEarth., 2014, 35(1):35-38. (in Chinese)
[4] 王莉,宋玉民. 稀土-姜黄素-吡啶/2,2-联吡啶/1,10-菲啰啉配合物的抗肿瘤活性研究 [J].中国稀土学报, 2014, 32(1):50-60.
WANG L, SONG Y M. Anti-tumor activity of rare earth-curcumin-pyridine/2,2-bipyridine /1,10-phenanthroline complexes [J].J.Chin.Soc.RareEarth., 2014, 32(1):50-60. (in Chinese)
[5] 宋玉民,李文娟,杨美玲. 稀土-全反式维甲酸-精氨酸三元配合物的合成、表征及抗肿瘤活性研究 [J].无机化学学报, 2014, 30(5):1087-1091.
SONG Y M, LI W J, YANG M L. Study on synthesis, characterization and antitumor activity of rare earth metal complexes with all trans retinoic acid and arginine acid [J].Chin.J.Inorg.Chem., 2014, 30(5):1087-1091. (in Chinese)
[6] 蒋建宏,肖圣雄,肖航英,等. 稀土水杨酸8-羟基喹啉三元配合物的合成表征及其对红酵母活性的影响 [J]. 稀土, 2013, 34(3):69-73.
JIANG J H, XIAO S X, XIAO H Y,etal.. Preparation and characterization of ternary complexes of rare earth with salicylic acid and 8-hydroxylquinoline and their influence on activity of rhodotorula [J].Chin.RareEarth., 2013, 34(3):69-73. (in Chinese)
[7] 霍丽娜,杨天林,李寒玉,等. 2,7-二(苄胺酰乙氧基) 萘稀土苦味酸配合物的合成、表征及其与DNA的作用 [J]. 应用化学, 2013, 30(2):159-164.
HUO L N, YANG T, LI H Y,etal.. Synthesis,characterization and DNA-binding of rare earth picorate complexes with 2,7-bis(benzylamine carbonyl ethoxy) naphthaedi [J].Chin.J.Appl.Chem., 2013, 30(2):159-164. (in Chinese)
[8] GHAMMAMY S, SEDAGHAT S. Synthesis, characterization, and antitumor activity of azomethine derivative of triazole and its complexes with Copper(Ⅰ) and Zinc(Ⅱ) salts [J].RussianJ.GeneralChem., 2013, 83(4):722-725.
[9] JAMALI A A, TAVAKOLI A, DOLATABADI J E N. Analytical overview of DNA interaction with Morin and its metal complexes [J].Eur.FoodRes.Technol., 2012, 235:367-373
[10] ADAM A M A, REFAT M S, MOHAMED M A. Synthesis and spectroscopic characterizations of noble metal complexes (gold, silver, platinum) in the presence of selenium, and their biological applications as antibacterial, antifungal, and anticancer [J].Res.Chem.Intermed., 2015, 41:965-1000.
[11] 李小芳,冯小强,张宏伟,等. 甲基丙烯酸-8-羟基喹啉-镧配合物的合成及与鲱鱼精DNA相互作用的光谱学研究 [J]. 化学研究与应用, 2014, 26(9):1406-1410.
LI X F, FENG X Q, ZHANG H W,etal.. Synthesis and DNA-binding of La(Ⅲ) complex with methacrylic acid and 8-hydroxyquinoline [J].Chem.Res.Appl., 2014, 26(9):1406-1410. (in Chinese)
[12] 王文,汪联辉,章文贡,等. Sm(Ⅲ), Eu(Ⅲ)-丙烯酸-8-羟基喹啉三元配合物的合成及荧光性质研究 [J]. 稀土, 1999, 20(1):50-52.
WANG W,WANG L H, ZHANG W G,etal.. Synthesis and fluorescence properties of ternary complexes of rare earth with acrylic acid and 8-Hydroxyquinoline[J].Chin.RareEarth., 1999, 20(1):50-52. (in Chinese)
[13] 何其庄,马树芝,许东芳. 稀土酰基吡唑啉酮邻菲咯啉配合物的合成、表征及其生物活性 [J]. 无机化学学报, 2007, 23(10):1723-1728.
HE Q Z, MA S Z, XU D F. Synthesis, characterization and biological activity of rare earth complexes with acylpyrazolone ando-phenanthroline [J].Chin.J.Inorg.Chem., 2007, 23(10):1723-1728. (in Chinese)
[14] PYLE A M, REHMANN J P, MESHOYRER R,etal.. Mixed-ligand complexes of ruthenium (Ⅱ): factors governing binding to DNA [J].J.Am.Chem.Soc., 1989, 111:3051-3058.
[15] OUAMEUR A A, MARTY R, TAJMIR-RIAHI H A. Human serum albumin complexes with chlorophyll and chlorophyllin [J].Biopolymers, 2005, 77:129-136.
[16] 黎泓波,拓宏桂,王兴明,等.光谱学研究血卟啉与鲱鱼精DNA的相互作用 [J]. 光学学报, 2008, 28(10):2015-2021.
LI H B, TA H G, WANG X M,etal..Study on internaction between hematoporphyrin dhydrochloride and herring sperm DNA by spectroscopy [J].ActaOpt.Sinica, 2008, 28(10):2015-2021. (in Chinese)
[17] 倪永年,杜姗. 核黄素与脱氧核糖核酸相互作用的电化学和光谱法研究 [J]. 分析化学, 2006, 34(5):659-662.
NI Y N, DU S. Electrochemical and spectral investigation on interaction between riboflavin with deoxyribonucleic acid [J].Chin.J.Anal.Chem., 2006, 34(5):659-662. (in Chinese)
[18] 杨频,周春琼. 两种新稀土双核配合物的合成、表征及其对磷酸二酯键模型物(BDNPP) 和DNA的作用研究 [J]. 化学学报, 2003, 61(9):1455-1460.
YANG P, ZHOU C Q. Synthesis and characterization of two new rare-earth complexes and their research for cleaving an activated phosphate diester BDNPP and DNA [J].ActaChim.Sinica, 2003, 61(9):1455-1460. (in Chinese)
[19] 王丽娟,杨天林,杨欢春. 稀土配合物Eu(pic)3L·2H2O的合成、荧光性质及与DNA作用方式研究 [J]. 稀有金属, 2010, 34(2):257-263.WANG L J, YANG T L, YANG H C. Synthesis, fluorescence property and preliminary DNA-binding studies of Eu(pic)3L·2H2O [J].Chin.J.RareMetals, 2010, 34(2):257-263. (in Chinese)

李小芳(1983-),女,甘肃甘谷人,硕士,实验师,2009年于兰州大学获得硕士学位,主要从事功能高分子及有机稀土配位的研究。

E-mail: tslxffxq@163.com冯小强(1979-),男,甘肃华亭人,硕士,副教授,2007年于兰州大学获得硕士学位,主要从事功能高分子的研究。
E-mail: fengxiaoqiang1979@163.com
Synthesis, Characterization of Rare Earth Complexes with Succinic Acid and 1,10- Phenanthroline and Interacting with DNA
LI Xiao-fang1, FENG Xiao-qiang1*, YANG Sheng2, ZHU Yuan-cheng1
(1.CollegeofChemicalEngineeringandTechnology,TianshuiNormalUniversity,Tianshui741001,China;2.DingXiTeachers’College,Dingxi743000,China)
*CorrespondingAuthor,E-mail:fengxiaoqiang1979@163.com
Rare earth complexes with succinic acid and 1,10- phenanthroline were synthesized firstly and the interaction with DNA was investigated by spectroscopy method, which provide the basis for the design and development of new anticancer drugs. Three kinds of ternary complexes of rare earth(La3+,Nd3+,Eu3+) with succinic acid (SA) and 1,10-phenanthroline (phen) were synthesized in absolute ethanol solution, which were characterized by eleme-ntal analysis, IR, UV-Vis and TG-DTA methods. The compositions of the complexes were confirmed to be (RE)2(SA)(phen)·2H2O (RE=La, Nd, Eu). Meanwhile, the interactions between complexes and herring sperm DNA have been investigated by electronic absorption spectrum and fluorescence spectrum. The UV absorption spectra showed that the maximal absorption peaks intensity of complexes was weakened with the adding of DNA, and accompanied by a red shift. The combining ratio, binding constant of complex to DNA was obtained and the corresponding thermodynamic parameters were calculated, showed that the interaction between complex and hsDNA was driven mainly by entropy. All the above indicated that the interaction mode of the complexes with DNA belonged to intercalative.
succinic acid; 1,10-phenanthroline; rare earth; herring sperm DNA; interaction
2015-12-23;
2015-03-06
国家自然科学基金(51063006); 天水师范学院“青蓝人才”工程; 天水师范学院中青年教师科研项目(TSA1508)资助
1000-7032(2016)05-0616-08
O629.74
A
10.3788/fgxb20163705.0616

