纳米TiO2催化一锅法合成喹唑啉酮并酞嗪酮及3-酰胺基异吲哚酮并喹唑啉酮类化合物
张 金, 刘 佳, 马养民, 杨秀芳, 程 佩, 范 超, 卢 萍
(1. 陕西科技大学化学与化工学院, 2. 教育部轻化工助剂化学与技术重点实验室, 西安 710021)
纳米TiO2催化一锅法合成喹唑啉酮并酞嗪酮及3-酰胺基异吲哚酮并喹唑啉酮类化合物
张金1,2, 刘佳1, 马养民1,2, 杨秀芳1,2, 程佩1, 范超1, 卢萍1
(1. 陕西科技大学化学与化工学院, 2. 教育部轻化工助剂化学与技术重点实验室, 西安 710021)
以纳米TiO2为催化剂, 靛红酸酐、 2-甲酰基苯甲酸、 不同芳香肼或酰肼类化合物为原料, 在乙醇/水溶液为溶剂的条件下一锅法合成, 高产率得到6个喹唑啉酮并酞嗪酮类化合物及10个3-酰胺基取代的异吲哚酮并喹唑啉酮类化合物. 该方法简洁高效, 反应条件温和, 为喹唑啉酮并杂环类化合物的合成提供了一条新途径.
纳米TiO2; 一锅法; 喹唑啉酮并酞嗪酮; 3-酰胺基异吲哚酮并喹唑啉酮
喹唑啉酮及其衍生物是一类重要的含氮稠杂环化合物[1,2], 在天然产物和药物分子中广泛存在, 例如骆驼宁碱A[3]、 吴茱萸次碱[4]和色胺酮[5]等. 此类化合物具有广谱的生物及药理活性, 例如抗菌[6]、 抗炎[7]、 抗肿瘤[8]、 抗惊厥[9]及预防高血压[10]等. 喹唑啉酮骨架并多环化合物具有重要应用价值, 例如, 异吲哚酮并喹唑啉酮类化合物可作为一种潜在的Tumor Necrosis Factor-alpha(TNF-α)抑制剂[11], 用于治疗类风湿性关节炎和溃疡性结肠炎等炎症; 喹唑啉酮并吲唑类化合物是潜在的磷酸二酯酶抑制剂[12], 可以用于治疗哮喘和慢性肺炎等疾病, 同时这类化合物还是一种新型的蓝色荧光试剂材料[13]; 带有二芳基脲结构的喹唑啉衍生物具有潜在的抗肿瘤作用[14]; 前文[15]报道了喹唑啉酮螺吲哚酮类化合物对细菌有良好的抑制作用.
近年来, 关于以喹唑啉酮为骨架的稠杂环化合物的合成取得了一些进展[16,17]. Kuma等[12]及Yang等[18]分别以金属钯盐为催化剂利用不同的原料合成喹唑啉酮并吲唑类化合物. Chen等[19]与Yang等[20]采用一价铜盐作为催化剂合成了一系列喹唑啉酮并吲唑类化合物. 另外, 酵母菌[21]、 环糊精[22]及纳米金属氧化物[23]等作为催化剂及微波辅助[24]等催化方法也被应用于稠杂环类喹唑啉酮类化合物的合成, 并取得良好的产率. 但这些方法均存在催化剂价格昂贵、 溶剂毒性大及产物后处理复杂等局限性. 为了设计更加简洁的合成路线, 得到更多具有潜在活性的稠杂环化合物, 本文利用纳米TiO2催化三组分一锅法反应, 以乙醇/水溶液为溶剂, 更加绿色环保; 并且使用不同的氮源(肼或酰肼)参与反应时, 分别得到喹唑啉酮并酞嗪酮类化合物及3-酰胺基取代的异吲哚酮并喹唑啉酮类化合物.
1 实验部分
1.1试剂与仪器
靛红酸酐、 5-氯靛红酸酐和纳米TiO2(粒径5~15 nm)均购于萨恩化学技术上海有限公司; 2-甲酰基苯甲酸、 苯甲酰肼、 对甲基苯甲酰肼、 对甲氧基苯甲酰肼、 3-吡啶甲酰肼、 乙酰肼、 苯肼、 对氯苯肼和对甲氧苯肼均为分析纯, 购于北京偶合科技有限公司; 乙醇、 石油醚和乙酸乙酯(均为分析纯)均购于天津市河东区红岩试剂厂; 柱层析Al2O3(200~300目)购于天津科密欧试剂有限公司.
XT5型显微熔点仪(北京市科仪电光仪器厂); VECTOR-22型傅里叶红外光谱仪、 AVANCE Ⅲ 400 MHz核磁共振仪(TMS内标)和Impact HD Q-TOF高分辨质谱(德国Bruker公司); 旋转蒸发仪(上海亚荣科技有限公司); DF-101S型集热式恒温加热磁力搅拌器(郑州长城科工贸有限公司).
1.2实验过程
目标化合物5a~5f及6a~6j的合成路线如Scheme 1所示.
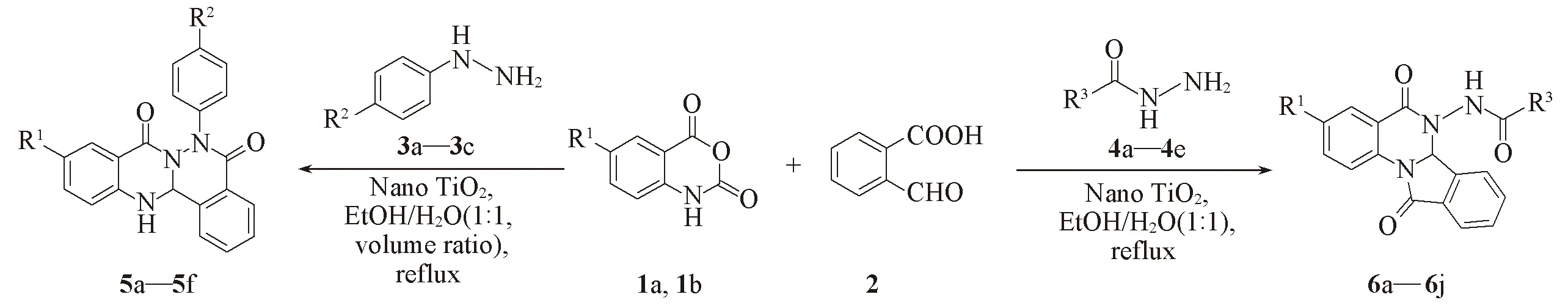
5a:R1=H, R2=H; 5b:R1=H, R2=OCH3; 5c:R1=H, R2=Cl; 5d:R1=Cl, R2=H; 5e:R1=Cl, R2=OCH3; 5f:R1=Cl, R2=Cl; 6a:R1=H, R3=Ph; 6b:R1=H, R3=4-CH3-Ph; 6c:R1=H, R3=4-OCH3-Ph; 6d:R1=H, R3=3-pyridyl; 6e:R1=H, R3=CH3; 6f:R1=Cl, R3= Ph; 6g:R1=Cl, R3=4-CH3-Ph; 6h:R1=Cl, R3=4-OCH3-Ph; 6i:R1=Cl, R3=3-pyridyl; 6e:R1=Cl, R3=CH3Scheme 1 Synthesis of isoindolo[2,1-a]quinazolinone and quinazolino[2,1-b]phthalazine-5,8-dione derivatives
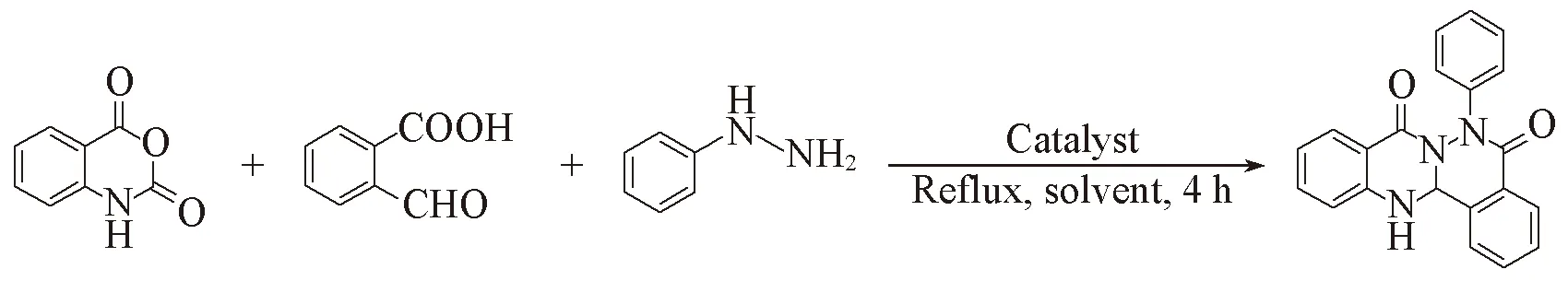
1.2.1反应条件的优化以靛红酸酐(1.0 mmol)、 2-甲酰基苯甲酸(1.1 mmol)和苯肼(1.1 mmol)为反应底物, 对合成喹唑啉酮并酞嗪酮类化合物反应的催化剂用量和溶剂进行探索, 利用薄层色谱层析(TLC)监测反应进程, 根据不同反应条件下的产率筛选出最佳反应条件.
1.2.2反应底物的拓展在优化的反应条件下, 向反应瓶中加入靛红酸酐、 2-甲酰基苯甲酸、 芳香肼或酰肼类化合物, 以3 mL乙醇水溶液(乙醇与水体积比为1∶1)为溶剂, 搅拌加热至80 ℃回流反应4 h后, 利用柱层析(用石油醚和乙酸乙酯分别以体积比10∶2, 10∶3, 10∶4, 2∶1和1∶1进行梯度洗脱)对产物分离纯化, 粗产品用二氯甲烷重结晶, 得到纯品化合物. 化合物的结构经核磁共振氢谱、 核磁共振碳谱、 红外光谱及高分辨质谱表征. 所得化合物的表征数据如表1所示, 核磁共振谱图、 红外谱图及质谱图见图S1~S64(见本文支持信息).
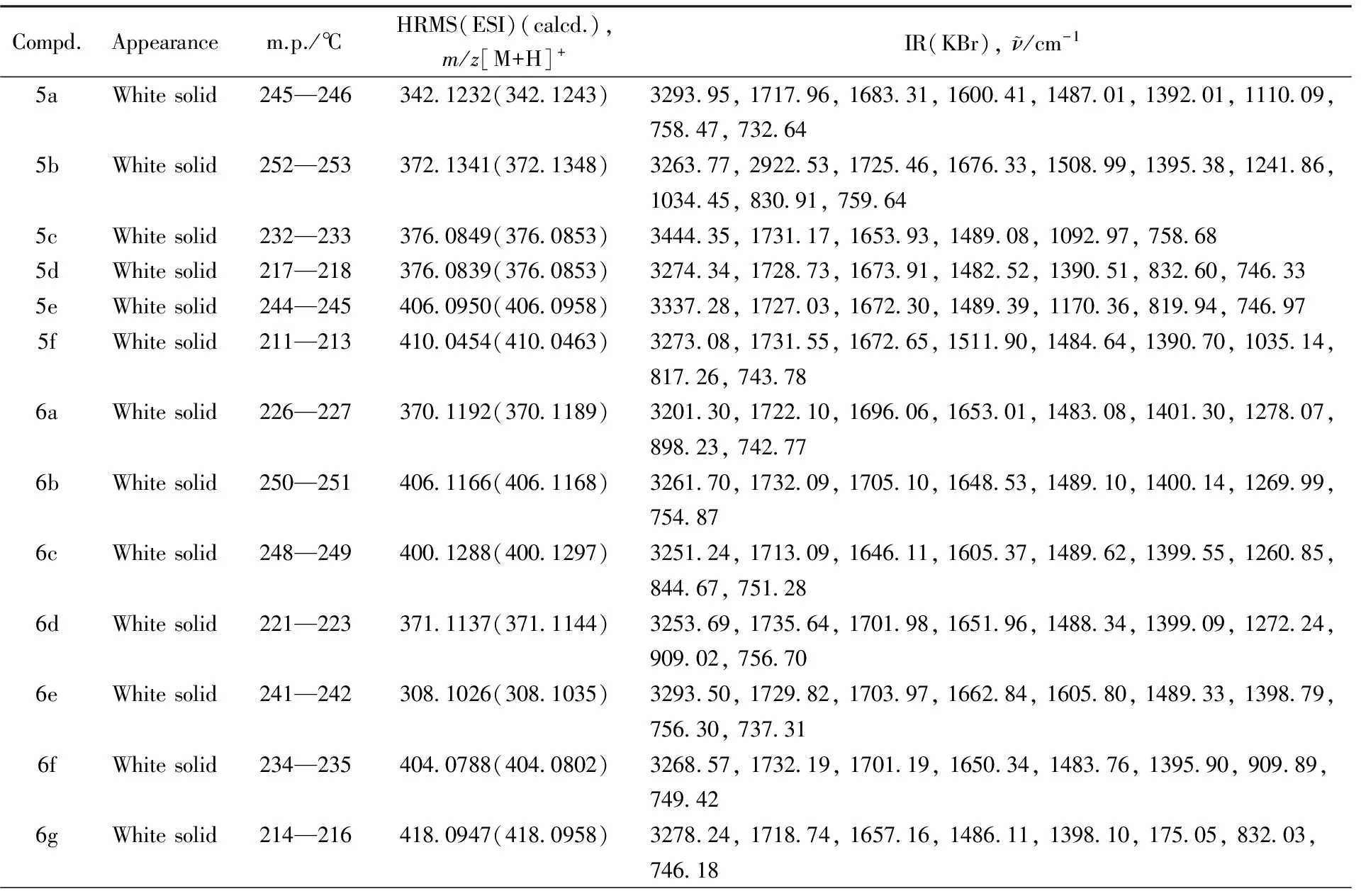
Table 1 Appearance, yields, melting points and HR-MS data of compounds 5a—5f and 6a—6j
Continued

Compd.Appearancem.p./℃HRMS(ESI)(calcd.),m/z[M+H]+IR(KBr),ν/cm-16hWhitesolid233—2344560723(4560727)173529,165435,150835,102170,669816iWhitesolid199—2014050748(4050754)324055,170944,165475,148351,139686,109893,91388,744856jWhitesolid217—2193420636(3420645)327439,173321,170590,166870,148500,139700,82531,74587

Table 2 1H NMR and 13C NMR data of compounds 5a—5f and 6a—6j
Continued

Compd.1HNMR(400MHz),δa13CNMR(100MHz),δb6f868(s,1H),806(d,J=87Hz,1H),791(dd,J=80,47Hz,4H),760(dd,J=89,55Hz,4H),748(dd,J=165,86Hz,3H),670(s,1H)16703,16466,16318,13741,13497,13397,13264,13258,13128,13058,13027,13022,12864,12854,12708,12493,12441,12163,11963,71376g874(s,1H),804(d,J=87Hz,1H),787(dd,J=51,32Hz,2H),780(d,J=82Hz,2H),763—756(m,3H),748(dd,J=84,36Hz,1H),722(d,J=80Hz,2H),665(s,1H),241(s,3H)16735,16512,16371,14383,13790,13544,13439,13303,13170,13098,13063,12960,12909,12785,12759,12547,12482,12206,12011,7182,21656h857(s,1H),808(d,J=87Hz,1H),793(dd,J=140,56Hz,4H),764(tt,J=74,41Hz,3H),757—750(m,1H),695(d,J=88Hz,2H),672(s,1H),390(s,3H)16696,16517,16380,16345,13804,13551,13439,13302,13180,13103,13064,12963,12912,12553,12485,12294,12211,12025,11422,7193,55526i1143(s,1H),917(s,1H),888(d,J=40Hz,1H),844—828(m,1H),814(dd,J=87,29Hz,1H),803—798(m,2H),791(dd,J=87,26Hz,1H),782(t,J=70Hz,1H),776(t,J=73Hz,1H),767(d,J=30Hz,1H),759(d,J=74Hz,1H),685(s,1H)16514,16478,16224,15325,14863,13834,13568,13558,13426,13375,13119,13089,12962,12806,12578,12431,12399,12241,12046,9950,71466j1060(s,1H),806(d,J=87Hz,1H),795(d,J=79Hz,2H),783(t,J=75Hz,2H),776(d,J=71Hz,1H),764(d,J=75Hz,1H),664(s,1H),211(s,3H)16993,16486,16214,13825,13548,13407,13363,13104,13083,12959,12793,12593,12418,12234,12050,7118,2034
a. Compounds 5a—5f, 6b, 6d, 6f, 6g, 6h:1H NMR(400 MHz, CDCl3),13C NMR(100 MHz, CDCl3);b. compounds 6a, 6c, 6e, 6i, 6j:1H NMR(400 MHz, DMSO-d6),13C NMR(100 MHz, DMSO-d6).
2 结果与讨论
2.1最佳反应条件探索
以靛红酸酐(1.0 mmol)、 2-甲酰基苯甲酸(1.1 mmol)和苯肼(1.1 mmol)为反应底物, 探索纳米TiO2催化合成喹唑啉酮并稠杂环类化合物的最佳反应条件(反应溶剂, 催化剂用量), 结果如表3所示. 利用TLC监测反应进程, 比较反应所得化合物纯品的产率, 筛选出最佳反应条件. 由表3可知, 不使用催化剂时, 未得到目标化合物(表3, Entry 1); 使用不同量的纳米TiO2为催化剂时, 目标产物产率从20%提高到89%, 说明纳米TiO2在反应过程中起到了关键作用. 当分别使用纯乙醇、 甲醇或水为溶剂时, 产率分别为32%, 20%和40%(表3, Entries 2~4). 使用不同体积比的乙醇/水为溶剂进行反应4 h后, 发现产率在乙醇与水体积比为1∶1时达到89%(表3, Entries 5~9), 说明水作为溶剂有利于催化反应的进行, 而乙醇作为溶剂有利于原料在溶剂中分散, 因此选择乙醇/水(体积比1∶1)为最佳反应溶剂. 还考察了催化剂的用量对产率的影响, 当催化剂用量(摩尔分数)从3%增加到5%时, 产率不断增加, 当催化剂用量大于5%, 产率无明显增加(表3, Entries 7,10~13), 因此, 选择最佳催化剂用量为5%.
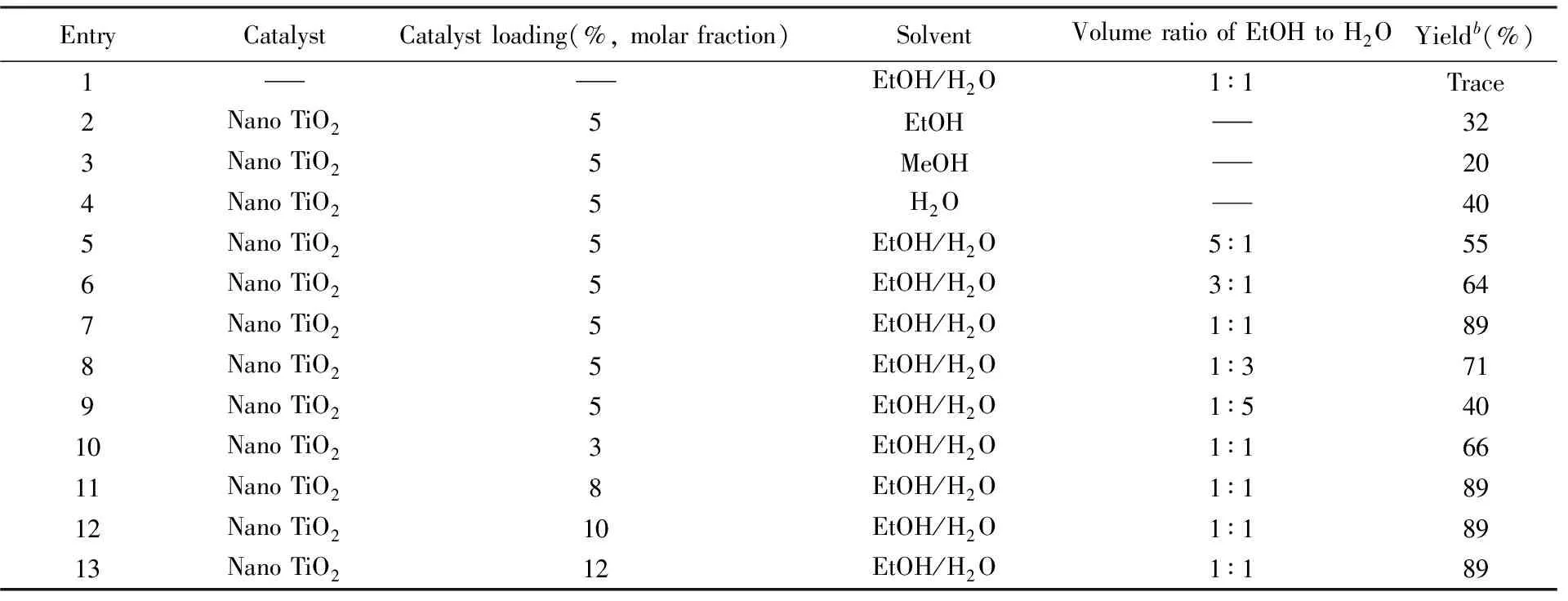
Table 3 Optimization of the reaction conditionsa
综上, 筛选出最优反应条件为使用靛红酸酐(1.0 mmol)、 2-甲酰基苯甲酸(1.1 mmol)和肼及酰肼类衍生物(1.1 mmol)进行一锅法反应, 以5%纳米TiO2为催化剂, 以乙醇/水(体积比为1∶1)为溶剂, 反应4 h后得到产物.
2.2反应底物的拓展
在最优反应条件下, 对反应底物的适用范围进行了考察. 首先选取带有不同取代基的芳香肼类化合物作为氮源, 与靛红酸酐及2-甲酰基苯甲酸进行反应, 共合成了6种喹唑啉酮并酞嗪酮化合物5a~5f, 其中5b~5f为首次合成. 与苯肼为底物进行反应的产率(表4, Entry 1)相比, 当芳香肼上带有供电子基团甲氧基时, 反应产率高达93%(表4, Entry 2), 说明反应物中带有供电子基团利于杂环的形成. 当芳香肼上有卤素取代时, 产率相对降低(表4, Entries 3和4). 另外, 当选用5-氯靛红酸酐进行反应时, 产率略有下降(表4, Entries 4~6).
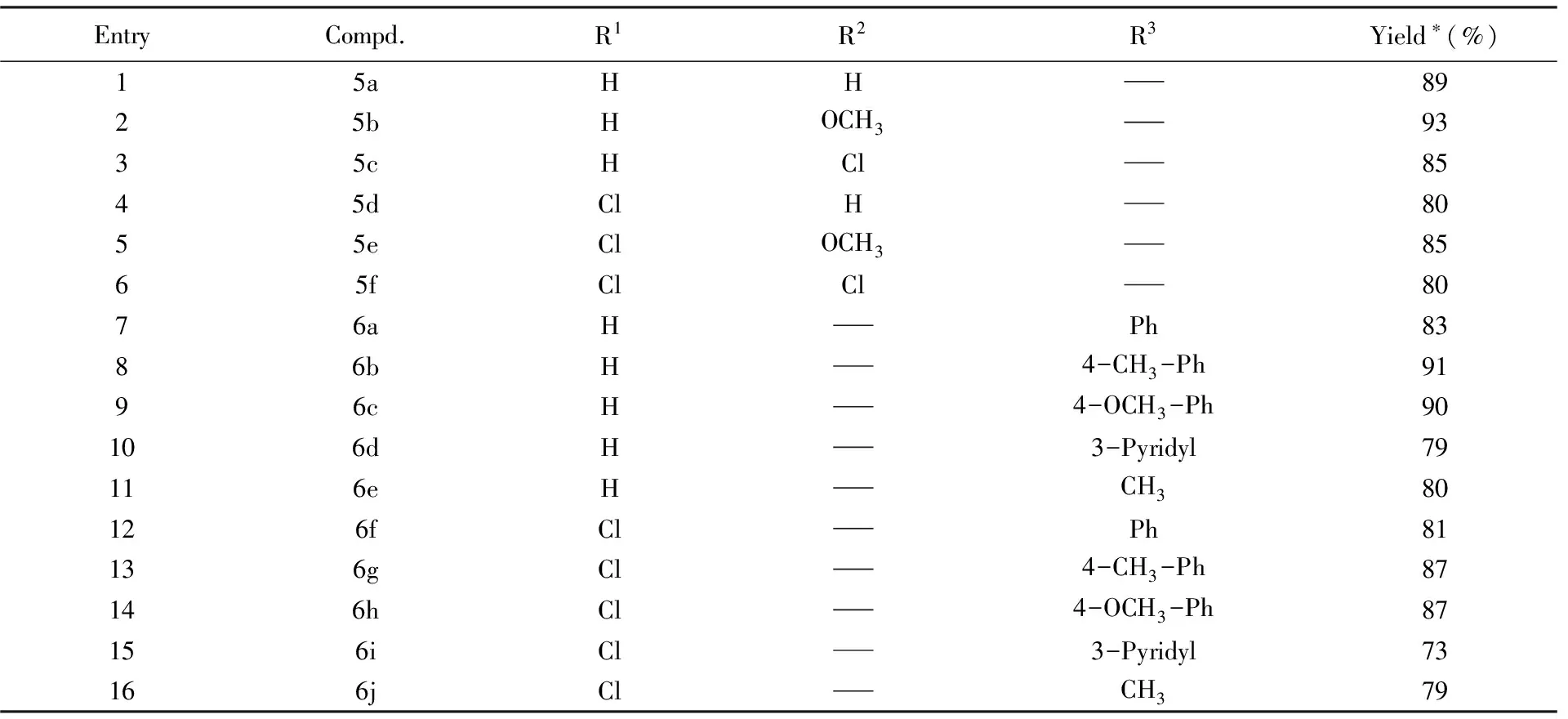
Table 4 One-pot synthesis of isoindolo[2,1-a]quinazolinone and quinazolino[2,1-b]phthalazine-5,8-dione derivatives
* Isolated yield.
在优化的反应条件下, 当选取酰肼衍生物作为氮源进行反应时, 并未得到喹唑啉酮并酞嗪酮类化合物, 而是以高收率得到了一系列3-酰胺基取代的异吲哚酮并喹唑啉酮类化合物6a~6j, 其中6b~6j为首次报道(见表4). 由表4可知, 与选用苯甲酰肼进行反应对比(表4, Entry 7), 当选用带有供电子基团的芳香酰肼进行反应时, 产率明显提高(表4, Entries 8, 9, 13和14). 当选用3-吡啶酰肼进行反应时, 产物产率略有下降, 这与3-吡啶酰肼有一定的吸电子作用有关(表4, Entries 10, 15). 当选用乙酰肼进行反应时, 与芳香酰肼参与反应时的产率相比略有减小, 说明芳香酰肼更有利于环的形成(表4, Entries 11, 16).
2.3反应机理的推测
纳米TiO2催化合成喹唑啉酮并酞嗪酮和3-酰胺基异吲哚酮并喹唑啉酮可能的反应机理如Scheme 2所示, 推测合成反应可能按照A和B 2种不同的途径进行. 首先, 靛红酸酐在纳米TiO2的作用下, 亲核反应活性增加, 与芳香肼或酰肼类化合物反应脱去1分子CO2, 分别生成中间体ⅠA或ⅠB. 在纳米TiO2作用下, 中间体ⅠA或ⅠB与2-甲酰基苯甲酸的醛羰基缩合分别生成中间体ⅡA或ⅡB, 中间体ⅡA和ⅡB发生分子内的环化反应, 再经过1,5-H质子转移形成中间体喹唑啉酮环, 得到中间体ⅢA和ⅢB. 其中, A途径生成的ⅢA中间体上的羧基与肼上的氨基发生缩合反应, 从而生成喹唑啉酮并酞嗪酮类化合物5. 然而, 中间体ⅢB上由于酰肼上的氨基与羰基相连, 导致酰肼氮原子上的电子云密度降低, 减小了其亲核进攻的活性, 不能生成酞嗪酮环, 羧基与喹唑啉酮环上的氨基发生缩合反应, 脱去1分子水进而生成3-酰胺基异吲哚酮并喹唑啉酮类化合物6.
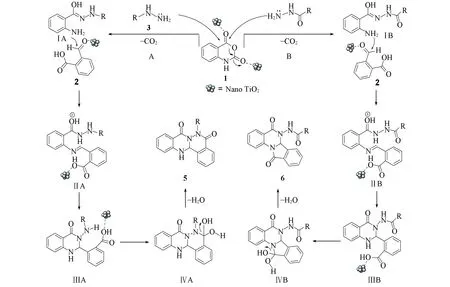
Scheme 2 Proposed formation mechanism of compounds 5 and 6
2.4催化剂的可回收性
通过离心分离对催化剂进行回收, 通过对其催化活性进行考察发现, 相同的催化条件下催化剂重复使用4次,产率无明显降低(见图1).
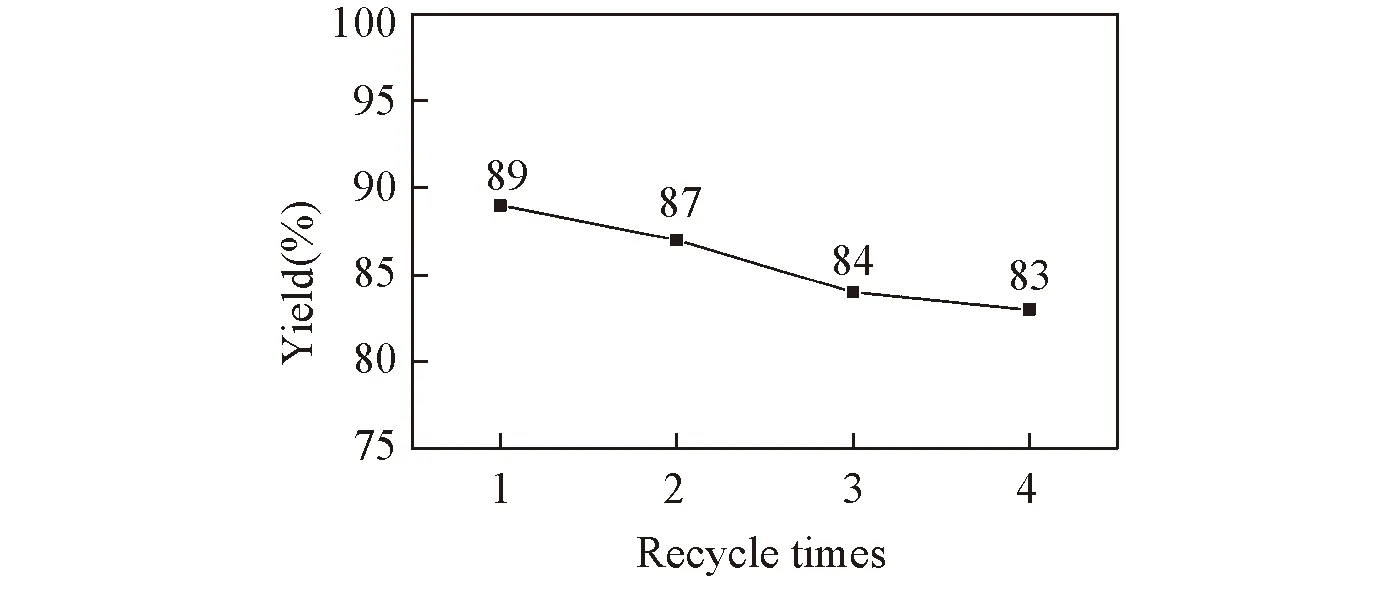
Fig.1 Recyclability of the catalyst for the one-pot synthesis of compound 5a under the optimal reaction
综上所述, 以纳米TiO2作为催化剂, 靛红酸酐、 酰肼或芳香肼类化合物与2-甲酰基苯甲酸在乙醇/水(体积比为1∶1)溶剂中回流, 一锅法合成了喹唑啉酮并酞嗪酮及3-酰胺基异吲哚酮并喹唑啉酮类化合物, 共合成16个化合物, 其中有14个化合物为首次报道. 该合成方法简洁易行, 反应条件温和, 使用溶剂绿色环保, 催化剂廉价且用量少, 为喹唑啉酮并杂环类化合物的合成提供了新方法.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20160292.
[1]Khan I., Ibrar A., Abbas N., Saeed A.,Eur.J.Med.Chem., 2014, 76, 193—244
[2]Khan I., Ibrar A., Ahmed W., Saeed A.,Eur.J.Med.Chem., 2015, 90, 124—169
[3]Servais A., Azzouz M., Lopes D., Courillon C., Malacria M.,AngewChem.Int.Ed., 2007, 46(4), 576—579
[4]Granger B. A., Kaneda K., Martin S. F.,Org.Lett., 2011, 13(17), 4542—4545
[5]Bandekar P. P., Roopnarine K. A., Parekh V. J., Mitchell T. R., Novak M. J., Sinden R. R.,J.Med.Chem., 2010, 53(9), 3558—3565
[6]Grover G., Kini S. G.,Eur.J.Med.Chem., 2006, 41(2), 256—262
[7]Manivannan E., Chaturvedi S. C.,Bioorg.Med.Chem., 2011, 19(15), 4520—4528
[8]Giardina D., Martarelli D., Sagratini G., Angeli P., Ballinari D., Gulini U., Melchiorre C., Poggesi E., Pompei P.,J,Med.Chem., 2009, 52(15), 4951—4954
[9]Kashaw S. K., Kashaw V., Mishra P., Jain N. K., Stables J. P.,Eur.J.Med.Chem., 2009, 44(11), 4335—4343
[10]Jain K. S., Bariwal J. B., Kathiravan M. K., Phoujdar M. S., Sahne R. S., Chauhan B. S., Shah A. K., Yadav M. R.,Bioorg.Med.Chem., 2008, 16(9), 4759—4800
[11]Kumar K. S., Kumar P. M., Kumar K. A., Sreenivasulu M., Jafar A. A., Rambabu D., Krishna G. R., Reddy C. M., Kapavarapu R., Shivakumar K., Priya K. K., Parsa K. V., Pal M.,Chem.Commun., 2011, 47(17), 5010—5012
[12]Siva Kumar K., Mahesh Kumar P., Sreenivasa Rao V., Jafar A. A., Meda C. L. T., Kapavarapu R., Parsa K. V. L., Pal M.,Org.Biomol.Chem., 2012, 10(15), 3098—3103
[13]Yang W., Chen J., Huang X., Ding J., Liu M., Wu H.,Org.Lett., 2014, 16(20), 5418—5421
[14]Hou Y., Wu S., Ma L., Bai J., Liu Z., Zhao Y.,Chem.Res.ChineseUniversities, 2015, 31(5), 766—773
[15]Zhang J., Zhao J., Wang L., Liu J., Ren D., Ma Y.,Tetrahedron, 2016, 72(7), 936—943
[16]Tang J. H., Shi D. X., Wang X. Z., Liu X., Li J. R.,Chem.J.ChineseUniversities, 2012, 33(3), 501—506(唐健红, 史大昕, 王秀珍, 刘璇, 李加荣. 高等学校化学学报, 2012, 33(3), 501—506)
[17]Zhang J., Ren D., Ma Y., Wang W., Wu H.,Tetrahedron, 2014, 70(34), 5274—5282
[18]Yang W., Qiao R., Chen J., Huang X., Liu M., Gao W., Ding J., Wu H.,J.Org.Chem., 2015, 80(1), 482—489
[19]Chen D., Dou G., Li Y., Liu Y., Wang X.,J.Org.Chem., 2013, 78(11), 5700—5704
[20]Yang W., Ye L., Huang D., Liu M., Ding J., Chen J., Wu H.,Tetrahedron, 2013, 69(46), 9852—9856
[21]Avalani J. R., Patel D. S., Raval D. K.,J.Mol.Catal.B:Enzym., 2013, 90, 70—75
[22]Reddy G. R., Reddy T. R., Chary R. G., Joseph S. C., Mukherjee S., Pal M.,TetrahedronLett., 2013, 54(49), 6744—6746
[23]Santra S., Bagdi A. K., Majee A., Hajra A.,RSCAdv., 2013, 3(47), 24931—24935
[24]Milad T., Haniyeh A., Hamideh N.,Chem.Res.ChineseUniversities, 2014, 30(3), 405—408
(Ed.:P, H, D, K)
† Supported by the Natural Science Basic Research Plan in Shaanxi Province of China(No.2014JQ2064), the Scientific Research Project Item for Key Laboratory of Shaanxi Province Education Department, China(No.15JS012) and the Foundation for Young Scholars of Shaanxi University of Science & Technology, China(No.BJ12-26).
TiO2Nanoparticles-catalyzed One-pot Synthesis of Quinazolino[2,1-b]phthalazin-8-one and 3-Acylamino Isoindolo[2,1-a]quinazoline Derivatives†
ZHANG Jin1,2, LIU Jia1, MA Yangmin1,2*, YANG Xiufang1,2, CHENG Pei1, FAN Chao1, LU Ping1
(1. College of Chemistry & Chemical Engineering, Shaanxi University of Science & Technology, Xi’an 710021, China;2.KeyLaboratoryofAuxiliaryChemistry&TechnologyforChemicalIndustry,MinistryofEducation,Xi’an710021,China)
An efficient and simple one-pot method was developed for the synthesis of two kinds ofN-fused quinazolinone derivatives using nano TiO2particles as catalyst from isatoic anhydride, 2-carboxy benzaldehyde, hydrazides or aromatic hydrazines. Six quinazolino[2,1-b]phthalazin-8-ones and ten 3-acylamino isoindolo[2,1-a]quinazolines were obtained in excellent yields, and the reaction refluxed in aqueous ethanol were environmentally friendly. Attractive features of this methodology were its versatility, mild condition and high efficiency in creating two different structures in a single operation.
TiO2Nanoparticles; One-pot reaction; Quinazolino[2,1-b]phthalazin-8-one; 3-Acylamino isoindolo[2,1-a]quinazoline
10.7503/cjcu20160292
2016-04-29. 网络出版日期:2016-08-18.
陕西省自然科学基础研究计划项目(批准号:2014JQ2064)、 陕西省教育厅重点实验室项目(批准号:15JS012)和陕西科技大学博士科研启动基金(批准号:BJ12-26)资助.
O626.4
A
联系人简介:马养民, 男, 博士, 教授, 博士生导师, 主要从事天然产物提取、 鉴定及合成研究. E-mail:mym63@sina.com

