二氧化氮催化硝化甘油分解机理的数值计算
裴海潮,吴婉娥,付 潇,陈 晨,王 广,强洪夫,王明良
(1.第二炮兵工程大学,西安 710025;2.深圳大学 化学与化工学院,深圳 518060)
二氧化氮催化硝化甘油分解机理的数值计算
裴海潮1,吴婉娥1,付潇1,陈晨1,王广1,强洪夫1,王明良2
(1.第二炮兵工程大学,西安710025;2.深圳大学 化学与化工学院,深圳518060)
采用密度泛函理论(DFT)在B3LYP/6-31+G(d,p)水平上模拟计算了NO2对硝化甘油(NG)催化分解的反应机理。通过与O—NO2均裂、HNO2分子内消去反应对比发现,NO2分子对NG分解反应有显著的催化效应;NG的催化分解途径有α-H夺氢催化和β-H夺氢催化,计算得出2种途径的反应能垒分别为105.337 kJ/mol和124.381 kJ/mol,说明α-H夺氢催化更容易发生。
量子化学;硝化甘油;催化分解;数值模拟;NEPE固体推进剂
0 引言
高能硝酸酯增塑聚醚(Nitrate Ester Plasticized Polyether,以下简称NEPE)具有能量高、低温力学性能好的特点[1],现已成功用于各种导弹、导弹发动机及武器运载工具上[2-4]。由于推进剂具有一次使用、长期贮存的特点,所以就要求推进剂要有良好的贮存性能。作为NEPE推进剂中重要增塑剂的硝化甘油(NG)[5-12]稳定性较差,易受热分解,释放出性质比较活泼的氮氧化物(NOx)[13],这些氮氧化物通过催化作用加速NG的分解,造成NEPE推进剂化学安定性能下降,引发推进剂自燃和甚至发生爆炸[14]。
国内外采用热加速老化手段和高压DSC法,做了大量关于NG热分解实验的研究[5,7,15-20],结果表明,NG的分解源于O—NO2键的断裂[21-23],继而生成氮氧化物(以NO2为主),这些氮氧化物对NG的分解具有催化作用,进一步促进NG的分解并释放大量热,引起推进剂温度升高[24]。
目前,国内外对于NG热分解的研究已经较透彻,但有关氮氧化物催化NG分解的研究尚未见系统报道,用量子化学等方法对催化理论进行研究的文献更为少见。姚子云等[25]采用红外光谱实验研究了不同温度和不同时间硝化甘油的热分解产物,认为NO2为分解的中间产物,并推断硝化甘油的分解产物NO2与NG上的氢原子发生夺氢反应,从而促进O—NO2的断裂,实现NG的催化分解。
本文重点从催化分解角度出发,运用密度泛函理论(DFT)[26-27],探究NO2存在的条件下,NG分子的催化分解反应机理,为探究NEPE推进剂贮存过程中化学安定性降低奠定理论基础。
1 计算方法
本研究运用B3LYP/6-31+G**方法,对反应物、过渡态(TS)、中间体及产物的分子结构进行全优化;然后,再对优化构型进行单点能和振动频率的计算。通过频率分析来判断所得到的结构是不是一个过渡态。反应的过渡态结构有且只有一个虚频(IF)。每个过渡态连结着相应的反应物和生成物,并通过内禀反应坐标(IRC)进一步验证其真实性[28-29]。所有计算都采用Gaussian 09程序包完成。
2 结果与讨论
2.1NG催化反应与O—NO2均裂、HNO2分子内消去的能垒比较
NG的老化分解主要有3种途径:O—NO2均裂、HNO2分子内消去[30]、NG催化,其中均伴随着能量的变化。根据过渡态理论,反应能垒的大小决定化学反应的难易程度。反应能垒越大,化学反应越难发生;反应能垒越小,化学反应越容易发生。表1为B3LYP/6-31+**基组下,计算所得NG分子中3种途径的α位与β位夺氢反应能垒。
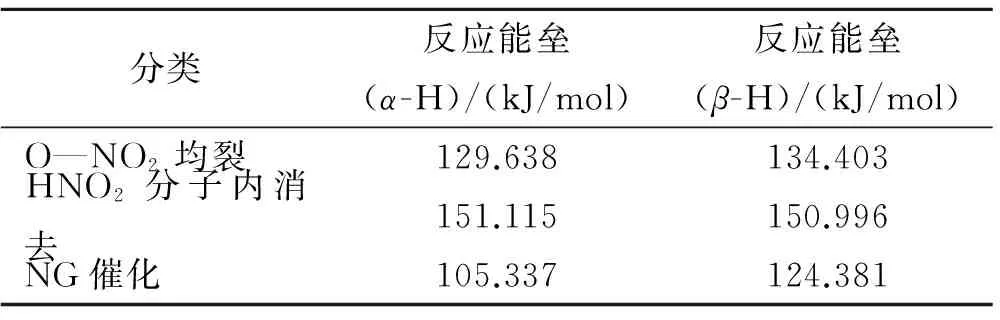
表1 O—NO2均裂、HNO2分子内消去和NG催化的反应能垒
由表1可知,相同计算条件下,O—NO2均裂反应和NG催化反应的α位的反应能垒低于β位的反应能垒。说明针对这2种反应,α位上的H和O—NO2的化学性质要比β位上的H和O—NO2要活泼,相应的化学反应更容易发生;但HNO2分子内消去反应则相反,但两者差距不大,说明在同一条件下,2种位置上的HNO2分子内消去反应可能同时存在;同一反应位上,3种化学反应的反应能垒的次序为HNO2分子内消去>O—NO2均裂>NG催化,说明相对于O—NO2均裂反应和HNO2分子内消去反应,NG分子的催化分解反应更容易发生。
2.2NG的催化分解
NG分解反应始于O—NO2的断裂已得到公认,且在分解时产生NO2自由基。NO2自由基的电子结构式为O→O,其氮原子上有1个未成对电子,化学性质活泼。通过2.1反应能垒计算可知,NO2自由基与NG中的活泼H作用,加速NG的分解。在NG分子上存在2种类型的H原子:即α-和β-H。本文从理论上计算NO2催化NG分解时分子结构的变化及可能的机理。
2.2.1分子几何构型优化及相关数据
利用Guassion View软件,依据NG催化分解过程中各分子的简化结构建立相应的分子模型,并进行结构优化和频率计算,所得结果均无虚频,说明所得构型均为各分子的稳定构型。在结构优化和频率计算的基础上,对各分子进行单点能(Energy)计算,得到最优稳定态下分子的能量值。
2.2.2α位夺氢催化
利用Guassion View构建NG与NO2发生的α-H夺氢催化反应预聚物,并进行结构优化和Mulliken电荷分析。运用QST3方法对α位夺氢反应的预聚物进行过渡态搜索,期间伴随着键长、原子电荷、体系能量的变化,如图1所示。

反应坐标
由图1可见,在QTS3过渡态搜索过程中,由于氢键的作用,H2脱离C1的吸引,向O22靠近;随着O22—H2之间的键长由2.720 Å缩短为1.189 Å,C1—H2之间的键长由1.093 Å增长到1.409 Å,O22的电负性逐渐减弱,由-0.185降到-0.030,H2的电正性逐渐增强,由0.175增到0.287;与此同时,NG分子中O11—N18之间的键长由1.428 Å增长到1.504 Å,O11的电负性逐渐减弱,由-0.044降到-0.011,N18的电正性逐渐增强,由-0.124增到0.037。在此过程中,能量变化(以反应物总能量值为零点)由-3.852 kJ/mol增长到101.485 kJ/mol,两者的差值即为α位夺氢催化的反应能垒,约为105.337 kJ/mol。
通过分析发现,在α位夺氢催化反应过程中,NO2表现出较强的亲核能力,NO2靠近NG,吸引并夺取C1上的H2。C1失去对H2的束缚后,多出的1个单电子被O11吸引,形成CO双键。同时,O—NO2键断裂,实现α位的夺氢催化。其反应机理为
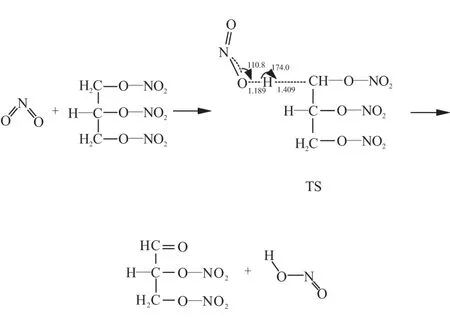
2.2.3β位夺氢催化
利用Guassion View构建NG与NO2发生的β-H夺氢催化反应预聚物,并进行结构优化和Mulliken电荷分析,运用QST3方法对β位夺氢反应的预聚物进行过渡态搜索,期间伴随着键长、原子电荷、体系能量的变化,如图2所示。
由图2可见,在QTS3过渡态搜索过程中,由于氢键的作用,H5脱离C4的吸引,向O23靠近;随着O23—H5之间的键长由2.733 Å缩短为1.170 Å,C4—H5之间的键长由1.093 Å增长到1.461 Å,O23的电正性逐渐增强,由0.031降到0.109,H5的电正性逐渐增强,由0.207增到0.317;与此同时,NG分子中O10—N15之间的键长由1.449 Å增长到1.520 Å,O10的电负性逐渐增强,由-0.006增到-0.007,N15的电正性逐渐增强,由-0.149增到0.169。在此过程中,能量变化(以反应物总能量值为零点)由-4.272 kJ/mol增长到120.109 kJ/mol,两者的差值即为β位夺氢催化的反应能垒,约为124.381 kJ/mol。
通过分析发现,在β位夺氢催化反应过程中,NO2自由基表现出较强的亲核能力,NO2靠近NG分子,吸引并夺取C4上的H5后,C4上的单电子被O10吸引,形成CO双键。同时,O—NO2键断裂,实现β位的夺氢催化。其反应机理为
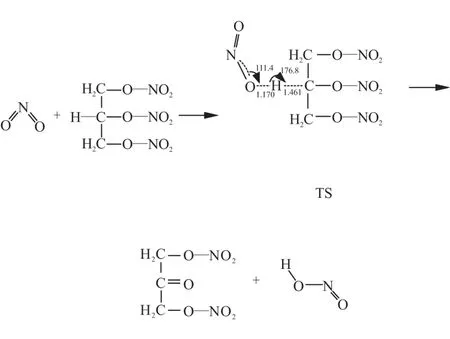
3 结论
(1)相同计算条件下,O—NO2均裂反应、HNO2分子内消去反应和NG催化反应的反应能垒次序为HNO2分子内消去>O—NO2均裂>NG催化,说明在NG老化过程中,NG的催化分解反应更容易发生。
(2)NG的催化分解反应是NO2与NG分子间的夺氢催化反应,其可能存在2种途径:α位夺氢催化与β位夺氢催化。
(3)计算得出2种途径(α-H和β-H)下,NG催化反应的反应能垒分别为105.337 kJ/mol和124.381 kJ/mol,说明NO2存在的情况下,NG的α位夺氢催化分解反应更容易发生。
[1]庞爱民, 马新刚, 唐承志. 固体火箭推进剂理论与工程[M].北京:中国宇航出版社, 2014.
[2]郑剑, 侯林法, 杨仲雄. 高能固体推进剂技术回顾与展望[J]. 固体火箭技术, 2001, 24(1): 28-34.
[3]侯林法. 复合固体推进剂[M]. 北京:中国宇航出版社, 1994.
[4]Iage K K, Rogers C J, Smith P L, 等. 复合固体推进剂浇入发动机时的流变学[J]. 国外固体火箭技术, 1980(1): 31-34.
[5]Sadasivan N, Bhaumik A. Thermal decomposition studies on double-based propellant compositions[J]. Journal of Thermal Analysis, 1984, 29(5): 1043-1052.
[6]Li S N, Liu Y, Tuo X L, et al. Mesoscale dynamic simulation on phase separation between plasticizer and binder in NEPE propellants[J]. Polymer, 2008, 49(11): 2775-2780.
[7]Mcdonald B A. Study of the effects of aging under humidity control on the thermal decomposition of NC/NG/BTTN/RDX propellants[J]. Propellants, Explosives, Pyrotechnics, 2011, 36(6): 576-583.
[8]Yi J H, Zhao F Q, Xu S Y, et al. Thermal behavior, nonisothermal decomposition reaction kinetics of mixed ester double-base gun propellants[J]. Chemical Research in Chinese Universities, 2008, 24(5): 608-614.
[9]Sui X, Wang N F, Wan Q A, et al. Effects of relaxed modulus on the structure integrity of NEPE propellant grains during high temperature aging[J]. Propellants, Explosives, Pyrotechnics, 2010, 35(6): 535-539.
[10]Zhao Y J, Zhang W, Zhang X G, et al. Aging property and storage life prediction of NEPE propellant[J]. Theory and Practice of Energetic Materials, 2007(7): 163-166.
[11]Zhang T H, Wang S Y, Liu P D. Safety assessment studies of a damaged high-energy solid propellant[J]. Journal of Energetic Materials, 2002, 20(2): 175-189.
[12]Hiegel G A, Nguyen J, Zhou Y. Preparation of alkyl nitrates, nitrites, and thiocyanates from alcohols utilizing trichloroisocyanuric acid with triphenylphosphine[J]. Synthetic Communications, 2004, 34(14): 2507-2511.
[13]Tomas L Jensen, John F Moxnes, Erik Unneberg, et al. Calculation of decomposition products from components of gunpowder by using ReaxFF reactive force field molecular dynamics and thermodynamic calculations of equilibrium composition[J]. Propellants, Explosives, Pyrotechnics, 2014, 39(6): 830-837.
[14]David A Reese, Lori J Groven, Steven F Son. Formulation and characterization of a new nitroglycerin-free double base propellant[J].Propellants, Explosives, Pyrotechnics, 2014, 39(6):205-210.
[15]Roos B D, Brill T B. Thermal decomposition of energetic materials 82. Correlations of gaseous products with the composition of aliphatic nitrate esters[J]. Combustion and Flame, 2002, 128(1-2): 181-190.
[16]Chas E, Waring G K. Kinetics and mechanism of the thermal decomposition of nitroglycerin[J]. Journal of Physical Chemistry, 1970, 74(5): 999-1006.
[17]Hiyoshi R I, Brill T B. Thermal decomposition of energetic materials 83. Comparison of the pyrolysis of energetic materials in air versus argon[J]. Propellants, Explosives, Pyrotechnics, 2002, 27(1): 23-30.
[18]Chin A, Ellison D S, Poehlein S K. Investigation of the decomposition mechanism and thermal stability of nitrocellulose/nitroglycerine based propellants by electron spin resonance[J]. Propellants, Explosives, Pyrotechnics, 2007, 32(2): 117-126.
[19]Roos B D, Brill T B. Thermal decomposition of energetic materials 81. Flash pyrolysis of GAP/RDX/BTTN propellant combinations[J]. Propellants, Explosives, Pyrotechnics, 2001, 26(5): 213-220.
[20]Musanic S M, Houra I F, Suceska M. Applicability of non-isothermal DSC and Ozawa method for studying kinetics of double base propellant decomposition[J]. Ceuropean Journal of Energetic Material, 2010, 7(3): 233-251.
[21]Yan Qi-long, Martin Künzel, Svatopluk Zeman. The effect of molecular structure on thermal stability, decomposition kinetics and reaction models of nitric ester[J]. Thermochimica Acta, 2013, 566(6):137-148.
[22]肖鹤鸣, 王大喜. 硝酸脂类的量子化学研究——硝化甘油的热分解[J]. 兵工学报, 1992, 2(1): 41-46.
[23]Yan Qing-li, Zhu Wei-hua, Pang Ai-min. Theoretical studies on the unimolecular decomposition of nitroglycerin[J]. J. Mol. Model, 2013, 19(4): 1617-1626.
[24]Anton Chin, Daniel S Ellison, Sara K Poehlein. Investigation of the decomposition mechanism and thermal stability of nitrocellulose/nitroglycerine based propellants by electron spin resonance[J]. Propellants, Explosives, Pyrotechnics, 2007, 32(2): 117-126.
[25]姚子云, 罗秉和. 硝化甘油在压力下的热分解动力学及机理[J]. 太原机械学院学报, 1989, 10(2): 42-48.
[26]Becke A D. Density-functional thermochemistry. III. The role of exact exchange[J]. Journal of Chemistry Physics, 1993, 98(7): 5648-5652.
[27]Lee C, Yang W, Parr R G. Development of the Colle-Salvetti correlation-energy formula into a functional of the electron density[J]. Physics Review B, 1988, 37(2): 785-789.
[28]Gonzalez C, Schlegel H B. An improved algorithm for reaction path following[J]. Journal of Chemistry Physics, 1989, 90(4): 2154-2159.
[29]Gonzalez C,Schlegel H B.Reaction path following in mass-weighted internal coordinates[J]. Journal of Physics Chemistry, 1990, 94(14): 5523-5527.
[30]Lemi Tu¨rker. Possibility of cyclic transition states of nitroglycerine[J]. Journal of Molecular Structure (Theochem), 2004, 681(1-3):15-19.
(编辑:刘红利)
Numerical simulation on catalytic decomposition mechanism of NO2on nitroglycerin
PEI Hai-chao1, WU Wan-e1, FU Xiao1, CHEN Chen1, WANG Guang1,QIANG Hong-fu1, WANG Ming-liang2
(1.The Second Artillery Engineering University,Xi'an710025,China;2.The College of Chemistry and Chemical Engineering of Shenzhen University, Shenzhen518060,China)
The catalytic decomposition mechanism of NO2on NG was simulated using density functional theory(DFT) at the B3LYP/6-31+G(d, p) level. Compared with the homolysis of O—NO2and the intra-molecular elimination of HNO2, NO2has significant catalytical effect on the decomposition of NG. There are two possible ways of the catalytic decomposition of NG by NO2, namedα-H catalytic hydrogen abstraction andβ-H catalytic hydrogen abstraction. Their energy barriers are 105.337 kJ/mol and 124.381 kJ/mol, respectively, which indicates thatα-H catalytic hydrogen abstraction occurs more easily.
quantum chemistry;nitroglycerin;catalytic decomposition;simulation;NEPE solid propellants
2015-05-29;
2015-08-04。
裴海潮(1988—),男,硕士,主要从事固体推进剂化学安定性研究。E-mail:361426995@qq.com
吴婉娥(1964—),女,副教授,主要从事固体推进剂老化机理研究。E-mail:wuwane@163.com
V512
A
1006-2793(2016)04-0538-04
10.7673/j.issn.1006-2793.2016.04.016

