粗茎秦艽中的人工生物碱及化学成分研究
杜 鹏
贵州医科大学附属医院,贵州贵阳 550004)
粗茎秦艽中的人工生物碱及化学成分研究
杜 鹏
贵州医科大学附属医院,贵州贵阳 550004)
[目的]研究粗茎秦艽中的人工生物碱及其他化学成分。[方法]以含氨溶剂对粗茎秦艽进行提取后,利用硅胶色谱分离纯化该浸膏中的化学成分,根据化合物的理化性质和光谱数据鉴定化合物的结构。[结果]分离并鉴定了8个化合物,其结构分别为粗茎龙胆碱A(gentiocrasine A,Ⅰ)、粗茎龙胆碱B(gentiocrasine B,Ⅱ)、秦艽甲素(gentianine,Ⅲ)、秦艽丙素(gentianal,Ⅳ)、西藏龙胆碱(gentiatibetine,Ⅴ)、胡萝卜苷(daucosterol,Ⅵ)、β-谷甾醇(β-sitosterol,Ⅶ)、棕榈酸(plamitic acid,Ⅷ)。[结论]化合物Ⅰ和化合物Ⅱ为首次得到的化合物。
粗茎秦艽;生物碱;化学成分
秦艽RadixGentianaeMacrophyllae是我国重要的传统中药之一,在我国具有悠久的药用历史,具有祛风湿、清湿热、止痹痛的功能,临床上用于风湿痹痛、筋脉拘挛、骨节酸痛、日曝潮热和小儿疳积发热等症。粗茎秦艽是中药志记载的秦艽主要原植物之一,分布于我国四川、云南西北部及西藏与四川的接壤地区,目前市场上流通的秦艽药材多为粗茎秦艽。
秦艽主要含裂环烯醚萜苷、甾醇苷、挥发油和糖类等成分[1-2],前人曾从秦艽G.macrophyllyPall.中分离到数种生物碱[3-5],但其后的研究表明秦艽生物碱类成分是在提取处理过程中由裂环烯醚萜苷类成分与氨作用转化而来[6-8],并非秦艽中本来存在的化学成分。杨肖锋等[9]分析认为龙胆苦苷的抗炎药效是龙胆苦苷转化为生物碱后二者的总和作用。乔卫等[10]研究指出环烯醚萜苷和其乙酰酯在体内转化为相应的半缩醛和其他衍生物,这些衍生物才是具有药理活性的物质。为了更深入地探索秦艽药效作用的物质基础,该研究首次对龙胆科植物粗茎秦艽进行了生物碱类化学成分的研究,并通过硅胶柱色谱及UV、IR、NMR、MS等波普技术鉴定化合物结构,以期为秦艽药理活性研究提供基础依据。
1 材料与方法
1.1材料
1.1.1研究对象。药材秦艽购于贵州省药材市场,由贵州医科大学龙庆德副教授鉴定为粗茎秦艽GentianacrassicaulisDuthie ex Burk.的干燥根。
1.1.2仪器。Bruker AC-E200和Varian Unity INOVA 400/54核磁共振仪,TMS为内标;FINNIGAN LCQDECA 质谱仪; VECTOR22红外仪,KBr压片;Cintra 10e UV-Visible Spectrometer紫外可见分光光度计;Perkin Elmer Mode-134微量旋光仪;Boetius微量熔点测定仪;Sartorius BP-211D电子天平;Senco R201旋转蒸发仪。
1.1.3试剂。薄层层析用硅胶G为吸附剂,以0.5%CMC-Na调制涂板(0.3~1.4 mm),改良Dragendorff’s试剂和8%硫酸乙醇试剂显色;柱层析用硅胶H为吸附剂;硅胶均为青岛海洋化工厂制品;氯仿、石油醚、乙酸乙酯、丙酮、甲醇、乙醇为分析纯。
1.2提取与分离取干燥粗茎秦艽9.5 kg,粉碎。以混合溶液:吐温80-70%乙醇溶液-10%氨水(0.5∶99.5∶14.0)浸润24 h后渗漉。以5%盐酸调节渗漉液至pH 1~2,酸水液用氯仿萃取,氯仿萃取液回收溶剂后得到流动性较大的棕色油状浸膏A(120 g);用浓氨水将酸水部分碱化至pH 5~6,用氯仿萃取至水液中无生物碱检出,浓缩氯仿萃取液得流动性较大的棕色浸膏B(60 g)。
A部分(120 g)经减压硅胶H柱层析,氯仿-甲醇系统(按1%比例加入二乙胺),梯度洗脱(99∶1~4∶1),洗脱液以TLC指导合并得A1、A2、A3三部分。A1浓缩后析出化合物Ⅵ;A2浓缩后析出无色针晶,以丙酮重结晶得化合物Ⅶ;A3浓缩后析出化合物Ⅷ。B部分(60 g)经减压硅胶H柱层析,石油醚-乙酸乙酯系统(按1%比例加入二乙胺),梯度洗脱(99∶1~4∶1),洗脱液以TLC指导合并得B1、B2、B3三部分。B1浓缩后析出黄色柱状结晶,以丙酮重结晶后得化合物Ⅳ。B2经硅胶H柱层析,石油醚-乙酸乙酯系统,梯度洗脱(99∶1~4∶1),洗脱液以TLC指导合并得到C1、C2两部分。B3经硅胶H柱层析,石油醚-乙酸乙酯系统,梯度洗脱(99∶1~4∶1),洗脱液以TLC指导合并后析出化合物V。
C1浓缩后析出白色羽状结晶,以环己烷重结晶后得化合物Ⅲ。C2部分经硅胶H柱层析,石油醚-乙酸乙酯(4∶1)洗脱,洗脱液以TLC指导合并得D1、D2两部分。D1浓缩后得到化合物Ⅰ;D2浓缩后得到化合物Ⅱ。
2 结果与分析
对龙胆科植物粗茎秦艽加氨后提取分离得到了8个化合物,其中5个是裂环烯醚萜苷类生物碱,且化合物Ⅰ和化合物Ⅱ为首次得到的化合物。秦艽生物碱类化合物均未见碳谱数据报导,该研究补充了秦艽丙素、西藏龙胆碱的碳谱数据。
1H-1H COSY谱与HMQC谱提示分子中含有-CH2-CH2-O-结构:δ 4.12 (1H,ddd,J=11.92 Hz,3.16 Hz,2.88 Hz)和δ 3.64(1H,m)为同碳上非化学等价的共振峰,该亚甲基碳与氧相连,其化学位移为δ 56.2。δ 2.95(1H,m)和δ 2.56(1H,m)为同碳上非化学等价的共振峰,该亚甲基碳的化学位移为δ 27.4,并从HMBC谱观察到该亚甲基上2个
氢与吡啶环的C3、C4、C5均有相关信号,说明该碳与C5相连。同时HMBC谱上显示δ 5.49(1H,s)的质子信号与位移值为δ 27.4的亚甲基碳相关,推测分子中含有吡啶单萜结构。
另外,Ⅰ的氢谱中δ 2.45(3H,s)为一个处于较低场的甲基信号,由HMBC谱观察到该甲基上的氢与吡啶环上的C2、C3之间的远程相关,推断该甲基与C2相连,HMQC谱提示该甲基碳的化学位移为δ 21.1。
Ⅰ的氢谱还可见δ 3.92(1H,m)、δ 3.64(1H,m)和δ 1.26(3H,t,J=7.06 Hz)的一组共振峰信号,由化学位移及质子的相互耦合情况推测分子中含有乙氧基,其中信号δ 3.92(1H,m)、δ 3.64(1H,m)为同碳上非化学等价的共振峰;HMQC谱及DEPT谱提示该乙氧基中2个碳的化学位移分别为δ 63.5(CH2)和δ 15.0(CH3)。由HMBC谱观察到质子信号δ 5.49(1H,s)与碳信号δ 63.5(CH2)相关,说明该乙氧基与环醚结构中的次甲基相连。
根据以上证据,推断化合物Ⅰ结构如图1,并归属了Ⅰ的NMR数据(表1),HMBC图谱关键相关信息见图2。该研究是首次获得该化合物,暂命名为粗茎龙胆碱A(gentiocrasine A)。

图1 化合物Ⅰ结构式Fig.1 Structure of compound Ⅰ
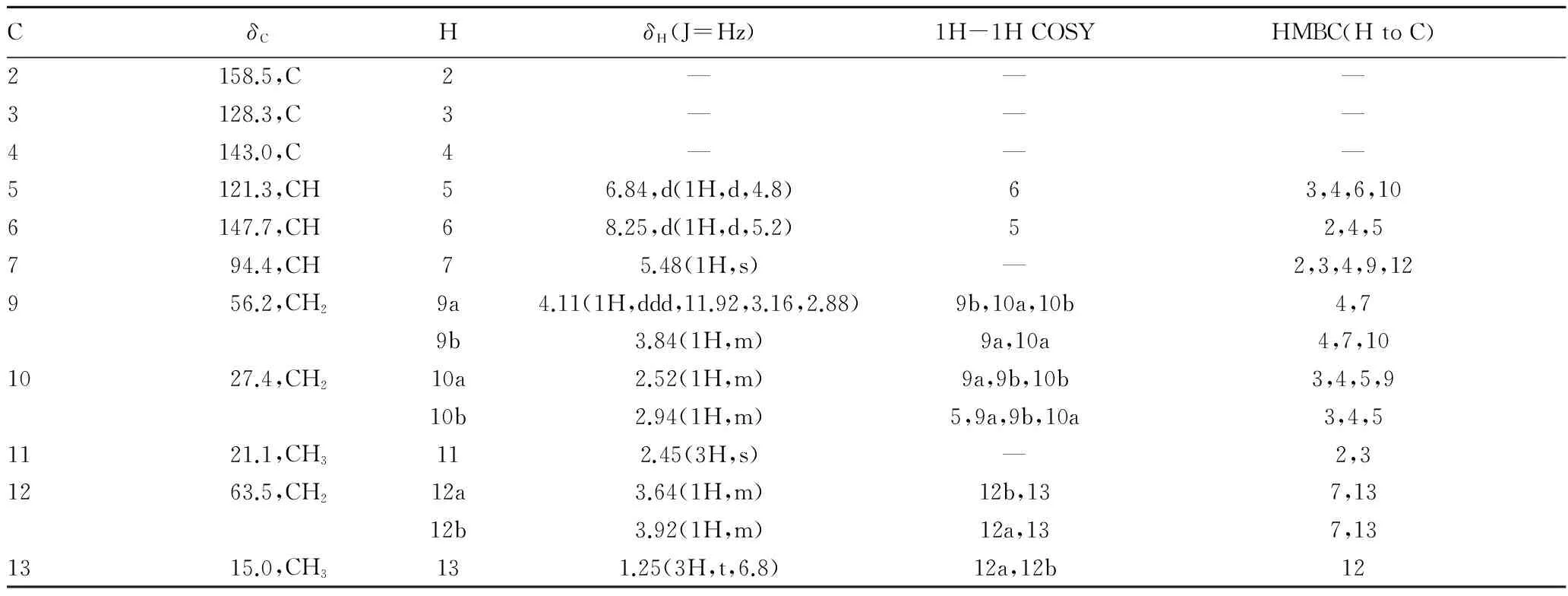
CδCHδH(J=Hz)1H-1HCOSYHMBC(HtoC)2158.5,C2———3128.3,C3———4143.0,C4———5121.3,CH56.84,d(1H,d,4.8)63,4,6,106147.7,CH68.25,d(1H,d,5.2)52,4,5794.4,CH75.48(1H,s)—2,3,4,9,12956.2,CH29a4.11(1H,ddd,11.92,3.16,2.88)9b,10a,10b4,79b3.84(1H,m)9a,10a4,7,101027.4,CH210a2.52(1H,m)9a,9b,10b3,4,5,910b2.94(1H,m)5,9a,9b,10a3,4,51121.1,CH3112.45(3H,s)—2,31263.5,CH212a3.64(1H,m)12b,137,1312b3.92(1H,m)12a,137,131315.0,CH3131.25(3H,t,6.8)12a,12b12
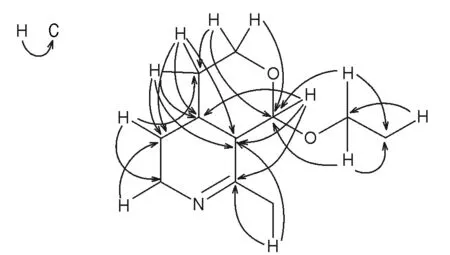
图2 化合物Ⅰ的HMBC图谱的关键相关信息Fig.2 Key correlation information of HMBC spectrum of compound Ⅰ
Ⅱ的碳氢谱数据与Ⅰ比较,乙氧基的数据相似:1H-NMR(CDCl3,200 MHz)谱中可见δ 3.85(1H,m)、δ 3.68(1H,m)和δ 1.27(3H,t,J=7.00)的乙氧基共振峰信号,结合13C-NMR(DEPT)谱推断该乙氧基的化学位移分别为δ 64.0(CH2)和δ 15.2(CH3)。由于Ⅱ分子中的环醚与二氢吡啶相连,与Ⅰ的环醚信号相差较大。1H-NMR谱中可观察到C1~C10上各质子间的耦合:δ 2.28(1H,m)和δ 4.38(2H,q)为二氢吡啶环上C5-H与C6-H的信号峰;信号δ 4.24(1H,m)和δ 4.38(1H,q)为C9上非化学等价的同碳二氢共振峰;信号δ 2.53(1H,m)和δ 2.18(1H,m)为C10上非化学等价的同碳二氢共振峰;δ 5.36(1H,s)为C7上的氢信号。另外,1H-NMR谱中δ 2.14(3H,m)及13C-NMR(DEPT)谱中信号δ 20.7(CH3)共同提示了一个处于较低磁场的甲基,由其化学位移及氢谱中各信号峰的耦合关系,推断该甲基与C5相连。根据以上证据,推断化合物Ⅱ结构如图3,并归属了Ⅱ的NMR数据(表2)。该研究是首次获得该化合物,暂命名为粗茎龙胆碱B(gentiocrasidine B)。

图3 化合物Ⅱ结构式Fig.3 Structure of compound Ⅱ


表2 化合物Ⅱ的NMR数据(CDCl3)

图4 化合物Ⅲ结构式Fig.4 Structure of compound Ⅲ

图5 化合物Ⅳ结构式Fig.5 Structure of compound Ⅳ
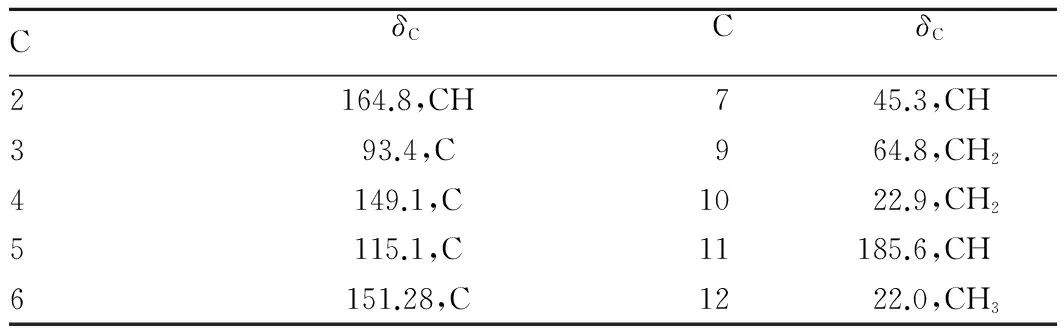
CδCCδC2164.8,CH745.3,CH393.4,C964.8,CH24149.1,C1022.9,CH25115.1,C11185.6,CH6151.28,C1222.0,CH3
13C-NMR(DEPT)(CD3OD,50 MHz)谱给出9个碳信号,由5个低场区的碳信号δ 157.5(C)、δ 146.0(CH)、δ 147.7(C)、δ 131.8(C)、δ 123.2(CH),以及1H-NMR(CD3OD,200 MHz)谱中的特征质子信号δ 8.25(1H,d,J=5.02 Hz)和δ 7.11(1H,d,J=5.05 Hz)推测分子中含有吡啶环[13];并由13C-NMR谱信号δ 28.6(CH2)、δ 57.0 (CH2)、δ 89.4(CH),结合生源初步推断Ⅴ为吡啶单萜类生物碱。1H-NMR谱中信号δ 8.25(1H,d,J=5.02 Hz)和δ 7.11(1H,d,J=5.05 Hz)为吡啶环上α-H与β-H的共振峰;信号δ4.28(1H,ddd,J=11.9 Hz,3.48 Hz,2.86 Hz)和 δ 3.93(1H,m)为C9上同碳二氢的共振峰;信号δ 3.02(1H,m)和δ 2.66(1H,m)为C10上同碳二氢的共振峰。δ 5.98(1H,s)为C7上的氢信号;13C-NMR(DEPT)谱中C7的信号峰δ 94.4(CH)为缩醛结构,处于较低磁场。C9及C10的化学位移为δ 56.2(CH2)和δ 27.4(CH2),δ 20.9(CH3)为与吡啶环相连的C11信号峰。波谱数据与文献[11]对照,与已知化合物西藏龙胆碱基本一致,鉴定化合物Ⅴ为西藏龙胆碱(gentiatibetine),其结构见图6。该研究归属了Ⅴ的碳谱数据(表4)。

图6 化合物Ⅴ结构式Fig.6 Structure of compound Ⅴ
2.6化合物Ⅵ白色无定形粉末,50 mg,mp:290~295 ℃,Liebermann-Burchard反应和Molish反应均显阳性。碳氢谱数据经与文献[12]比较,鉴定化合物Ⅵ为胡萝卜苷(daucosterol),其结构见图7。
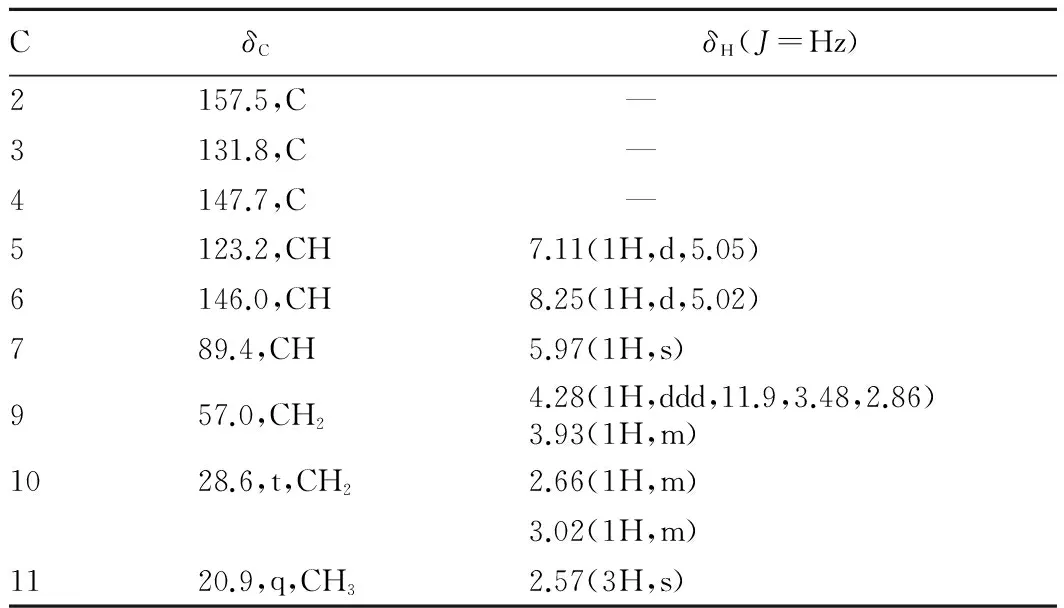
表4 化合物Ⅴ的NMR数据(CD3OD)

图7 化合物Ⅵ结构式Fig.7 Structure of compound Ⅵ
2.7化合物Ⅶ无色针晶(丙酮),30 mg,mp:135~137 ℃,与茴香醛试剂产生亮天蓝色斑点,渐变成绿色。TLC与β-谷甾醇标准品比较,Rf值一致,混合测熔点不下降。鉴定化合物Ⅶ为β-谷甾醇(β-sitosterol),其结构见图8。

图8 化合物Ⅶ结构式Fig.8 Structure of compound Ⅶ
2.8化合物Ⅷ白色无定形粉末,25 mg,mp:60~61 ℃,溴甲酚绿反应阳性。1H-NMR(CDCl3,400 MHz)谱低场区无质子信号;δ 0.88(3H,t,J=6.4 Hz)显示唯一的-CH3; δ 2.35(2H,t,J=7.6 Hz)显示羰基α位次甲基;δ 1.63(2H,m)显示羰基β位次甲基;在δ 1.25处有一脂肪链质子信号,提示该化合物为一长链脂肪酸。TLC与棕榈酸标准品比较,Rf值一致,混合测熔点不下降。鉴定化合物Ⅷ为棕榈酸(plamitic acid)。
3 结论
该研究首次对龙胆科植物粗茎秦艽加氨后生成的生物碱类成分进行了提取、分离,共得到了8个化合物,通过波谱和化学分析鉴定分别为粗茎龙胆碱A(gentiocrasine A,Ⅰ)、粗茎龙胆碱B(gentiocrasine B,Ⅱ)、秦艽甲素(gentianine,Ⅲ)、秦艽丙素(gentianal,Ⅳ)、西藏龙胆碱(gentiatibetine,Ⅴ)、胡萝卜苷(daucosterol,Ⅵ)、β-谷甾醇(β-sitosterol,Ⅶ)、棕榈酸(plamitic acid,Ⅷ),其中5个是裂环烯醚萜苷类生物碱,化合物Ⅰ和化合物Ⅱ为首次得到的化合物。秦艽生物碱类化合物均未见碳谱数据报导,该研究补充了秦艽丙素、西藏龙胆碱的碳谱数据。
[1] 刘艳红,李兴从,刘玉清,等.秦艽中的环烯醚萜甙成分[J].云南植物研究,1994,16(1):85-89.
[2] 中国医科学院药物研究所.中草药有效成分的研究:第1分册[S].北京:人民卫生出版社,1972:390.
[3] 傅丰永,孙南君.秦艽化学成份的研究(Ⅰ)[J].药学学报,1958,6(4):198-203.
[4] 梁晓天,于德泉,傅丰永.秦艽化学成分的研究 Ⅱ.秦艽乙素的结构及其合成[J].药学学报,1964,11(6):412-415.
[5] 薛智,梁晓天.秦艽丙素的结构[J].科学通报,1974,19(8):378-379.
[6] KUBOTA T, TOMITA Y. Derivation of gentianin from swertiamarin [J]. Tetrahedron letters, 1961, 14: 453-454.
[7] 林辉明.リンドウ科植物を基源とする生藥の研究(第1報)ゲンチアナ,リュウタン中の苦味成分Gentiopicrosideの定量[J].药学杂志(日),1976,96(3):356-361.
[8] 郭亚健,陆蕴如.龙胆苦甙转化为秦艽丙素等生物碱的研究[J].药物分析杂志,1983,3(5):268-271.
[9] 杨肖锋,宋纯清. 龙胆苦苷的肠内菌群代谢研究[J].中国中药杂志,2000,25(11):673-676.
[10] 乔卫,张彦文,吴寿金. 天然环烯醚萜苷类化合物的生物活性[J].国外医药(植物药分册),2001,16(2):65-67.
[11] FULKO F J. Structure of alkaloid fromGentianatibetica[J].Rocz Chem,1967, 41(3): 567.
[12] KOJIMA H,SATO N,HATANO A,et al. Sterol glucosides fromPrunellavulgaris[J]. Phytochemistry, 1990, 29(7): 2351-2355.
[13] 于德泉,杨峻山,谢晶曦.分析化学手册:第5分册:核磁共振波谱分析[S].北京:化学工业出版社,1989:72-76,524-529.
Artificial Alkaloids and Chemical Constituents ofGentianacrassicaulisDuthie ex Burk.
DU Peng
Affiliated Hospital of Guizhou Medical University,Guiyang,Guizhou 550004)
[Objective] To study artificial alkaloids and other chemical constituents ofGentianacrassicaulisDuthie ex Burk.. [Method] After the crude total alkaloids were extracted with a solvent containing ammonia,the chemical constituents in the extract were isolated and purified by silica gel column chromatography and identified on the basis of their physiochemical and spectral data. [Result] Eight compounds were isolated and identified,including gentiocrasine A (Ⅰ),gentiocrasine B (Ⅱ),gentianine (Ⅲ),gentianal (Ⅳ),gentiatibetine (Ⅴ),daucosterol (Ⅵ),β-sitosterol (Ⅶ),and plamitic acid (Ⅷ). [Conclusion] Compounds Ⅰ and Ⅱ are new compounds.
GentianacrassicaulisDuthie ex Burk.; Alkaloid; Chemical constituents
2016-08-26
S 567
A
0517-6611(2016)26-0091-04
杜鹏(1979- ),男,宁夏银川人,主管药师,硕士,从事天然药物及药物临床试验研究。

