白芨多糖两亲性聚合物的合成及载药纳米体系
管清香, 张广远, 孙丹丹, 孙士淋, 孙 诚, 刘 昕, 韩 冰
(吉林大学药学院, 长春 130021)
白芨多糖两亲性聚合物的合成及载药纳米体系
管清香, 张广远, 孙丹丹, 孙士淋, 孙诚, 刘昕, 韩冰
(吉林大学药学院, 长春 130021)
制备了硬脂酸改性白芨多糖两亲性聚合物(SA-BSPS)药物载体, 采用红外光谱及核磁共振氢谱对SA-BSPS药物载体进行了表征, 并以核磁共振氢谱峰面积计算取代度. 以多西他赛(DTX)为模型药物, 制备了多西他赛-硬脂酸改性白芨多糖聚合物(DTX-SA-BSPS)胶束, 测定了DTX-SA-BSPS的粒径分布、Zeta电位、 载药量及包封率. 结果表明, 硬脂酸已接枝到白芨多糖的羟基上, 取代度为12.94%. DTX-SA-BSPS胶束的粒径为(97.01±3.17) nm,Zeta电位为(-19.56±0.22) mV, 载药量为(9.13±0.17)%、 包封率达(81.11±0.18)%. 探讨了SA-BSPS胶束的细胞毒性及其被人肝癌细胞(HepG2)株摄入的情况. 细胞毒性实验表明, 浓度为0.5 μg/mL的SA-BSPS胶束孵育72 h时, 肝癌细胞存活率为(78.82±3.25)%. 荧光摄入实验表明, 孵育4 h后细胞中包载罗丹明B的SA-BSPS胶束的荧光强度明显强于游离罗丹明B, 且在孵育过程中, 荧光强度随孵育时间的延长而增强.
白芨多糖; 两亲性聚合物; 聚合物胶束; 载药量; 包封率
两亲性接枝或嵌段聚合物在水溶液中能自组装形成聚合物胶束, 广泛用于药物载体研究[1~4]. 多糖类高分子如壳聚糖、 普鲁兰多糖和海藻酸钠等因具有生物相容性好、 安全性高及生物可降解性等特点而广泛应用于药物递送系统[5~7]. Jung等[8]制备了乙酰化普鲁兰(PA)纳米粒, 发现普鲁兰乙酰化程度越高, 疏水性越强, 载药量增加, 且呈缓慢释药的趋势. Tang等[9]用聚对二氧环己酮修饰壳聚糖, 通过共价结合形成两亲性嵌段共聚物, 在水溶液中自组装成胶束, 氨基的质子化使其具有pH依赖性. 白芨多糖是从白芨[(Thunb.)Reichb.f.]药材中用一定工艺提取的由葡萄糖和甘露糖(1∶4, 摩尔比)以β-糖苷键聚合而成的一种葡甘聚糖, 具有抗炎及抗肿瘤等生物学活性, 无刺激、 无毒副作用且廉价易得, 其应用越来越受到重视[10]. 研究表明, 白芨多糖作为药物传送载体具有自身的缺陷, 主要体现在两方面: (1) 白芨多糖的分子结构主要由多羟基的葡萄糖和甘露糖构成, 亲水性较强, 在水中溶蚀较快, 机械强度较低, 故不宜直接作为缓释或控释骨架材料使用; (2) 白芨多糖缺少疏水域, 对难溶性药物的载药量低且包封率差. 许多研究者尝试对其进行疏水性修饰. Chen等[11]对白芨多糖进行硫酸酯化修饰, 结果表明, 在一定浓度条件下硫酸酯化的白芨多糖有促进B淋巴细胞增殖的作用, 对体外白血病细胞株U937的生长具有抑制作用; Bi等[12]制备了一种胆甾醇琥珀酰基修饰白芨多糖, 增强了白芨多糖的疏水性, 并制备了一种两亲性的嵌段共聚物, 扩大了其应用范围.
本文采用内源性生理物质硬脂酸对白芨多糖进行疏水性修饰, 制备了一种两亲性的硬脂酸改性白芨多糖聚合物(SA-BSPS)药物载体, 考察了SA-BSPS药物载体自组装形成聚合物胶束的形态和大小, 并以多西他赛(DTX)为模型药物, 探讨SA-BSPS的载药量和包封率, 评价了人肝癌细胞(HepG2)对SA-BSPS胶束的摄取情况及载体的细胞毒性.
1 实验部分
1.1试剂与仪器
多西他赛(DTX), 上海波以尔化工有限公司, 纯度99.6%; 多帕菲(规格1 mL∶40 mg), 齐鲁制药有限公司; 白芨多糖(BSPS), Pioneer Biotech有限公司, 纯度98.5%; 1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(EDC, 纯度99%)和4-二甲氨基吡啶(DMAP, 纯度98.5%), Energy化学品有限公司; 硬脂酸(SA, 纯度99%)和二甲基亚砜(DMSO, 纯度96%), 国药集团化学试剂有限公司; 噻唑蓝(MTT), Sigma Aldrich公司, 纯度98%. AVANCE400型核磁共振波谱(1H NMR)仪, 瑞士Bruker公司; LC-20AT型高效液相色谱(HPLC)仪, 日本Shimadzu公司; 8300型傅里叶变换红外光谱(FTIR)仪, 日本Shimadzu公司; IX71型荧光倒置显微镜, 日本Olympus公司.
1.2实验过程
1.2.1SA-BSPS药物载体的合成反应过程如Scheme 1所示.n(SA)∶n(DMAP)∶n(EDC)=1∶1∶1.2, 将127.6 mg SA, 53.4 mg DMAP和96.7 mg EDC溶解于3 mL DMSO中, 室温磁力搅拌活化1 h, 得到活化反应液; 将400 mg BSPS溶于4 mL DMSO中, 逐滴加入到活化反应液中, 于38 ℃反应48 h; 反应结束后向反应液中加入10倍体积的冰无水乙醇, 静置过夜, 过滤, 将沉淀物用无水乙醇与乙醚各100 mL交替洗涤3次, 于50 ℃干燥, 得到SA-BSPS药物载体203.6 mg. 利用溴化钾压片法测定[13]BSPS及SA-BSPS药物载体的红外光谱; 以DMSO-d6为溶剂, TMS为内标, 分别测定BSPS及SA-BSPS药物载体的1H NMR[14], 通过1H NMR峰面积计算取代度.
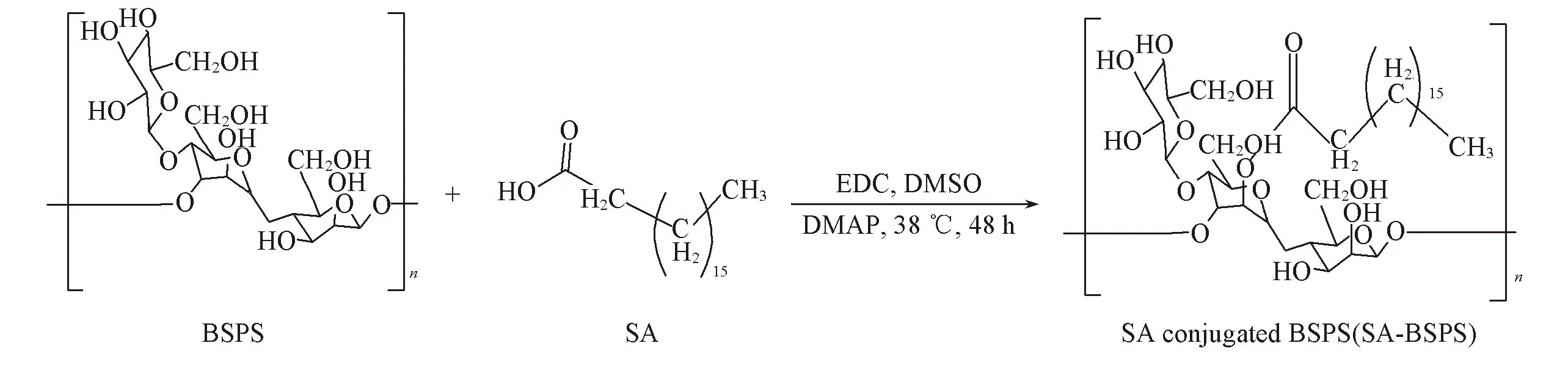
Scheme 1 Synthetic route of BSPS(SA-BSPS)
1.2.2SA-BSPS胶束及DTX-SA-BSPS胶束的制备将25.0 mg SA-BSPS药物载体加入4 mL DMSO中, 超声使SA-BSPS药物载体全部溶解, 转移至透析袋(截留分子量8000~12000)中, 于500 mL蒸馏水中透析, 磁力搅拌速率为100 r/min; 透析过程中, 前8 h中每2 h更换一次蒸馏水, 后24 h中每8 h更换一次蒸馏水, 用0.45 μm微孔滤膜过滤, 滤液用蒸馏水定容至50 mL, 即得SA-BSPS胶束.
将DTX用乙醇超声溶解, 在搅拌(100 r/min)下将DTX/乙醇溶液逐滴加入到SA-BSPS胶束溶液中, 滴加完成后继续搅拌10 min, 于40 ℃旋转蒸发除去乙醇, 待SA-BSPS胶束溶液冷却至室温后, 加蒸馏水定容至50 mL, 即得DTX-SA-BSPS胶束.
1.2.3载药量及包封率测定取DTX-SA-BSPS胶束1 mL, 于4 ℃超速离心(12000 r/min)离心10 min, 取上层清液, 测定HPLC, 通过标准曲线方程计算药物含量, 记为mfree; 取1 mL DTX-SA-BSPS胶束, 加入2 mL无水乙醇, 涡旋振荡2 min, 超声5 min, 使药物充分溶解在无水乙醇中, 于4 ℃超速离心(12000 r/min) 10 min, 取上层清液, 测定HPLC, 通过标准曲线方程计算药物含量, 记为mtotal, SA-BSPS的质量记为mcarrier, 通过下式计算DTX-SA-BSPS胶束中DTX的载药量(LC)及包封率(EE):
1.2.4细胞毒性及细胞摄入考察用噻唑蓝(MTT)方法评价SA-BSPS胶束的细胞毒性[11]. 以HepG2细胞作为癌细胞组, 将指数生长期的HepG2细胞用胰酶消化, 调节细胞浓度为5×104Cell/mL, 以100 μL/孔接种于96孔板中, 于5%(体积分数)CO2及37 ℃条件下培养24 h后除去培养液, 将不同浓度(0.0005, 0.005, 0.05, 0.5 μg/mL)的SA-BSPS胶束、 多西他赛参比制剂(多帕菲®)及DTX-SA-BSPS胶束悬浮液置于培养基中, 于5% CO2及37 ℃条件下培养72 h, 每孔加入20 μL MTT溶液, 在相同条件下培养4 h, 除去培养液, 加入DMSO溶液(150 μL/每孔溶解甲瓒, 振荡10 min, 待蓝紫色结晶充分溶解后, 用酶标仪测定492 nm处的OD值, 以不加药物组为正常对照组, 空白培养基为空白组, 每个样品平行测定3次. 细胞存活率计算公式:
取适量荧光染料罗丹明B与0.5 mg/mL SA-BSPS胶束混合, 室温搅拌5 h; 将混合液加入透析袋(截留分子量约500), 置于500 mL蒸馏水中透析8 h, 磁力搅拌速率为100 r/min, 每2 h更换一次蒸馏水. 罗丹明B和透析后得到的包载罗丹明B的SA-BSPS胶束溶液均用基础培养基定容至5 μg/mL(罗丹明B初始浓度), 将密度为2×104Cell/mL的胰酶消化HepG2肝癌细胞, 以1 mL/孔接种于24孔板中, 在5%(体积分数)CO2及37 ℃条件下培养过夜, 分别于0, 2和4 h在对应孔中加入1.0 mL 5 μg/mL罗丹明B和包载罗丹明B的SA-BSPS胶束进行孵育, 孵育结束后, 用1.0 mol/L冷磷酸盐缓冲(PBS)冲洗3次, 每次1.0 mL, 再加入1.0 mL PBS和2 μL 1 mg/mL Hoechest33342染料染核, 静置15 min, 用倒置荧光显微镜观察拍照.
2 结果与讨论
2.1SA-BSPS药物载体的表征

Fig.1 FTIR spectra of BSPS(a) and SA-BSPS(b)

图2给出了BSPS和SA-BSPS药物载体的1H NMR图. 从图2可知,δ5.4和4.55的特征峰分别代表H1和H2, 这2个特征峰分别为BSPS 1, 6位连接氢与1, 4位连接氢的吸收峰; 在δ1.24附近出现了很明显的强峰, 为硬脂酸的亚甲基(—CH2) H3特征峰,δ0.85处为硬脂酸的甲基(—CH3) H4特征峰.1H NMR进一步证明了硬脂酸疏水链连接到BSPS骨架上, 同时通过1H NMR上CH2和CH3特征峰的积分面积计算出SA-BSPS药物载体的取代度为12.94%.

Fig.2 1H NMR spectra of BSPS(a) and SA-BSPS(b) in DMSO-d6
2.2DTX-SA-BSPS胶束性质
测定DTX含量的色谱条件: 色谱柱为迪马C18色谱(5 μm,φ4.6 mm×250 mm); 流动相为V(乙腈)∶V(水)=60∶40; 检测波长为230 nm; 柱温为30 ℃; 进样量为20 μL; 流速为1.0 mL/min. 准确移取DTX储备液适量, 用无水乙醇稀释配制成浓度分别为10.12, 21.21, 50.31, 80.24, 70.06及100.53 μg/mL的DTX标准溶液, 按照上述色谱条件进样测定, 以峰面积(Y)对浓度(X)进行线性回归, 线性回归方程为Y=11952X+9498.7(R2=0.9998). 结果表明, DTX在10.12~100.53 μg/mL浓度范围内线性关系良好. 日内精密度(RSD)为1.25%, 日间RSD为1.28%. 图3给出了SA-BSPS胶束加入量对载药量的影响. 由图3可知, 随着m(DTX)∶m(SA-BSPS)从1∶20增加到1∶9, DTX-SA-BSPS胶束的包封率与载药量呈增加趋势, 当m(DTX)∶m(SA-BSPS)为1∶9时, 包封率与载药量达到最高, 此时载药量为(9.13±0.17)%, 包封率为(81.11±0.18)%. 继续增加DTX用量, 载药量与包封率均呈下降趋势, 但包封率下降明显, 其原因可能为疏水核心载药能力有限, 在m(DTX)∶m(SA-BSPS)为1∶9 时达到最高, 继续增加的DTX无法进入SA-BSPS胶束疏水核心, 反而会引起粒子的直接碰撞导致DTX粒子析出. 当m(DTX)∶m(SA-BSPS)为1∶5时, 可明显地观察到有药物粒子悬浮在SA-BSPS胶束溶液中. 通过动态光散射仪(DLS)测定SA-BSPS胶束粒径分布与Zeta电位, 结果见图4. 由图4可见,m(DTX)∶m(SA-BSPS)从1∶20到1∶5时, DTX粒子的粒径均小于100 nm. DTX-SA-BSPS胶束Zeta电位维持在-20 mV左右, 未随药物与SA-BSPS比值发生明显变化, 说明DTX的加入不会改变DTX-SA-BSPS胶束的Zeta电位, 从而保持DTX-SA-BSPS胶束水溶液维持在稳定状态.

Fig.3 EE and LC of DTX loaded SA-BSPS copolymer micelles

Fig.4 Particle size and zeta potential of DTX loaded SA-BSPS copolymer micelles
2.3细胞毒性及SA-BSPS胶束细胞摄入的荧光分析

Fig.5 Cytotoxicity of the blank SA-BSPS copolymermicelles, Duopafei, DTX-loaded SA-BSPS copolymer micelles in HepG2 cell for 72 h
载药体系的生物安全性和细胞跨膜特性尤为重要, DTX-SA-BSPS胶束进入机体内后, 主要被网状内皮系统的巨噬细胞吞噬, 故富集于网状内皮细胞丰富的肝脾等器官处. 因此, 本文采用HepG2为模型细胞, 测定SA-BSPS胶束、 参比制剂(多帕菲®)及DTX-SA-BSPS胶束的细胞毒性, 结果如图5所示. SA-BSPS胶束浓度在0.0005 μg/mL条件下对HepG2作用较低, 72 h时HepG2存活率为(97.1±1.32)%. 随着SA-BSPS胶束浓度的增加, HepG2的存活率呈降低趋势, 当SA-BSPS胶束浓度为0.5 μg/mL时, 72 h时HepG2存活率最低为(78.82±3.25)%, 这可能是因为SA-BSPS胶束对HepG2具有抑制作用[14]或由于72 h时营养物质耗竭所致. 在相同浓度条件下, 72 h时DTX-SA-BSPS胶束对HepG2的抑制作用明显, 其原因可能是SA-BSPS胶束粒径较小(<100 nm)能够进入HepG2内部, 避免了DTX被P-糖蛋白排出细胞外[15], 能够较长时间存在于HepG2内部, 缓慢释放抗癌药物从而对HepG2具有抑制作用. 以此模型包载抗癌药物, 在提高抗癌药物靶向性的同时, 也能降低抗癌药物对正常细胞的毒副作用.
药物能否被载体材料携带进入细胞, 是衡量该材料是否是一个良好的药物载体的重要指标之一. 通常, 药物以内吞方式被细胞摄入, 因此药效与细胞内吞摄入量密切相关. 为了验证本文中的SA-BSPS胶束可高效通透细胞膜的假设, 采用荧光倒置显微镜初步检测了包载罗丹明B的SA-BSPS胶束和罗丹明B被HepG2细胞株摄入的情况, 结果见图6. 红色荧光表示药物摄取进入细胞的分布及强度, 荧光强度越大摄取量越多. 从荧光强度上比较, 孵育2 h时二者在细胞质的荧光强度相近, 说明摄入程度相当, 但孵育4 h后包载罗丹明B的SA-BSPS胶束的荧光强度强于游离罗丹明B, 且在整个过程中, 荧光强度随孵育时间的延长而增强[16]. 包载罗丹明B的SA-BSPS胶束摄取的荧光强度大于游离罗丹明B, 可能是SA-BSPS胶束具有较好的生物相容性, 增强了罗丹明B与细胞的融合, 促进细胞的摄取.
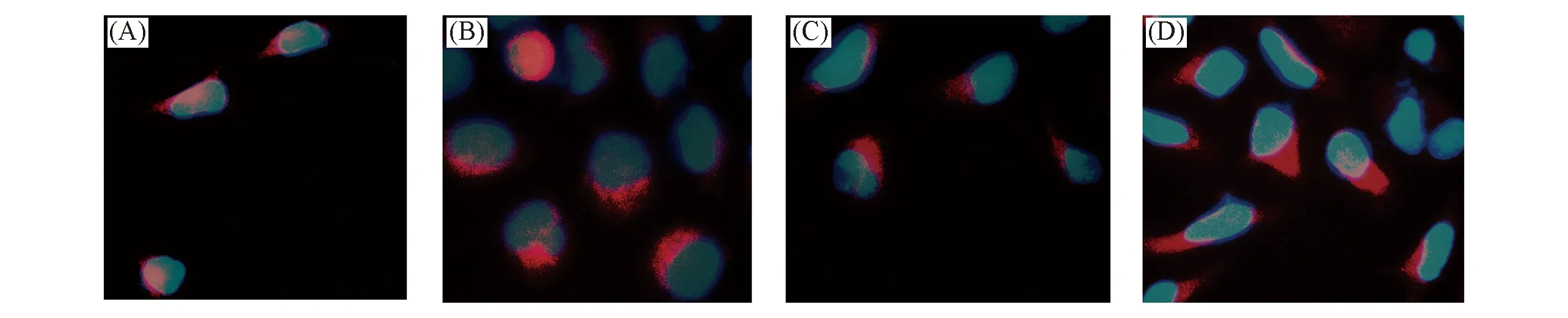
Fig.6 Fluorescent images of HepG2 cells incubated with Rhodamine B(A, B) and Rhodamine B-labeled SA-BSPS copolymer micelles(C, D) for 2 h(A, C) and 4 h(B, D)
3 结 论
将硬脂酸接枝到白芨多糖的羟基上, 合成了SA-BSPS药物载体, 取代度为12.94%. 采用透析法制备了SA-BSPS胶束, 载药量为(9.13±0.17)%、 包封率达(81.11±0.18)%. SA-BSPS胶束毒性低, 浓度为0.5 μg/mL的SA-BSPS胶束孵育72 h时, 肝癌细胞存活率为(78.82±3.25)%. 细胞对SA-BSPS胶束的摄取率较高. 结果表明, 制备的SA-BSPS有望在疏水性药物及肝癌等相关疾病治疗方面成为一种新的有潜在应用价值的药物载体.
[ 1 ]Wang Y., Wang Y. Q., Xiang J. N., Yao K. T.,Biomacromolecules, 2010, 11(12), 3531—3538
[ 2 ]Xiao K., Luo J., Li Y. P., Lee J. S., Fung G., Lam K. S.,JournalofControlledRelease, 2011, 155(2), 272—281
[ 3 ]Tang D. H., Zhang W. R., Wang Y. F., Miao J., Qiao Z. A., Huo Q. S., Zhang L. R.,Chem.Res.ChineseUniversities, 2014, 30(4), 531—537
[ 4 ]Yang S., Guo Z. H., Yang X. W., Xie J., Robert J. L., Jiang D., Teng L. S.,Chem.Res.ChineseUniversities, 2015, 31(3), 401—405
[ 5 ]Xiong X. B., Ma Z. S., Lai R., Lavasanifar A.,Biomaterials, 2010, 31(4), 757—768
[ 6 ]Liu Y., Huang Y., Boamah P. O., Zhang Q., Liu Y. Y., Hua M. Q.,Chem.Res.ChineseUniversitiees, 2014, 30(4), 549—555
[ 7 ]Wang L., Wang L. P., Xu T. S., Guo C. R., Liu C. Z., Zhang H., Li J., Liang Z. Q.,Chem.Res.ChineseUniversities, 2014, 30(6), 959—964
[ 8 ]Jung S. W. , Jeong Y. I. , Kim S. H. ,InternationalJournalofPharmaceutics, 2003, 254(2), 109—121
[ 9 ]Tang D. L., Song F., Chen C., Wang X. L., Wang Y. Z.,Nanotechnology, 2013, 24(14), 145101
[10]Zhao W. C., Song L. J., Xu J. H.,PharmacyToday, 2010, 20(3), 2—3(赵文昌, 宋丽军, 许健煌. 今日药学, 2010, 20(3), 2—3)
[11]Chen J. Y., Zhang W. M., Wang X. D., W T., Lu C. M., Wu G. R.,FoodScience, 2007, 28(4), 27—31(陈景耀, 张卫明, 王习达, 吴婷, 陆长梅, 吴国荣. 食品科技, 2007, 28(4), 27—31)
[12]Bi Y. J., Wang Y. P., Liu F. Q., Zhao N., Liu D., Han D., Liu T. J.,JournalofPharmaceuticalPractice, 2013, 31(3), 220—223(毕亚静, 王艳萍, 刘福强, 赵楠, 刘丹, 韩丹, 刘天娇. 药学实践杂志, 2013, 31(3), 220—223)
[13]Wang C. M., Sun J. T., Luo Y. , Xue W. H., Diao H. J., Dong L., Chen J. N., Zhang J. F.,BiotechnologyLetters, 2006, 28(8), 539—543
[14]Sheng F. G., Li X., Sheng Z. C., Zhou C. K., Liu X., Wu H. P.,Natl.Med.J.China, 2003, 83(5), 421—416(冯敢生, 李欣, 郑传胜, 周承凯, 柳曦, 吴汉平. 中华医学杂志, 2003, 83(5), 421—416)
[15]Morris G. A., Castile J., Smith A., Adams G. G., Harding S. E.,CarbohydratePolymers, 2011, 84(4), 1430—1434
[16]Vasir J. K., Labhasetwar V.,AdvancedDrugDeliveryReviews, 2007, 59(8), 718—728
(Ed.: W, Z)
† Supported by the National Natural Science Foundation of China(No.81401513) and the Graduate Innovation Fundation of Jilin University, China(No.2016225).
Investigation on Synthesis of Bletilla Striata Polysaccharides Amphiphilic Polymer and Drug-loaded Delivery System†
GUAN Qingxiang, ZHANG Guangyuan, SUN Dandan, SUN Shilin,SUN Cheng, LIU Xin*, HAN Bing*
(SchoolofPharmacy,JilinUniversity,Changchun130021,China)
Stearic acid(SA)-modifiedBletillaStriatapolysaccharides(BSPS) amphiphilic copolymers(SA-BSPS) were prepared. Fourier transform infrared spectroscopy and1H nuclear magnetic resonance spectroscopy(1H NMR) were used to describe SA-BSPS group. The substitued degree of the SA-BSPS group was determined by the peak area oflH NMR. Docetaxel-loaded SA-conjugated BSPS(DTX-SA-BSPS) copolymer micelles were formulated and characterized in terms of particle diameter,Zetapotential, drug loading capacity(LC) and encapsulation efficiency(EE). Further, the uptake of rhodamine B-labeled SA-BSPS copolymer micelles and antitumor activityinvitroon human liver cancer cell line (HepG2) were carried out. The results indicated that SA was successfully conjugated with BSPS and the substitued degree of the SA-BSPS group was 12.94%. DTX-SA-BSPS copolymer micelles had an average size of (97.01±3.17) nm withZetapotential in the range of (-19.56±0.22) mV. The drug encapsulation and loading capacity were (81.11±0.18)% and (9.13±0.17)% respectively. The average cell line viability of blank SA-BSPS polymer micelles were (78.82±3.25)% at 0.5 μg/mL after 72 h incubation. Fluorescent intensity of HepG2 cells incubated for 4 h with rhodamine B-labeled SA-BSPS copolymer micelles was higher than that of rhodamine B and fluorescent intensity exhibited an increase trend when incubation time were prolonged.
BletillaStriatapolysaccharide; Amphiphilic copolymer; Polymer micelle; Drug loading capacity; Encapsulation efficiency
10.7503/cjcu20160342
2016-05-16. 网络出版日期: 2016-08-31.
国家自然科学基金(批准号: 81401513)和吉林大学研究生创新基金(批准号: 2016225)资助.
O636
A
联系人简介: 韩冰, 男, 博士, 副教授, 主要从事药物制剂研究. E-mail: hanb@jlu.edu.cn
刘昕, 女, 副教授, 主要从事聚合物材料及药物分析研究. E-mail: liux@jlu.edu.cn

