α-氨基酸各官能团对其Co(Ⅱ)配合物可逆氧合性能的影响
薛 鹏, 魏雅娜, 岳 凡, 张 翼, 王吉德
(1. 新疆大学化学与化工学院, 石油天然气精细化工教育部和自治区共建重点实验室, 乌鲁木齐 830046;2. 中南大学化学与化工学院, 生物传感与表面分析研究所, 长沙 410083;3. 新疆应用职业技术学院石油与化学工程系, 奎屯 833200)
α-氨基酸各官能团对其Co(Ⅱ)配合物可逆氧合性能的影响
薛鹏1,2, 魏雅娜1,3, 岳凡1, 张翼2, 王吉德1
(1. 新疆大学化学与化工学院, 石油天然气精细化工教育部和自治区共建重点实验室, 乌鲁木齐 830046;2. 中南大学化学与化工学院, 生物传感与表面分析研究所, 长沙 410083;3. 新疆应用职业技术学院石油与化学工程系, 奎屯 833200)
选择氧合性能良好的组氨酸(His)-Co(Ⅱ)作为研究对象, 分别掩蔽—NH2、 取代—O-和去除—COO-, 得到短肽、 伪肽和多胺等类组氨酸结构. 采用UV-Vis光谱法研究了α-氨基酸中的3个官能团对其Co(Ⅱ)配合物氧合性能的影响. 对比研究表明:α-氨基酸中—NH2对其Co(Ⅱ)配合物的吸氧性具有决定作用; —COO-对其Co(Ⅱ)配合物氧合作用的可逆性起关键作用; 而—O-对其Co(Ⅱ)配合物的吸氧性影响不大. 在前期研究结果的基础上, 对α-氨基酸-Co(Ⅱ)配合物可逆吸收和释放O2的机理进行了探讨.
α-氨基酸; Co(Ⅱ)配合物; 可逆氧合; 组氨酸; 氧载体
天然氧载体(如血红蛋白和肌红蛋白)对生物体内分子O2的传递和贮存等生命活动起着重要的作用[1], 研究其作用方式和机理对探索生物体奥秘具有重要意义[2,3]. 但是天然氧载体结构复杂, 影响氧合作用的因素众多, 因此常选择结构相对简单的过渡金属配合物作为模型化合物来模拟研究生物的氧合作用[4~6].
在众多人工氧载体模型化合物中, 常用的金属离子为Co(Ⅱ), Fe(Ⅱ), Cu(Ⅰ)和Mn(Ⅲ)等[7~10], Co(Ⅱ) 由于具有良好的稳定性而被广泛研究[11,12]. 氨基酸-Co(Ⅱ)配合物在近似生理环境(室温、 水溶液)中表现出良好的氧合可逆性[13~16], 因此研究氨基酸-Co(Ⅱ)配合物的氧合机理有利于揭示生物氧载体的可逆载氧机理.
Hearon等[17]首先发现了His-Co(Ⅱ) 配合物在水溶液中具有很好的可逆氧合性能. Martell等[18]发现His-Co(Ⅱ)和其它氨基酸-Co(Ⅱ) 配合物室温下在水溶液中具有不同的可逆氧合性能, 是研究氧载体很好的模型化合物.
为了研究Co(Ⅱ) 配合物可逆吸收分子O2的机理, 我们分别选择了不同的双官能团配体:α-氨基酸类(—NH2和—COO-)、α-氨基醇类(—NH2和—O-)、 多胺类(—NH2)和含羟基的羧酸类(—O-和—COO-)配体, 对比研究了其Co(Ⅱ)配合物在水溶液中的氧合性能[19], 发现只有氨基酸类配体的Co(Ⅱ)配合物具有可逆吸氧性能. 通过测试20多种氨基酸的氧合性能, 发现α-氨基酸Co(Ⅱ)配合物都具有可逆氧合能力, 而β-氨基酸Co(Ⅱ)配合物没有氧合能力[20]. 因此, 确定α-氨基酸结构单元为其Co(Ⅱ)配合物具有氧合能力的关键单元. 为了考察α-氨基酸官能团邻位再联结一个官能团后对可逆吸氧性能的影响, 分别研究了2,3-二氨基丙氨酸(DAPA)和β-(2-吡啶基)-α-丙氨酸(PyA)的氧合性能, 结果发现引入的氨基[21]和吡啶基[22]使α-丙氨酸(Ala)氧合性能有明显的提高. 对His、 组氨醇和组胺的Co(Ⅱ)配合物的对比研究表明, —COO-的共轭作用对Co(Ⅱ)配合物的可逆吸氧性能有着重要的作用[23].
α-氨基酸中包含3种官能团(—NH2, —O-和—COO-), 为了弄清α-氨基酸结构单元中各官能团本身及其之间的协同作用对氧合作用的贡献, 本文选择氧合性能良好的组氨酸(His)为研究对象, 分别利用Fmoc保护基掩蔽—NH2、 甲酯基(—OMe)取代—O-和去除—COO-氧合结构单元后研究其氧合性能. 通过红外表征、 氧电极测试和质谱分析等方法均可以判断配合物配位、 氧合前后的形态变化[24,25]. 但由于Co(Ⅱ)配合物吸氧前后的UV-Vis光谱差异明显, 因此UV-Vis光谱法是实时表征Co(Ⅱ)配合物氧合反应最简单、 可靠的手段[23]. 本文通过UV-Vis光谱在室温下考察了His和几种类His物质的氧合可逆性和氧合动力学性质, 对比评价了其氧合性能, 从而确定了各官能团对氧合作用的影响. 本文研究结果对探讨α-氨基酸单元中各官能团对可逆氧合作用的贡献、 发现并合成具有良好可逆吸氧的模型化合物及揭示生物氧载体的可逆载氧机理提供了重要实验依据.
1 实验部分
1.1试剂与仪器
组氨酸、 苯丙氨酸(Phe)、N,1-二-Fmoc-L-组氨酸[Fmoc-His(Fmoc)]、 组氨酸甲酯(His-OMe)和Fmoc-L-苯丙氨酸(Fmoc-Phe)购于吉尔生化(上海)有限公司; 组胺(Hist)和四水合醋酸钴[Co(OAc)2·4H2O, Co(Ⅱ)]购于成都西亚化工股份有限公司;N,N-二甲基甲酰胺(DMF)购于天津市致远化学试剂有限公司; N2和O2的纯度均为99.9%.
UV2550型紫外-可见光谱仪(日本Shimadzu公司); XS105DU型高精度天平(瑞士Mettler Toledo公司); PHS-3C型pH计(上海盛磁公司).
1.2氨基酸Co(Ⅱ)配合物氧合可逆性测试
移取10.0 mL配体溶液于样品池中, 在N2气保护下加入10.0 mL Co(Ⅱ)水溶液(表1), 用NaOH调节溶液pH值, 在300~600 nm波长范围内测定N2气氛下配合物的吸收光谱; 然后通O2气10 min, 在O2气氛下测定氧合配合物的吸收光谱. 此前先分别测定配体溶液与Co(Ⅱ)溶液的吸收光谱.

Table 1 Concentration of Co(Ⅱ) and ligands, volume ratio of the solvent and pH value of the reaction
1.3 Co(Ⅱ)配合物氧合动力学测试
在pH=7.3~9.0和Co(Ⅱ)氧合配合物最大吸收波长条件下, 分别在通入O2和N2时测定吸光度随时间的变化. 以一次交替充入N2/O2的测试为1个可逆氧合循环, 通过测试吸光度的变化来评价配合物的可逆氧合性能.
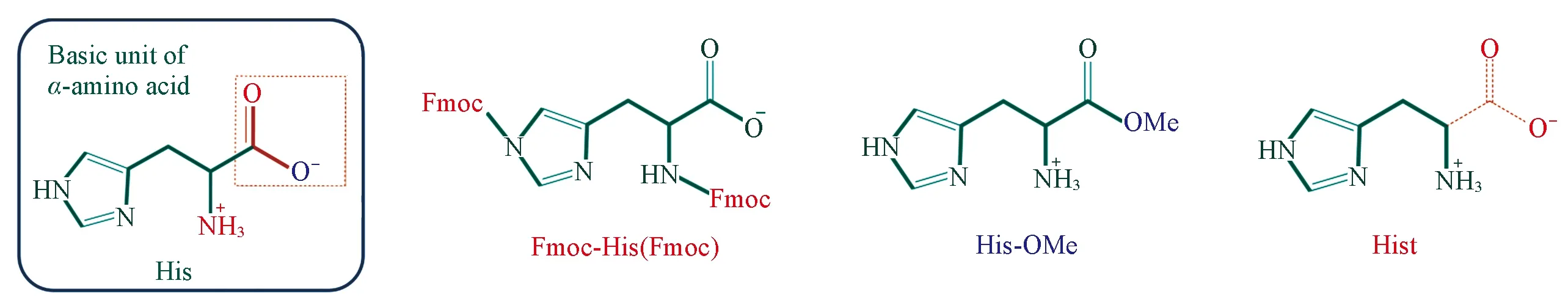
Fig.1 Treatment of different functional groups of histidine
2 结果与讨论
为确定α-氨基酸各官能团在氧合过程中的贡献, 以His作为母体, 分别选择掩蔽—NH2、 取代—O-和去除—COO-后的类His化合物进行氧合性能研究(图1).
2.1α-氨基酸结构单元中—NH2对氧合性能的影响
2.1.1His-Co(Ⅱ)与Fmoc-His(Fmoc)-Co(Ⅱ) 配合物氧合性能及动力学性能研究由UV-Vis光谱[图2(A)]可见, 室温下, Co(Ⅱ)(谱线a)在520 nm附近处有微弱的吸收峰, His配体(谱线b)溶液在300~600 nm波长范围内没有明显的特征吸收峰. N2气氛下混合Co(Ⅱ)和His溶液, 谱线发生变化(谱线c), 表明两者配位形成His-Co(Ⅱ)配合物, 此时溶液呈浅粉色(图3). 用O2代替N2, 在320和384 nm处出现2个新的较强的吸收峰(谱线d), 溶液颜色迅速由浅粉色变为黄色, 表明His-Co(Ⅱ)与O2发生作用, 生成氧合配合物. 再通入N2时氧合吸收峰会明显降低, 光谱曲线与初始曲线重合(谱线c′), 黄色溶液又会变成浅粉色, 表明His-Co(Ⅱ)氧合配合物发生脱O2作用. 重复通入O2时光谱曲线又会增加至初始通O2附近位置(谱线d′), 表明His-Co(Ⅱ)配合物具有良好的可逆吸收-释放O2性能.

Fig.2 UV-Vis spectra of His-Co(Ⅱ)(A) and Fmoc-His(Fmoc)-Co(Ⅱ)(B) complexes (A) a. Co(Ⅱ); b. His; c/c′. His-Co(Ⅱ)-N2 1st/2nd; d/d′. His-Co(Ⅱ)-O2 1st/2nd; (B) a. Co(Ⅱ); b. Fmoc-His(Fmoc); c/d. Fmoc-His(Fmoc)-Co(Ⅱ)-N2/O2.

Fig.3 Color variations of His-Co(Ⅱ) complex during reversible oxygenation reaction
由图2(B)可知, 室温下, Co(Ⅱ)(谱线a)在510 nm附近处有微弱的吸收峰, Fmoc-His(Fmoc)配体(谱线b)溶液在300~600 nm波长范围内没有明显的特征吸收峰. N2气氛下混合Co(Ⅱ)和Fmoc-His(Fmoc)溶液, 谱线发生变化(谱线c), 表明两者配位形成Fmoc-His(Fmoc)-Co(Ⅱ)配合物. 用O2代替N2, 谱线未发生变化(谱线d), 溶液颜色未变, 表明Fmoc-His(Fmoc)-Co(Ⅱ)配合物不能吸收O2.
His-Co(Ⅱ)具有良好的可逆吸收-释放O2性能, 而Fmoc-His(Fmoc)-Co(Ⅱ)配合物没有吸收O2的能力. 这证明了—NH2在可逆吸O2中的重要作用. 但也不排除双Fmoc-基团引起的空间位阻阻碍O2分子进入配位所起的作用, 因此选择单Fmoc基苯丙氨基酸(Fmoc-Phe)进一步验证—NH2在结构单元吸O2过程中的作用.
2.1.2Phe-Co(Ⅱ)与Fmoc-Phe-Co(Ⅱ)配合物氧合性能及动力学性能研究为了进一步确定—NH2对氧合作用的影响, 同时选择了Phe和Fmoc-Phe 2种氨基酸进行对比研究. 由UV-Vis光谱[图4(A)]可见, 室温下Phe配体(谱线b)溶液在300~600 nm波长范围内均未出现明显特征吸收峰. 在N2气氛下混合Co(Ⅱ)与Phe溶液, 谱线发生变化(谱线c). 用O2代替N2, 在385和540 nm附近出现2个新的较强的吸收峰(谱线d), 溶液颜色迅速由粉红色变为橙黄色, 表明Phe-Co(Ⅱ)配合物与O2发生作用, 生成氧合配合物. 再次通入N2, 385 nm处的氧合吸收峰的强度减弱, 谱线下降(谱线c′), 溶液颜色由橙黄色变成浅粉色, Phe-Co(Ⅱ)氧合配合物发生脱氧作用. 重复通入O2, 溶液颜色又会变回橙黄色, 光谱曲线又会上升(谱线d′). 由此可以判定Phe-Co(Ⅱ) 配合物具有可逆的吸收-释放O2性能.
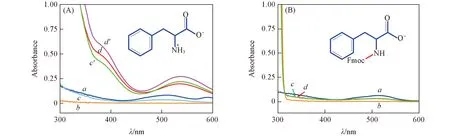
Fig.4 UV-Vis spectra of Phe-Co(Ⅱ)(A) and Fmoc-Phe-Co(Ⅱ)(B) complexes (A) a. Co(Ⅱ); b. Phe; c/c′. Phe-Co(Ⅱ)-N21st/2nd; d/d′. Phe-Co(Ⅱ)-O21st/2nd; (B) a. Co(Ⅱ); b. Fmoc-Phe; c/d. Fmoc-Phe-Co(Ⅱ)-N2/O2.
由图4(B)可见, 室温下Fmoc-Phe配体(谱线b)溶液在300~600 nm波长范围内没有明显的特征吸收峰. N2气氛下混合Co(Ⅱ)和Fmoc-Phe溶液, 谱线发生微小变化(谱线c), 形成Fmoc-Phe-Co(Ⅱ)配合物. 用O2代替N2, 谱线未发生变化(谱线d与谱线c重合), 证明Fmoc-Phe-Co(Ⅱ)配合物不能吸收O2.
His-Co(Ⅱ)和Phe-Co(Ⅱ)都具有很好的可逆氧合能力, 而用Fmoc-保护基屏蔽了—NH2的Fmoc-His(Fmoc)和Fmoc-Phe, 与Co(Ⅱ)离子配位形成的配合物没有吸收O2的能力. 这说明在α-氨基酸结构单元中—NH2起了重要配位作用, 有—NH2官能团时可以吸收O2, 缺少—NH2将不吸收O2. 这与实验室先前工作认为含有—COO-和—O-双官能团配体的Co(Ⅱ)配合物没有吸氧性能的结论相符[19].

Fig.5 UV-Vis spectra(A) and dynamics test(B) of (His-OMe)-Co(Ⅱ) complexes a. Co(Ⅱ); b. His-OMe; c/c′:(His-OMe)-Co(Ⅱ)-N2 1st/2nd; d/d′:(His-OMe)-Co(Ⅱ)-O21st/2nd.
2.2α-氨基酸结构单元中—O-对氧合性能的影响
为验证α-氨基酸结构单元羧基中—O-的作用, 用—OMe基团取代—O-, 选择His-OMe对比His进行氧合性能测试. 由图5(A)可见, 室温下His-OMe配体(谱线b)溶液在300~600 nm波长范围内没有明显的特征吸收峰. N2气氛下混合Co(Ⅱ)和His-OMe溶液, 谱线发生变化(谱线c), 形成浅粉色的(His-OMe)-Co(Ⅱ)配合物. 用O2代替N2, 在320和385 nm处出现2个新的较强的吸收峰(谱线d), 溶液颜色迅速由浅粉色变为黄色, 表明(His-OMe)-Co(Ⅱ)与O2发生作用, 生成氧合配合物. 再通入N2时谱线明显降低(谱线c′), 黄色溶液又会变成浅粉色, 表明(His-OMe)-Co(Ⅱ)氧合配合物发生脱O2作用. 重复通入O2时谱线又会增强至初始通O2附近位置(谱线d′), 证明(His-OMe)-Co(Ⅱ)配合物具有良好的可逆吸收-释放O2性能.
为了考察配合物的可逆吸收-释放O2速率与老化过程, 对(His-OMe)-Co(Ⅱ)配合物氧合性能进行UV-Vis光谱动力学测试, 选定吸收峰在320 nm处, 在O2/N2交替下考察吸光度随时间的变化. 通过图5(B)可以看出, (His-OMe)-Co(Ⅱ)配合物具有较快的氧合速率, 在400 s内即达到吸O2饱和; 脱O2过程需要350 s. 将其配合物首次吸收O2饱和值定为100%, 经过40 h反复交替通入N2/O2, 发现其氧合能力几乎未衰减, 仍达到初始值的98%以上. 这表明(His-OMe)-Co(Ⅱ)配合物的氧合能力很稳定, 可逆氧合性能及老化寿命类似His-Co(Ⅱ)配合物.
对比His-Co(Ⅱ)和(His-OMe)-Co(Ⅱ) 2种配合物在水溶液中的吸氧性能和动力学测试, 发现用—OMe基取代His中的—O-对His可逆氧合性能没有影响, 且对吸O2的可逆性影响不大.
2.3α-氨基酸结构单元中—COO-对氧合性能的影响

Fig.6 UV-Vis spectra of Hist-Co(Ⅱ) complexes a. Co(Ⅱ); b. Hist; c/d. Hist-Co(Ⅱ)-N2/O2 1st; d′. Hist-Co(Ⅱ)-N2 2nd.
为验证α-氨基酸单元中的—COO-对氧合性能的影响, 选择没有—COO-的组胺(Hist)与His对比, 进行氧合性能研究. 由图6可见, 室温下Hist配体(谱线b)溶液在300~600 nm波长范围内没有明显的特征吸收峰. 在N2气氛下混合Co(Ⅱ)和Hist溶液, 光谱曲线发生微小变化(谱线c), 形成Hist-Co(Ⅱ)配合物. 用O2代替N2, 在314和371 nm处出现2个新的较强的吸收峰(谱线d), 表明Hist-Co(Ⅱ)与O2发生作用, 生成氧合配合物. 再通入N2时光谱曲线没有变化(谱线d′), 证明Hist-Co(Ⅱ)配合物能够吸收分子O2, 但不能释放分子O2, 无可逆氧合性能.
对比His-Co(Ⅱ)和Hist-Co(Ⅱ) 2种配合物在水溶液中吸收O2的性能, 发现His去掉—COO-后(Hist)具有特殊的吸O2行为: 即可吸收O2但不释放O2, 这与多胺Co(Ⅱ)吸O2不放O2的氧合性质相似[19]. 由于Hist配体只有2个N原子配位, O2分子以过氧形式与Co(Ⅱ)发生配位, —NH2为给电子作用, 使Co-O2的电子密度增加而不易脱O2, 因此Hist-Co(Ⅱ)配合物的吸O2能力很强, 但是可逆性极差[22]. 可见吸氧单元中—COO-的作用与可逆吸放O2有关, 当存在—COO-时Co(Ⅱ)配合物具有放O2性能.
2.4α-氨基酸-Co(Ⅱ)可逆吸收-释放O2的机理探讨
关于His-Co(Ⅱ)吸收O2的机理已有文献[15,26]报道. 但这些文献都没有探讨Co(Ⅱ)配合物可逆吸收和释放O2的机理. 本文在实验结果和前期研究的基础上, 以His-Co(Ⅱ)为模型, 对α-氨基酸-Co(Ⅱ)配合物可逆吸收和释放O2的机理进行了探讨(图7).

Fig.7 Calculated simulation of oxygenation of His-Co(Ⅱ) complexes
通过氧合前后的密度泛函理论(DFT)计算, 氧合配合物中N—C, C—O, Co—O和Co—N键长变短. 如His-Co(Ⅱ)配合物中Co—O, Co—N和Co—N(咪唑)的键长分别为0.22723, 0.20113, 0.20775, 0.22847和0.19847, 0.19910 nm, 氧合后变为0.19519, 0.19286, 0.19361, 0.20006, 0.19632和0.19580 nm[27]. 结果表明氧合反应中α-氨基和—COO-发生了共轭作用. 由于—COO-与钴离子配位的能力弱于—NH2, 使Co-O2的电子密度适中. O2分压降低时, —COO-重新取代O2发生脱O2反应, 又变回His-Co(Ⅱ)配合物(图7结构Ⅱ). 当O2和N2(使O2分压降低)气氛交替时, 随着电子的转移和共轭作用的交替, His-Co(Ⅱ)配合物与O2的结合构型也随之发生可逆转变(图7结构Ⅱ, Ⅲ, Ⅳ)[20].
随着可逆氧合反应的进行, His-Co(Ⅱ)配合物逐渐发生老化, 结构转变为(图7结构Ⅴ), 此时His-Co(Ⅱ)配合物氧合能力减弱.
3 结 论
通过UV-Vis分光光度法研究了α-氨基酸结构单元中各官能团对氧合性能的影响, 发现—NH2在氧合配合物中起到重要作用, 为α-氨基酸-Co(Ⅱ)吸收O2的核心官能团. 在α-氨基酸-Co(Ⅱ)配合物中存在—NH2即可发生氧合反应吸收O2, 没有—NH2则无法发生氧合作用; —COO-对α-氨基酸-Co(Ⅱ)配合物可逆吸放氧性能影响很大, 没有—COO-不能释放O2; —O-对α-氨基酸-Co(Ⅱ)配合物的氧合性能和可逆性无影响. 在实验结果和前期研究的基础上, 以His-Co(Ⅱ)为模型, 探讨了α-氨基酸-Co(Ⅱ)配合物可逆吸收和释放O2的机理. 本文研究结果初步确定了α-氨基酸结构单元中3种官能团对其Co(Ⅱ)配合物氧合性能的影响, 对发现和合成具有良好可逆吸氧性能的化合物具有参考价值.
[ 1 ]Niederhoffer E. C., Timmons J. H., Martell A. E.,Chem.Rev., 1984, 84(2), 137—203
[ 2 ]Murray L. J., Dinca M., Yano J., Chavan S., Bordiga S., Brown C. M., Long J. R.,J.Am.Chem.Soc., 2010, 132(23), 7856—7857
[ 3 ]Johnson C., Ottiger S., Pini R., Gorman E. M., Nguyen J. G., Munson E. J., Mazzotti M., Borovik A., Subramaniam B.,AICHEJ., 2009, 55(4), 1040—1045
[ 4 ]Wang J. D., Collange E., Aymes D. J.,Bull.Soc.Chim.Fr., 1994, 131, 37—44
[ 5 ]Wang J. D., Martell A. E., Reibenspies J. H.,Inorg.Chim.Acta, 2002, 328, 53—60
[ 6 ]Vogt L. H., Faigenbaum H. M., Wiberly S. E.,Chem.Rev., 1963, 63(3), 269—277
[ 7 ]Johnson C., Long B., Nguyen J. G., Day V. W., Borovik A., Subramaniam B., Guzman J.,J.Phys.Chem.C, 2008, 112(32), 12272—12281
[ 8 ]Yang H. Q., Zhang L., Zhong L., Yang Q. H., Li C.,Angew.Chem.Int.Ed., 2007, 46(36), 6861—6865
[ 9 ]Hong S., So H., Yoon H., Cho K., Lee Y., Fukuzumi S.,DaltonTrans., 2013, 42(22), 7842—7845
[10]Liu L. L., Li H. X., Wan L. M., Ren Z. G., Wang H. F., Lang J. P.,Chem.Commun., 2011, 47, 11146—11148
[11]Henderson I. M., Hayward R. C.,J.Mater.Chem., 2012, 22(40), 21366—21369
[12]Wei Y. N., Zhang X. C., Li H., Xu Q., Yue F., Wang J. D.,Chem.J.ChineseUniversities, 2016, 37(2), 354—360(魏雅娜, 张新村, 李辉, 徐骞, 岳凡, 王吉德. 高等学校化学学报, 2016, 37(2), 354—360)
[13]Martell A. E.,J.Mol.Catal., 1988, 44(1), 1—14
[14]Martell A. E., Motekaitis R. J., Chen D., Murase I.,PureAppl.Chem., 1993, 65(5), 959—964
[15]Simplicio J., Wilkins R. G.,J.Am.Chem.Soc., 1967, 89(24), 6092—6095
[16]Guo M., Dong H., Li J., Cheng B., Huang Y. Q., Feng Y. Q., Lei A. W.,Nat.Commun., 2012, 3, 1190
[17]Burk D., Hearon J., Caroline L., Schade A. L.,J.Biol.Chem., 1946, 165(2), 723—724
[18]Harris W. R., McLendon G., Martell A. E.,J.Am.Chem.Soc., 1976, 98(26), 8378—8381
[19]Wen H. M., Zhang X., Li H., Yue F., Wang J. D.,Chem.J.ChineseUniversities, 2013, 34(10), 2262—2269(文红梅, 张旭, 李辉, 岳凡, 王吉德. 高等学校化学学报, 2013, 34(10), 2262—2269)
[20]Zhang X. C., Yue F., Li H., Huang Y., Zhang Y., Wen H. M., Wang J. D.,Bioinorg.Chem.Appl., 2016, 2016, http://dx.doi.org/10.1155/2016/3585781
[21]Zhang X. C., Yue F., Huang Y., Fu P., Cheng X., Wang J. D.,Chem.J.ChineseUniversities, 2012, 33(7), 1370—1375(张新村, 岳凡, 黄艳, 付佩, 程翔, 王吉德. 高等学校化学学报, 2012, 33(7), 1370—1375)
[22]Yue F., Song N., Huang Y., Wang J. D., Xie Z. F., Lei H. Q., Zhang X. C., Fu P., Tao R. P., Chen X., Shi M. S.,Inorg.Chim.Acta, 2013, 398, 141—146
[23]Zhang X. C., Yue F., Huang Y., Cheng X., Wen H.M., Hu D., Wang J. D.,ChineseJ.Inorg.Chem., 2013, 29(11), 2387—2393(张新村, 岳凡, 黄艳, 程翔, 文红梅, 胡地, 王吉德. 无机化学学报, 2013, 29(11), 2387—2393)
[24]Fu J. H., Li J.F., Fu P., Yue F., Zhang X. L., Wang J. D.,Chem.J.ChineseUniversities, 2011, 32(7), 1483—1487(符继红, 李俊芳, 付佩, 岳凡, 张旭龙, 王吉德. 高等学校化学学报, 2011, 32(7), 1483—1487)
[25]Fu P., Fu J. H., Li J.F., Yue F., Zhang X. L., Wang J. D.,ChineseJ.Inorg.Chem., 2012, 28(7), 1360—1364(付佩, 符继红, 李俊芳, 岳凡, 张旭龙, 王吉德. 无机化学学报, 2012, 28(7), 1360—1364)
[26]Harris W. R., Martell A. E.,J.Am.Chem.Soc., 1977, 90(20), 6746—6750
[27]Yang Y., Deng Y. L., Yue F., Chen H. M., Sun D. C., Wang J. D.,Comput.Appl.Chem., 2013, 30(6), 633—637(杨杨, 邓雅丽, 岳凡, 陈华梅, 孙都成, 王吉德. 计算机与应用化学, 2013, 30(6), 633—637)
(Ed.: F, K, M)
Effects of Functional Groups inα-Amino Acids on Reversible Oxygenation Performance of Co(Ⅱ) Complexes†
XUE Peng1,2, WEI Yana1,3, YUE Fan1, ZHANG Yi2, WANG Jide1*
(1.KeyLaboratoryofOilandGasFineChemicals,MinistryofEducation&XinjiangUygurAutonomousRegion,CollegeofChemistryandChemicalEngineering,XinjiangUniversity,Urumqi830046,China;2.InstituteofBiosensingandSurfaceAnalysis,CollegeofChemistryandChemicalEngineering,CentralSouthUniversity,Changsha410083,China;3.PetroleumChemicalEngineeringDepartment,XinjiangCareerTechnicalCollege,Kuitun833200,China)

α-Amino acid; Co(Ⅱ) complex; Reversible oxygenation; Histidine; Oxygen carrier
10.7503/cjcu20160298
2016-04-29. 网络出版日期: 2016-09-20.
国家自然科学基金(批准号: 21162027, 21261022)资助.
O614
A
联系人简介: 王吉德, 男, 博士, 教授, 主要从事配位化学和催化研究. E-mail: awangjd@sina.cn
† Supported by the National Natural Science Foundation of China(Nos.21162027, 21261022).

