h-BN负载纳米NbH对LiBH4放氢性能的协同改性作用
屠国平, 何剑灵, 肖学章, 陈立新, 任钱江, 杜锡勇, 骆明儿
(1. 浙江大学材料科学与工程学院, 杭州 310027; 2. 绍兴市质量技术监督检测院, 绍兴 312071)
h-BN负载纳米NbH对LiBH4放氢性能的协同改性作用
屠国平1,2, 何剑灵2, 肖学章1, 陈立新1, 任钱江2, 杜锡勇2, 骆明儿2
(1. 浙江大学材料科学与工程学院, 杭州 310027; 2. 绍兴市质量技术监督检测院, 绍兴 312071)
制备了h-BN负载纳米NbH改性剂(NbH@h-BN), 并采用X射线衍射(XRD)、 X射线光电子能谱(XPS)、 透射电子显微镜(TEM)以及X射线能谱(EDS)等测试手段对其进行表征, 分析了NbH@h-BN对LiBH4放氢反应的掺杂改性作用及机理. 结果表明: 经NbH@h-BN掺杂改性后, LiBH4的放氢峰值温度和表观活化能分别降低至380 ℃和142.31 kJ/mol, 放氢动力学性能也得到大幅改善. 分析认为: NbH@h-BN具备协同改性LiBH4的放氢性能是因为NbH@h-BN可以生成稳定的粒径为5~10 nm的NbH颗粒, 并且可以避免纳米NbH在掺杂改性过程和放氢过程中发生团聚, 能够充分发挥纳米NbH和h-BN各自的改性作用.
储氢材料; 硼氢化锂; 协同效应
氢能是一种极具发展潜力的理想清洁能源, 因而其相关研究广受关注. 安全、 高效且低成本的储氢技术是目前氢能开发应用亟需解决的瓶颈技术[1]. 硼氢化锂(LiBH4)具有18.5%的质量储氢密度和121 kg H2/m3的体积储氢密度, 已成为目前高容量储氢材料研究的热点之一[2,3]. 然而, LiBH4热力学稳定性较高, 吸放氢动力学性能较差, 可逆吸氢的条件过于苛刻, 严重阻碍了其实用化进程[4].
近年来, 研究者发现多种金属氧化物和金属卤化物对LiBH4能够产生很好的去稳定化作用, 但前者的去稳定化产物是热力学稳定性高的LiMOx[5], 而后者则容易产生B2H6副产物, 导致体系不可逆性[6~8]. 添加金属/金属氢化物可以实现可逆储氢, 但其对改善放氢性能作用不明显[9,10]. 例如, 在LiBH4中添加MgH2可以改变放氢路径, 降低放氢反应焓变[11], 但主要放氢温度仍高于400 ℃, 并且由于该体系放氢生成MgB2的过程是一个非常缓慢的形核过程, 致使其动力学过程也极其缓慢[12].
本课题组研究发现氮化硼(h-BN)掺杂改性LiBH4可以大幅提高LiBH4放氢速率[13], NbCl5掺杂改性LiBH4的机理是原位生成的纳米NbH颗粒改善提高了LiBH4的储氢性能[14]. 本文制备了h-BN负载纳米NbH并将其用作改性剂, 研究了其对LiBH4的协同改性作用及机理.
1 实验部分
1.1试剂与仪器
LiBH4(纯度>95%)、 NbCl5(纯度>99.9%)和LiH(纯度>97%)购于Alfa Aesar公司; h-BN(纯度>99%)和铌粉(纯度>99.9%)购于Aladin公司; 无水四氢呋喃购于Acros Organics公司, 经单质Na进一步除水后使用.
X’Pert Pro型X射线衍射仪(荷兰PANalytical公司), CuKα辐射源,λ=0.15406 nm; ESCALAB MARK Ⅱ型能谱仪(英国VG公司), MgKα射线源 (1253.6 eV); STA449F3&Q403C差示扫描量热-质谱联动分析仪(德国Netzsch公司); Su-70型扫描电子显微镜(日本Hitachi公司); Tecnai G2 F0型透射电子显微镜(美国FEI公司).
1.2实验过程
1.2.1改性剂的制备在充有高纯氩气的手套箱内, 称取1.81 mmol NbCl5和18.1 mmol h-BN的混合物置于球磨罐中, 密封后机械球磨2 h. 然后加入9.05 mmol LiH作为还原剂, 密封后再充入4 MPa氢气, 继续球磨反应4 h后取出样品. 将样品装入反应器中密封, 加热至300 ℃, 恒温并用真空泵抽真空30 min, 然后充入4 MPa氢气并恒温30 min, 接着继续恒温抽真空30 min, 如此循环3~5次后, 样品自然缓慢冷却. 将样品分散在四氢呋喃中, 使生成的副产物LiCl溶解, 然后高速离心分离, 所得粉末固体继续加入四氢呋喃, 如此循环操作直至LiCl完全被除去. 然后在密封反应器中在80 ℃下抽真空干燥, 而后取出样品置于手套箱内备用, 记为NbH@h-BN.
称取1.81 mmol NbCl5, 9.05 mmol LiH和18.1 mmol LiCl置于球磨罐中, 采用制备NbH@h-BN的流程制备纳米NbH, 记为NbHnano.
称取2 g金属铌粉装入球磨罐后密封, 充入4 MPa氢气. 球磨反应6 h, 每隔1 h重新取下球磨罐, 手工将粘在球磨罐壁上的物料刮下, 重新充分混合, 然后继续球磨. 球磨完成后取出微米NbH样品置于手套箱内备用, 样品记为NbHmicro.
1.2.2NbH@h-BN改性剂掺杂LiBH4在手套箱内按n(LiBH4)∶n(NbH)∶n(h-BN)=1∶0.03∶0.3称取LiBH4和NbH@h-BN改性剂, 转移至球磨罐后密封, 球料比为40∶1, 然后充入 3 MPa氢气. 使用行星式球磨机在200 r/min转速下球磨制备样品, 标记为S1.
30%h-BN(摩尔分数)掺杂LiBH4(样品S2)、 3%NbHnano(摩尔分数)掺杂LiBH4(样品S3)、 3%NbHmicro(摩尔分数)掺杂LiBH4(样品S4)、 NbHmicro/h-BN复合掺杂改性LiBH4(样品S5)以及纯LiBH4(样品S0)的制备工艺参数与NbH@h-BN掺杂改性LiBH4样品的相同.
2 结果与讨论
2.1NbH@h-BN改性剂的表征
图1为不同反应时间后NbH@h-BN改性剂样品的XRD谱图. 由图1可见, 反应1 h后, NbCl5的特征衍射峰完全消失, 并出现了Nb与LiCl的特征衍射峰, 说明NbH@h-BN改性剂制备过程中NbCl5与LiH发生氧化还原反应生成Nb单质和LiCl. 反应2 h后, 测试样品的XRD谱图中开始出现NbH的特征衍射峰, 并且同时存在Nb的特征衍射峰. 反应4 h后, Nb单质相完全消失, 其XRD谱中只有h-BN和NbH的特征衍射峰.
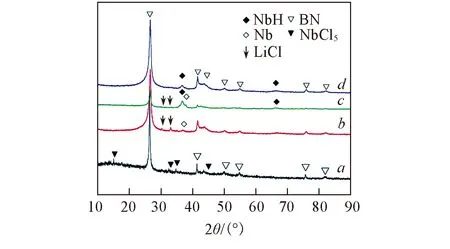
Fig.1 XRD patterns of NbH@h-BN samples during preparation Reaction time/h: a. 0; b. 1; c. 2; d. 4.
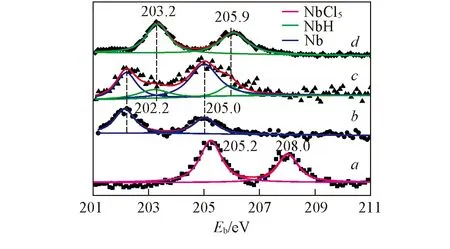
Fig.2 XPS spectra of NbH@h-BN samples during preparation Reaction time/h: a. 0; b. 1; c. 2; d. 4.
图2为NbH@h-BN制备过程中不同反应时间样品的Nb3dXPS图谱. 由图2可见, 反应起始物NbCl5的Nb3d3/2和Nb3d5/2XPS特征峰分别出现在205.2 eV和208.0 eV处. 经过1 h的球磨反应后, NbCl5的Nb3d3/2和Nb3d5/2XPS特征峰完全消失, 在202.2 eV和205.0 eV的位置出现了2个新的特征峰, 查阅文献和XPS数据库可以得出[15,16], 这2个特征峰分别对应Nb0的Nb3d3/2和Nb3d5/2XPS特征峰, 说明反应1 h后, NbCl5完全转变Nb0相. 反应进行2 h后, 从测试样品的XPS图谱中可以看到2个峰宽较大且不对称的峰. 通过分峰软件拟合分析可得202.2, 203.2, 205.0和205.9 eV的分峰. 与文献资料和XPS数据库中的数据[15,17]对比得出, 202.2和205.0 eV处的特征峰属于Nb0, 203.2和205.9 eV的特征峰对应的是NbH. 反应进行4 h后, 样品的XPS图谱则只出现了203.2和205.9 eV处的特征峰, 说明Nb单质相完全消失.
结合XRD和XPS分析结果可得出NbH@h-BN制备过程分两步进行: 首先NbCl5与LiH发生如下化学反应:
(1)
然后Nb在球磨过程中与H2反应, 进一步转变为NbH:
(2)
NbH@h-BN的TEM照片如图3所示. 由图3(A)和(B)可以看到, 原本光滑的h-BN表面[图3(C)]被均匀覆盖了粒径为5~10 nm的纳米颗粒. 在其高角环形暗场像-扫描投射电子显微镜(HAADF-STEM)照片中亦可以清楚地观测到白色亮点均匀分散在h-BN表面[图3(D)]. 对图3(D)圆圈位置的亮点进行EDX元素点分析, 结果如图3(D)插图所示. 该亮点处仅含有Nb, N和Cu元素, 其中Cu是由TEM测试所用的铜网引入的, 而N元素是来自h-BN, 因此该亮点是由Nb元素组成的, 结合XRD和XPS数据可知h-BN表面的纳米颗粒是NbH. TEM照片及EDX结果说明成功制备了负载型纳米改性剂NbH@h-BN.

Fig.3 TEM images of NbH@h-BN sample(A,B), neat h-BN(C) and HAADF-STEM image and the corresponding EDX spectrum of NbH@h-BN(D and the inset)
2.2NbH与h-BN协同改性作用对LiBH4放氢性能的影响

Fig.4 Dehydrogenation curves of samples S0, S1, S2 and S3
为了研究h-BN负载纳米NbH对LiBH4放氢性能的协同改性作用, 采用等温放氢方法测试了样品S0, S1, S2和S3的放氢动力学性能, 结果如图4所示. 由图4可见, 样品S3在20 min内可释放2.0%(质量分数)氢气; 样品S2可以释放出约4.4%(质量分数)氢气; 样品S1则可在20 min内释放12%的氢气, 大于样品S2和S3在同样时间所能释放的氢气量的和(6.4%). 说明NbH@h-BN对LiBH4放氢速率的改善效果不仅仅是NbHnano和h-BN两种改性剂单独掺杂改性效果的叠加, 而是二者协同改性LiBH4的放氢性能.
采用DSC-MS方法对比分析了样品S0, S1, S2和S3的放氢温度. 由DSC曲线[图5(A)]可见: 未进行任何掺杂改性的样品S0的放氢反应的峰值温度为464 ℃; 经NbHnano掺杂改性后, 样品S3的放氢反应的峰值温度降低到451 ℃; 经h-BN掺杂改性后, 样品S2的放氢反应的峰值温度降低至438 ℃; 而经NbH@h-BN掺杂改性后, 样品S1的放氢反应的峰值温度则降低到380 ℃. 由MS谱图[图5(B)]可见, NbH@h-BN掺杂改性后, 样品S1的放氢反应的峰值温度降低到377 ℃, 低于样品S0, S2和S3的放氢峰值温度, 结果与DSC的数据一致; 并且放氢反应过程中只有氢气释放出来, 并无NH3和B2H6等杂质气体逸出. DSC-MS分析结果同样说明NbH@h-BN掺杂改性LiBH4的效果优于NbHnano和h-BN 2种改性剂单独掺杂的效果, 具有一定的协同改性作用.

Fig.5 DSC curves(A) and MS spectra(B) of samples S0, S1, S2 and S3

Fig.6 DSC curves of samples S0(A), S1(B), S2(C) and S3(D) with different heating rates Heating rate/(K·min-1): a. 5.0; b. 7.5; c. 10.0; d. 12.5; e. 15.0.

Fig.7 Kissinger plots of different LiBH4 samplesa. Ball milled LiBH4, y=-23853x+20.7921, Ea=198.316 kJ/mol, R2=0.9890; b. LiBH4-0.03 NbHnano, y=-20645.6x+16.96, Ea=171.646 kJ/mol, R2=0.9977; c. LiBH4-0.03 h-BN, y=-18740x+14.7909, Ea=155.804 kJ/mol, R2=0.99863; d. LiBH4-0.03 NbH@h-BN, y=-17117x+14.84, Ea=142.31 kJ/mol, R2=0.99723.
为了对NbH@h-BN掺杂改性LiBH4的效果有更直观的了解, 采用Kissinge方法[18~20]分别测定了样品S0, S1, S2和S3放氢反应的表观活化能. 首先采集在不同升温速率下各个样品的DSC曲线, 如图6(A)~(D)所示, 得到测试样品放氢反应的峰值温度, 并利用Kissinger方法作图, 计算出各个样品放氢反应的表观活化能, 结果见图7. 样品S0的放氢反应表观活化能为198.31 kJ/mol, 与文献报道的数值相符[21,22]; 样品S3和S2放氢反应的表观活化能分别为171.64和155.80 kJ/mol; 样品S1放氢反应的表观活化能为142.31 kJ/mol, 远小于样品S0, S2和S3. 这说明通过掺杂NbH@h-BN可以更好地降低LiBH4放氢反应活化能垒, 进而改善体系的放氢反应动力学性能.

Fig.8 Dehydrogenation curves of samples S0(a), S1(b), S2(c), S4(d) and S5(e) at 400 ℃
2.3NbH@h-BN对LiBH4放氢性能的协同改性机理分析
为了说明h-BN与NbH协同改性作用对LiBH4放氢性能的影响, 将NbHmicro与h-BN按照同样的摩尔比及同样的掺杂方式复合掺杂至LiBH4体系中, 然后对比分析其与NbH@h-BN掺杂LiBH4体系的放氢性能. 由图8可见, 样品S0, S4和S5在30 min内分别能够释放出1.0%(质量分数)、 6.9%和7.8%(质量分数)的氢气, 样品S5的放氢量只是样品S0和S4放氢量的叠加. 而样品S1在相同条件下则可以释放12.5%氢气. 说明NbH@h-BN的改性效果优于NbHmirco和h-BN复合掺杂改性LiBH4. 结合对NbH@h-BN微观结构的分析[图3(B)], 我们认为, NbH@h-BN中的NbH以纳米颗粒形式存在是其协同改性LiBH4储氢性能的关键因素.
图9为样品S4, S3和S1放氢后的SEM照片以及各自对应的Nb元素的EDX元素面分析结果. 由图9(A)和(D)可以清楚地看到样品S4中Nb元素分布不均匀, 而且Nb是以块体的形式分散在样品体系中, 颗粒尺寸较大. 从图9(B)可以看出, 样品S3的部分Nb集中聚在一起形成尺寸约为1 μm的亮点. 即NbH是以纳米颗粒形式掺入LiBH4[NbHnano改性剂的纳米结构见图9(B)插图], 其纳米结构也不稳定, 会在掺杂过程或吸放氢反应过程中团聚, 从而降低了其掺杂改性的效果. 由图9(C)和(F)可以看出, 样品S1放氢后, Nb在样品体系中分散得很均匀, 而且没有出现大尺寸颗粒. NbH@h-BN在掺杂改性和放氢后依旧能够很好地保持纳米NbH均一稳定地分散在h-BN表面. 因此, 我们认为NbH@h-BN掺杂改性LiBH4具有显著的协同改性作用是因为NbH@h-BN可以生成稳定的粒径为5~10 nm的NbH颗粒, 并且可以避免纳米NbH在掺杂改性过程和放氢过程发生团聚, 能够充分发挥纳米NbH和h-BN各自的改性作用. 因此NbH@h-BN改性效果要优于NbHnano和h-BN 2种改性剂单独掺杂改性效果的叠加.

Fig.9 SEM images(A—C) and corresponding EDX elements map of Nb(D—F) of samples S4(A, D), S3(B, E) and S1(C, F) after dehydrogenation at 400 ℃ Inset of (A) is the TEM image of NbHmicro. Inset of (B) is the TEM image of NbHnano.
3 结 论
制备了粒径为5~20 nm的NbH均匀分散在h-BN表面的NbH@h-BN改性剂. NbH@h-BN可显著改善LiBH4的放氢动力学性能, 放氢峰值温度和表观活化能分别降低至380 ℃和142.31 kJ/mol. NbH@h-BN对LiBH4的改性效果优于NbH和h-BN分别单独改性LiBH4效果的叠加, 具有协同改性LiBH4放氢的性能. NbH@h-BN协同改性LiBH放氢性能的原因是NbH@h-BN可以生成稳定的粒径为5~10 nm NbH颗粒, 并且可以避免纳米NbH在掺杂改性过程和放氢过程中发生团聚, 能够充分发挥纳米NbH和h-BN各自的改性作用.
[ 1 ]Zhang L. N., Tao J. H., Ji K. J., Yue Q. F.,Chem.J.ChineseUniversities, 2014, 35(6), 1318—1322(张玲娜, 陶金慧, 纪开吉, 岳群峰. 高等学校化学学报, 2014, 35(6), 1318—1322)
[ 2 ]Züttel A., Borgschulte A., Orimo S.,ScriptaMater., 2007, 56, 823—828
[ 3 ]Yan Y., Remhof A., Hwang S., Li H., Mauron P., Orimo S., Züttel A.,Phys.Chem.Chem.Phys., 2012, 14, 6514—6519
[ 4 ]Vajo J., Skeith S., Mertens F.,J.Phys.Chem.B, 2005, 109, 3719—3722
[ 5 ]Yu X. B., Grant D., Walker G.,J.Phys.Chem.C, 2009, 113, 17945—17949
[ 6 ]Zhang B. J., Liu B. H.,Int.J.HydrogenEnerg., 2010, 35, 7288—7294
[ 7 ]Yuan P. P., Liu B. H., Zhu H. P., Pan W. Y., Li Z. P.,J.AlloyCompd., 2013, 557, 124—129
[ 8 ]Guo Y. H., Yu X. B., Gao L., Xia G. L., Guo Z. P., Liu H. K.,Energ.Environ.Sci., 2010, 3, 465—470
[ 9 ]Liu H., Xu F., Sun L. X., Cao Z., Zhou H. Y.,Chem.J.ChineseUniversities, 2013, 34(8), 1953—1958(刘昊, 徐芬, 孙立贤, 曹忠, 周怀营. 高等学校化学学报, 2013, 34(8), 1953—1958)
[10]Zhou Y. F., Liu Y.F, Wu W., Zhang Y., Gao M. X., Pan H. G.,J.Phys.Chem.C, 2012, 116, 1588—1595
[11]Bosenberg U., Doppiu S., Mosegaard L., Barkhordarian G., Eigen N., Borgschulte A., Jensen T. R., Cerenius Y., Gutfleisch O., Klassen T., Dornheim M., Bormann R.,ActaMater., 2007, 55, 3951—3958
[12]Boesenberg U., Kim J., Gosslar D., Eigen N., Jensen T., Colbe J. V., Zhou Y., Dahms M., Kim D., Guenther R., Cho Y., Oh K., Klassen T., Bormann R., Dornheim M.,ActaMater., 2010, 58, 3381—3389
[13]Tu G. P., Xiao X. Z., Qin T., Jiang Y. Q., Li S. Q., Ge H. W., Chen L. X.,RSCAdv., 2015, 5, 51110—51115
[14]Kou H. Q., Sang G., Zhou Y. L., Wang X. Y., Huang Z. Y., Luo W. H., Chen L. X., Xiao X. Z., Yang G. Y., Hu C. W.,Int.J.HydrogenEnerg., 2014, 39, 11675—11682
[15]Measurements, Standards and Information Services for Industry and Science, http://srdata.nist.gov/xps/Default.aspx
[16]Tu G. P., Xiao X. Z., Jiang Y. Q., Qin T., Li S. Q., Ge H. W., Wang Q. D., Chen L. X.,Int.J.HydrogenEnerg., 2015, 40, 10527—10535
[17]Gu H., Zhu Y. F., Li L. Q.,Int.J.HydrogenEnerg., 2009, 34, 7707—7713
[18]Du X. J., Li X. D., Yang R. J., Li Y. C., Pang S. P.,Chem.Res.ChineseUniversities, 2014, 30(1), 130—136
[19]Kissinger H.,Anal.Chem., 1957, 29, 1702—1706
[20]Ge Q. F.,J.Phys.Chem.A, 2004, 108, 8682—8690
[21]Shao J., Xiao X. Z., Fan X. L., Zhang L. T., Li S. Q., Ge H. W., Wang Q. D., Chen L. X.,J.Phys.Chem.C, 2014, 118, 11252—11260
[22]Ward P. A., Teprovich J. A., Peters B., Wheeler J., Compton R. N., Zidan R.,J.Phys.Chem.C, 2013, 117, 22569—22575
(Ed.: F, K, M)
Synergetic Effect of NbH@h-BN on Dehydrogenation of LiBH4†
TU Guoping1,2, HE Jianling2, XIAO Xuezhang1, CHEN Lixin1*,REN Qianjiang2, DU Xiyong2, LUO Minger2
(1.SchoolofMaterialsScienceandEngineering,ZhejiangUniversity,Hangzhou310027,China;2.ShaoxingTestingInstituteofQualityTechnicalSupervision,Shaoxing312071,China)
NbH@h-BN was prepared by mechanically milling h-BN, NbCl5and LiH, and the samples were detected by X-ray diffraction(XRD), X-ray photoelectron spectroscopy(XPS), transmission electron microscopy(TEM) and energy dispersive spectrometry(EDS). The enhancement of NbH@h-BN on the dehydrogenation of LiBH4and its mechanism were investigated. The results showed that the onset dehydroge-nation temperature and the apparent activation energy(Ea) of LiBH4were reduced to 380 ℃ and 142.31 kJ/mol respectively after the addition of NbH@h-BN, and the dehydrogenation kinetics of LiBH4was improved significantly. These remarkable results are largely attributed to the nano NbH particles which were dispersed on the surface of h-BN stably.
Hydrogen storage material; LiBH4; Synergetic effect
10.7503/cjcu20160468
2016-07-01. 网络出版日期: 2016-09-23.
国家自然科学基金(批准号: 51471151, 51571179, 51671173)资助.
O611.6; O643
A
联系人简介: 陈立新, 男, 博士, 教授, 博士生导师, 主要从事储氢材料研究. E-mail: lxchen@zju.edu.cn
† Supported by the National Natural Science Foundation of China(Nos.51471151, 51571179, 51671173).

