SPECT/CT融合显像与WB-DWI成像对骨转移瘤诊断价值比较
魏 强,邱 刚,房保栓,边艳珠,田丛娜,吴大勇
(河北省人民医院,河北 石家庄 050051)
物理诊断
SPECT/CT融合显像与WB-DWI成像对骨转移瘤诊断价值比较
魏强,邱刚,房保栓,边艳珠,田丛娜,吴大勇
(河北省人民医院,河北 石家庄 050051)
目的评价SPECT/CT融合显像与磁共振全身弥散加权成像(WB-DWI)对骨转移瘤可疑病灶诊断效能并进行比较,为可疑骨转移瘤患者选择最为适合的影像学诊断方法提供依据。方法回顾性分析35例可疑恶性肿瘤骨转移患者,于5 d内分别行平面核素骨显像及可疑转移灶部位SPECT/CT融合显像和WB-DWI显像,对所得结果行双盲法判读,判断并记录两种显像结果中可疑骨转移灶数量、位置并逐一对比分析。以活检病理、综合多种影像学检查或随访至少6个月以上作为最终确诊依据。计算两种显像方法在诊断骨转移病灶的敏感度、特异性、准确度和ROC曲线下面积,并对2种检查方法在骨转移瘤诊断中的价值是否存在统计学差异进行比较。结果SPECT/CT融合显像对35例可疑骨转移瘤患者105处可疑骨转移灶诊断的敏感度、特异性、准确率、Kappa值及ROC曲线下面积分别为92.13%,68.75%,88.57%,0.579,0.804。WB-DWI显像诊断骨转移瘤的敏感度、特异性、准确率、Kappa值及ROC曲线下面积分别为83.15%,81.25%,86.67%,0.492,0.822。经卡方检验,2种影像学检查方法对骨转移瘤的检出率相比差异无统计学意义(P>0.05)。结论SPECT/CT融合显像与WB-DWI显像对骨转移瘤的诊断效能相似,可根据患者病情及就诊条件酌情选择最适宜的检查方法。
体层摄影术;发射型计算机;单光子;骨肿瘤;弥散加权成像;放射性核素显像
骨骼是恶性肿瘤常见转移部位,有研究统计所有恶性肿瘤中约80%最终会发生骨转移,其中尤以乳腺癌、肺癌、前列腺癌及消化道肿瘤最为多见。随着肿瘤综合治疗技术的发展和水平的提高,患者生存期延长,骨转移瘤的发生率也随之增加,严重影响了晚期癌症患者的生活质量及预后[1]。因此早期发现和确定骨转移瘤发生部位及数量对患者治疗方案制定及预后评估均具有重要意义[2]。核素全身骨显像一直被公认为早期诊断骨转移瘤的传统检查项目,具有操作简单、全身扫描等特点。其具有很高的灵敏度,但特异性较低。随着配备有诊断级螺旋CT的单电子发射断层成像(SPECT)/CT出现及广泛应用,在全身骨显像发现可疑骨转移灶的同时可以进行单电子发射断层成像(SPECT)和同机螺旋CT扫描,并将SPECT的功能影像与CT的解剖影像进行同机融合,大大提高了骨转移瘤诊断的特异性[3-4]。磁共振全身弥散加权成像(WB-DWI)是新兴磁共振成像技术,它可一次性完成全身体部扫描,所得图像与正电子发射计算机断层显像(PET)相似,因此又被称为类PET成像技术。其图像中病灶组织与正常组织对比明显,对于诊断有疑问的病灶可同机行常规MR扫描以鉴别诊断,它可用于肿瘤良恶性鉴别、寻找肿瘤原发灶与转移灶、肿瘤临床病理分期(TNM)等,具有无辐射、操作简便、全身大范围显像等特点[5-7]。本研究将两种较新的成像方法加以比较,以探讨两种影像技术在骨转移瘤诊断中的应用价值。
1 临床资料
1.1一般资料选取2013年6月—2014年6月在河北省人民医院就诊的35例可疑恶性肿瘤骨转移患者,其中32例为经病理证实恶性肿瘤患者(乳癌10例,肺癌12例,结肠癌2例,前列腺癌6例,黑色素瘤2例),另有3例患者未经病理证实而依靠临床症状及影像检查诊断为肿瘤。35例患者中男21例,女14例;年龄(53±12)岁。患者均无MR及SPECT/CT核素检查禁忌证且同意并签署知情同意书,于5 d内分别接受SPECT/CT融合显像及WB-DWI成像,平均时间间隔为3.7 d。
1.2检查方法
1.2.1SPECT/CT融合显像采用美国GE公司Discovery NM/CT 670双探头SPECT/CT。亚甲基二磷酸盐由北京师宏药物研制中心提供,钼锝发生器由北京原子高科提供,自行标记99Tcm-MDP,要求放化纯>95%。静脉注射99Tcm-MDP 740~925 MBq后间断饮水约500 mL,2~3 h后开始显像。检查前嘱患者尽量排空膀胱,采用低能高分辨准直器,图像矩阵1 024×1 024,取平卧位进行常规全身前位和后位平面连续扫描,显像速度为15~20 cm/min,再对可疑骨转移灶部位行SPECT/CT断层融合显像。能峰:140 kEV,窗宽20%,矩阵128×128,放大1倍,6度/STEP,10 s/帧。CT扫描球管电压120 kV,球管电流80 mAs,层厚5.62 mm,层间距3.75 mm。断层采集时患者平静呼吸,CT采集时患者自然屏气采集。并于Xeleris工作站中将两种图像融合显示。
1.2.2全身弥散加权成像(WB-DWI)使用GE超导型3.0T磁共振显像仪(GE Medical Systems,Signa ExciteTM,HD),采用内置一体化体线圈发射和接收信号。所有患者采取仰卧位,采集过程中制动、平静自由呼吸,行6~7段显像,每段采集26层,范围大约从颅顶到小腿水平。采用STIR-EPI序列进行轴面DWI显像,参数为:TE 62.5 ms,TR 6 000 ms,TI 220 ms,FOV 38 cm×38 cm,层厚8 mm,无间隔显像,矩阵96×96,NEX3次,b值为800 mm2/s。每段显像时间150 s,总的显像时间约30 min。使用连接(bind)技术将所有轴面图像进行连接,后行三维重建得到最大信号投影(MIP)图像,行黑白反转得到最终三维类PET图像。对于难以明确诊断的病灶行同机常规MR扫描(包括T1WI、T2WI、DWI或FLAIR序列等)。
1.3影像分析由有经验的2名影像医师和2名核医学医师分别独立对WB-DWI图像及SPECT/CT融合图像进行判读。对同一病例2名医师诊断有分歧时以讨论协商结果为准。WB-DWI图像中骨骼系统每处结节样异常高信号影计为1处可疑骨转移灶,必要时结合常规MR序列进行诊断。SPECT/CT融合显像中所有核素平面骨显像中异常放射性浓聚或稀疏影均进行SPECT/CT融合显像,以同机诊断CT为依据鉴别骨转移瘤及骨良性病变,最终确定可疑骨转移灶数量及位置。因WB-DWI成像范围限制,仅对两种检查中颅顶到小腿(不包括双上肢)显像范围内可疑骨转移灶进行统计分析。本研究中骨转移瘤诊断“金标准”为符合以下条件中1项及以上:①经手术或穿刺病理学证实为骨转移瘤;②结合PET/CT、常规MRI及高分辨CT等多种影像学检查结果综合诊断骨转移瘤;③对无病理学结果且多种影像学检查仍难以判断的骨病灶采用放化疗疗效反应判断,或随访3个月后复查以明确诊断。
1.4统计学方法采用SPSS 17.0统计软件,对35例患者所有可疑骨转移灶进行统计分析,分别计算WB-DWI成像及SPECT/CT融合显像的灵敏度、特异度、准确率、阳性预测值、阴性预测值。以Kappa值及ROC曲线下面积来比较两种影像学方法对骨转移瘤诊断效能有无差异,曲线下面积(area under curve,AUC)>0.5表示具有诊断效能,越接近1表示诊断效能越高。P<0.05表示两者差异有统计学意义。
2 结 果
2.1WB-DWI及SPECT/CT两种显像方法可疑骨转移灶检出情况35例患者共105处可疑骨转移灶,以本文所述骨转移瘤诊断“参考标准”为依据确诊骨转移瘤89处(其中5处经病理证实,7处经随访证实,77处经多种影像综合诊断证实);其余16处诊断为良性骨病灶。WB-DWI成像发现可疑骨转移灶90处,经医师判读诊断骨转移瘤77处,骨良性病变13处。SPECT/CT融合显像发现可疑骨转移灶98处,经医师判读诊断骨转移瘤87处,骨良性病变11处。见表1及表2。
2.2WB-DWI及SPECT/CT两种显像方法对可疑骨转移瘤诊断效能WB-DWI成像和SPECT/CT融合显像对骨转移瘤诊断的灵敏度、特异度、准确率、阳性预测值、阴性预测值及Kappa值见表3。为了评价WB-DWI成像与SPECT/CT融合显像对骨转移瘤病灶的诊断效能绘制ROC曲线。见图1。分析结果显示,WB-DWI成像的AUC=0.822[95%CI(0.702,0.942),P<0.001]和SPECT/CT融合显像的AUC=0.804[95%CI(0.664,0.945),P<0.001]均具有较好的诊断效能。与“参考标准”比较,WB-DWI成像的Kappa值为0.492(P<0.05);SPECT/CT融合显像的Kappa值为0.579(P<0.05)。AUC及Kappa值在两者之间无明显差异(P>0.05)。
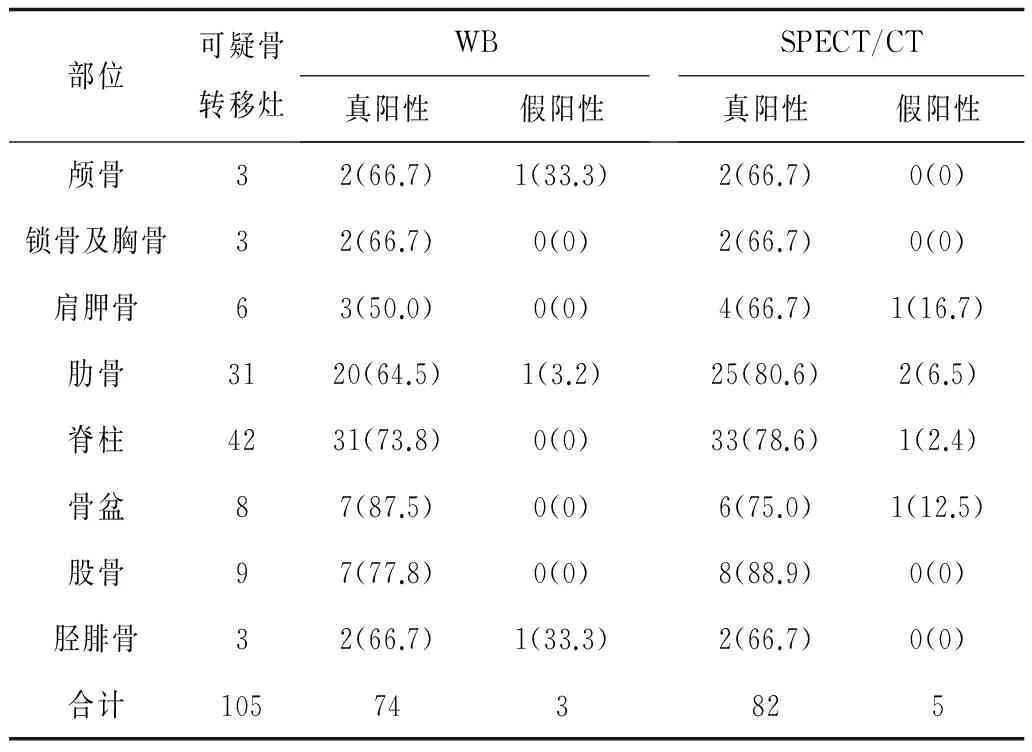
表1 2种显像方法检出不同部位可疑骨转移灶比较 处(%)

表2 2种显像方法诊断结果与金标准比较 处
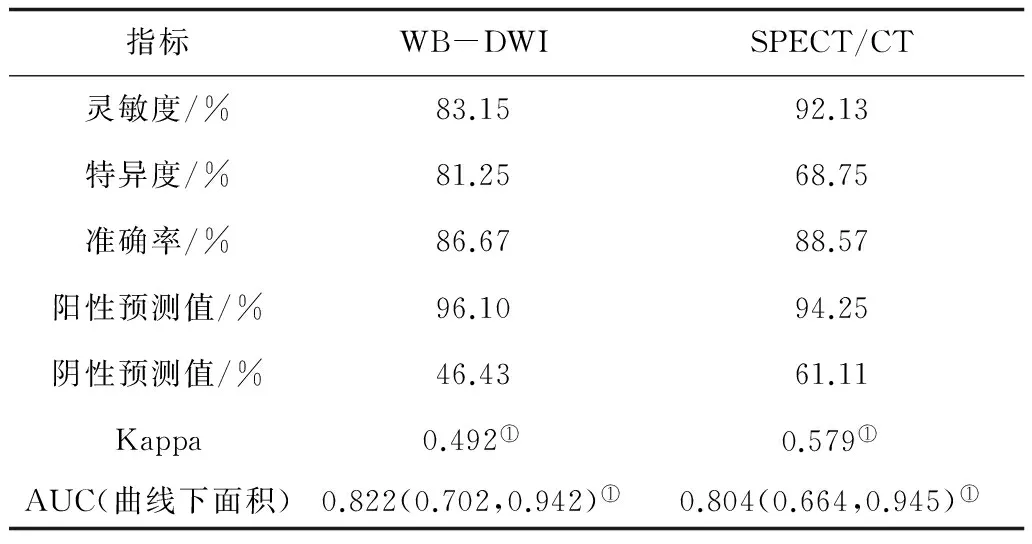
表3 2种显像方法对105处可疑骨转移瘤诊断效能对照
注:①与金标准比较,P<0.001。
3 讨 论
99Tcm-MDP核素全身骨显像是临床筛查骨转移瘤的首选影像检查方法,其优势是操作简便、全身成像。核素全身骨显像不但可显示骨转移瘤病灶,同时还可显示各种影响局部骨血流量及骨盐代谢的良性骨病变,如:骨退行性变、骨创伤、骨感染性疾病等。其诊断敏感性较高但特异性较低[8]。随着配备16层甚至更高扫描层数CT的SPECT/CT设备应用,在核素全身骨显像发现可疑骨转移灶后可同机行SPECT/CT融合显像,弥补了平面显像组织重叠、定位困难、生理性摄取干扰等多种不足,大大提高了核素骨显像的特异度及准确率[9]。本研究中有29例患者35处可疑骨转移灶依靠同机高分辨率CT影像鉴别定性,其中包括16处良性骨病灶(退行性改变9处,外伤或术后损伤7处)。另有11处平面核素骨扫描未显示或显示不清的溶骨性病变经SPECT/CT融合显像检出。刘雪辉等[10]对64例肿瘤患者96处可疑骨转移灶进行分析研究,获得SPECT/CT融合显像灵敏度、特异度、准确率分别为93.1%,86.8%和90.6%。本研究中35例患者105处可疑骨转移灶的SPECT/CT融合显像的灵敏度、特异度、准确率分别为92.13%,68.75%和88.57%,与上述报道相近。
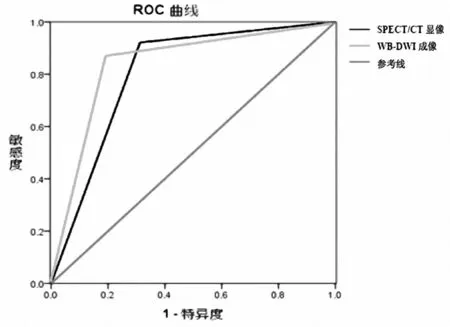
图1 2种显像方法对105处可疑骨转移瘤病灶诊断效能工作特征曲线
WB-DWI成像通过检测活体细胞内水分子布朗运动受限信息,来反映组织微观结构的细微变化,它可同时显示骨骼、软组织及淋巴结等器官的水分子弥散信息,从而诊断是否存在肿瘤转移。因此它不仅能显示骨转移瘤病灶,还能显示软组织及淋巴结的受累。该检查无辐射,探测骨转移灶的同时还可对软组织病变进行显像,可较好地对肿瘤患者进行临床分期。但因该检查受空间分辨率和扫描范围FOV的限制,部分较小病灶及四肢远端病变无法显示。其图像易受颅脑、胃肠道生理信号的干扰,导致诊断准确性降低[11-12]。既往国内外多个研究将核素全身骨平面显像与WB-DWI成像进行对比研究,认为两者对骨转移瘤诊断灵敏度无明显差异,WB-DWI成像的诊断特异性明显优于核素全身骨平面显像[13-14]。但对于配备诊断级CT的SPECT/CT融合显像与WB-DWI成像对骨转移瘤诊断效能比较研究尚未见报道。
本研究结果显示SPECT/CT融合显像可大大提高单纯核素全身骨平面显像的诊断特异度和准确率。SPECT/CT融合显像与WB-DWI成像对骨转移瘤诊断的Kappa值和ROC曲线下面积经统计差异无统计学意义,因此认为两种显像均对骨转移瘤具有较高诊断价值。WB-DWI成像检出脊柱、盆骨及股骨区域可疑骨转移灶稍多,可能原因为上述区域骨髓含量较易发生骨转移瘤[15]。对于可疑病灶同机进行常规MR扫描序列检查,从而进一步提高WB-DWI成像诊断骨转移瘤的特异度和准确率[16]。SPECT/CT融合显像对于颅骨、肋骨及肩胛骨区域骨转移灶有较好显示,可能原因为上述区域骨髓含量较少,肿瘤易侵犯骨皮质,且上述区域易因外伤而造成骨皮质不连续有关。SPECT/CT显像设备中的诊断级螺旋CT图像对于核素骨平面显像难以鉴别的骨创伤及骨退行性病变具有较好显示,对于扫描范围内的一些软组织病变及淋巴结转移也可部分显示(未纳入本研究数据)。WB-DWI成像亦可对软组织病变及淋巴结转移灶有较好显像,其扫描范围较SPECT/CT融合显像更广,因此与SPECT/CT显像相比更有利于患者查找原发灶、病程分期、指导治疗和进行疗效随访。
本研究通过对所有105处可疑骨转移灶统计比较得知,两种显像方法的骨转移瘤检出率比较差异无统计学意义。SPECT/CT融合显像具有扫描速度快、费用低廉、应用范围广泛等优点,但其因诊断级CT所带来的患者受照辐射剂量增加问题需在临床使用中引起注意,对于婴幼儿及孕妇需结合病情权衡利弊是否行此检查。WB-DWI成像具有无辐射危害、扫描范围广、图像诊断信息丰富等优点,但其成像时间较长,易受患者体位移动影响,内置金属异物患者无法行此检查。另外WB-DWI成像技术对磁共振扫描仪磁场强度要求较高,因此设备昂贵普及率不高,也限制其在临床中的应用推广。两种显像方法在骨转移瘤的诊断中相辅相成、互为补充,需临床医师结合患者病情及医院设备配置选择最为适合的骨转移瘤检查方法。
[1]Coleman RE. Clinical features of metastatic bone disease and risk of skeletal morbidity[J]. Clin Cancer Res,2010,12(20 Pt 2):6243s-6249s
[2]刘双鲁,于庆巍,左建林. 靶向给药体系在骨转移瘤中的研究进展[J]. 国际免疫学杂志,2015,38(3):303-305
[3]Palmedo H,Marx C,Ebert A,et al. Whole-body SPECT/CT for bone scintigraphy: diagnostic value and effect on patient management in oncological patients[J]. Eur Med Imaging,2014,41(1):59-67
[4]李德志,赵新明,张敬勉,等. 全身骨显像联合CT扫描对骨良恶性病变鉴别诊断的价值[J]. 中国全科医学,2011,14(33):3884-3886
[5]胡佳寿,田洪梓,孙金凤,等. 磁共振全身弥散加权成像在体部肿瘤筛查中的应用[J]. 中国医学影像学杂志,2011,19(9):695-699
[6]Ording Mailer LS,Avenarius D,Olsen OE. High signal in bone marrow at diffusion-weighted imaging with body background suppression(DWIBS) in healthy children[J]. Pediatr Radiol,2011,41(2):221-226
[7]杨宏志,郑玄中,杜笑松,等. MR弥散加权成像对脊柱转移瘤的诊断价值[J]. 实用放射学杂志,2011,27(2):250-254
[8]洪理伟,沈浩霖,林丽卿,等. 全身骨显像联合超声检查在肺癌骨转移诊断中的价值[J]. 福建医药杂志,2014,36(1):102-104
[9]刘雪辉,李洪均,于鸿煦,等. SPECT/CT显像诊断脊柱单发转移瘤效能分析及有效辐射剂量评估[J]. 山东医药,2015,55(10):7-10
[10] 刘雪辉,李洪均,于鸿煦,等. SPECT/CT融合显像对可疑骨转移灶的诊断效能[J]. 国际放射医学杂志,2015,39(3):201-204
[11] 刘帅,赵卫东,陈鹏,等. MR全身弥散扫描在多发性骨肿瘤性病变中的应用研究[J]. 中国临床医学影像杂志,2011,22(11):790-793
[12] Tarnoki DL,Tarnoki AD,Richter A,et al. Clinical value of whole-body magnetic resonance imaging in health screening of general adult population[J]. Radiol Oncol,2015,49(1):10-16
[13] 刘苑红. 全身弥散加权成像与核素骨扫描对骨转移瘤诊断价值的对比研究[J]. 吉林医学,2014,35(6):1169
[14] 孙梦恬,程敬亮,张勇,等. 比较背景抑制全身弥散加权成像与SPECT对骨转移瘤的诊断价值[J]. 中国医学影像技术,2013,29(9):1500-1504
[15] 魏来,赵泽华,陈克敏,等. 3.0T磁共振全身弥散成像技术的初步应用[J]. 医学信息,2014,27(6):180
[16] 刘辉,闫呈新,李长勤. WB-DWI联合常规CT/MRI在恶性肿瘤全身转移中的应用价值[J]. 中国CT和MRI杂志,2015,13(2):90-94
河北省卫生厅2009年度青年科技课题(20090232)
10.3969/j.issn.1008-8849.2016.30.034
R738.1
B
1008-8849(2016)30-3401-04
2016-05-10

