上海市动物源性大肠杆菌的分离鉴定和 药敏试验
宁 昆,沈莉萍,王晓旭,徐 锋, 张维谊
(上海市动物疫病预防控制中心,上海 201103)
上海市动物源性大肠杆菌的分离鉴定和 药敏试验
宁 昆,沈莉萍,王晓旭,徐 锋, 张维谊
(上海市动物疫病预防控制中心,上海201103)
为掌握上海市动物源性大肠杆菌的耐药情况及耐药规律,对2013—2015年在门诊畜禽中分离到的大肠杆菌进行药敏试验。共分离到236株大肠杆菌,其中猪源164株、禽源72株。选用15种抗生素,采用CLSI推荐的微量肉汤稀释法,对大肠杆菌进行药物敏感试验。结果表明,无论是猪源大肠杆菌,还是禽源大肠杆菌,对大多数抗生素的耐药程度均较高。其中,对磺胺异噁唑、复方新诺明、恩诺沙星和大观霉素等抗生素的耐药情况较为严重;对丁胺卡那霉素和阿莫西林/棒酸2种抗生素较为敏感,耐药率低于20%。从耐药谱型来看,猪源大肠杆菌较禽源大肠杆菌具有更加复杂的耐药谱型。
大肠杆菌;分离鉴定;药敏试验;耐药性
抗生素是一类对细菌、寄生虫等具有抑制和杀灭作用的药物,在畜牧饲料行业中已得到广泛应用,在动物疫病防治、提高饲料转化效率、促进畜禽生长方面发挥了重要作用。在我国,由于养殖密度大、畜禽疫病复杂、政府监管力度不够等多种原因,抗生素滥用现象较为严重,伴随而来的耐药问题也越来越严重,给养殖业的持续健康发展埋下了隐患。大肠杆菌病是养殖业中最为常见的一种细菌性疾病。在实际养殖过程中,由于畜主对药物的滥用,使得许多常用抗菌药物的药效下降甚至无效,给畜禽养殖业造成了严重的经济损失[1]。
动物养殖过程中滥用抗生素所带来的影响最终是会通过各种途径“转嫁到”人身上,从而加剧抗生素耐药性问题,影响人类的健康。因此,对畜禽大肠杆菌进行耐药性监测,掌握大肠杆菌耐药规律及变化情况,对指导临床合理用药,减少养殖户经济损失具有重要意义。
本实验对上海市的畜禽大肠杆菌进行了细菌的分离培养和生化鉴定,并对分离株进行了药物敏感试验,讨论了大肠杆菌在上海市的耐药情况,为指导养殖户临床合理用药提供了参考。
1 材料
1.1病料及标准株
病料(心、肝、脾、肺和肾脏)来自2013—2015年上海市动物疫病预防控制中心畜禽门诊接收的发病畜禽。大肠杆菌标准株(ATCC25922)由上海市兽药饲料检测所馈赠。
1.2主要试剂与仪器
革兰氏染色液,购自珠海贝索生物技术有限公司;营养琼脂、麦康凯琼脂、伊红美兰琼脂和哥伦比亚琼脂,购自北京陆桥技术有限责任公司;无菌羊血,购自上海市闵行区诸翟无菌动物血试剂供应站;比浊仪、API 20E和VITEK 2,购自法国梅里埃公司;药敏板,购自天津金章科技发展有限公司,其含15种抗菌药物标准物质:氧氟沙星(OFL)、恩诺沙星(ENR)、阿莫西林(AMX)、庆大霉素(GEN)、多西环素(DOX)、头孢噻呋(EFT)、磺胺异噁唑(SF)、氨苄西林(AMP)、大观霉素(STP)、卡那霉素(KAN)、环丙沙星(CIP)、丁胺卡那霉素(AMK)、氟苯尼考(FFC)、复方新诺明(CO-SMZ)和阿莫西林/棒酸(AMC)。
2 方法
2.1细菌的分离培养及鉴定
2.1.1初次分离培养。无菌采集畜禽的心、肝、脾、肺和肾脏,分别接种于巧克力琼脂平板、麦康凯琼脂平板和伊红美兰琼脂平板,37 ℃培养24 h。
2.1.2形态学观察、镜检。观察菌落生长情况,在麦康凯琼脂平板上挑取红色菌落,在伊红美兰琼脂平板上挑取黑色带金属光泽菌落,进行染色、镜检。
2.1.3纯培养及生化鉴定。将可疑菌落划线接种于营养琼脂,应用API 20E和VITEK 2鉴定系统对细菌进行鉴定。
2.2药敏试验
2.2.1菌液制备。用灭菌棉签取适量待测菌,悬浮于3 mL 0.45% NaCl溶液中,用比浊仪调整菌液的浓度,使其麦氏单位达到0.48~0.52;同时用ATCC 25922作为试验质控菌株。
2.2.2菌液接种。首先从12 mL肉汤管中吸取100 μL加到空白对照孔,然后吸取待测菌液100 μL到剩余的12 mL肉汤管中,混匀,加100 μL到其余各孔。质控菌株操作同待测菌。
2.2.3孵育。将药敏板置于垫有湿纱布的瓷方盘内,36 ℃温箱孵育16~18 h。
2.2.4结果观察。在衬有黑底板的光线下观察,无细菌生长的孔内所含的最低抗菌药物浓度即为最低抑菌浓度(MIC)。其中,对磺胺药的终点判定,其与阳性生长对照,抑制80%细菌生长的药物浓度即为最低抑菌浓度(MIC)。结果判定及质量控制参照CLSI标准。
3 结果
3.1细菌分离鉴定
从2013—2015年门诊畜禽中共分离到大肠杆菌236株,其中猪源164株、禽源72株。大肠杆菌在巧克力琼脂平板上生长成圆形、凸起、湿润、光滑、半透明、灰白色、直径约2~3 mm的菌落;在麦康凯琼脂上形成红色菌落;在伊红美蓝琼脂上形成黑色带金属光泽菌落。在光学显微镜下,大肠杆菌呈短杆状,革兰氏染色阴性。经API 20E和VITEK 2 COMPACT鉴定系统确认为大肠杆菌。
3.2药敏试验
3.2.1耐药情况。本次试验,质控菌株及空白对照均成立,其余待测菌试验结果见表1。164株猪源大肠杆菌对磺胺异噁唑、多西环素、氧氟沙星及头孢噻呋等12种药物的耐药率达到了50%以上,其中对磺胺异噁唑等5种药物的耐药率甚至达到了90%以上;对丁胺卡那霉素和阿莫西林/棒酸的耐药率较低,分别为13.4%和6.1%。72株禽源大肠杆菌的耐药情况与猪源大肠杆菌相似,对磺胺异噁唑、复方新诺明、恩诺沙星及大观霉素等12种药物的耐药率达到了50%以上,其中对磺胺异噁唑、复方新诺明2种药物的耐药率达到了90%以上;对头孢噻呋、丁胺卡那霉素和阿莫西林/棒酸的耐药率在50%以下,分别为41.7%、8.3%和4.2%(表1)。
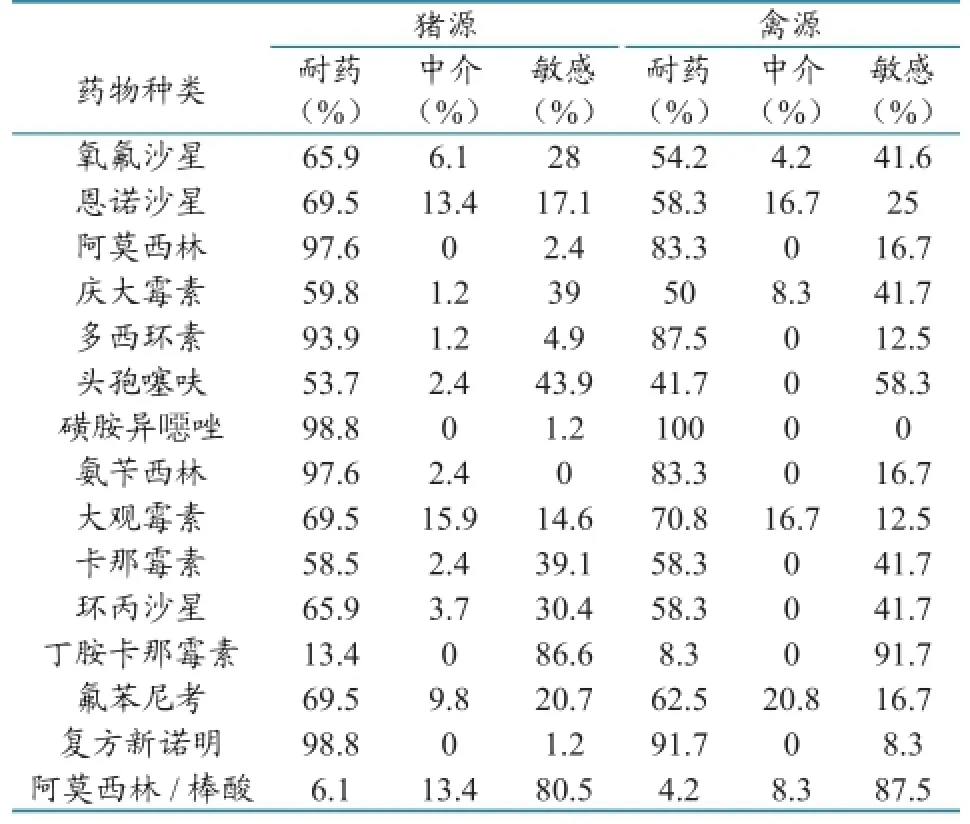
表1 猪源、禽源大肠杆菌耐药情况
3.2.2多重耐药情况和耐药谱。164株猪源大肠杆菌,均耐4种药物以上。其中,耐4~6种的有12株,占总数的7.3%;耐7~9种的有38株,占总数的23.2%;耐10~12种的有84株,占总数的51.2%;耐13~15种的有30株,占总数的18.3%;耐10种以上的占到了69.5%。72株禽源大肠杆菌中,耐3种药物以下的有6株,占总数的8.3%;耐4~6种的有15株,占总数的20.8%;耐7~9种的有15株,占总数的20.8% ;耐10~12种的有18株,占总数的25%;耐13种以上的有18株,占总数的25%。该结果说明分离菌株多重耐药情况十分严重。从耐药谱型来看,猪源大肠杆菌的耐药谱型明显多于禽源大肠杆菌,共有51种。猪源、禽源大肠杆菌主要耐药谱详见表2。
3.2.3不同来源菌株耐药比较。猪源、禽源大肠杆菌对药物的敏感性见图1。整体而言,禽源大肠杆菌对除磺胺异噁唑和大观霉素之外的13种抗菌药物的敏感性强于猪源大肠菌群。比如,禽源大肠杆菌和猪源大肠杆菌对阿莫西林的敏感性分别为16.7%和2.4%,对氨苄西林的敏感性分别为16.7%和0。两种不同来源的分离菌株对其它抗菌药物的敏感性没有显著差别。

表2 猪源、禽源大肠杆菌的主要耐药谱型
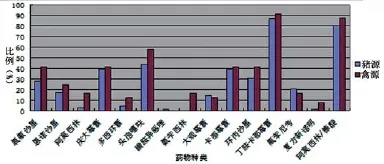
图1 猪源和禽源大肠杆菌对药物的敏感性对比
4 讨论
4.1大肠杆菌的分离鉴定
本研究中的大肠杆菌是从畜禽门诊送检的发病畜禽体内分离得到的。由于动物疾病种类复杂多样,很多缺乏典型症状,因此在接种病料时选择了巧克力琼脂平板、麦康凯及伊红美蓝琼脂平板。目的是在保证不漏检其它细菌的同时,增加对大肠杆菌的分离率。在大肠杆菌鉴定中,使用了商品化的微生物鉴定系统API 20E和VITEK 2,相较于传统生化鉴定的耗时、繁琐,此方法方便快捷,同时准确率也有保证,可大大提高细菌的鉴定效率。
4.2大肠杆菌的耐药性
对分离到的236株大肠杆菌(猪源164株、禽源72株),使用15种抗生素进行药敏试验。试验结果表明,大肠杆菌对其中12种抗生素有不同程度的耐药;对磺胺类、青霉素类和四环素类抗生素耐药率极高,达到80%以上,有些甚至达到95%以上。整体来看,猪源和禽源大肠杆菌的耐药性无明显差异,仅在个别药物上有所区别。从耐药谱型看,猪源大肠杆菌耐药谱型明显多于禽源大肠杆菌,推测与猪场临床用药更加不规范有关,还有待进一步研究。此外,大肠杆菌的多重耐药性十分严重,一半以上的细菌都耐10种以上药物。这可能与临床上药物种类繁多、药物滥用及大剂量使用有关。有研究表明,养殖场中多重耐药的大肠杆菌在动物、环境和人体之间存在传递、扩散现象,具有潜在的公共卫生隐患。因此建议在临床上使用抗生素时,要采用联合用药和交替用药,必要时做药敏试验。根据结果合理选择抗菌药物,严格控制药物剂量,避免细菌耐药性的加重和蔓延[2]。
据文献报道,在某地区畜禽大肠杆菌的药敏分析中,丁胺卡那霉素耐药率达到60%以上。在本研究中,该药物的耐药率在20%以下,说明大肠杆菌在不同地区的耐药性差异较大,所以在临床应用时,切勿乱用药,要因地制宜[1]。依据研究结果,在上海市治疗大肠杆菌病时,建议使用阿莫西林/棒酸和丁胺卡那霉素,可提高疾病的治愈率。
4.3大肠杆菌耐药性的控制策略
抗生素在防治畜禽疾病方面发挥了较大作用,但伴随而来的耐药问题及公共卫生问题也日益严重。加强对细菌耐药性的监测、管理和技术支持,对细菌耐药性的控制具有重要意义。首先是监测方面。应建立健全监测网络,提高监测水平和监测质量,保证及时、完整、准确地获得细菌耐药性数据,用监测结果指导养殖户更加科学合理地使用抗生素[3]。其次是管理方面。要控制和管理制药企业在畜牧养殖业中的不合理销售及竞争行为,同时对基层兽医从业人员进行有效监管,加强教育培训,提高其理论知识,防止抗生素滥用、乱用。最后是技术层面。临床上可以使用一些中草药,以减少抗生素的使用。例如:金银花对耐青霉素的金黄色葡萄球菌有增敏作用,在低于抗菌浓度时还能增强白细胞的吞噬能力,对青霉素抗菌有增效作用;葛根芪连汤与氨苄青霉素配伍均有协同作用。同时也可以探索新的抗菌治疗方法,来应对细菌耐药性问题,如抗生素的轮流替用和联合用药。
[1] 江飙,董嘉文,张献杰,等. 广东地区动物源性大肠杆菌的分离及药敏分析[J].中国兽药杂志,2009,43(1):14-16.
[2] 马全朝,顾欣,张可煜,等. 上海市鸡源大肠杆菌分离鉴定及药敏分析[J].中国家禽, 2009,31(17):11-13.
[3] 刘海林,武新国. 大肠杆菌的药敏试验报告[J].当代畜牧,2014(11):70-71.
(责任编辑:朱迪国)
Isolation,Identifi cation and Antimicrobial Susceptibility Test to Escherichia coli of Animal Origin in Shanghai City
Ning kun,Shen Liping,Wang Xiaoxu,Xu Feng,Zhang Weiyi
(Shanghai Animal Disease Control Center,Shanghai 201103)
In order to investigate the antibiotic resistance of Escherichia coli of animal origin in Shanghai city,antimicrobial susceptibility test of 236 E.coli isolates from animal clinics to 15 antimicrobial agents was surveyed. Among them,164 strains were identified as swine origin,72 strains were identified as avian origin. Broth microdilution method according to the recommendation of the CLSI was used. The results showed that both E. coli from swine and avian showed antibiotic resistance to most antimicrobial agents. E.coli strains were highly resistant to sulfi soxazole,sulfamethoxazole,enrofl oxacin and spectinomycin,etc. Lower antibiotic resistance rate( ≤20%)against amikacin and amoxicillin or clavulanate was showed. In addition,E.coli from swine had a more complex type of drug resistance spectrum than E.coli from avian.
E.coli;isolation and identifi cation;antimicrobial susceptibility test;antibiotic resistance
S852.61
B
1005-944X(2016)09-0023-04
10.3969/j.issn.1005-944X.2016.09.008
上海地区主要动物病原微生物种质资源保存利用(沪农科攻字〔2014〕第7-3-3号)
张维谊

