泛素连接酶Cbl⁃b在黑素瘤组织和细胞系A375、M14、MV3中的表达及意义
王小坡 温斯健 粟倩雅 宋昊 倪娜娜 姜祎群 陈浩 孙建方
210042南京,中国医学科学院 北京协和医学院 皮肤病研究所病理科(王小坡、温斯健、宋昊、倪娜娜、姜祎群、陈浩、孙建方),激光科(粟倩雅),江苏省皮肤病性病分子生物学重点实验室(倪娜娜)
泛素连接酶Cbl⁃b在黑素瘤组织和细胞系A375、M14、MV3中的表达及意义
王小坡 温斯健 粟倩雅 宋昊 倪娜娜 姜祎群 陈浩 孙建方
210042南京,中国医学科学院 北京协和医学院 皮肤病研究所病理科(王小坡、温斯健、宋昊、倪娜娜、姜祎群、陈浩、孙建方),激光科(粟倩雅),江苏省皮肤病性病分子生物学重点实验室(倪娜娜)
目的探讨泛素连接酶Cbl⁃b在皮肤黑素瘤组织及黑素瘤细胞系A375、M14、MV3中的表达及意义。方法收集69份黑素瘤、30份色素痣组织,采用免疫组化法检测Cbl⁃b蛋白表达水平。实时荧光定量PCR、免疫印迹法分别检测黑素瘤细胞系A375、M14、MV3及黑素细胞中Cbl⁃b mRNA及蛋白表达水平。结果69份皮肤黑素瘤标本中,52份(75.36%)表达Cbl⁃b;30份色素痣标本中,4份(13.33%)表达Cbl⁃b,两组Cbl⁃b蛋白表达水平差异有统计学意义(χ2=32.745,P<0.01)。黑素瘤组织中Cbl⁃b表达水平与肿瘤进展程度、Clark分级和Breslow厚度均呈正相关(rs分别为0.569、0.654、0.727,均P< 0.01)。实时荧光定量PCR显示,A375、M14、MV3细胞Cbl⁃b mRNA表达差异有统计学意义(F=176.537,P< 0.01)。免疫印迹法显示,A375细胞Cbl⁃b蛋白表达水平最高,黑素细胞最低。结论Cbl⁃b蛋白在皮肤黑素瘤组织及其细胞株中均高表达。
泛素蛋白连接酶类;黑色素瘤;黑素细胞;肿瘤侵润;肿瘤分级;Cbl⁃b
皮肤恶性黑素瘤(cutaneous malignant melanoma,CMM)起源于黑素细胞,具有高度侵袭及致死率。尽管原位黑素瘤通过早期手术切除可完全治愈,但转移性黑素瘤预后差,平均生存时间仅6~8个月[1]。随着黑素瘤分子生物学机制的研究进展,分子靶向治疗对提高黑素瘤无进展期生存提供了希望[2]。Cbl(casitas B⁃lineage lymphoma)⁃b 属于泛素连接酶Cbl家族。研究表明,Cbl⁃b可作为泛素连接酶或连接蛋白调控各种细胞内信号转导,参与肿瘤发病过程,因此可作为分子靶向治疗的有效靶点之一[3⁃5]。未探讨Cbl⁃b是否参与CMM发生发展过程,我们采用免疫组化检测Cbl⁃b在黑素瘤组织及色素痣中表达,并分析Cbl⁃b表达与黑素瘤临床病理特征相关性。同时利用实时荧光定量PCR和免疫印迹检测黑素瘤细胞系及正常黑素细胞中Cbl⁃b表达。
材料与方法
一、标本来源
CMM和色素痣石蜡标本均来自2014年1月至2015年12月在中国医学科学院皮肤病医院病理科,其中CMM 69例,色素痣30例,所有标本均经临床、组织病理或免疫病理证实诊断。69例CMM中肢端CMM 55例,非肢端CMM 14例;男34例,女35例。发病年龄26~89岁,平均年龄62岁。根据文献[6]分类,原位CMM 28例,侵袭CMM 37例,转移CMM 4例,3例淋巴结转移,1例皮肤转移。
二、主要试剂及细胞系
鼠抗人单克隆Cbl⁃b抗体(美国Santa Cruz生物技术公司),二氨基联苯胺(DAB)酶底物显色试剂盒和即用型快捷免疫组化试剂盒(福州迈新生物技术公司),DMEM培养基(美国Gibco公司),Trizol试剂(美国Invitrogen公司),逆转录PCR(RT⁃PCR)试剂盒(美国Promega公司),30%过氧化氢溶液[生工生物工程(上海)股份有限公司],实时荧光定量PCR试剂盒(南京诺唯赞生物科技有限公司)。A375黑素瘤细胞系(美国ATCC公司)来自1例54岁恶性黑素瘤女性。M14黑素瘤细胞系(江苏凯基生物技术股份有限公司),来自1例33岁男性转移至臀部的无色素黑素瘤。MV3人类黑素瘤细胞系(江苏凯基生物技术股份有限公司)来源于淋巴结转移性黑素瘤。以上3株黑素瘤细胞系均由中国医学科学院皮肤病研究所中心试验室长期保存,使用时复苏、培养。正常黑素细胞分离自1例11岁男孩包皮,传代3次后用于后续试验(本所研究生粟倩雅惠赠)。
三、方法
1.免疫组化检测石蜡组织切片中Cbl⁃b蛋白表达:石蜡切片常规脱蜡至水,0.01 mol/L柠檬酸缓冲液(pH 6.0)中高压抗原修复,自然冷却后水洗,之后将切片置于含10%过氧化氢溶液塑料盒中,60℃恒温水浴脱色素,时间40~60 min,脱色素完成后以磷酸盐缓冲液(PBS)冲洗,后续步骤同常规SP法[7]。免疫组化结果判定:以胞质和(或)胞膜出现棕褐色颗粒为Cbl⁃b阳性。读片者在不清楚临床信息的情况下,于400倍视野下随机选取5个不同视野,按肿瘤细胞阳性率及染色强度分别计算得分。染色强度判定标准:不着色0分,淡黄色1分,棕黄色2分,棕褐色3分;阳性细胞率:无阳性细胞为0分,阳性细胞<10%为1分,10%~50%为2分,>50%为4分。两项积分相乘为该视野得分,5个视野的平均得分为最后得分。按得分划分等级:0~1分为(-),2~3分为(+),4 ~ 6分为(++),> 6分为(+++)[8]。结果判定由我科两位皮肤病理医师独立进行。
2.实时荧光定量PCR检测Cbl⁃b mRNA相对表达:用Trizol试剂分别提取A375、M14、MV3细胞系和黑素细胞总RNA,测定总RNA质量和浓度,A260/A280在1.9~ 2.1之间为合格,各样本取1 μg RNA按说明书将其反转录为cDNA。引物设计和合成由生工生物工程(上海)股份有限公司完成。Cbl⁃b:上游引物:5′⁃GATGAATCGGTTGGCAAAC⁃3′,下游引物:5′⁃GGGTGGCAGGCTTAGATG⁃3′,目的产物139 bp。3磷酸甘油醛脱氢酶(GAPDH):上游引物:5′⁃AAATCCCATCACCATCTTCC⁃3′,下游引物:5′⁃ATGACCCTTTTGGCTCCC⁃3′,目的产物 147 bp。PCR扩增目的基因片段,扩增条件:95℃预变性10 min;95 ℃变性10 s;60℃退火/延伸30 s,收集荧光,共40个循环。所有试验重复3次。以2⁃△△Ct值表示Cbl⁃b mRNA相对表达量。
3.免疫印迹法检测Cbl⁃b蛋白表达:离心收集黑素细胞和上述3株黑素瘤细胞系细胞,按常规蛋白样品制备方法提取蛋白,用二喹啉甲酸(BCA)方法测定蛋白浓度。将样品用裂解缓冲液稀释至相同浓度,取等量上样缓冲液于试管中,蛋白量为50 μg,并于95~100℃条件下变性5 min后冷却上样。电泳条件:浓缩胶恒压80 V约30 min,分离胶100 V约90 min。电泳后将凝胶中蛋白通过湿电转移至聚偏二氟乙烯膜(PVDF膜)上。用含5%脱脂奶粉的封闭液4℃封闭PVDF膜过夜,按约0.1 ml/cm2的量加入封闭液和适量一抗(Cbl⁃b单克隆抗体工作浓度为1∶500,β肌动蛋白作为内参照),4℃摇床振荡孵育过夜。PBS漂洗滤膜4次,每次10 min。将膜与辣根过氧化物酶标记的羊抗鼠二抗(1∶5 000)室温振荡孵育2 h。显影,曝光,成像。用Image J分析软件对条带灰度进行分析。
4.统计学方法:采用SPSS23.0系统分析软件。计数资料比较采用卡方检验,两组等级资料比较采用Mann⁃WhitneyU检验;Cbl⁃b和肿瘤进展、分级相关性分析采用Spearman相关检验。多组间计量资料采用方差分析,方差不齐时采用非参数检验(Kruskal⁃Wallis检验)。P<0.05为差异有统计学意义。
结 果
一、黑素瘤组织Cbl⁃b蛋白表达与临床特征及肿瘤侵袭和转移的关系
69份黑素瘤组织切片中,52份(75.36%)表达Cbl⁃b;30份色素痣组织切片中,4份(13.33%)表达Cbl⁃b(图1),两组表达率差异有统计学意义(χ2=32.745,P< 0.01)。而且,黑素瘤有溃疡组Cbl⁃b表达水平明显高于无溃疡组(U=148.00,P<0.01),但不同性别组间、有/无炎症细胞浸润组间Cbl⁃b表达差异均无统计学意义(U=507.00,470.50,均P>0.05)。Cbl⁃b 表达水平与肿瘤进展、Clark分级和Breslow 厚度均呈正相关(rs分别为 0.569、0.654、0.727,均P< 0.01)。见表1。
二、黑素细胞及A375、M14、MV3细胞系Cbl⁃b mRNA相对表达水平
黑素细胞及A375、M14和MV3细胞内 Cbl⁃b mRNA相对表达量分别为1.00±0.00、0.72±0.06、0.20±0.02、0.58±0.06,各组mRNA表达差异有统计学意义(F=176.537,P<0.01),以黑素细胞表达量最高,其次为A375、MV3,M14表达量最低。
三、黑素细胞及A375、M14、MV3细胞系 Cbl⁃b蛋白表达水平
A375细胞Cbl⁃b蛋白表达水平最高,依次为M14、MV3,黑素细胞中表达最低(图2)。
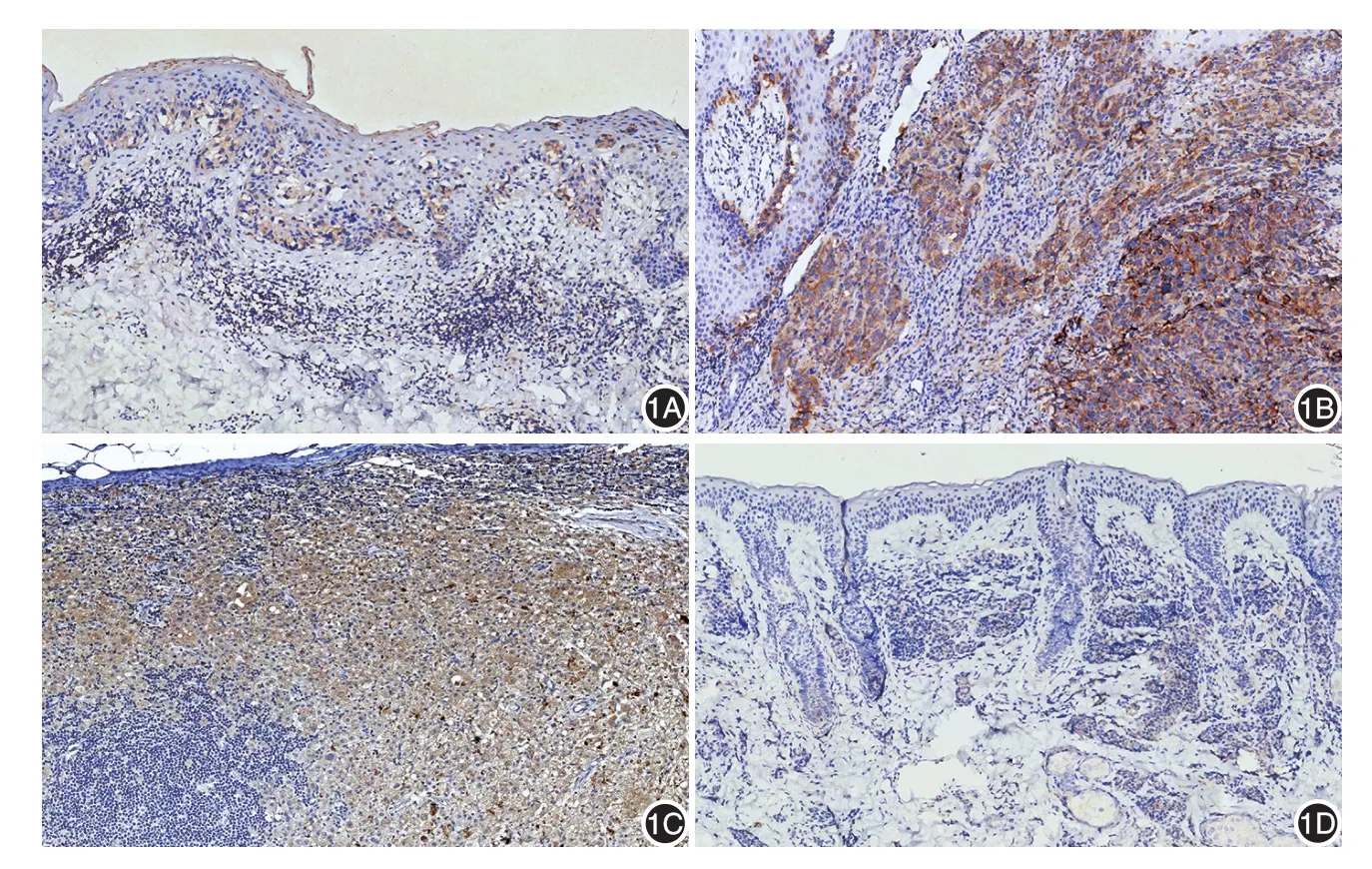
图1 免疫组化结果(SP×100) 1A:浅表播散性原位黑素瘤组织中Cbl⁃b胞质阳性表达;1B:侵袭性黑素瘤组织中Cbl⁃b胞质阳性表达;1C:淋巴结转移性黑素瘤组织中Cbl⁃b胞质阳性表达;1D:皮内痣中Cbl⁃b阴性表达
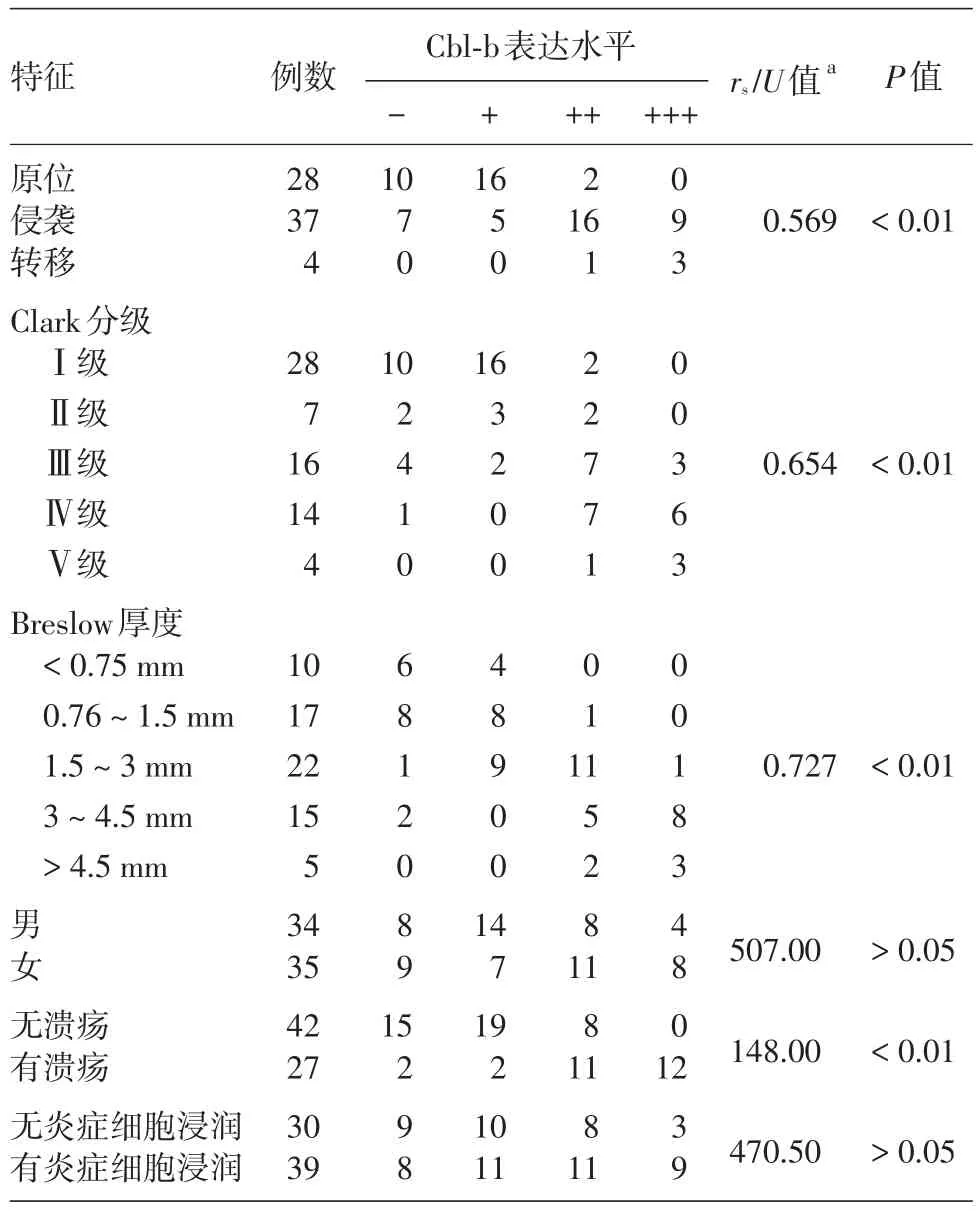
表1 皮肤黑素瘤组织中Cbl⁃b蛋白表达与黑素瘤患者临床特征的关系
讨 论
Cbl⁃b属于环指(RING)型泛素连接酶E3,由位于3q13.11的CBLB基因编码。Cbl⁃b通过N⁃端酪氨酸激酶结合(tyrosine kinase binding,TKB)结构域识别并结合底物蛋白酪氨酸激酶,RING结构域募集泛素结合酶E2,从而启动底物泛素化降解,参与细胞内信号转导的负向调控[9]。然而Cbl⁃b蛋白也可作为连接蛋白招募信号分子至蛋白酪氨酸激酶,从而激活Ras⁃MAPK、PI3K/AKT等一系列下游信号通路分子,发挥促进细胞有丝分裂、分化、抗凋亡和促转移等作用[10⁃12]。
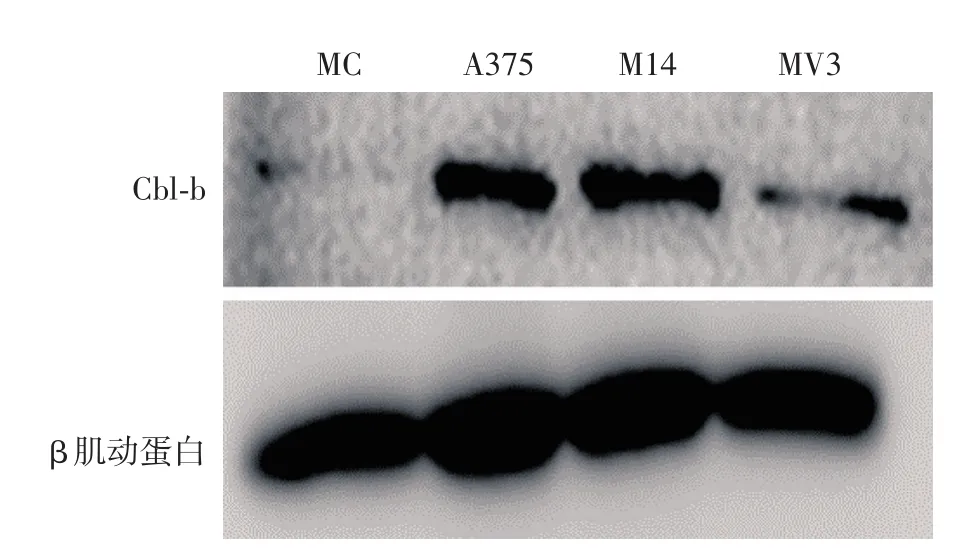
图2 免疫印迹法检测Cbl⁃b蛋白在黑素细胞(MC)及A375、M14、MV3细胞系中的表达
我们通过免疫组化发现,黑素瘤组织中Cbl⁃b表达阳性率明显高于色素痣。而且,Cbl⁃b在伴有溃疡的CMM中表达水平明显高于无溃疡的CMM,其表达水平与影响预后因素(Clark分级、Breslow厚度)正相关,随肿瘤的侵袭和转移而升高。因此我们推测,Cbl⁃b在黑素瘤中可能作为连接蛋白激活Ras⁃MAPK、PI3K/AKT等一系列下游信号通路,从而促进黑素瘤侵袭和转移,但不能完全否认Cbl⁃b在黑素瘤组织中高表达是肿瘤发生发展中的一种伴随现象。Fan等[13]研究表明,Cbl⁃b可使抑癌蛋白富含脯氨酸的酪氨酸激酶2(Pyk2)泛素化降解,从而引起肿瘤细胞解离,促进肿瘤转移。因此,不排除Cbl⁃b通过降解有关抑癌蛋白从而促进黑素瘤发生发展的可能。
本研究中实时荧光定量PCR结果显示,黑素细胞和黑素瘤细胞系Cbl⁃b mRNA表达水平差异有统计学意义,以黑素细胞表达量最高,其次为A375、MV3,M14表达量最低。免疫印迹结果显示,3株黑素瘤细胞系Cbl⁃b蛋白表达水平均高于黑素细胞,以A375细胞表达水平最高。在黑素细胞和黑素瘤细胞系中,Cbl⁃b mRNA和蛋白表达水平不一致,这可能与黑素细胞和黑素瘤细胞中Cbl⁃b基因转录后存在不同的转录后加工、翻译、翻译后加工及修饰(如microRNA调节、泛素化、蛋白稳定性)等有关[14]。本研究发现,黑素瘤组织中Cbl⁃b表达高于色素痣,黑素瘤细胞株Cbl⁃b蛋白表达高于黑素细胞,组织水平与细胞水平Cbl⁃b蛋白表达结果一致。
本研究结果显示,Cbl⁃b在黑素瘤组织中的表达明显高于良性色素痣,并且黑素瘤细胞株中Cbl⁃b蛋白的表达也高于黑素细胞。但Cbl⁃b是否影响黑素瘤细胞株的生物学行为及相关分子机制尚需更深入的研究。综上所述,我们认为Cbl⁃b可能是靶向药物的筛选靶点之一以及判断黑素瘤恶性程度、侵袭性的指标之一。
[1]Cummins DL,Cummins JM,Pantle H,et al.Cutaneous malignant melanoma[J].Mayo Clin Proc,2006,81(4):500 ⁃507.DOI:10.4065/81.4.500.
[2]Vennepureddy A,Thumallapally N,Motilal NV,et al.Novel drugs and combination therapies for the treatment of metastatic melanoma[J].J Clin Med Res,2016,8(2):63 ⁃75.DOI:10.14740/jocmr2424w.
[3]Paolino M,Choidas A,Wallner S,et al.The E3 ligase Cbl⁃b and TAM receptors regulate cancer metastasis via natural killer cells[J].Nature,2014,507(7493):508 ⁃512.DOI:10.1038/nature12998.
[4]Li H,Xu L,Li C,et al.Ubiquitin ligase Cbl⁃b represses IGF⁃I⁃induced epithelialmesenchymaltransition via ZEB2 and microRNA ⁃200c regulation in gastric cancer cells[J].Mol Cancer,2014,13:136.DOI:10.1186/1476⁃4598⁃13⁃136.
[5]Tsygankov AY,Teckchandani AM,Feshchenko EA,et al.Beyond the RING:CBL proteins as multivalent adapters[J].Oncogene,2001,20(44):6382⁃6402.DOI:10.1038/sj.onc.1204781.
[6]Balch CM,Gershenwald JE,Soong SJ,et al.Final version of 2009 AJCC melanoma staging and classification[J].J Clin Oncol,2009,27(36):6199⁃6206.DOI:10.1200/JCO.2009.23.4799.
[7]Liu CH,Lin CH,Tsai MJ,et al.Melanin bleaching with dilute hydrogen peroxide:a simple and rapid method[J].Appl Immunohistochem Mol Morphol,2013,21(3):275 ⁃279.DOI:10.1097/PAI.0b013e31826d81db.
[8]Bosman FT,de Goeij AF,Rousch M.Quality control in immuno⁃cytochemistry:experiences with the oestrogen receptor assay[J].J Clin Pathol,1992,45(2):120⁃124.DOI:10.1136/jcp.45.2.120.
[9]Liyasova MS,Ma K,Lipkowitz S.Molecular pathways:cbl proteins in tumorigenesis and antitumor immunity⁃opportunities for cancer treatment[J].Clin Cancer Res,2015,21(8):1789 ⁃1794.DOI:10.1158/1078⁃0432.CCR⁃13⁃2490.
[10]Arron JR,Vologodskaia M,Wong BR,et al.A positive regulatory role for Cbl family proteins in tumor necrosis factor⁃related activation⁃induced cytokine(trance)and CD40L⁃mediated Akt activation[J].J Biol Chem,2001,276(32):30011⁃30017.DOI:10.1074/jbc.M100414200.
[11]Yasuda T,Tezuka T,Maeda A,et al.Cbl⁃b positively regulates Btk⁃mediated activation of phospholipase C⁃gamma2 in B cells[J].J Exp Med,2002,196(1):51⁃63.DOI:10.1084/jem.20020068.
[12]Liu J,DeYoung SM,Hwang JB,et al.The roles of Cbl⁃b and c⁃Cbl in insulin ⁃stimulated glucose transport[J].J Biol Chem,2003,278(38):36754⁃36762.DOI:10.1074/jbc.M300664200.
[13]Fan Y,Qu X,Ma Y,et al.Cbl⁃b accelerates trypsin⁃induced cell detachment through ubiquitination and degradation of proline⁃rich tyrosine kinase 2[J].Tumour Biol,2014,35(11):11129 ⁃11135.DOI:10.1007/s13277⁃014⁃2296⁃z.
[14]de Sousa Abreu R,Penalva LO,Marcotte EM,et al.Global signatures of protein and mRNA expression levels[J].Mol Biosyst,2009,5(12):1512⁃1526.DOI:10.1039/b908315d.
Casitas B⁃lineage lymphoma b in malignant melanoma tissues and cell lines A375,M14 and MV3:expression and clinical significance
Wang Xiaopo,Wen Sijian,Su Qianya,Song Hao,Ni Nana,Jiang Yiqun,Chen Hao,Sun Jianfang
Department of Pathology,Institute of Dermatology,Chinese Academy of Medical Sciences and Peking Union Medical College,Nanjing 210042,China(Wang XP,Wen SJ,Song H,Jiang YQ,Chen H,Sun JF);Department of Cosmetic Laser Surgery(Su QY);Jiangsu Key Laboratory of Molecular Biology for Skin Diseases and STIs,Nanjing 210042,China(Ni NN)
< class="emphasis_italic">Corresponding author:Sun Jianfang,Email:fangmin5758@aliyun.com
Sun Jianfang,Email:fangmin5758@aliyun.com
ObjectiveTo measure the expression of casitas B⁃lineage lymphoma b(Cbl⁃b)in cutaneous malignant melanoma(CMM)tissues and cell lines A375,M14 and MV3,and to assess its clinical significance.MethodsImmunohistochemistry was carried out to measure Cbl⁃b expression in paraffin⁃embedded tissue sections from 69 cases of CMM and 30 cases of pigmented nevus.Real⁃time fluorescence⁃based quantitative PCR and Western⁃blot analysis were performed to determine the mRNA and protein expressions of Cbl⁃b in melanocytes and the three cell lines respectively.ResultsThe positive rate of Cbl⁃b was significantly higher in CMM tissues than in pigmented nevus tissues(75.36%[52/69]vs.13.33%[4/30],χ2=32.745,P< 0.01).The expression level of Cbl⁃b in CMM tissues was positively correlated with the stage of tumor progression,Clark′s level and Breslow thickness of CMM(rs=0.569,0.654,0.727,respectively,allP< 0.01).As fluorescence⁃based quantitative PCR showed,there were significant differences in the mRNA expression of Cbl⁃b among A375,M14 and MV3 cells(F=176.537,P< 0.01).Western⁃blot analysis revealed the protein expression of Cbl⁃b in the 3 melanoma cell lines and melanocytes,which was highest in A375 cells,and lowest in melanocytes.ConclusionCbl⁃b was overexpressed in CMM tissues and cell lines.
Ubiquitin⁃proteinligases;Melanoma;Melanocytes;Neoplasminvasiveness;Neoplasmgrading;Cbl⁃b
孙建方,Email:fangmin5758@aliyun.com
10.3760/cma.j.issn.0412⁃4030.2016.12.007
国家自然科学基金(81272992);江苏省自然科学基金(BK20131063);北京协和医学院研究生创新基金(2015⁃1002⁃01⁃12)
Fund programs:National Natural Science Foundation of China(81272992);Natural Science Foundation of Jiangsu Province(BK20131063);Graduate Innovation Fund of Peking Union Medical College(2015⁃1002⁃01⁃12)
2016⁃03⁃14)
(本文编辑:尚淑贤)

