绞股蓝多糖保护力竭运动诱导肝细胞凋亡
宿彦峰,齐波
(1.新乡医学院体育教学部,河南新乡453000;2.中南大学体育教研部,湖南长沙410083)
绞股蓝多糖保护力竭运动诱导肝细胞凋亡
宿彦峰1,齐波2,*
(1.新乡医学院体育教学部,河南新乡453000;2.中南大学体育教研部,湖南长沙410083)
为研究绞股蓝多糖(GMP)对力竭运动诱导大鼠肝细胞凋亡的影响。采用大鼠力竭运动模型,将32只雄性Wistar大鼠随机分为4组:安静对照组、运动力竭对照组、绞股蓝多糖低剂量组+运动力竭组,绞股蓝多糖高剂量组+运动力竭组;采用免疫组织化学方法检测大鼠肝组织Bax、Bcl-2蛋白的表达,对各组大鼠肝组织Bax/Bcl-2比值与肝组织细胞凋亡情况进行分析;采用以分光光度法检测肝脏主要抗氧化酶活性与丙二醛(MDA)含量。结果发现,绞股蓝多糖后能使力竭运动后大鼠肝组织Bax的表达减弱、Bcl-2的表达增强、Bax/Bcl-2比值降低;超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPx)、过氧化氢酶(CAT)活性增加;MDA含量降低。绞股蓝多糖对力竭运动诱导肝组织氧化应激及细胞凋亡具有保护作用。
绞股蓝多糖;力竭运动;氧化应激;肝细胞;凋亡
研究表明,力竭运动过程中机体会产生大量的自由基,当所产生的自由基超过机体抗氧化防御系统的清除能力,则使机体处于氧化应激(Oxidative stress,OS)状态。机体在OS状态下对核酸、蛋白质及脂质等生物大分子物质均可产生破坏,导致机体出现肌肉、心血管等损伤,甚至引起细胞凋亡或坏死。细胞凋亡是细胞应答不同有害刺激或疾病而发生的一种特殊的细胞自杀行为。通过这种细胞自杀行为,机体消除损伤、衰老、突变的细胞,以维持生理平衡[1]。力竭运动可加速机体的物质代谢和能量代谢,并使机体处于缺血、缺氧状态,引起ATP减少、自由基增多、Ca2+浓度改变、线粒体结构及功能变化等,导致细胞启动细胞凋亡[2]。研究发现,调控细胞凋亡的基因有两类,包括促进基因和抑制基因。Bcl-2基因家族是目前最受重视的调控细胞凋亡的基因家族,属于一类新的癌基因家族[3],Bcl-2和Bax是凋亡调节基因Bcl-2家族的两个重要成员。许多研究表明Bcl-2是抑制凋亡的主要基因,Bax是促凋亡基因,它们和其家族成员共同构成了复杂的相互作用的网络,调控细胞凋亡的发生[4]。目前,力竭运动诱导的氧化应激及其引起的细胞凋亡在运动医学研究领域备受关注。
1 材料与方法
1.1 材料与试剂
绞股蓝干品:购于湖南药材公司(长沙),粉碎后过60目筛备用;超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPx)、过氧化氢酶(CAT)、丙二醛(MDA)等分析试剂盒:购于建成生物工程研究所(南京);兔抗鼠Bax、Bcl-2多克隆抗体:购于博士德生物工程有限公司(武汉);辣根过氧化物酶标记的羊抗兔IgG、二氨基联苯胺(DAB)显色液:购于中杉金桥生物技术有限公司(北京);乙醇、丙酮、石油醚、三氯乙酸、盐酸、苏木素等常规试剂:均为国产分析纯,由中南大学分析测试中心提供。
1.2 仪器
DK-8AS电热恒温水槽:上海合恒仪器设备有限公司;ML-T分析天平:德国梅特勒-托利公司;DW-86L388A超低温冰箱:海尔公司;SQ510高压蒸汽灭菌器:日本三洋公司;MPT250L生化培养箱:深圳市帕特腾飞科技公司;CARY60紫外分光光度计:美国安捷伦公司;Allegra X-15R冷冻离心机:美国Beckman Coulter公司;YB-6LF生物组织包埋机:孝感市亚光医用电子技术公司;LKB2188超薄切片机切片:瑞典LKB公司;ELX-800酶标仪:美国BioTek公司;GWA-UN1-10纯水超纯水器:北京普析公司;CX41显微镜:日本奥林巴斯公司。
1.3 方法
1.3.1 绞股蓝多糖的制备
干燥绞股蓝粉末用75%乙醇80℃下回流提取2次,回收乙醇,残渣用加10倍蒸馏水提取3次,每次1 h,合并滤液并减压蒸馏浓缩,加入4倍95%乙醇,过夜,离心后收集沉淀再溶于蒸馏水中,加入三氯乙酸去除蛋白,上清液加入4倍95%乙醇,过夜,离心后收集沉淀经无水乙醇、丙酮、石油醚各洗涤3次,真空干燥得GMP。
1.3.2 实验动物与分组
雄性Wistar大鼠32只,体重200 g~220 g(中南大学实验动物中心提供),常规分笼喂养,室温(24±3)℃,湿度为(60±1)%。普通大鼠饲料适应性喂养一周,随机分为安静对照组(Quiet control group,QC)、运动力竭对照组(Exhausting exercises control group,EC)、低剂量绞股蓝多糖+运动力竭组(Low dose GMP+exhausting exercises group,LGE),高剂量绞股蓝多糖+运动力竭组(High dose GMP+exhausting exercises group,HGE),每组8只。QC组大鼠不运动,其余组为力竭运动组。LGE组与HGE组大鼠每只每天灌胃GMP溶液,给药量以100mg/kg·bw和300mg/kg·bw计算,每天1.0mL灌服一次;QC组和EC组灌服同样剂量的蒸馏水。
1.3.3 力竭运动模型的建立
力竭运动组大鼠进行3 d的跑台运动适应性训练(速度为10 m/min,时间为10 min/d,坡度为0°)。正式实验采用Bedford依据大鼠体重/摄氧量回归方程所建立的递增运动负荷训练大鼠模型[8-9]。按以下运动程序运动至力竭:第一级负荷:0 °,8.2 m/min,15 min(相当于 53%VO2max);第二级负荷:5 °,15 m/min,15 m(相当于 64%VO2max);第三级负荷:10 °,19.3 m/min(相当于76%VO2max)运动至力竭。总运动时间为(66±24)min。大鼠运动时为保证运动强度,对其采用声音、小木棍等方式刺激,如效果不明显,可给予一定电刺激,使动物始终保持在跑道前1/3处。力竭运动后,将大鼠断头处死,迅速摘取肝脏经0.9%生理盐水漂洗后用滤纸吸干,测定肝组织Bax、Bcl-2蛋白表达、SOD、GPx、CAT活性及MDA含量。
高血压主要危险因素为肥胖、高血脂,而后两者为脂肪肝的危险因素。QIAN等[13]的研究指出NAFLD与患者的血压水平相关。ANENI等[14]的研究指出IR是NAFLD的主要危险因素,IR对高血压有作用,而高血压对NAFLD的发展有作用,三者之间的关系密不可分[15-16]。
1.3.4 力竭判定标准
到运动末期,大鼠运动强度减缓,速度下降,不能保持在跑道前1/3处的次数大3次以上,即使给予电刺激也驱赶无效,停跑后体征表现为神情倦怠、腹部触地、呼吸急促、卧位、对刺激反应迟钝[10]。
1.3.5 肝组织Bax、Bcl-2蛋白表达的检测
采用免疫组织化学方法检测大鼠肝组织Bax、Bcl-2蛋白的表达。4 μm切片,常规脱蜡水化,一抗为兔抗鼠Bax和Bcl-2多克隆抗体,滴加辣根过氧化物酶标记的羊抗兔IgG二抗,以PBS代替一抗作为阴性对照,DAB显色,苏木素复染,树脂封片。在光学显微镜下进行观察、照相记录。在高倍镜下,每张切片随机观察10个视野,计数阳性细胞数,以阳性细胞数所占百分比作为Bax、Bcl-2蛋白阳性表达指数[11]。阳性染色为细胞内有棕黄色点状或颗粒状物质。重复进行3次操作,取3次参数的均值为分析数据。
1.3.6 肝组织SOD、GPx、CAT活性及MDA含量测定
取肝组织剪碎,倒入玻璃匀浆管中,加入冷生理盐水,在盛有冰水混合物的器皿中制成10%匀浆,然后离心,取上清液,按试剂盒说明测定SOD、GPx、CAT活性及MDA含量。
1.3.7 统计学处理
各组试验数据以Mean±SD表示,用SPSS15.0进行统计学分析。组间差异采用单因素方差分析(One Way ANOVA),组间P<0.05为差异有统计学意义。
2 结果与分析
2.1 绞股蓝多糖对各组大鼠肝细胞凋亡调控基因Bax表达影响
绞股蓝多糖对各组大鼠肝细胞凋亡调控基因Bax表达影响见图1。
由图1可以看出,QC组大鼠的Bax表达量很低,EC组大鼠的Bax表达量较高,LGE组与HGE组大鼠的Bax表达量处于两者之间。
2.2 绞股蓝多糖对各组大鼠肝细胞凋亡调控基因Bcl-2表达影响
绞股蓝多糖对各组大鼠肝细胞凋亡调控基因Bcl-2表达影响见图2。
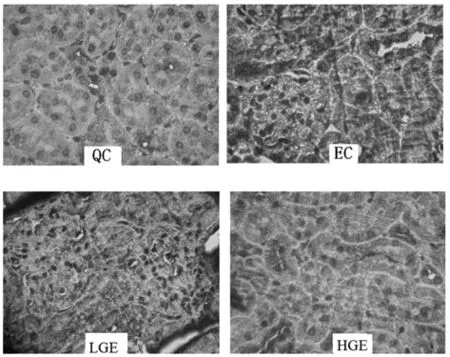
图1 绞股蓝多糖对各组大鼠肝细胞凋亡调控基因Bax表达影响Fig.1 Effects of GMP on the expressions of Bax in the liver
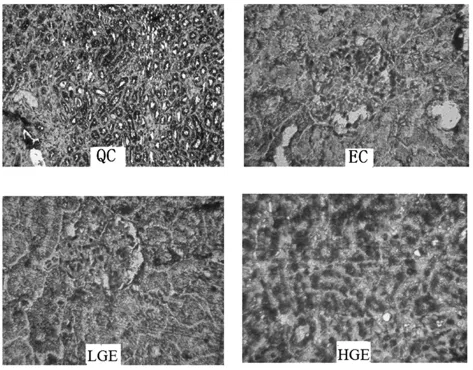
图2 绞股蓝多糖对各组大鼠肝细胞凋亡调控基因Bcl-2表达影响Fig.2 Effects of GMP on the expressions of Bcl-2in the liver
由图2可以看出,QC组、LGE组、HGE组大鼠的Bcl-2表达量明显,EC组组大鼠的Bcl-2表达量较弱。
2.3 绞股蓝多糖对各组大鼠肝组织Bax、Bcl-2、Bax/Bcl-2比值变化影响
绞股蓝多糖对各组大鼠Bax、Bcl-2表达量及Bax/Bcl-2比值的计算结果见图3。
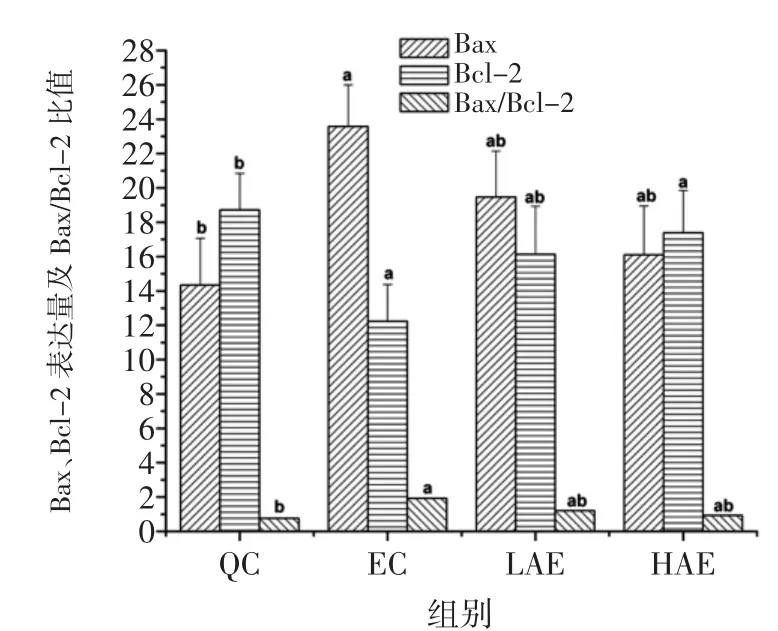
图3 绞股蓝多糖对各组大鼠肝组织Bax、Bcl-2表达量及Bax/Bcl-2比值变化影响Fig.3 Effects of GMP on the expressions quantity of Bax and Bcl-2 and the changes of Bcl-2/Bax ratio in the liver
由图3可以看出,与QC组比较,EC组、LGE组、HGE组的Bax表达量及Bax/Bcl-2比值显著上升(P<0.05),EC组、LGE组Bcl-2表达量显著下降(P<0.05)。与EC组比较,LGE组与HGE组的Bax表达量及Bax/Bcl-2比值显著下降,Bcl-2表达量有显著上升(P<0.05)。这表明灌胃绞股蓝多糖能使力竭运动大鼠肝组织中Bax的表达减弱,Bcl-2的表达增强,能抑制力竭运动大鼠肝细胞凋亡。
2.4 绞股蓝多糖对各组大鼠肝组织SOD、GPx、CAT活性影响
绞股蓝多糖对各组大鼠肝组织SOD、GPx、CAT活性影响见图4。
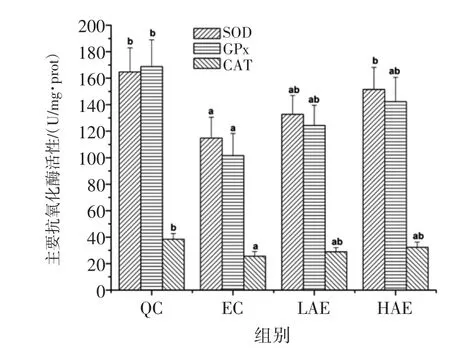
图4 绞股蓝多糖对各组大鼠肝组织SOD、GPx、CAT活性影响Fig.4 Effects of GMP on the main antioxidant enzyme activities in the liver
由图4可以看出,与QC组比较,LGE组、HGE组的 SOD 活性,EC组、LGE组、HGE组的 GPx、CAT活性均显著降低(P<0.05)。与EC组比较,EC组、LGE组、HGE组的 SOD、CAT活性,EC组、HGE组的 GPx活性均显著提高(P<0.05);LGE组的GPx活性虽然有少量增加,但差异不显著(P>0.05)。这表明力竭运动能使机体主要抗氧化酶活性下降,这是与以往研究结果相一致的。绞股蓝多糖能增强大鼠肝组织抗氧化酶活性,清除氧化应激状态下的过量自由基,进而加强对机体的保护。
2.5 绞股蓝多糖对各组大鼠肝组织MDA含量影响
绞股蓝多糖对各组大肝组织MDA含量影响见图5。
由图5可以看出,与QC组比较,EC组、LGE组、HGE组的MDA含量均显著提高(P<0.05)。与EC组比较,EC组、LGE组、HGE组的MDA含量均显著降低(P<0.05)。这表明力竭运动能导致大鼠肝组织脂质过氧化增强。绞股蓝多糖能降低大机体组织脂质过氧化,保护剧烈运动后自由基介导的氧化损伤。
3 讨论
剧烈运动会使组织代谢率增加而导致自由基产生产生加速,发生氧化应激。运动时自由基产生的具体来源包括线粒体呼吸链的电子漏、黄嘌呤氧化酶反应、血红蛋白氧化、中性粒细胞活化途径等。运动诱导的氧化应激与细胞凋亡密切相关,其中运动强度与运动量无疑是影响细胞凋亡的重要因素。细胞凋亡需要启动细胞内的Bcl-2蛋白家族、Caspase家族、Fas/Fasl肿瘤坏死因子超家族成员、IGF家族等特殊基因来转录及合成特殊的蛋白质[12-13]。其中,Bcl-2家族成员是目前运动与细胞凋亡研究中研究最多的蛋白质。有研究表明,Bcl-2蛋白与Bax蛋白两者的平衡调节着细胞的存亡,Bcl-2与Bax既可以形成同源二聚体,也可以形成异源二聚体。研究发现,Bax同源二聚体可以使发生细胞凋亡,但当Bcl-2占优势时,会与Bax结合形成异源二聚体,剩余的Bcl-2会使细胞凋亡受到抑制;但当Bax占优势时,会与Bcl-2结合形成异源二聚体,剩余的Bax就会使细胞发生凋亡[14]。Bax/Bcl-2比值的大小决定细胞凋亡发生的走向[15]。本研究结果显示,大鼠力竭运动后,与QC组相比,肝组织Bax的表达增强,Bcl-2的表达减弱,Bax/Bcl-2比值升高。这说明Bax与Bcl-2共同调控力竭运动致肝组织细胞凋亡的发生。Bax作为上调基因促进凋亡发生,Bcl-2作为下调基因抑制细胞的凋亡,肝细胞向着凋亡方向发展,这可能是力竭运动引起大鼠肝组织细胞凋亡的基因调控机制。同时,研究结果也表明,大鼠灌胃GMP后进行力竭运动,肝组织Bax的表达减弱。Bcl-2的表达增强。Bax/Bcl-2比值降低。说明GMP可通过调节Bax、Bcl-2及Bax/Bcl-2比值,对力竭运动大鼠起到抗肝细胞凋亡的作用,对肝组织起到保护作用。
在剧烈运动中,SOD、CAT、GPx是机体抗氧化酶系统清除自由基及活性氧产生的第一道防线。SOD能催化O2-·使其发生歧化反应,生成O2和H2O2,CAT能催化H2O2分解成O2和H2O·GPx能催化GSH变为GSSG,使有毒的过氧化物还原成无毒的羟基化合物,从而保护细胞膜的结构及功能不受过氧化物的干扰及损害。脂质过氧化作用能使细胞膜的流动性以及渗透性发生改变、损伤DNA以及蛋白质等大分子物质。MDA是脂质过氧化最丰富的终产物,也是最常用的评价脂质过氧化指标之一。相关研究已经证实,剧烈运动能够通过增加生物体内肌肉、肝、肾等组织中脂质过氧化而引起氧化损伤。本研究结果显示,GMP能显著增加力竭运动后大鼠肝组织中SOD、GPx和CAT活性,降低MDA含量。这说明GMP在保护力竭运动诱导的氧化应激中展示的重要的抗氧化与降低脂质过氧化作用,能保护剧烈运动后自由基介导的氧化损伤。其原因可能与破坏自由基链式反应有关,具体原因还有待进一步研究。上述实验结果为绞股蓝多糖在运动营养领域的应用提供了理论参考。
4 结论
绞股蓝多糖后能使力竭运动后大鼠肝组织Bax的表达减弱、Bcl-2的表达增强、Bax/Bcl-2比值降低;超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPX)、过氧化氢酶(CAT)活性增加;MDA含量降低。绞股蓝多糖对力竭运动诱导肝组织氧化应激及细胞凋亡具有保护作用。
[1] 周未艾,吕丹云.运动训练中细胞凋亡研究进展[J].中国运动医学杂志,2001,20(1):65-67
[2] 程丽彩,何玉秀.运动与肝细胞凋亡研究进展[J].中国运动医学杂志,2006,25(5):623-625
[3] Green D R,Kroemer G.The pathophysiology of mitochondrial cell death[J].Science,2004,305(5684):6263-629
[4] 邱红.细胞凋亡调控基因Bcl-2、Bax与心力衰竭[J].中华临床医学研究杂志,2007,13(24):3609-3610
[5] 沈宏伟,肖彦春,车仁国,等绞股蓝化学成分研究的现状[J].时珍国医国药,2008,19(7):1561-1562
[6]李艳茹.绞股蓝多糖对疲劳运动小鼠免疫能力的影响[J].食品科学,2008,29(8):584-586
[7] Qi B,Huang H.Anti-fatigue effects of polysaccharides from Gynostemma pentaphyllum Makino by forced swimming test[J].Advanced Materials Research,2014,881-883:426-429
[8] 史绍蓉,刘田,龚丽,等.一次性力竭运动后大鼠心室肌蛋白质组的差异性表达[J].中国运动医学杂志,2008,27(2):144-148
[9]Bedford T G,Tipton C M,Wilson C N.Maximal oxygen consumption of rats and its changes with various experi-mental procedures[J].J Appl Physiol,1979(47):1278-1283
[10]刘慧敏,贺洪,印大中.赖氨酸对力竭运动后的大鼠保护作用[J].湖南师范大学学报(医学版),2007,4(1):49-54
[11]周晓慧,韩亚玲,杨鹤梅,等.黄芩茎叶总黄酮对H2O2诱导的心肌细胞凋亡相关基因Bcl-2及Bax表达的影响[J].广东医学,2007,28(10):1590-1591
[12]Xu J P,Li X,Mori E.Expression of Fas-Fas Ligand in murine testis[J].Am J Reprod I mmunol,1999,42:381-388
[13]Adams J M,Cory S.The Bcl-2 protein family:Arbiters of cell survival[J].Science,1998,281(5381):1322-1326
[14]Kim W H,Lee J W,Suh Y H.Exposure to Chronic High Glucose Induces Beta-cell Apoptosis through Decreased Interaction of Glucokinase with Mitochondria:Downregulation of Glucokinase in Pancreatic Beta-cells[J].Diabetes,2005,54(9):2602-2611
[15]Lee S G,Yum J S,Moon H M.Analysis of mannose-binding lectin 2(MBL2)genotype and the serum protein levelsin the Korean population[J].Mol Immunol,2005,42(8):969
Protective Effects of Polysaccharides from Gynostemma pentaphyllum Makino on the Exhaustive Exercise-induced Hepatocyte Apoptosis
XU Yan-feng1,QI Bo2,*
(1.Department of Physical Education,Xinxiang Medical College,Xinxiang 453000,Henan,China;2.Department of Physical Education,Central South University,Changsha 410083,Hunan,China)
The effects of polysaccharides from Gynostemma pentaphyllum Makino(GMP)on the exhaustive exercise-induced hepatocyte apoptosis of rats was studied.The animal model of exhaustive exercise was used for study.Thirty two male Wistar rats were randomly assigned into quiet control group(QC),exhausting exercises control group(EC),low dose GMP+exhausting exercises group(LGE),high dose GMP+exhausting exercises group(HGE).The expressions of Bcl-2 and Bax were detected by the immunohistochemical staining and image analyzer.The correlation between the ratio of Bcl-2/Bax and histiocyte apoptosis was analyzed.Meanwhile,main antioxidant enzyme activities and malondialdehyde (MDA)were detected by the spectrophotometric method.After GMP was provided by gavage,the expression of Bax decreased remarkably,and of Bcl-2 increased significantly,the ratio of Bax/Bcl-2 decreased remarkably.GMP could decrease MDA contents and increase superoxide dismutase(SOD),glutathione peroxidase(GPx),catalase(CAT)activities in liver of rats.GMP possessed protective effects on the exhaustive exercise-induced cell apoptosis and oxidative stress.
polysaccharides from Gynostemma pentaphyllum Makino;exhaustive exercise;oxidative stress;hepatocyte;apoptosis
10.3969/j.issn.1005-6521.2016.14.040
湖南省教育厅科技规划项目(20130482)
宿彦峰(1977—),男(汉),讲师,硕士研究生,研究方向:体育教育训练学与运动生理学。
*通信作者:齐波(1978—),女(汉),副教授,硕士研究生,研究方向:运动生理学。
2015-07-02

