草苁蓉提取物对小鼠H22肝癌移植瘤血管生成的抑制作用
尹学哲,朴龙,金爱花,高峰,全吉淑,*
(1.延边大学附属医院,吉林延吉133000;2.延边大学医学院,吉林延吉133002)
草苁蓉提取物对小鼠H22肝癌移植瘤血管生成的抑制作用
尹学哲1,朴龙1,金爱花1,高峰2,全吉淑2,*
(1.延边大学附属医院,吉林延吉133000;2.延边大学医学院,吉林延吉133002)
探讨富含环烯醚萜苷的草苁蓉提取物(IGBR)对H22小鼠移植瘤血管生成的抑制作用。建立H22肝癌皮下移植瘤模型,并用IGBR干预10 d。利用HE染色法观察肿瘤组织病理学改变,利用免疫组化法检测肿瘤组织内微血管密度(MVD),利用蛋白印迹法检测肿瘤组织缺氧诱导因子(HIF)-1α、血管内皮生长因子(VEGF)和血管内皮细胞生长因子受体(VEGFR)-2蛋白的表达。与模型组比较,IGBR组肿瘤细胞生长受抑,细胞数目较少,坏死程度较严重。与模型组比较,IGBR组肿瘤组织MVD显著降低;HIF-1α、VEGF和VEGFR-2蛋白的表达显著降低。提示IGBR对H22小鼠移植瘤新生血管生成具有抑制作用,可能与下调肿瘤组织HIF-1α和VEGF的蛋白表达有关。
草苁蓉;环烯醚萜;H22;抗血管生成
草苁蓉(Boschniakia rossica)为列当科草苁蓉属多年生寄生性草本植物,寄生于桦木科桤木属(东北桤木,又称东北赤杨)的须根上,主要分布于我国东北长白山区,是国家二类保护植物[1]。草苁蓉性味甘、酸、湿,全草入药,治肾虚阳痿,腰膝冷痛,小便遗沥,崩漏带下,津枯便秘,膀胱炎及膀胱出血等证,在民间被誉为“不老草”[2]。近年的研究结果表明,草苁蓉具有清除自由基和抗氧化作用,能抑制大鼠肝脏化学致癌过程[3-5]。环烯醚萜化合物是一类单萜化合物,是一些植物的自身防御物质,具有多种生理活性[3-4]。我们前期研究证实,草苁蓉环烯醚萜苷(iridoid glucosides from Boschniakia rossica,IGBR)对小鼠H22移植瘤具有明显的抑制作用,可改善H22移植瘤小鼠的免疫抑制状态,提高小鼠机体抗氧化能力[6-7]。本文通过小鼠H22肝癌移植瘤模型,观察IGBR对肿瘤组织内微血管密度(MVD)以及血管生成相关蛋白表达的影响,旨在对草苁蓉抗肿瘤血管生成作用进行探讨。
1 材料
1.1 IGBR的制备
草苁蓉全草干燥后,切碎,用乙醇提取,并减压浓缩。加水溶解后,用二氯甲烷萃取,取其水层上MCI-gel CHP20P凝胶柱,用甲醇梯度洗脱,收集50%甲醇洗脱成分,冷冻干燥得IGBR,主要含草苁蓉纳拉苷(49.1%)和7-脱氧表马钱子酸(30.3%)[6-7]。
1.2 细胞和动物
小鼠H22肝癌细胞由延边大学医学院韩春姬教授惠赠。昆明小鼠[体重(20±2)g]由延边大学实验动物中心提供。
1.3 试剂
5-氟尿嘧啶(5-Fu)为上海旭东海普药业有限公司产品;兔CD34单克隆抗体为北京博奥森生物技术有限公司产品;兔VEGF多克隆抗体为美国Santa Cruz公司产品;兔VEGFR-2单克隆抗体为美国Cell Signaling公司产品;小鼠HIF-1α单克隆抗体为美国Abcam公司产品;二抗(羊抗小鼠IgG-HRP)为南京凯基生物有限公司产品;二抗(羊抗兔IgG-HRP)为南京凯基生物有限公司产品。
1.4 仪器
OLYMPUS倒置显微镜为日本奥林巴斯株式会社产品;小型垂直版电泳槽及Trans-Blot转印槽为美国伯乐公司产品;UVP凝胶成像分析仪为美国UVP公司产品。
2 方法
2.1 建立H22小鼠肝癌移植瘤模型及分组处理[6-7]
将H22肝癌细胞常规复苏,以腹腔传代形式在小鼠腹腔内传代。取第2代腹水调肿瘤细胞密度至1×107个/mL,将肿瘤细胞悬液0.2 mL接种到小鼠的右腋下[6-7]。第2天将小鼠分成模型组、IGBR高、中、低剂量组和5-Fu组,每组10只。IGBR高、中、低剂量组分别按 400、200、100mg/kg体质量,每日灌胃 1次,连续 10d;5-Fu组按25 mg/kg体质量,隔日腹腔注射1次;模型组则每日等容积0.9%氯化钠溶液灌胃1次。第10天末次给药16 h后,处死动物,取出肿瘤组织。
2.2 肿瘤组织病理学检查
各组瘤体用中性福尔马林固定24 h后,石蜡包埋切片,常规HE染色,在光镜下观察肿瘤组织病理学改变。
2.3 免疫组化法检测肿瘤组织MVD
CD34表达于肿瘤血管内皮细胞,以胞浆呈现棕黄色为阳性。按Weidner[8]方法计算肿瘤组织MVD,即,在低倍镜下寻找“热点”,观察棕染的微血管密集区,然后在高倍镜下选取3个视野计微血管数,取平均值[7-8]。
2.4 蛋白印迹法检测肿瘤组织HIF-1α、VEGF和VEGFR-2蛋白的表达
提取总蛋白,加热变性后,进行常规聚丙烯酰胺凝胶电泳,并转膜。将PVDC膜用脱脂奶粉封闭,在4℃加一抗孵育过夜,加二抗继续孵育2 h,ECL显色,并在成像分析仪中采集图像并进行相对灰度比值分析。
2.5 统计学分析
3 结果与分析
3.1 肿瘤组织形态学观察
模型组瘤体较大,表面淡红,质地较软,与周围组织分界较清楚,剖面渗血较多。IGBR组和5-Fu组肿瘤组织边缘区毛细血管明显减少肿瘤瘤体较小,表面灰白,质地较韧,剖面灰白,中央区可见坏死,切面渗血较少。
3.2 肿瘤组织HE染色结果
肿瘤组织病理学观察结果(HE×200)见图1。
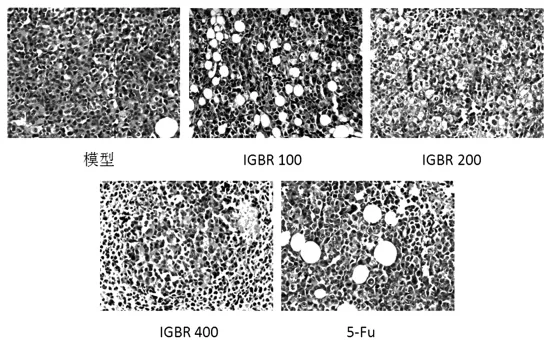
图1 肿瘤组织病理学观察结果(HE×200)Fig.1 Pathological observation of tumor tissues(HE×200)
模型组肿瘤细胞较为完整,排列紧密,细胞体积大,核浆比例增大,间质稀少;细胞大小不均,异质性较高;毛细血管丰富,以肿瘤边缘明显。IGBR组和5-Fu组肿瘤细胞数目较少,细胞间隙增大,界限清楚,毛细血管减少,中央区可见坏死。
3.3 免疫组化检测肿瘤组织MVD结果
肿瘤组织CD34免疫组化结果(×100)见图2。IGBR对肿瘤组织MVD的影响见表1。
CD34阳性颗粒主要定位于毛细血管、小静脉和小动脉血管内皮细胞膜和胞质。结果显示,模型组小鼠肿瘤组织微血管大量增生,而IGBR组和5-Fu组肿瘤边缘区MVD与模型组比较显著减少(P<0.05)。

图2 肿瘤组织CD34免疫组化结果(×100)Fig.2 Immunohistochemical staining of CD34 in tumor tissues(×100)

表1 IGBR对肿瘤组织MVD的影响Table 1 Effect of IGBR on MVD of tumor tissues
3.4 蛋白印迹法检测肿瘤组织HIF-1α、VEGF、VEGFR-2蛋白的表达
肿瘤组织HIF-1α、VEGF、VEGFR2蛋白的表达见图3。

图3 肿瘤组织HIF-1α、VEGF、VEGFR2蛋白的表达Fig.3 Expression of HIF-1α,VEGF and VEGFR2 proteins in tumor tissues
VEGF是目前已知的最主要最直接的血管生成因子,与主要受体VEGFR2结合后,可促进血管内皮细胞增殖,诱导新生血管形成;而HIF-1α则参与包括VEGF在内的多种基因的转录调控[9-11]。免疫印迹结果显示,与模型组比较,IGBR组和5-Fu组血管生成调控因子HIF-1α、VEGF和VEGFR-2蛋白表达水平显著降低(P<0.05)。
4 结论
草苁蓉为传统中药,其抗肿瘤研究已有一定积累[5-7]。汪霞等[4]报道IGBR可降低肝癌前病变大鼠血清标志酶活性,升高血清抗氧化酶活力。我们的前期工作已证实,IGBR抑制小鼠H22移植瘤生长,改善荷瘤小鼠的免疫抑制状态[6-7]。本研究HE染色结果也显示,IGBR治疗使肿瘤细胞生长受抑,排列较疏松,瘤细胞异质性降低,浸润程度减轻,坏死严重。
本实验利用小鼠H22移植瘤模型观察IGBR对荷瘤小鼠肿瘤新生血管的抑制作用。肿瘤新生血管形成是肿瘤细胞的持续生长及转移的必备条件[9-11]。新生血管的生成不仅为肿瘤生长提供氧气和营养物质,而且在肿瘤的侵袭和转移中也发挥着重要作用。因此,抗肿瘤血管生成治疗是很有前景的肿瘤治疗策略[9-11]。MVD是目前用以衡量肿瘤新生血管程度的有效指标,肿瘤组织中MVD的增高预示瘤体增长速度加快、转移可能性增大[6,11]。本研究结果显示,IGBR降低实体瘤组织的MVD,抑制肿瘤新生血管生成。VEGF是目前已知的最主要最直接的血管生成因子[10-11]。它有4种异构体,即 VEGF121、VEGF165、VEGF189、VEGF206,其中VEGF165是主要效应分子[6]。而VEGF主要受体VEGFR-1、2和3中,VEGFR-2主要表达在生长期的血管内皮细胞上,是VEGF发挥血管生成功能的主要受体,两者结合后通过一系列的调节机制,启动血管生成促进血管内皮细胞增殖,诱导新生血管形成,增加血管的通透性,导致肿瘤细胞生长、渗出及转移[6]。而HIF-1α则参与包括VEGF在内的多种基因的转录调控,它可通过多种途径上调VEGF的表达,进而诱导肿瘤新生血管的形成[10-11]。本实验结果显示,IGBR下调肿瘤组织中HIF-1α、VEGF和VEGFR-2蛋白的表达,提示,IGBR可能是通过抑制HIF-lα的表达使其下游的VEGF表达下降,从而抑制肿瘤血管内皮细胞增殖以及血管形成,进而使VEGFR-2蛋白表达得到负反馈减弱。综上所述,IGBR可通过抑制肿瘤新生血管生成而抑制小鼠H22移植瘤生长。
[1] 全国中草药汇编编写组.全国中草药汇编第二版 (下)[M].北京:人民卫生出版社,1996:433-434
[2] 贾敏如,李星炜.中国民族药志要[M].北京:中国医药科技出版社,2005:105
[3] Tsuda T,Sugaya A,Liu Y Z,et al.Radical scavenger effect of Boschniaria rossica[J].J Ethnopharmacol,1994,41(1/2):85-90
[4] Lin LC,Wang YH,Hou YC,et al.The inhibitory effect of phenylpropanoid glycosides and iridoid glucosides on free radical production and beta2 integrin expression in human leucocytes[J].J Pharm Pharmacol,2006,58(1):129-135
[5] 汪霞,周微,李天,等.草苁蓉环烯醚萜对肝癌前病变大鼠血清标志酶及抗氧化酶活性的影响[J].食品科技,2010,35(7):242-245
[6]朴龙.草苁蓉环烯醚萜苷的肝损伤保护作用及抑瘤作用的研究[D].延吉:延边大学,2011
[7] 金爱花,朴龙,尹学哲,等.草苁蓉环烯醚萜对H22小鼠肝癌移植瘤的抑瘤作用[J].中草药,2012,43(2):332-335
[8] Weidner N.Current pathologic methods for measuring intratumoral microvessel density with breast carcinoma and other solid tumors[J].Breast Cancer Res Treat,1995,36(2):169-180
[9] 宋晓琳,彭瀛,沈明花.薰衣草提取物对小鼠H22移植瘤的抑制作用[J].食品研究与开发,2014,35(2):63-65
[10]隋文文,张维东,武利存,等.蝎毒多肽促进5-氟尿嘧啶抑制H22肝癌血管生成的作用机制研究[J].中草药,2014,45(3):392-397
[11]张云峰.多硫酸化磷酸甘露寡糖的制备及其抗肿瘤血管生成作用的研究[D].济南:山东大学,2009
Anti-angiogenic Effect of Iridoid Glucosides from Boschniakia rossica in H22-bearing Mice
YIN Xue-zhe1,PIAO Long1,JIN Ai-hua1,GAO Feng2,QUAN Ji-shu2,*
(1.Yanbian University Hospital,Yanji 133000,Jilin,China;2.Medical College,Yanbian University,Yanji 133002,Jilin,China)
To investigate the anti-angiogenic effect of Boschniakia rossica extract mainly consisted of iridoid glucoside(IGBR)in H22-bearing mice,mice bearing H22hepatoma cells were established and treated with IGBR for 10 days.The pathological changes were detected with HE staining,the microvessel densities(MVD)were detected using immunohistochemical assay,and the protein expression of hypoxia-inducible factor(HIF)-1α,vascular endothelial growth factor(VEGF)and vascular endothelial growth factor receptor(VEGFR)-2 was detected by western blot method.As compared with the model group,IGBR treatment reduced the cell proliferation,aggravated the necrosis of transplanted tumor tissues of H22hepatoma cells.In addition,the administration with IGBR decreased MVD of tumor tissue,and down-regulated the protein expression of HIF-1α,VEGF and VEGFR-2 in the transplanted tumor tissue.Taken together,IGBR could exhibit anti-angiogenic effect against H22hepatoma cells in mice,and its mechanism was probably related to down-regulation of HIF-1α and VEGF proteins.
Boschniakia rossica;iridoids;H22;anti-angiogenic
10.3969/j.issn.1005-6521.2016.14.001
国家自然科学基金资助项目(81160539;81360651)
尹学哲(1962—),男(朝鲜),教授,博士,主要研究方向:天然产物活性研究。
*通信作者
2015-07-06

