高通量基因测序对血清学筛查临界风险孕妇的应用价值*
周 琴,郑芳秀,陈英苹,张晓青,张 玢,黄瑞萍,陆蓓亦,缪婷婷,袁 珮,虞 斌
(南京医科大学附属常州妇幼保健院/常州市产前诊断中心,江苏常州 213003)
论著·临床研究doi:10.3969/j.issn.1671-8348.2016.27.011
高通量基因测序对血清学筛查临界风险孕妇的应用价值*
周琴,郑芳秀,陈英苹,张晓青,张玢,黄瑞萍,陆蓓亦,缪婷婷,袁珮△,虞斌
(南京医科大学附属常州妇幼保健院/常州市产前诊断中心,江苏常州 213003)
目的探讨对于血清学筛查临界风险的孕妇应用高通量基因测序价值。方法选择2012年5月至2015年5月在常州市妇幼保健院产前诊断中心就诊的1 066例血清学筛查临界风险的孕妇,在知情同意的原则下抽取孕妇外周血,提取血浆中胎儿游离DNA,制备文库,采用Illumina NextSeq500测序平台对其进行测序分析,对测序提示的染色体异常患者行羊膜腔穿刺,羊水细胞培养后染色体G显带核型分析。结果1 066例样本中,高通量基因测序提示15例染色体非整倍体异常,经知情同意,13例孕妇自愿接受羊水产前诊断,其中7例羊水G带核型结果与测序结果一致,包括4例21三体,1例18三体,1例47,XXX,1例47,XXY,其余6例G带核型正常。结论高通量基因测序可作为血清学筛查临界风险孕妇的有效补充检测手段。
产前诊断;DNA;高通量测序;临界风险;无创产前筛查
产前筛查和诊断是减少出生缺陷有效的预防手段之一。目前,大多机构采用孕中期母体血清AFP+βHCG 的二联产前筛查, 而后对高危人群进行羊水产前诊断。国内外研究显示,这种筛查模式胎儿非整倍体染色体异常检出率仅为60%~70%[1-2]。国内学者提出了临界风险的概念,希望能够加强此部分孕妇的管理,减少漏诊病例的发生。
随着分子生物学技术和医学遗传学的发展,应用高通量基因测序技术检测母血中胎儿游离DNA进行无创产前筛查(non-invasive prenatal testing,NIPT)逐渐应用于临床。我国将临界风险孕妇作为该技术适用人群,但迄今为止尚缺少相关的临床数据。本文回顾性分析本中心接受NIPT检测的临界风险孕妇结果,探讨该技术用于临界风险孕妇检测胎儿染色体非整倍体的应用价值。
1 资料与方法
1.1研究对象2012年5月至2015年5月,在常州市妇幼保健院因唐氏筛查临界风险就诊,经知情同意自愿选择NIPT的1 066例单胎孕妇,孕龄16~24周,年龄16~40岁。
1.2判断标准血清学筛查临界风险:即 1/1 000≤21三体综合征(简称21三体)风险值小于1/300,1/1 000≤18三体综合征(简称18三体)风险值小于1/350)。
1.3方法
1.3.1孕中期血清学筛查经末次月经或B超确定孕周,所有对象抽取肘静脉血3 mL,室温静置30 min后离心分离血清,如在24 h内不能及时测定,则放置-20 ℃冰箱内保存。采用时间分辨免疫荧光分析法(Wallac1235 全自动时间分辨荧光免疫分析仪,美国PE公司)检测孕妇血清AFP和f -βHCG浓度。结合孕妇年龄、孕周、体质量、有无糖尿病等因素,应用Lifecycle软件计算风险值,包括神经管缺陷(NTD)风险值、唐氏综合征(DS)风险值、18-三体风险值。对临界风险者及时召回进行遗传咨询[3]。
1.3.2无创基因检测孕妇知情同意后,使用Streck公司生产的cell-free DNA BCT采血管抽取孕妇外周血10 mL,室温保存,48 h内分离血浆,4 ℃条件下1 600×g离心10 min,取上清液血浆16 000×g离心10 min,分离上清液血浆至EP管中,得到至少1.2 mL血浆。按Shaw等[4]的方法进行高通量测序检测,主要包括:提取血浆中胎儿游离DNA,构建文库。采用Illumina NextSeq cn500测序平台(美国Illumina公司)对其进行测序,获得不低于400 M的有效reads数,平均每个样本不低于4 M的reads。运行序列比对软件BWA map将测序所得序列比对至人类基因组参考序列图谱。使用自有软件BGPD v2.0.1针对对比对结果进行每条染色体序列个数统计。计算每条染色体reads所占比例(%hrN),sample代表需检测的样品,mean%ChrNreference和S.D.% ChrNreference分别代表参照样品组平均值和变异系数,并利用以下公式计算各个染色体Z值。利用Z值来评估样本的实际患病情况(cutoff:|Z|=3)。
1.3.3羊水细胞培养和核型分析对NIPT提示胎儿染色体非整倍体异常孕妇,进行产前遗传咨询,经知情同意后于孕18~24周在超声引导下行羊膜腔穿刺术,细胞培养、制片、阅片过程均按本实验室常规操作进行[3]。
1.4随访采用病例查询和电话的方式对妊娠结局进行随访,重点关注新生儿健康状况。
2 结 果
2.1无创基因检测和羊水细胞核型分析结果血清学筛查提示临界风险孕妇经知情同意有1 066例自愿接受NIPT进一步产前筛查,经高通量基因测序和生物信息学分析,提示有15例胎儿染色体非整倍体高风险,高风险率1.41%(15/1 066),包括4例21三体,2例18三体,1例18单体,3例47,XXX,2例47,XXY,3例45,XO。NIPT提示高风险孕妇均及时召回进一步产前遗传咨询,13例孕妇自愿接受羊膜腔穿刺术,经羊水细胞培养G显带染色体核型分析,发现7例结果与NIPT结果一致,包括4例21三体,1例18三体,1例47,XXX,1例47,XXY。6例样本羊水染色体核型分析均为正常核型,即NIPT为假阳性。见表1。
虽经充分产前咨询,仍有1例孕妇NIPT提示18单体,拒绝羊膜腔穿刺,出生后随访家属自述正常。另1例孕妇NIPT提示18三体,因胎儿B超示胎儿多发畸形予引产。
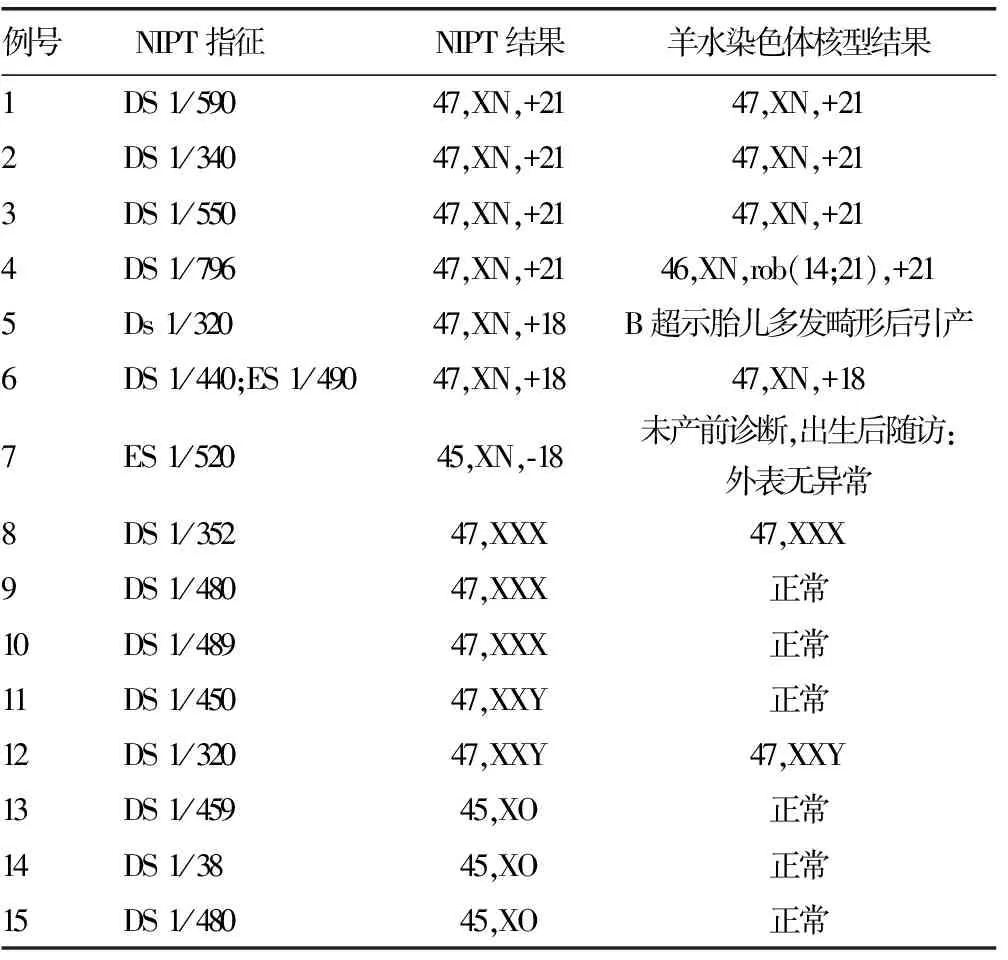
表1 临界风险中NIPT高危与产前诊断结果对比
2.2高通量基因测序应用于染色体非整倍体产前检查的准确性1 066例血清学产前筛查临界风险孕妇,经NIPT后羊水细胞核型分析确诊7例胎儿染色体非整倍体异常,发生率为0.66%(7/1 066),应用高通量基因测序技术检测染色体非整倍体异常的阳性预测值为53.85%(7/13)。其中,21三体及18三体的阳性预测值均为100%(5/5)。性染色体异常的阳性预测值为25.00%(2/8),性染色体异常假阳性率为75.00%(6/8)。
3 讨 论
孕中期进行母体血清学筛查,对筛查高风险孕妇进一步产前诊断,这是目前常用的产前筛查与诊断模式。经大量临床数据证实,在出生缺陷防控方面起到巨大作用,但由于技术本身的局限性,筛查检出率有待进一步提高。同时,以羊膜腔穿刺方法获取胎儿遗传物质进行染色体核型分析是产前诊断的金标准,但该方法为有创性、费时长,对实验要求高,孕妇接受程度不高。在实际工作中,回顾性分析本中心的假阴性病例,发现绝大多数漏诊病例均为临界风险孕妇。国内其他研究也显示,临界风险孕妇存在相当比例的漏诊可能,包括风险值临界风险和单纯MoM值异常[5]。因此,如果能够进一步加强临界风险孕妇的管理,将有效提高产前筛查的效能,提高出生人口素质。然而,是否需要将临界风险孕妇全部纳入羊水产前诊断值得进一步商榷。
近年来,随着分子生物学的发展,高通量基因测序产前筛查项目逐步应用于临床,国内外诸多报道均已证实,NIPT对T21、T18和T13的高敏感度、特异度、阳性预测值及正确率,与染色体核型分析技术有较高的一致性,并有无创性、高准确性和高通量等优势[6-10]。此方法的漏诊率较低,并且具有非介入性的优势,可作为介入性产前诊断资源不足情况下的一种有效补充。为了进一步提高筛查效率,国内专家特别将临界风险孕妇作为该技术适用人群,希望通过“高级”筛查技术减少漏诊的发生。与此同时,国际产前诊断协会2015年更新了NIPT专家共识,提出NIPT可以用于中风险人群,以减少漏诊的发生[11]。为进一步探讨该技术用于临界风险孕妇胎儿染色体非整倍体检测的应用价值,本文回顾性分析了本中心接受NIPT检测的临界风险孕妇结果。
本研究中,1 066例临界风险样本中,NIPT提示15例染色体非整倍体异常,除1例孕妇拒绝做羊膜腔穿刺,1例孕妇因胎儿超声示多发畸形引产,13例样本经染色体核型分析验证,7例与测序结果一致,其余6例为正常核型。应用高通量基因测序技术检测染色体非整倍体异常的阳性预测值为53.85%(7/13)。其中,21三体及18三体的阳性预测值均为100%(5/5),性染色体异常的阳性预测值为25.00%(2/8)。可见使用高通量测序作为无创产前检测技术对21三体及18三体的准确率较高,而对于性染色体异常的准确性相对较低,可能与该技术本身存在一定的技术劣势有关[12]。其数据分析部分对算法的依赖太大,给出的是一个统计分析的结果,故不能排除小概率事件的发生。上述结果由于样本例数偏少,有待进一步积累病例资料研究分析。
本研究中出现6例假阳性,NIPT均提示性染色体高风险,可能与母体因素、胎盘滋养层细胞、性染色体互换等因素有关。而随访过程中,6例孕妇均拒绝做进一步检测,故无法得知假阳性产生的确切原因。另外本研究中1例NIPT提示18三体的孕妇因胎儿B超提示胎儿多发畸形直接引产。据研究报道 ,超过90%的18三体胎儿中晚孕期可发现超声影像改变,故推测该例样本进行羊水诊断证实为18三体的可能性大[13]。另1例NIPT提示18单体的孕妇拒绝羊水穿刺,出生后随访,家属自述正常,但未做外周血染色体诊断,无法确诊。目前本单位获得了国家高通量基因测序NIPT临床试点资质,将加大该技术的规范应用,同时也会加强临床应用的研究,以得出更科学的临床数据。
综上所述,本研究中有7例孕妇因唐氏筛查检测结果为临界中风险进而选择NIPT,最终确诊胎儿为染色体数目异常。此类孕妇若按之前的产前诊断指导方案极有可能漏诊,若等患儿出生时才发现异常,不仅会给这些家庭带来巨大的精神和经济压力,更会给社会造成巨大的负担。因此,本课题组认为,NIPT可做为唐氏筛查临界风险孕妇的有效补充检测手段。
[1]Weisz B,Pandya P,Chitty L,et al.Practical issues drawn from the implementation of the integrated test for Down syndrome screening into routine clinical practice[J].BJOG,2007,114(4):493-497.
[2]边旭明,戚庆炜.染色体异常产前筛查和诊断工作任重而道远[J].中国实用妇科与产科杂志,2010,26(12):889-891.
[3]张晓青,韩小亚,孙达成,等.常州地区2005~2009年孕中期产前筛查结果分析[J].中国现代医学杂志,2011,21(10):1258-1260,1263.
[4]Shaw SW,Hsiao CH,Chen CY,et al.Noninvasive prenatal testing for whole fetal chromosomal aneuploidies:a multicenter prospective cohort trial in Taiwan[J].Fetal Diagn Ther,2014,35(1):13-17.
[5]王挺,文萍,李琼,等.产前血清学筛查MoM低值和临界风险在染色体异常诊断中的应用[J].江苏医药,2013,39(16):1942-1944.
[6]向萍霞,刘翎,冷培,等.游离胎儿DNA高通量基因测序技术在产前筛查的临床应用[J].实用妇产科杂志,2013,29(10):777-780.
[7]马京梅,潘虹,付杰,等.高危孕妇外周血胎儿游离核酸无创性产前检测的前瞻性研究[J].中华医学杂志,2015,95(11):849-852.
[8]Gil MM,Quezada MS,Revello R,et al.Analysis of cell-free DNA in maternal blood in screening for fetal aneuploidies:updated meta-analysis[J].Ultrasound Obstet Gynecol,2015,45(3):249-266.
[9]Norton ME,Jacobsson B,Swamy GK,et al.Cell-free DNA analysis for noninvasive examination of trisomy[J].N Engl J Med,2015,372(17):1589-1597.
[10]Zhang H,Gao Y,Jiang F,et al.Non-invasive prenatal testing for trisomies 21,18 and 13:clinical experience from 146,958 pregnancies[J].Ultrasound Obstet Gynecol,2015,45(5):530-538.
[11]Benn P,Borrell A,Chiu RW,et al.Position statement from the Chromosome Abnormality Screening Committee on behalf of the Board of the International Society for Prenatal Diagnosis[J].Prenat Diagn,2015,35(8):725-734.
[12]Bianchi DW,Parker RL,Wentworth J,et al.CARE Study Group.DNA sequencing versus standard prenatal aneuploidy screening[J].New Eng J Med,2014,370:799- 808.
[13]许争峰,徐倩君,曹荔,等.中晚孕期18三体综合征胎儿的超声特征[J].现代妇产科进展,2008,17(9):647-650.
Application of high-throughput sequencing in pregnant women with critical risk of serological screening*
Zhou Qin,Zheng Fangxiu,Chen Yingping,Zhang Xiaoqing,Zhang Bin,HuangRuiping,MiaoTingting,YuanPei△,YuBin
(ChangzhouMaternalandChildHealthCareHospital,theAffiliatedChangzhouMaternalandChildHealthCareHospitalofNanjingMedicalUniversity/ChangzhouPrenatalDiagnosisCenter,Changzhou,Jiangsu213003,China)
ObjectiveTo evaluate the clinical value of the application high-throughput sequencing for the detection of fetal chromosome in pregnant women with critical risk.MethodsA total of 1 066 pregnant women with critical risk of serological screening were collected from May 2012 to May 2015 at our center.The peripheral venous blood from the pregnant women was drawn,plasma DNA was extracted,and the sequencing library was prepared.High-throughput sequencing procedure was carried out on Illumina NextSeq500 platform.The cases of sex chromosomal abnormalities were advised to accept prenatal fetal chromosomal karyotype analysis of amniotic fluid cells using G-banding technique.ResultsHigh-throughput sequencing revealed 15 cases of sex chromosomal aneuploidies in 1 066 pregnant women.After receiving informed consent,13 cases of pregnant women voluntarily received amniotic fluid prenatal diagnosis,of which 7 cases were consistent with the sequencing results,including four cases of Trisomy21,one cases of Trisomy18,one cases of 47,XXX and one cases of 47,XXY,while the other six cases were confirmed to be normal karyotype.ConclusionHigh-throughput sequencing can be used as an effective method for the detection of critical pregnant women with critical risk.
prenatal diagnosis;DNA;high-throughput sequencing;critical risk;non-invasive prenatal testing
江苏省常州市科技支撑计划(社会发展)项目(CE20155055)。作者简介:周琴(1983-),主治医师,本科,主要从事临床优生优育、遗传咨询、产前诊断等工作。△
,E-mail:ybcz0519@163.com。
R175
A
1671-8348(2016)27-3780-03
2016-02-22
2016-04-26)

