冻干奶粉样品中大肠杆菌O157和O111的检测方法
曹 文 博, 郑 秋 月, 张 公 亮, 侯 红 漫
( 1.大连工业大学 食品学院, 辽宁 大连 116034;2.辽宁出入境检验检疫局, 辽宁 大连 116001 )
冻干奶粉样品中大肠杆菌O157和O111的检测方法
曹 文 博1,郑 秋 月2,张 公 亮1,侯 红 漫1
( 1.大连工业大学 食品学院, 辽宁 大连116034;2.辽宁出入境检验检疫局, 辽宁 大连116001 )
应用实时荧光PCR技术建立一种检测冻干奶粉样品中大肠杆菌的方法。通过传统培养法将大肠杆菌O157和O111分离纯化,根据大肠杆菌O157和O111的两对特异性基因rfbE和wbdl设计引物和探针,进行RT-PCR检测;由于该大肠杆菌可能是产志贺毒素大肠杆菌,对STEC的特异性毒力基因stx1、stx2b、eae设计引物和探针并检测。结果表明,该冻干奶粉样品中含有大肠杆菌O157和O111,且致病菌O157检出毒力基因stx1、stx2b、eae,即产志贺毒素与黏附素,致病菌O111检出毒力基因eae,不产志贺毒素而产黏附素。该方法能准确分离大肠杆菌O157和O111,利用实时荧光PCR的高灵敏度和特异性快速检验致病菌及其特异性毒力基因。
大肠杆菌O157;大肠杆菌O111;实时荧光PCR;冻干奶粉
0 引 言
肠出血性大肠杆菌(EHEC) O157能产生致死性志贺毒素(Shiga toxin, Stx),1982年被确认为严重致病菌。O157型是STEC中致病力最强、流行趋势最广及发病率最高的血清型,感染100 CFU O157 STEC就能致病,病患接触者也能引起继发感染,可引起人类腹泻、出血性结肠炎(hemorrhagic colitis, HC),溶血性尿毒综合征(hemolytic uremic syndrome, HUS),甚至死亡[1]。近年来,非O157型STEC中一些高致病力菌株对人类的健康也存在严重威胁,多达200多种的非O157菌株与人类疾病相关,如O111、O26、O45、O103等[2]。目前世界范围内对STEC仍缺乏有效的控制手段[3-4]。
对食源性致病菌大肠杆菌的检测未达到分型,检测后对致病菌的产毒情况缺乏了解,这给公共食品卫生和人类生命安全带来了极大的威胁。本研究将传统培养法与实时荧光PCR结合,利用3M纸片法初步判断样品中含有大肠杆菌,经分离纯化,以特异基因rfbE、wbdl[5]和STEC特异性毒力基因stx1、stx2b、eae作为大肠杆菌O157和O111检测的靶基因[6],应用RT-PCR建立一种检测冻干奶粉样品中的大肠杆菌及其毒力因子的方法。
1 材料与方法
1.1材料
NB营养肉汤、TSB胰蛋白胨大豆肉汤、EMB琼脂、普通营养琼脂、TSI三糖铁琼脂,英国OXOID 公司;3M PetrifilmTME.coli纸片,美国3M公司;O157显色培养基,上海欣中生物工程有限公司;O157、O111诊断血清,丹麦国家血清研究公司;TaKaRa MiniBEST Bacterial Genomic DNA Extraction Kit Ver. 2.0(Code:DV810A)、引物、Taqman探针,大连宝生物公司。荧光定量PCR仪,美国ABI公司。
1.2方法
1.2.1菌种的分离
挑取蓝色带有气泡的单菌落进行血清鉴定,经鉴定后的单菌落划线接种于EMB、O157显色培养基,于(36±1) ℃下过夜培养,观察菌落特征,挑取O157显色培养基上的单菌落接种于普通肉汤过夜培养,待提取DNA。
1.2.2细菌DNA的提取
取4 mL单菌落的肉汤培养基于100 ℃下煮沸15 min灭活,用试剂盒提取细菌DNA。
1.2.3引物与Taqman探针
根据大肠杆菌O157和O111的特异性基因rfbE和wbdl,以及STEC的特异性毒力基因stx1、stx2b、eae为靶基因设计引物探针,如表1、2所示。
1.2.4荧光PCR的反应体系与反应条件
PCR反应体系为25 μL,含Premix Ex TaqTM12.5 μL, Rox Reference Dye Ⅱ 0.5 μL,上下游引物、探针各1 μL,ddH2O 8 μL,模板2 μL。采用两步法PCR扩增:95 ℃预变性10 s,95 ℃ 5 s,60 ℃ 34 s,共运行40个循环,并于60 ℃ 收集荧光进行检测,设阴性菌及水对照检验特异性[7-8]。

表1 大肠杆菌O157和O111的特异性基因rfbE、wbdl引物和探针序列
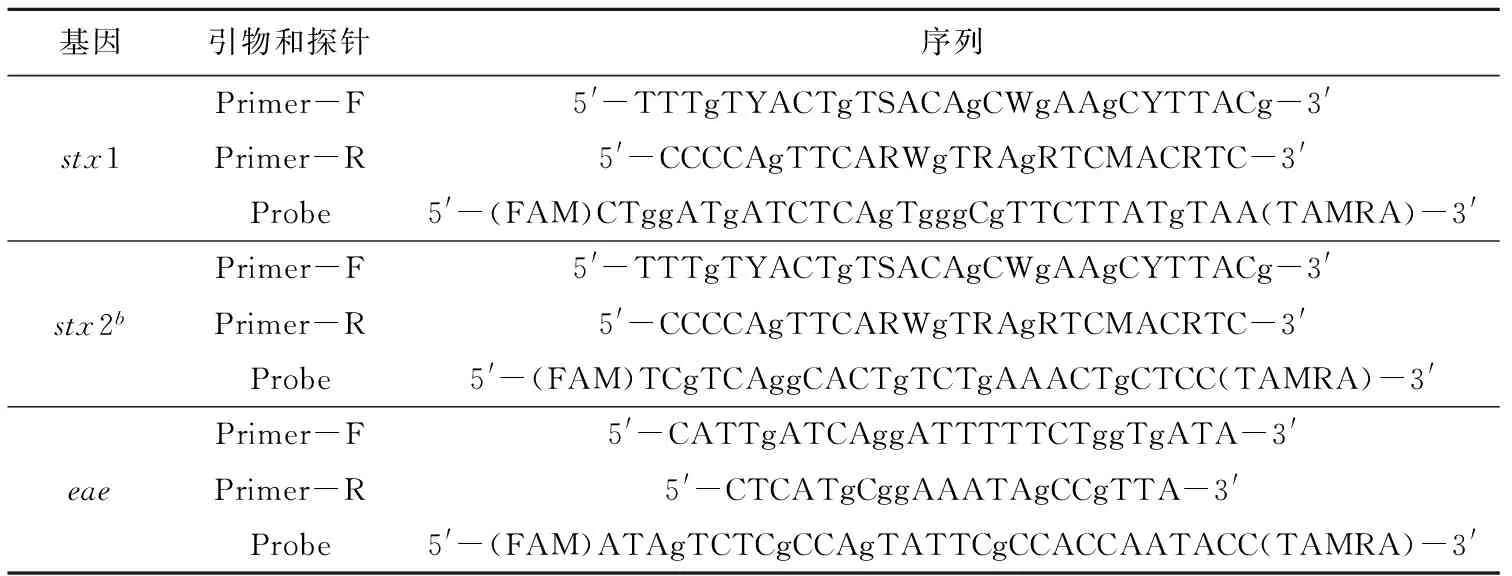
表2 产志贺毒素大肠杆菌的毒力基因stx1、stx2b、eae引物和探针序列
2 结果与讨论
2.1菌种的培养、分离与纯化
奶粉样品在TSB肉汤混浊生长;3M PetrifilmTME.coli纸片出现蓝色带有气泡单菌落,为大肠杆菌,结果如图1所示。O157与O111血清试验凝集;EMB琼脂培养出典型的具有金属光泽的深紫色菌落;O157显色培养基培养出圆形、较小、淡紫色菌落为大肠杆菌O157,培养出圆形、蓝色单菌落为大肠杆菌O111,结果见图2、3。
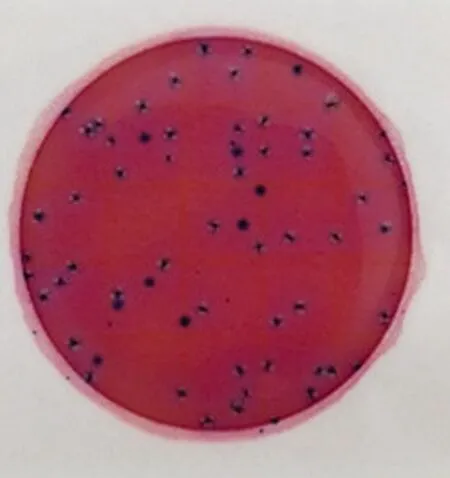
(a) 稀释度10-7 (b) 稀释度10-8
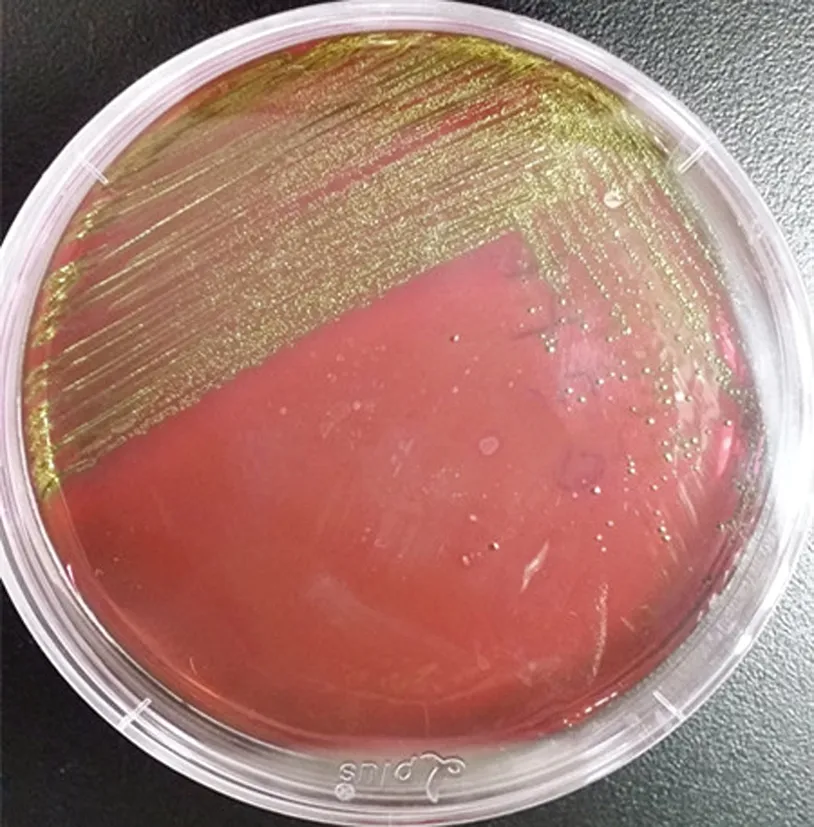
(a) 琼脂培养基 (b) 显色培养基
图2大肠杆菌O157在EMB琼脂和显色培养基上的生长情况
Fig.2GrowthofE.coliO157onEMBagarandchromogenicagar
2.2荧光PCR鉴定结果
E.coliO157中rfbE基因检测结果为阳性,stx1、stx2b、eae基因检测结果均为阳性,Ct均小于35,表明冻干奶粉样品中含有产志贺毒素且产黏附素的大肠杆菌O157型;E.coliO111中wbdl 基因检测结果为阳性,eae基因检测结果为阳性,Ct均小于35,其余为阴性,无扩增曲线,表明奶粉样品中含有不产志贺毒素、产黏附素的大肠杆菌O111型[9-10],结果如表3所示。
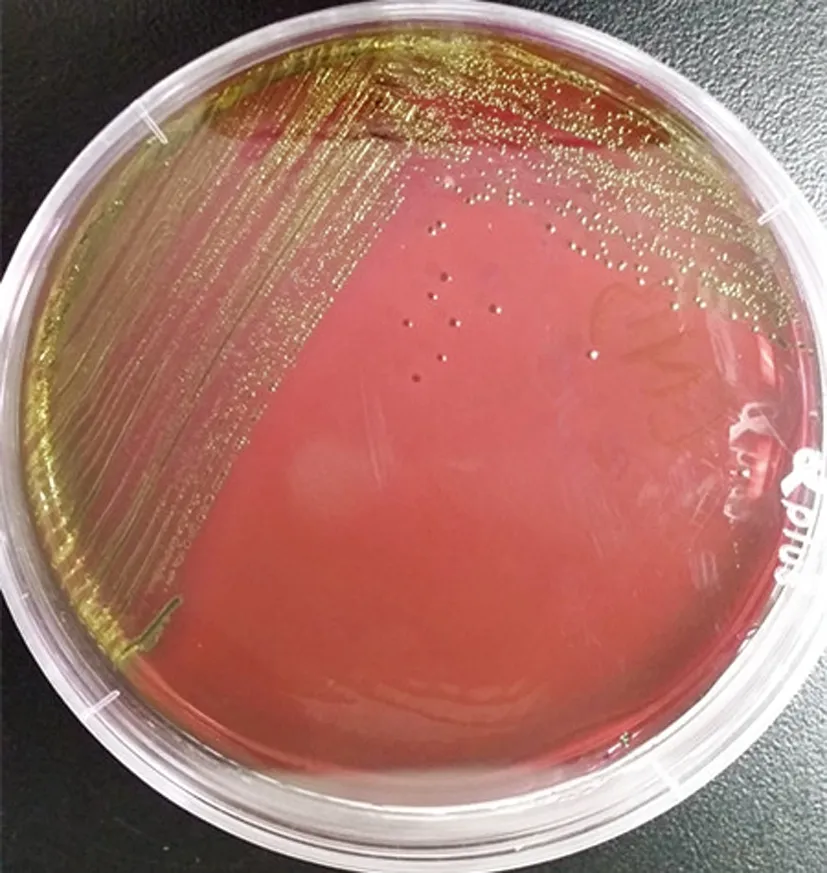
(a) 琼脂培养基 (b) 显色培养基
图3大肠杆菌O111在EMB琼脂和显色培养基上的生长情况
Fig.3GrowthofE.coliO111onEMBagarandchromogenicagar
表3冻干奶粉中大肠杆菌O157与O111的荧光PCR鉴定结果
Tab.3RT-PCRidentificationresultofE.coliO157andO111
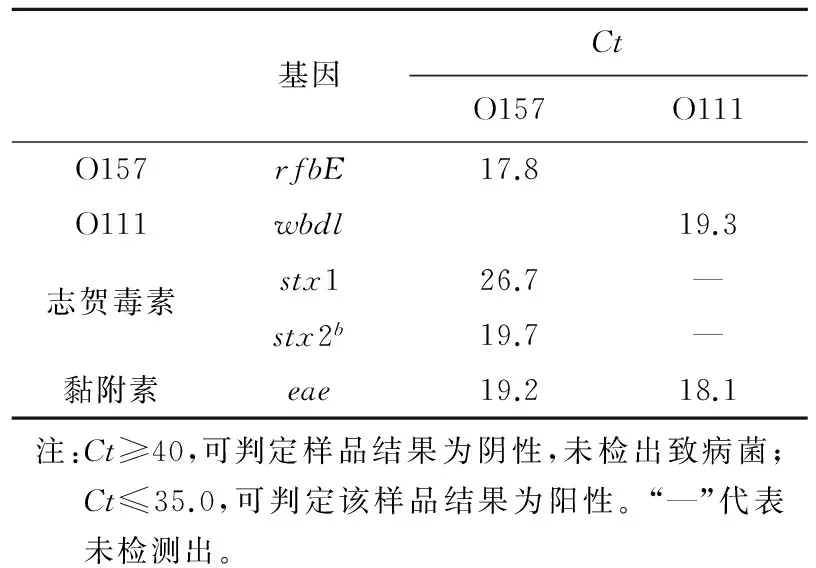
基因CtO157O111O157rfbE17.8O111wbdl19.3志贺毒素stx126.7—stx2b19.7—黏附素eae19.218.1注:Ct≥40,可判定样品结果为阴性,未检出致病菌;Ct≤35.0,可判定该样品结果为阳性。“—”代表未检测出。
荧光PCR扩增曲线光滑平稳,峰值较高,阴性菌及空白对照的检测结果均为阴性,结果如图4、5所示。
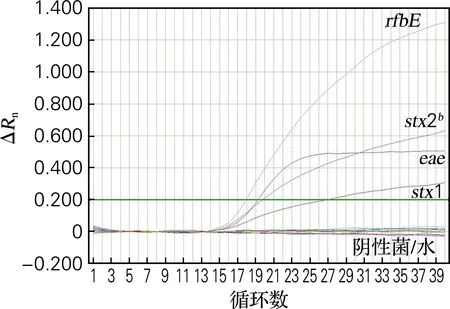
图4 大肠杆菌O157荧光PCR扩增曲线

图5 大肠杆菌O111荧光PCR扩增曲线
3 结 论
本实验将传统培养法与实时荧光PCR技术结合,利用3M EC纸片法初步判断样品中含有大肠杆菌,通过血清学鉴定以及菌落特征的差异将两种致病菌分离纯化,以特异基因rfbE和wbdl及STEC特异性毒力基因stx1、stx2b、eae作为大肠杆菌O157和O111检测的靶基因,设计引物、探针,检测冻干奶粉样品中的大肠杆菌,并研究致病菌的产毒情况。结果表明,实时荧光PCR扩增曲线光滑平稳,Ct均小于35,冻干奶粉样品中含有E.coliO157和O111,E.coliO157产志贺毒素与黏附素,E.coliO111不产志贺毒素而产黏附素。
仅依靠传统培养方法可以检测出大肠杆菌,却无法进一步对该致病菌的携带毒素情况以及危害能力进行检测。目前世界范围内对STEC仍缺乏有效的控制手段,STEC致病能力很强,是一类危害严重的食源性病原菌,携带志贺毒素(stx1、stx2)基因是其共有的一个特征,该基因是疾病最终发展成为溶血性尿毒综合征HUS的关键因素,紧密黏附素eae可与stx1/stx2相互作用导致肾脏损伤。本实验所设计的引物、探针用于实时荧光PCR,Ct平均值为20,较其他相比敏感性有较大提高,具有广阔的应用前景和较强的实际应用价值,为STEC的检测和携带毒素情况及其致病情况的研究提供了一种有效的检测方法[9,11]。产志贺毒素型大肠杆菌的流行情况及各个毒力因子的致病作用,对食品卫生公共安全有着重要的意义,STEC对人类的危害不容忽视。
[1] 刘飞,宋定州,李键,等.产志贺毒素大肠杆菌的流行病学及致病因子的研究进展[J].中国畜牧兽医,2014,41(1):187-191.
[2] 陈洪章,邹全明.肠出血性大肠杆菌(EHEC)O157:H7志贺毒素研究进展[J].中国人兽共患病学报,2007,23(1):83-85.
[3] 徐德顺,沈月华,程平庆.大肠杆菌O157:H7实时荧光PCR快速检测方法的建立[J].上海预防医学杂志,2009,21(4):174-177.
[4] 张建华,陆群英,程苏云,等.实时PCR在大肠杆菌O157:H7快速检测中的应用[J].中国人兽共患病学报,2007,23(8):839-841.
[5] 郝江燕,胡文忠,冯叙桥,等.食品中大肠杆菌生物检测方法的研究进展[J].食品工业科技,2013,34(15):370-374.
[6] 旷代,潘海建,杨筱薇,等.产志贺毒素大肠杆菌流行病学及主要毒力因子研究进展[J].中国畜牧兽医,2013,40(8):180-184.
[7] 周微,张伟钦,付宇,等.荧光定量PCR方法快速检测原料乳中的大肠杆菌[J].中国乳品工业,2009,37(19):39-42.
[8] 胡慧,陈雅君,段志刚,等.大肠杆菌O157:H7特异基因的实时荧光定量PCR检测[J].食品科学,2011,32(12):278-282.
[9] 孙庆元,王建军,刘建文,等.抗大肠杆菌荧光抗体的制备及其特性[J].大连工业大学学报,2012,31(5):322-325.
[10] 王昊宇,张公亮,侯红漫.应用SYBR Green Ⅰ溶解曲线检测食源性单增李斯特菌[J].食品工业科技,2013,34(3):77-78.
[11] IZHAR U H, VIC G, ROB K, et al. Development of a rapid quantitative PCR assay for direct detection and quantification of culturable and non-culturableEscherichiacolifrom agriculture watersheds[J]. Journal of Microbiological Methods, 2007, 69(3): 480-488.
Detection method forEscherichiacoliO157 and O111 in lyophilized milk powder
CAOWenbo1,ZHENGQiuyue2,ZHANGGongliang1,HOUHongman1
( 1.School of Food Science and Technology, Dalian Polytechnic University, Dalian 116034, China;2.Liaoning Entry-Exit Inspection and Quarantine Bureau, Dalian 116001, China )
TherealtimefluorescencePCRwasappliedtoestablishadetectionmethodforEscherichia coliO157andO111inlyophilizedmilkpowder. E. coliO157andO111wereisolatedandpurifiedthroughtraditionalculturemethod,andtheprimersandprobesweredesignedbasedontherfbEgeneandwbdlgeneofE. coliO157andO111.ConsideringthepossibilityofSTEC,theprimersandprobesweredesignedbasedonthetoxingenesstx1, stx2b, eaeandthegenesweredetectedbyRT-PCR.TheresultsshowedthatlyophilizedmilkpowderwascontaminatedbyE. coliO157andO111. Stx1andstx2bgenesweredetectedinE. coliO157whichcouldproduceShigatoxinandadhesin,whiletheeaegenewasdetectedinE. coliO111whichcouldproduceadhesin. E. coliO157andO111couldbeseparatedaccuratelybyRT-PCRmethod,indicatingthemethodcouldbeusedinquicklydetectingforthepathogensandtoxingenesinhighsensitivityandspecificity.
EscherichiacoliO157;EscherichiacoliO111; real-time PCR; lyophilized milk powder
2015-03-06.
质检公益性行业科研专项(201210043).
曹文博(1991-),女,硕士研究生;通信作者:张公亮(1978-),男,副教授.
TS207.4
A
1674-1404(2016)05-0317-04
曹文博,郑秋月,张公亮,侯红漫.冻干奶粉样品中大肠杆菌O157和O111的检测方法[J].大连工业大学学报,2016,35(5):317-320.
CAO Wenbo, ZHENG Qiuyue, ZHANG Gongliang, HOU Hongman. Detection method forEscherichiacoliO157 and O111 in lyophilized milk powder[J]. Journal of Dalian Polytechnic University, 2016, 35(5): 317-320.

