一起典型猪瘟病毒感染病例的诊断与分析
杨 超
(1.襄阳正大农牧食品有限公司,湖北 襄阳 441104;2.长江大学动物科学学院,湖北 荆州 434025)
一起典型猪瘟病毒感染病例的诊断与分析
杨 超1,2
(1.襄阳正大农牧食品有限公司,湖北 襄阳 441104;2.长江大学动物科学学院,湖北 荆州 434025)
2015年6月湖北某农户饲养的150头的育肥猪,先后出现了弓背喜卧、粪便干结、全身皮肤出血等症状。病理剖检可见全身皮肤及心、肝、脾、肺、肾、胃、膀胱等多脏器广泛出血斑;采集病猪病变组织,提取RNA,用猪瘟病毒基因特异性引物进行RT-PCR检测,琼脂糖凝胶电泳结果显示,病料呈猪瘟病毒核酸阳性,确诊病猪为猪瘟病毒感染。
猪瘟;病理剖检;RT-PCR检测
猪瘟(Classical Swine Fever,CSF),曾称为猪霍乱(Hog Cholera,HC),在我国俗称烂肠瘟。其是由黄病毒科瘟病毒属的猪瘟病毒(CSFV)引起的猪的一种以高热稽留、全身广泛性出血、败血和母猪繁殖障碍为特征的热性高度致死性传染病,曾经给我国及世界养猪业的发展造成了巨大损失[1-2]。随着猪瘟疫苗的广泛使用,猪瘟在世界范围内得到了一定程度的控制,有的国家已经消灭了猪瘟[3-4]。近年我国虽无大规模猪瘟疫情暴发,但猪瘟仍不时在一些不注重防疫的中小型养殖场或农户饲养的猪群中散发或流行。2015年6月湖北某农户饲养的150头育肥猪,先后出现了弓背喜卧、被毛粗乱、粪便干结、眼角分泌物增多,随后腹部及四肢内侧出现出血斑等症状,经病理剖检和RT-PCR诊断确诊为猪瘟病毒感染。
1 材料与方法
1.1 试验材料湖北某农户饲养的育肥猪病猪及剖检采集的淋巴结和肾脏等病变组织。
分子生物学试剂:Trizol试剂、RT试剂盒为Invitrogen产品;ExTaq酶,dNTP等PCR相关试剂为宝生物(大连)有限公司产品,PCR引物参照已报道的猪瘟病毒Alfort株的基因序列E2保守区[5-7]设计1对引物HCV-F/HCV-R,扩增目标片段大小约为440 bp,引物由武汉擎科创新生物技术有限公司合成,序列分别为:
HCV-F:5′-AATGAGATTGGGTTACTCGG-3′;
HCV-R:5′-ACCACAGTGGAA AACGAA GAT-3′。
1.2 试验方法
1.2.1 临床诊断与剖检:观察和记录猪群病猪临床症状,剖检死亡猪只,检查大体病变,并采取具有典型病变的组织,-70℃冷冻备用。
1.2.2 总RNA提取:总RNA提取,按Trizol试剂盒操作说明进行:取具有明显病变的淋巴结或肾脏约 100 mg,置于 1.5 mL EP管中,加入 1 mL Trizol,放入磁力组织破碎匀浆器具中,匀浆破碎10 min,室温静置10 min,加入200 μL氯仿,用力颠倒离心管以混匀,静置2 min,12 000 r/min离心10 min,取上层水相移至新EP管中,加入等体积的异丙醇,振荡混匀,-20℃冰箱静置 20 min,12 000 r/min,高速离心15 min,弃上清液。加入300 μL 75%酒精振荡洗涤,12000r/min离心,弃上清液。室温静置10mim,加入RNase free水,-70℃冷冻保存。
1.2.3 RT-PCR反应及电泳:RT反应采用20 μL体系:5×Buffer 4 μL,10 mM 的 dNTP 1 μL,40 U/μL的 RNase inhibitor 1 μL,2 mM 的引物 PR 2 μL,5 U/μL 的 AMV 反转录酶 2 μL, 待 检 RNA 2.5 μL,RNase free H2O 7.5 μL加入PCR管中,置PCR仪中。 反应条件为:42℃60min,95℃5min,4℃10min。
PCR 采用 25 μL 反应体系:10×Ex Buffer(Mg2+)2.5 μL,2.5 mM dNTP 2 μL,HCV-F/HCV-R 各 1 μL,反转录产物 1 μL,ExTaq 0.25 μL,H2O 17.25 μL。反应条件为 94℃预变性 3 min;94℃ 30 s,55℃30 s,72℃ 40 s,30 循环;72℃ 10 min;4℃ 10 min。 PCR产物用1%琼脂糖凝胶进行检测。
2 试验结果
2.1 临床症状临床观察猪群,猪只多被毛粗乱、弓背喜卧、眼角可见分泌物和泪斑,有的猪只粪便干结,有的稀薄,部分猪只腹部及四肢内侧皮肤可见出血斑等症状。
2.2 剖检病变对死亡的猪只进行剖检,可见病猪心肌及心冠脂肪出血明显;脾脏明显梗死,边缘呈锯齿状;肾脏表面可见针尖状出血点,膀胱内膜出血有大小不一的出血斑,胃内膜出血并有溃疡斑,见图1。

图1 病猪剖检内脏病变
2.3 RT-PCR结果提取病变淋巴结和肾脏组织总RNA,用参照已发表的猪瘟病毒序列E2保守区设计合成的猪瘟特异性引物,进行猪瘟病毒核酸RT-PCR检测,结果扩增出了约440 bp的条带,显示病料呈猪瘟核酸阳性,见图2。
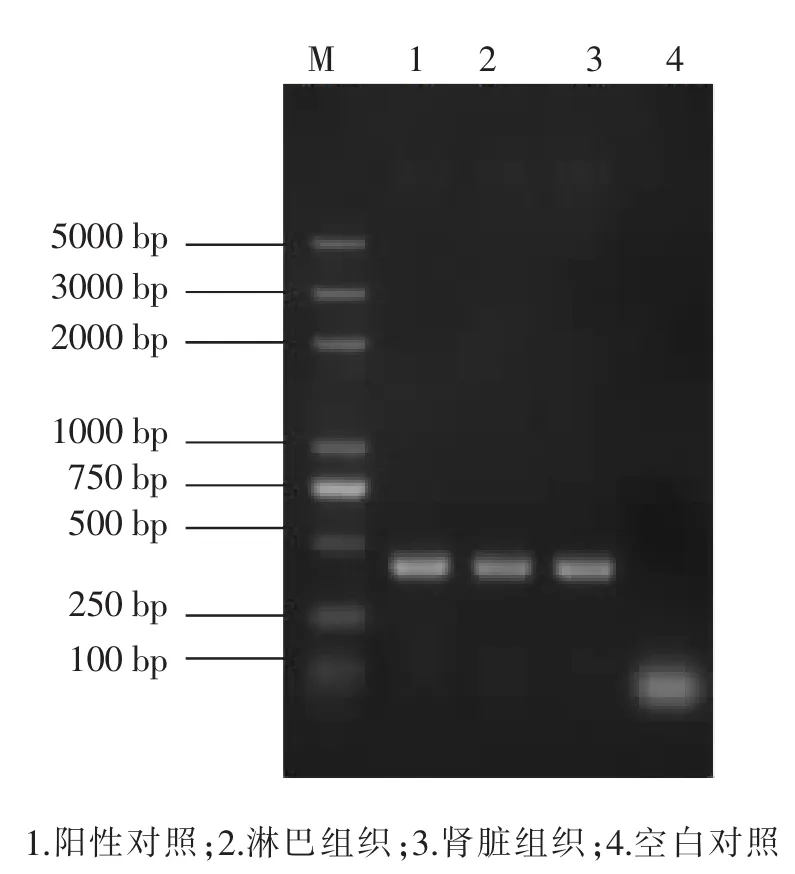
图2 RT-PCR检测猪瘟病毒核酸
3 讨论
典型的猪瘟往往是由强毒株引起的,开始时猪群内可能仅有个别猪只食欲减少,神情呆滞,弓背垂尾,体温升高,便秘[5]。随着病程的发展,猪群内有更多的猪发病,最初的病猪可能食欲废绝,出现眼结膜炎,两眼有多量黏液脓性分泌物,随后下痢,有的发生呕吐、惊厥,出现步态不稳等衰弱症状,常在几天内死亡。
近年来,猪瘟的流行和发病特点已转变为以非典型猪瘟为主的流行形式,出现了临床症状显著减轻,发病率较低,潜伏期及病程较长多呈散发的温和型猪瘟,这些病例往往病变不明显,常需依赖实验室诊断才能确诊[6]。
该研究通过对猪群进行临床观察,发现猪群症状符合猪瘟临床症状。对死亡病猪进行剖检发现,心脏、心冠脂肪、肾脏、膀胱及胃内膜等内脏器官广泛性出血;脾脏梗死,边缘呈锯齿状,呈现典型的猪瘟示病症状[7]。在临床诊断、病理剖检的基础上进一步进行RT-PCR病原分子生物学检测,扩增出了猪瘟病毒核酸,确诊该猪群为猪瘟感染。
对发病原因进行调查分析发现,养殖户一直未对猪群进行猪瘟疫苗免疫,可能是造成该次发病的主要原因。这种免不免疫都无所谓的侥幸心理也有可能正是造成当前猪瘟在我国中小型养殖场和养殖户的猪群中仍时有发生的根本原因。因此,中小型养殖户一定要提高防疫意识,采取积极有效的免疫措施,进行科学养殖,方能降低风险,提高养殖经济效益。
[1]吴忆春.某猪场猪伪狂犬病病毒与猪瘟病毒混合感染的诊断[J].动物医学进展,2014,35(6):171-174.
[2]高顺.浅谈猪瘟病毒[J].畜牧兽医科技信息,2015(10):89.
[3]王在时.猪瘟防治研究的回顾和展望[M].北京:中国农业出版社,1996:64-71.
[4]仇华吉,童光志,沈荣显.猪瘟兔化弱毒疫苗——半个世纪的回顾[J].中国农业科学,2005,38(8):1675-1685.
[5]邱杨,赵丽,卢小雨,等.五种动物疫病诊断方法研究进展[J].动物医学进展,2012,33(12):156-160.
[6]李文良,毛立,杨蕾蕾,等.猪瘟病毒糖基化E2蛋白和E0蛋白的协同免疫保护作用 [J].江苏农业学报,2015,31(2):357-361.
[7]MEYERS G,RUMENAPF T,THIE H.Molecular cloning and nucleotide sequencing of hog cholera virus [J].Virology,1989,171:55-56.
S858.282.651
A文章顺序编号:1672-5190(2016)01-0100-02
2015-12-31
杨超(1977—),男,硕士研究生,主要研究方向为动物疾病防控。
(责任编辑:赵景娣)

