鹅肉肌原纤维蛋白乳化及理化性质
计红芳,张令文,江开欣,王 方,刘慈坤,马汉军
(河南科技学院食品学院,河南新乡 453003)
鹅肉肌原纤维蛋白乳化及理化性质
计红芳,张令文*,江开欣,王方,刘慈坤,马汉军
(河南科技学院食品学院,河南新乡 453003)
为丰富鹅肉肉糜类产品,对鹅肉肌原纤维蛋白乳化及理化性质进行了研究。结果表明,鹅腿肉肌原纤维蛋白含量最高(48.27 mg/g),鹅胸肉次之,鸡胸肉最低(23.18 mg/g),三者差异显著(p<0.05);鹅腿肉自由巯基含量最高(2.85×10-4μmol/mg),鹅胸肉次之,猪腿肉最低(0.705×10-4μmol/mg),三者差异显著(p<0.05);蛋白浓度在2.5~7.5 mg/mL时,鹅腿、胸肉溶解度迅速上升,之后趋于平稳,浓度在12.5 mg/mL时,鹅腿蛋白溶解度>鹅胸>猪腿,三者差异显著(p<0.05),溶解度与浊度呈极显著负相关(r=-0.978,p<0.01);随蛋白浓度提高,鹅肉乳化稳定性指数与乳化能力均呈上升趋势,在各蛋白浓度条件下,鹅腿肉始终最高,鹅胸肉次之,猪腿肉最低;随蛋白浓度增加,鹅腿、胸肉乳化活性指数均呈下降趋势,当蛋白浓度在7.5 mg/mL后,二者没有显著差异(p>0.05),但始终高于对照。鹅腿肉的乳化能力最强,最适合制作糜类肉制品。
鹅肉,肌原纤维蛋白,乳化,溶解度,浊度
鹅肉营养丰富,其蛋白含量高于一般畜禽肉,且不饱和脂肪酸含量较高,富含各种维生素及微量元素,兼具益气补虚、和胃止渴、止咳平喘等功效,是越来越受欢迎的禽类制品[1]。目前,对鹅肉的研究主要集中在营养成分、品质特性、嫩化、产品工艺优化等方面,而对鹅肉乳化性质的研究鲜有报道[2-4]。
研究表明,肉中起乳化作用的蛋白主要是肌原纤维蛋白,它不仅能赋予肉制品独特的口感、风味和营养,还能对肉糜或类肉糜制品品质起决定性作用[5]。Grossi 等研究了高压对猪肉肌原纤维蛋白溶解度等功能特性的影响[6],陆健康等对多浪羊肉肌原纤维蛋白乳化性进行了研究[7],闫海鹏等研究表明,鸡肉肌原纤维蛋白乳化能力、乳化稳定性指数、乳化活性指数均高于猪肉,牛肉最低[8]。以猪肉、牛肉、鸡肉为主要原料的乳化型香肠(火腿)在市场上已大面积销售,而鹅肉乳化肠(火腿)等未广泛流通。因此,有必要研究鹅肉肌原纤维蛋白乳化特性,为鹅肉糜类产品的深加工,提供科学理论指导。
本文以猪腿肉、鸡腿肉、鸡胸肉为对照,开展鹅腿肉、鹅胸肉肌原纤维蛋白乳化及理化性质研究,从而可以选择出更加适合制作糜类产品的鹅肉部位,以丰富我国鹅肉产品种类,满足消费者需求。
1 材料与方法
1.1材料与仪器
原料肉:猪腿、鹅胸、鹅腿、鸡胸、鸡腿购于河南省新乡市永辉超市;金龙鱼牌大豆油购于河南省新乡市大学城易购超市;乙二醇双(2-氨基乙基醚)四乙酸(EGTA)、5,5二硫代二硝基苯甲酸盐(DTNB)购自美国Sigma公司;十二烷基磺酸钠(SDS)、牛血清蛋白(纯度≥99%)生化试剂,其他试剂均为国产分析纯。
BSA224S型电子天平赛多利斯科学仪器有限公司;JJ-2型组织捣碎匀浆机江苏常州国华电器有限公司;3-18K型高速冷冻离心机德国西格玛;TU-1810型紫外可见分光光度计北京普析通用仪器责任有限公司;FE30型电导率仪梅特勒-托利多仪器(上海)有限公司;FE30型pH计梅特勒-托利多仪器(上海)有限公司。
1.2实验方法
1.2.1肉的预处理选用屠宰24~48 h的新鲜肉,剔除多余的脂肪以及结缔组织,将其剪碎放入真空袋中在-20 ℃左右冷冻24 h,提取肌原纤维蛋白前在4 ℃解冻约15 h[8]。
1.2.2肌原纤维蛋白的提取与浓度测定根据Xiong等的方法进行改进[9]。提取温度0~4 ℃,分离提取缓冲液:1 mmol/L EGTA,2 mmol/L MgCl2·6H2O,0.2 mol/L NaCl,10 mmol/L Na2HPO4/NaH2PO4,pH=6.8。以肉∶分离提取缓冲液=1∶4(w/v)的比例,匀浆。2000×g、4 ℃离心15 min收集沉淀后,分散在4倍体积分离提取缓冲液中,重复离心2次,期间均用匀浆机在冰浴条件下匀浆30 s。第2次离心后,将沉淀重新分散在4倍体积0.2 mol/L NaCl溶液中,用纱布过滤,2000×g、4 ℃离心15 min收集沉淀,重复2次。将沉淀分散在4倍体积的去离子水中洗脱2次,离心后所得沉淀即为肌原纤维蛋白。根据双缩脲法做标准曲线在540 nm处测定蛋白质量浓度[8]。
1.2.3肌原纤维蛋白浊度和溶解度测定将肌原纤维蛋白溶液在25 ℃中水浴20 min。采用缓冲溶液作为空白对照,在340 nm处比色,即为浊度[10]。将肌原纤维蛋白原液分别稀释到不同质量浓度,将其在1500×g、4 ℃条件下离心10 min,采用双缩脲法540 nm处测蛋白浓度。根据以下公式计算溶解度[11]。
S(%)=Cx/Cy×100
式中:S为溶解度;Cx为离心后上清液中的蛋白浓度(mg/mL);Cy为离心前的蛋白浓度(mg/mL)。
1.2.4肌原纤维蛋白活性自由巯基测定采用Ellman比色法并进行一定改进[12]。取1 mL肌原纤维蛋白溶液于试管中,加入5 mL在25 ℃水浴锅恒温的0.1 mol/L的DTNB溶液,摇匀,准确静置 10 min,立即于波长412 nm处比色。公式:
-SH/(μmol/mg)=A×(D/ε)×ρ
式中:-SH为巯基含量;A为波长412 nm处吸光度;D为稀释倍数;ε为13600(mol/L);ρ为蛋白质量浓度(mg/mL)。
1.2.5肌原纤维蛋白乳化活性指数(EAI)和乳化稳定性指数(ESI)的测定采用Pearce和Agyare等的方法并稍作调整[13-14]。取28 mL稀释后的肌原纤维蛋白溶液于烧杯中,并加入7 mL大豆油,匀浆1 min后制成乳状液。使用移液枪迅速从新制的乳状液底部移取60 μL,并用30 mL 1 mg/mL的SDS溶液稀释500倍,空白对照为1 mg/mL的SDS溶液,立即在500 nm下测定样品的吸光度A0。将乳状液静置5 min后,采用同样的方法测定样品的吸光度A5。根据下式计算:
ESI=5A0/(A0-A5)
EAI=[2×2.303/(C×Φ×104)]×500×A0
式中:C为乳化前肌原纤维蛋白质量浓度,mg/mL;Φ为乳状液中大豆油所占的体积比例,%[15]。
1.2.6肌原纤维蛋白乳化能力(EC)的测定采用电导率法测定[11]。取15 mL稀释后的肌原纤维蛋白溶液,加入10 mL大豆油,组织匀浆,其间使用滴定管匀速加入一定量的大豆油,同时观察电导率的变化,当乳状液的电导率出现突变时记录大豆油使用量。计算公式为:
EC=V/m
式中:V-加入大豆油的总体积(mL);m-肌原纤维蛋白的质量(mg)。
1.3数据处理与分析
数据采用Excel 2010与 SPSS 13.0 软件进行处理。采用 ANOVA 进行方差分析,采用 LSD法检验进行显著性分析,相关性检验采用Pearson相关分析,p<0.05 判定为影响显著。所有数据均为三次重复的平均值。
2 结果与分析
2.1鹅肉肌原纤维蛋白含量分析
由图1可知,5种肉类肌原纤维蛋白含量各不相同。鹅肉的肌原纤维蛋白含量(腿部48.27 mg/g;胸部30.75 mg/g)>鸡腿肉(28.44 mg/g)>猪腿肉(25.65 mg/g)>鸡胸肉(23.18 mg/g)。实验范围内,就同一种肉类而言,腿肉均比胸肉的蛋白含量更高,且差异显著(p<0.05)。

图1 不同肉类肌原纤维蛋白含量Fig.1 Myofibrillar protein content of different meat
2.2鹅肉肌原纤维蛋白浊度、溶解度分析
由图2可知,5种肉类肌原纤维蛋白浊度随着蛋白的质量浓度上升而下降,其中鹅肉蛋白的浊度最低,鸡肉蛋白的浊度次之,猪肉蛋白的浊度最高,而在同种肉类中,鸡胸肉蛋白的浊度要高于鸡腿肉中蛋白的浊度,鹅胸肉蛋白的浊度要高于鹅腿肉中蛋白的浊度。

图2 不同肉类肌原纤维蛋白在不同质量浓度下的浊度Fig.2 The turbidity of different meat myofibrillar protein at different concentration
蛋白质溶解度对其乳化性质起重要作用,在油-水界面上蛋白质膜的稳定性取决于蛋白质-油相和蛋白质-水相的相互作用。由图3可知,5种肉类肌原纤维蛋白的溶解度随着蛋白的质量浓度上升而上升,并且在2.5~7.5 mg/mL之间上升较快,之后趋于稳定,这可能是由于蛋白质量浓度大于7.5 mg/mL时,蛋白分子间距减小,分子间的相互作用增强,蛋白分子的聚集能够使溶解度不再随浓度的增加而有显著变化。在相同质量浓度下,鹅肉肌原纤维蛋白的溶解度最高,鸡肉次之,猪肉的溶解度最低,鹅腿肉在12.5 mg/mL时溶解度为92.77%,高于鹅胸肉的88.32%,且差异显著(p<0.05)。总体来看,肉类中的肌原纤维蛋白溶解度随着其浊度的下降而上升,呈极显著负相关(r=-0.978,p<0.01)。

图3 不同肉类肌原纤维蛋白在不同质量浓度下的溶解度Fig.3 The solubility of different meat myofibrillar protein at different concentration
2.3鹅肉肌原纤维蛋白活性自由巯基含量分析
巯基存在蛋白分子内部,当蛋白质结构发生变化时,暴露自由巯基,这些自由巯基就会发生氧化反应形成二硫键,提高了蛋白质稳定脂肪的能力,从而提高了蛋白的乳化性[16]。由图4可知,5种肉类肌原纤维蛋白的自由巯基含量差异显著(p<0.05),鹅腿肉肌原纤维蛋白自由巯基含量最高(2.85×10-4μmol/mg),鸡腿肉次之,猪腿肉最低(0.705×10-4mmol/mg);在同种肉类中,不同部位的肌原纤维蛋白的自由巯基含量差别也较大,鹅腿部肌原纤维蛋白自由巯基的含量是其胸肌的1.75倍。

图4 不同肉类肌原纤维蛋白活性自由巯基含量Fig.4 The active-free sulfhydryl group content of different meat myofibrillar protein
2.4鹅肉乳化稳定性指数和乳化活性指数
由图5可知,5种肉类肌原纤维蛋白乳化稳定性指数在蛋白质量浓度为2.5~5 mg/mL之间较低,且差异不显著,当质量浓度大于5 mg/mL时,其值急剧增加,鹅肉增长最快,鸡肉次之,猪肉增加相对较慢,表明鹅肉的乳化稳定性指数最高。而在同种肉类中,腿肉的乳化稳定性指数要高于胸肉的乳化稳定性指数。原因可能是当肌原纤维蛋白溶解度较低时,连续相中没有足够的蛋白质来完全包围大量的小脂肪滴,从而导致乳浊液的分层。当蛋白质溶解度增加,有更多的蛋白质参与乳化,使乳化颗粒蛋白膜厚度增加,从而防止了油的聚集,使乳状液更加稳定[17]。Al-Malah等研究表明,随蛋白质量浓度的增加,蛋白分子在乳化界面上形成的界面膜表面积越来越大,乳状液的乳化稳定性越来越高[18]。本研究结果与Al-Malah 等报道相一致。
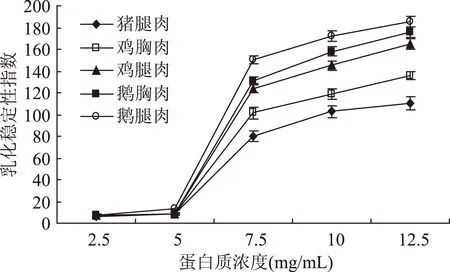
图5 蛋白质浓度对不同种类肉乳化稳定性指数的影响Fig.5 The effect of protein concentration on emulsifying stability index of different meat
乳化活性指数反映单位质量的蛋白质所产生的界面面积。随蛋白浓度的增加,5种肉类肌原纤维蛋白的乳化活性指数下降,不同种肉类中,鹅肉的蛋白乳化活性指数最高,鸡肉次之,猪肉最低;而在同种肉类中,腿部肌原纤维蛋白乳化活性指数高于胸部;当蛋白质量浓度在7.5 mg/mL以后时,乳化活性指数下降趋势减缓,鹅腿与鹅胸肉之间乳化活性指数无显著性差异(p>0.05)(图6)。陆健康对多浪羊肉肌原纤维蛋白乳化活性指数的研究也得到类似的结论[7]。上述原因可能为,随蛋白浓度的增加,尽管参与乳化的蛋白分子数量增多,但由于乳状液中的蛋白分子间距减小,使单个蛋白分子的有效乳化表面积减少,从而导致乳化活性指数逐渐降低[19]。

图6 蛋白质浓度对不同种类肉乳化活性指数的影响Fig.6 The effect of protein concentration on emulsifying activity index of different meat
2.55种肉类肌原纤维蛋白乳化能力的比较
EC代表了每毫克肌原纤维蛋白能够乳化的大豆油量,EC数值越大,其肌原纤维蛋白在单位质量内能够乳化的油量就越多[11]。由图7可知,5种肉类肌原纤维蛋白在相同质量浓度下,其乳化能力差异较大,鹅腿肉最高,其次为鹅胸肉、鸡腿肉、鸡胸肉,猪腿肉最低。随肌原纤维蛋白浓度的增加,5种肉类蛋白的乳化能力均有显著的提高(p<0.05),这一结果与 Cofrades 等的结论比较相似[19]。这可能是由于肌原纤维蛋白在低浓度时可以形成分散液,由于参与乳化的蛋白较少,单体蛋白更易与油滴结合,进而较完全的参与乳化[20]。随蛋白浓度的增加,乳状液中能够参与乳化的蛋白分子数量增多,其乳化能力随蛋白浓度的增加而显著增大[21]。另外,本研究发现,蛋白质乳化能力与溶解度呈显著正相关(r=0.957,p<0.01)。

图7 蛋白浓度对不同种类肉乳化能力的影响Fig.7 The effect of protein concentration on emulsifying ability of different meat
3 结论
通过测定肌原纤维蛋白含量、浊度、溶解度、活性自由巯基、乳化稳定性指数、乳化活性指数以及乳化能力等指标,对鹅肉的乳化及理化性质进行了研究。鹅腿肉肌原纤维蛋白含量最高,鸡胸肉含量最低;鹅腿肉自由巯基含量最高,猪腿肉含量最低;随肌原纤维蛋白浓度的提高,5种肉类蛋白浊度均呈下降趋势,溶解度均呈上升趋势。浊度:鹅腿肉<鹅胸肉<鸡腿肉<鸡胸肉<猪腿肉,溶解度顺序与浊度相反;随肌原纤维蛋白浓度的提高,5种肉类乳化稳定性指数与乳化能力均增加,乳化活性指数减小。乳化稳定性指数、乳化能力与乳化活性指数:鹅腿肉>鹅胸肉>鸡腿肉>鸡胸肉>猪腿肉。可见,在5种肉类当中,鹅肉肌原纤维蛋白的乳化性最强,鸡肉次之,猪肉蛋白乳化性最差。同种肉类中,腿部肌原纤维蛋白的乳化性优于胸部蛋白的乳化性,其原因及机制还需要进一步深入研究,可能由于肉的蛋白种类特性及成分的不同[22]。实验范围内,鹅腿肉肌原纤维蛋白的乳化性最好,最适合制作乳化肉糜类产品。
[1]杨勇,王存堂,任健,等. 鹅肉嫩化技术的研究进展[J]. 中国家禽,2010,32(1):41-44.
[2]高海燕,潘润淑,马汉军. 超高压技术对鹅肉嫩度的影响[J]. 食品科学,2011,32(8):107-110.
[3]曲湘勇,何俊,贺长青. 武冈铜鹅与其他3种鹅肉品质特性的比较[J]. 动物营养学报,2013,25(10):2277-2285.
[4]谢媚,曹锦轩,潘道东,等. 滚揉对成熟过程中鹅肉品质及其蛋白质结构的影响[J]. 现代食品科技,2014,30(10):205-211.
[5]Galluzzo S J,Regenstein J M. Role of chicken breast muscle proteins in meat emulsion formation:myosin,actin and synthetic actomyosin[J]. Food Science,1978,43(43):1761-1765.
[6]Grossi A,Olsen K,Bolumar T,et al. The effect of high pressure on the functional properties of pork myofibrillar proteins[J]. Food Chemistry,2016,196:1005-1015.
[7]陆健康,许倩,孟亚娟,等. 多浪羊肉肌原纤维蛋白乳化性的研究[J]. 食品工业科技,2014,35(21):91-93,101.
[8]闫海鹏,吴菊清,李美琳. 不同种类肉肌原纤维蛋白乳化及理化特性的研究[J]. 南京农业大学学报,2013,36(6):100-104.
[9]Xiong YL,Lou X,Wang C,et al. Protein extraction from chicken myofibrils irrigated with various poly phosphate[J]. Food Chemistry and Toxicology,2000,65(1):96-100.
[10]尚永彪,夏杨毅,张彩霞,等. 磷酸盐对PSE猪肉肌原纤维蛋白溶胶及凝胶性质的影响[J]. 食品科学,2010,31(1):38-42.[11]魏朝贵,吴菊清,邵俊花,等. KCl和MgCl2部分替代NaCl对猪肉肌原纤维蛋白乳化凝胶特性的影响[J]. 食品科学,2014,35(5):89-95.
[12]孔鹏,王志耕,熊国远,等. 3种淀粉对鸡肉糜盐溶蛋白特性影响及其配方研究[J]. 肉类研究,2011,25(6):9-15.
[13]Pearce K,Kinsella J. Emulsifying properties of proteins:evaluation of a turbidimetric technique[J]. Journal of Agricultural and Food Chemistry,1978,26(3):716-723.
[14]Agyare K,Addo K,Xiong Y. Emulsifying and foaming properties of transglutaminase-treated wheat gluten hydrolysateas influenced by pH,temperature and salt[J]. Food Hydrocolloids,2009,23(1):72-81.
[15]Gong KJ,Shi AM,Liu HZ,et al. Emulsifying properties and structure changes of spray and freeze-dried peanut protein isolate[J]. Journal of Food Engineering,2016,170(2):33-40.
[16]Omana D A,Xu Y,Moayedi V,et al. Alkali-aided protein extraction from chicken dark meat:chemical and functional properties of recovered proteins[J]. Process Biochemistry,2010,45(3):375-381.
[17]Silva V,Silvestre M. Functional properties of bovine blood plasma intended for use as a functional ingredient in human food[J]. LWT-Food Science and Technology,2003,36(7):709-718.
[18]Al-Malah KI,Azzam MOJ,Omari RM. Emulsifying properties of BSA in different vegetable oil emulsions using conductivity technique[J]. Food Hydrocolloids,2000,14:485-490.
[19]Cofrades S,Carballo J,Careche M,et al. Research note:emulsifying properties of actomyosin from several species[J]. Lebensmittel-Wissenschaft und-Technologie,1996,29(4):379-383.
[20]郭延娜,吴菊清,周光宏,等. 匀浆机转速、pH和肌原纤维蛋白质浓度对肌原纤维蛋白质乳化特性的影响[J]. 江苏农业学报,2010,26(6):1371-1377.
[21]Wang J C,Kinsella J E. Functional properties of novel proteins:alfalfa leaf protein[J]. Journal of Food Science,1976,41(2):286-292.
[22]Zorba O,Kurt S,Genccelep H. The effects of different levels of skim milk powder and whey powder on apparent yield stress and density of different meat emulsions[J]. Food Hydrocolloids,2005,19:149-155.
Emulsifying and physicochemical properties of myofibrillar protein from goose
JI Hong-fang,ZHANG Ling-wen*,JIANG Kai-xin,WANG Fang,LIU Ci-kun,MA Han-jun
(School of Food Science,Henan Institute of Science and Technology,Xinxiang 453003,China)
In order to enrich goose emulsion products,research was carried out to explore the emulsifying and physicochemical properties of myofibrillar protein from goose. The results were as follows,the content of myofibrillar protein from goose leg meat was the highest(48.27 mg/g),the second was that of goose breast,and the lowest was chicken breast(23.18 mg/g),and the difference among them was significant(p<0.05). The content of active-free sulfhydryl group of goose leg meat was the highest(2.85×10-4μmol/mg),the second was that of goose breast,and the last was pork leg(0.705×10-4μmol/mg),and the difference among them was significant(p<0.05). The solubility of goose leg and goose breast were increased quickly with the increment of protein concentration which changed from 2.5 to 7.5 mg/mL,but the change was tending towards stability when the protein concentration was higher than 7.5 mg/mL. At the concentration of 12.5 mg/mL,the size order of solubility was goose leg>goose breast>pork leg,and the difference among them was significant(p<0.05). Additionally,there was a significant negative correlation between solubility and turbidity(r=-0.978,p<0.01). With the increase of protein concentration,the emulsifying stability index and emulsifying ability of goose were increased,and under the same protein concentration,the size order of emulsifying stability index and emulsifying ability was goose leg>goose breast>pork leg. The emulsifying activity index of goose leg and goose breast were decreased with the increment of protein concentration. When the protein concentration was higher than 7.5 mg/mL,the difference between them was not significant(p>0.05),while they were always higher than that of the control. The myofibrillar protein from goose leg had the strongest emulsification ability,and was the most suitable for making emulsion products.
goose meat;myofibrillar protein;emulsifying properties;solubility;turbidity
2016-02-01
计红芳(1978-), 女, 博士, 副教授, 研究方向:食品加工与安全,E-mail:jhf300@126.com。
张令文(1977-),男,博士,副教授,研究方向:传统食品加工技术机理,E-mail:lingwen2008@163.com。
河南省教育厅重点项目(12B550005);河南省高校科技创新团队支持计划项目(13IRTSTHN006);国家级大学生创新训练计划项目(201410467020);大学生创新训练计划项目(2014CX030) 。
TS251.5
A
1002-0306(2016)17-0086-05
10.13386/j.issn1002-0306.2016.17.008

