苏云金芽孢杆菌BtZ01对胚后小鼠生长、肠道发育和微生物菌群的影响
谷明娟,陈 波,朱 遥,陶柳清,梁华阳,汪俊杰,潘康成
(四川农业大学 动物医学院 动物微生态研究中心,四川 成都 611130)
苏云金芽孢杆菌BtZ01对胚后小鼠生长、肠道发育和微生物菌群的影响
谷明娟,陈波,朱遥,陶柳清,梁华阳,汪俊杰,潘康成*
(四川农业大学 动物医学院 动物微生态研究中心,四川 成都 611130)
试验旨在研究苏云金芽孢杆菌(Bacillusthuringiensis,Bt)BtZ01对胚后小鼠生长、肠道发育及微生物菌群的影响。选取妊娠0 d的孕鼠48只,随机分为4组:对照组饮用灭菌水,试验组分别饮用添加106,108,5×109cfu·mL-1浓度BtZ01菌的灭菌水,试验从母鼠妊娠起至胚后小鼠成年,试验期66 d。结果表明:1)饮水中添加BtZ01菌对胚后小鼠体重、体长及料重比没有显著影响(P>0.05)。2)饮水中添加5×109cfu·mL-1水平的BtZ01菌显著降低了胚后小鼠断奶时空回肠和结直肠的相对重量(P<0.05);饮水中添加106,108cfu·mL-1水平的BtZ01菌对胚后小鼠断奶与成年时小肠的相对重量和体重校正长度没有影响(P>0.05)。3)饮水中添加108,5×109cfu·mL-1水平的BtZ01菌显著增加了胚后小鼠成年时的空肠绒毛长度及绒毛长度/隐窝深度(V/C)值(P<0.05)。4)饮水中添加108,5×109cfu·mL-1水平的BtZ01菌极显著降低了胚后小鼠肠道中大肠杆菌数(P<0.01)。由此可见,高浓度的BtZ01菌对胚后小鼠幼年肠道发育具有一定的抑制作用,但从长期饲养效果来看,饮水中添加BtZ01菌能够促进小肠绒毛的增长,提高消化吸收和抑制有害菌群定植的能力。
苏云金芽孢杆菌;胚后小鼠;肠道发育;微生物菌群
苏云金芽孢杆菌(Bacillusthuringiensis,简称Bt)是目前应用范围最广、最为成功的生物农药,占据了微生物农药市场的95%以上[1]。其在农业、渔业、林业、饮水等多个领域均有应用,主要集中在生物杀虫剂的开发和转基因作物研究两方面[2-3]。一直以来,Bt被认为是安全的、无毒副作用的,然而其分泌表达的部分非杀虫活性成分,如,苏云金素(Thuringiensin)、溶血素(Hemolysin)和肠毒素(Enterotoxin)等,却对人和哺乳动物存在潜在的毒性作用[4]。加之转基因作物的潜在风险性一直存在争议,使得其安全性的评价显得尤为重要[5-7]。长期以来,人们都致力于研究Bt菌本身及其转基因作物的安全性问题,但是Bt制剂对哺乳动物肠道发育及肠道菌群的影响却很少报道。Guimaraes等[8]给予大鼠Bt菌Cry1Ia12肠毒素,发现其十二指肠、绒毛与微绒毛、上皮细胞结构等并无改变。郭星等[9]以口服急性毒性试验向小鼠灌服Bt菌抗虫CrylC蛋白,利用变性梯度凝胶电泳(DGGE)分析证实该蛋白对小鼠肠道菌群影响较小。王小显等[10]的研究表明Bt营养体和芽孢对小鼠肠道有益菌群数量和细菌多样性没有不良影响。但是Bt菌的毒性与其血清型、活性成分、浓度以及培养条件等因素都有关系[11],而关于其对哺乳动物肠道发育影响的研究又极少。因此,本试验将不同浓度苏云金杆菌菌液直接给予怀孕母鼠,以观察胚后小鼠肠道发育和微生物菌群变化情况,为苏云金芽孢杆菌在农业生产中的安全应用及其对哺乳动物的安全性方面提供理论支持。
1 材料与方法
1.1试验材料
苏云金芽孢杆菌BtZ01(BacillusthuringiensisZ01,库尔斯塔克亚种,血清型H3a3b),由四川农业大学动物医学院发酵工程实验室保存、提供。90只健康成熟KM小鼠,由成都达硕实验动物有限公司购进,清洁级。其中雄鼠30只,体重30~40 g,雌鼠60只,体重30~35 g,未交配。
1.2试验设计
参照文献[12]方法获得妊娠孕鼠48只,随机分成4组,每组4个重复,每个重复3只。孕鼠妊娠0 d—胚鼠出生—胚后小鼠断奶—胚后小鼠成年为整个试验期,共66 d,其中母鼠孕期18 d,胚后小鼠哺乳期18 d,生长期30 d。菌株活化后接种营养肉汤(NB),37 ℃振荡培养36 h,使用灭菌水调整其浓度。整个试验过程对照组饮用灭菌自来水,试验组分别饮用含BtZ01浓度为106,108,5×109cfu·mL-1的灭菌水,各组饲喂相同基础饲粮,饲粮参照小鼠的营养需要,参考小鼠日粮配方AOAC配制,饲粮组成及营养水平见表1。
1.3指标测定及方法
1.3.1胚后小鼠生长性能测定
母鼠分娩时统计各组胚鼠死胎数,并分别于胚鼠出生时(试验第18天)、断奶时(试验第36天)及成年时(试验第66天)三个时间点称量小鼠体重、测量小鼠体长;同时,从胚后小鼠断奶开始记录各组采食情况,根据体重变化计算平均日增重、平均日采食量以及料重比。
表1基础饲粮组成及营养水平(%)
Table 1Composition and nutrient levels of basal diet (%)

原料含量/%营养成分2)含量/%玉米淀粉60.00粗蛋白质22.3酪蛋白21.00粗脂肪9.72豆粕粉2.00粗纤维3.83植物油8.00粗灰分5.24羧甲基纤维素钠3.00钙1.08矿物质添加剂5.00磷0.68维生素添加剂1)1.00合计100.00
1)维生素添加剂为每kg饲粮提供:VA 25 000 IU, VD313 000 IU,VE 200 IU,VK320 mg,VB130 mg,VB250 mg,VB650 mg,VB120.2 mg,生物素3 mg,烟酸35 mg,叶酸25 mg,泛酸钙20 mg,VC 600 mg;2)营养水平为计算值。
1.3.2小肠发育情况测定
分别在试验第36天和第66天,每个重复取2只胚后小鼠分离肠道,测量十二指肠、空回肠和结直肠长度,生理盐水冲洗肠内容物,称量十二指肠、空回肠和结直肠重量,比较各组间十二指肠、空回肠和结直肠的体重校正长度(肠道长度/体重,mm/g)与相对重量(肠道重量/体重,%)。
1.3.3小肠黏膜形态测定
经1.3.2节处理后的肠道,截取3 cm左右空肠肠段,浸于Bouin氏液中固定24 h,依次完成水洗、梯度酒精脱水、二甲苯透明、石蜡包埋、5 μm厚度切片、苏木精-伊红(HE)染色、封片等步骤。在显微镜下观察小肠黏膜绒毛并拍照,使用cellSens Standard图像处理系统测量绒毛长度(绒毛顶端至根部隐窝肩的距离)与隐窝深度(隐窝肩至隐窝基底的距离),并计算绒毛长度/隐窝深度(V/C)值[13]。
1.3.4盲肠菌群测定
在试验第66天,每个重复各取2只体重接近平均体重、健康状况良好的小鼠剖杀,无菌采集盲肠内容物,采用灭菌生理盐水进行10倍梯度稀释,取适宜稀释梯度的稀释液20 μL分别滴于相应的选择培养基平板上,每个样品重复3次。乳杆菌采用MRS琼脂培养基(HB0384)检测,37 ℃厌氧培养48 h;双歧杆菌采用双歧杆菌琼脂培养基(HB0396-1)检测,37 ℃厌氧培养48 h;大肠杆菌采用伊红美蓝琼脂培养基(HB0107)检测,37 ℃需氧培养24 h。统计菌落数,并计算出每1 g肠道内容物中所含菌量。
1.4数据处理与分析
试验数据采用SPSS 18.0软件进行单因素方差分析(ANOVA),用LSD法对数据的差异显著进行多重比较,所有数据均以平均数±标准差表示。
2 结果与分析
2.1BtZ01对胚后小鼠生长性能的影响
试验第18天时对母鼠生产情况进行统计,仅发现对照组与5×109cfu·mL-1添加组的母鼠各产下死胎一只,不具有统计学意义。由表2可知,饮水中添加106,108,5×109cfu·mL-1水平的苏云金芽孢杆菌BtZ01对胚后小鼠各阶段的体重和体长均没有显著影响(P>0.05)。与对照组相比,各试验组小鼠的平均日增重、平均日采食量及料重比在统计学上不具有显著差异(P>0.05),但是其料重比值均有所降低。
表2BtZ01对胚后小鼠生长性能的影响
Table 2Effects of BtZ01 on growth performance of post-embryonic mice
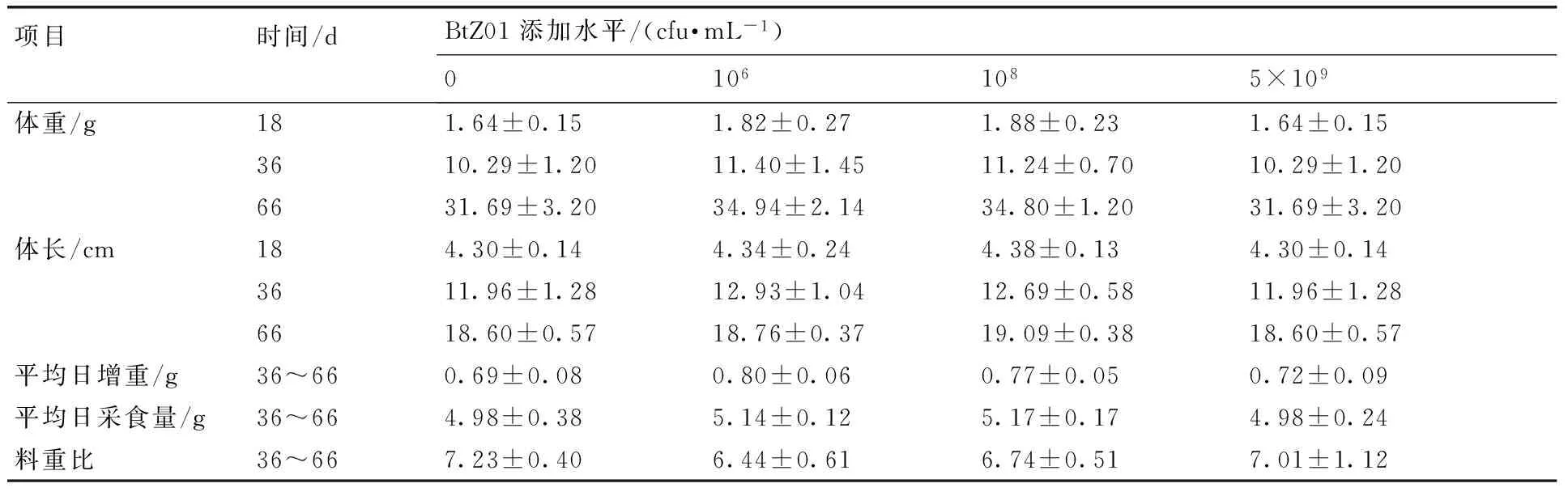
项目时间/dBtZ01添加水平/(cfu·mL-1)01061085×109体重/g181.64±0.151.82±0.271.88±0.231.64±0.153610.29±1.2011.40±1.4511.24±0.7010.29±1.206631.69±3.2034.94±2.1434.80±1.2031.69±3.20体长/cm184.30±0.144.34±0.244.38±0.134.30±0.143611.96±1.2812.93±1.0412.69±0.5811.96±1.286618.60±0.5718.76±0.3719.09±0.3818.60±0.57平均日增重/g36~660.69±0.080.80±0.060.77±0.050.72±0.09平均日采食量/g36~664.98±0.385.14±0.125.17±0.174.98±0.24料重比36~667.23±0.406.44±0.616.74±0.517.01±1.12
2.2BtZ01对胚后小鼠肠道发育的影响
由表3可知,饮水中添加106,108cfu·mL-1水平的苏云金芽孢杆菌BtZ01对胚后小鼠断奶时(试验第36天)十二指肠、空回肠和结直肠的相对重量和体重校正长度影响不显著(P>0.05)。饮水中添加5×109cfu·mL-1水平的BtZ01显著降低了胚后小鼠断奶时空回肠和结直肠相对重量(P<0.05),极显著地降低了结直肠的相对校正长度(P<0.01),而对十二指肠的相对重量及十二指肠和空回肠的体重校正长度影响不显著(P>0.05)。
饮水中添加106,108cfu·mL-1水平的BtZ01显著降低了胚后小鼠成年时(试验第66天)结直肠的相对重量(P<0.05),而对十二指肠和空回肠的相对重量没有影响(P>0.05)。饮水中添加5×109cfu·mL-1水平的BtZ01极显著降低了胚后小鼠成年时结直肠相对重量(P<0.01),而对十二指肠和空回肠的相对重量没有影响(P>0.05)。饮水中添加106,108,5×109cfu·mL-1水平的BtZ01极显著降低了胚后小鼠成年时结直肠的体重校正长度(P<0.01),而对十二指肠和空回肠的体重校正长度影响不显著(P>0.05)。
2.3BtZ01对胚后小鼠空肠形态的影响
由表4可知,饮水中添加106,108,5×109cfu·mL-1水平的苏云金芽孢杆菌BtZ01对胚后小鼠断奶时(试验第36天)的空肠绒毛长度、隐窝深度及V/C值均无显著影响(P>0.05)。饮水中添加106cfu·mL-1的BtZ01菌对胚后小鼠成年时(试验第66天)的空肠绒毛长度、隐窝深度及V/C值的影响不显著(P>0.05)。饮水中添加108,5×109cfu·mL-1水平的BtZ01菌对胚后小鼠成年时的空肠绒毛长度及V/C值有显著影响(P<0.05),但对隐窝深度影响不显著(P>0.05)。
表3BtZ01对胚后小鼠肠道发育的影响
Table 3Effects of BtZ01 on intestinal development of post-embryonic mice
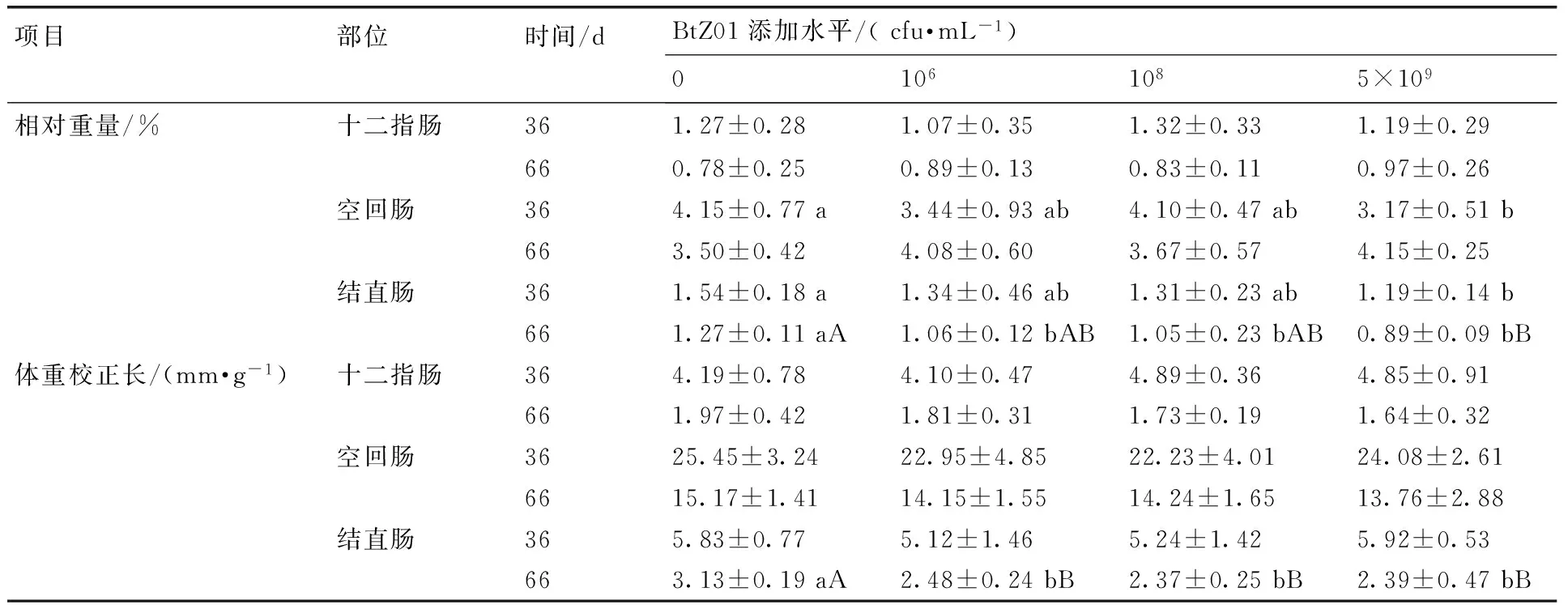
项目部位时间/dBtZ01添加水平/(cfu·mL-1)01061085×109相对重量/%十二指肠361.27±0.281.07±0.351.32±0.331.19±0.29660.78±0.250.89±0.130.83±0.110.97±0.26空回肠364.15±0.77a3.44±0.93ab4.10±0.47ab3.17±0.51b663.50±0.424.08±0.603.67±0.574.15±0.25结直肠361.54±0.18a1.34±0.46ab1.31±0.23ab1.19±0.14b661.27±0.11aA1.06±0.12bAB1.05±0.23bAB0.89±0.09bB体重校正长/(mm·g-1)十二指肠364.19±0.784.10±0.474.89±0.364.85±0.91661.97±0.421.81±0.311.73±0.191.64±0.32空回肠3625.45±3.2422.95±4.8522.23±4.0124.08±2.616615.17±1.4114.15±1.5514.24±1.6513.76±2.88结直肠365.83±0.775.12±1.465.24±1.425.92±0.53663.13±0.19aA2.48±0.24bB2.37±0.25bB2.39±0.47bB
注:同行数据无相同小写字母表示差异显著(P<0.05),无相同大写字母表示差异极显著(P<0.01)。无字母或有相同小写字母表示差异不显著(P>0.05)。下同。
表4BtZ01对胚后小鼠空肠形态的影响
Table 4Effects of BtZ01 on jejunum morphology of post-embryonic mice

项目时间/dBtZ01添加水平/(cfu·mL-1)01061085×109绒毛长度/μm36470.54±37.40495.77±25.96437.03±48.02461.29±44.9466500.07±39.74b546.42±44.21ab648.87±49.25a601.92±47.75a隐窝深度/μm3650.66±52352.34±5.9048.39±4.9549.03±4.226694.01±8.5393.32±7.76100.35±9.8995.58±6.23绒毛长度/隐窝深度369.41±0.599.57±0.669.04±0.419.40±0.35665.32±0.31b5.87±0.46ab6.45±0.37a6.28±0.41a
2.4BtZ01对胚后小鼠肠道菌群的影响
饮水中添加106cfu·mL-1水平的BtZ01菌极显著地提高了胚后小鼠成年时(试验第66天)盲肠内容物中的乳酸杆菌与大肠杆菌数(P<0.01),对双歧杆菌的影响不显著(P>0.05)。饮水中添加108cfu·mL-1水平的BtZ01菌极显著地提高了胚后成年小鼠盲肠内容物中的双歧杆菌数(P<0.01),同时极显著地降低了大肠杆菌数(P<0.01),对乳酸杆菌的影响不显著(P>0.05)。饮水中添加5×109cfu·mL-1水平的BtZ01菌能够极显著地提高胚后成年小鼠盲肠内容物中的双歧杆菌与乳酸杆菌数(P<0.01),大肠杆菌数也极显著低于对照组、106与108cfu·mL-1水平组(P<0.01)。BtZ01对胚后小鼠肠道菌群的影响见表5。
表5BtZ01对胚后小鼠肠道菌群的影响(log10n)
Table 5Effects of BtZ01 on intestinal flora of post-embryonic mice(log10n)

微生物菌群BtZ01添加水平/(cfu·mL-1)01061085×109双歧杆菌8.28±0.11B8.32±0.09B8.51±0.09A8.57±0.07A乳酸杆菌8.10±0.06B8.69±0.07A8.18±0.07B8.62±0.06A大肠杆菌8.24±0.15B8.80±0.15A7.77±0.10C6.66±0.11D
3 讨论
通常情况下,胎儿通过母体的胎盘进行物质交换,而胎盘屏障的保护作用又使得胎儿能免受母体内毒性物质及病原微生物的侵染,从而完成正常的生长发育过程。但部分小分子量化合物和高脂溶性物质却能轻松避过胎盘屏障直接到达胎儿体内,影响胚胎的生长发育,因此胎盘屏障的存在并不能完全保障胎儿的安全[14]。胚胎发育期是胎鼠主要器官发生及形态形成期,对外界的刺激最敏感,最易受到致畸因子的干扰而发生器官形态结构畸形,甚至引起死亡,因此从母鼠妊娠开始就在饮水中添加BtZ01菌直至胚鼠成年,能够更明显的观察其对胚后小鼠生长及肠道发育的影响。本试验中,各组小鼠的体重、体长等指标无显著差异,说明BtZ01菌对胚后小鼠的生长性能无不良影响。各组小鼠的饲料利用率虽然不存在显著差异,但BtZ01菌添加组小鼠的饲料利用率较对照组均有所提高,这提示了BtZ01可能有促进小鼠对营养物质吸收的作用。
小肠是动物营养物质吸收的主要场所,其消化作用包括小肠运动的机械性作用和胆汁、胰液和肠液等化学性作用,大部分营养物质在这里完成分解并消化吸收,只有不能消化和未经消化的食糜才进入大肠[15]。本试验的研究结果表明,添加5×109cfu·mL-1水平的BtZ01菌显著降低了胚后小鼠断奶时空回肠的相对重量,而在成年时恢复至正常水平,说明大剂量的BtZ01菌对胚后小鼠幼年小肠发育具有一定的抑制作用。 这可能与以下两方面原因有关:一方面胚后小鼠在哺乳期肠道处于快速发育阶段,对外来刺激相对敏感,若BtZ01菌能够少量分泌肠毒素等物质,则必然对肠道发育造成影响;而成年后,同样少量的毒素物质达不到引起组织损伤或生长发育受影响的临界浓度,不能再对肠道造成影响,肠道发育恢复正常。另一方面,胚后小鼠在哺乳阶段黏膜免疫机制尚不完善,由于很少接触除乳汁以外的食物,普通的食物抗原都能激活机体黏膜免疫系统,当幼鼠舔食饮水时将BtZ01菌引入肠道,引发黏膜免疫,从而影响肠道发育;成年后由于免疫耐受机制使得这种影响得以消除,肠道恢复正常发育[16]。本研究中,仅5×109cfu·mL-1浓度的BtZ01菌才出现了此结果,也从侧面反映出BtZ01菌对胚后小鼠肠道发育的影响是比较小的。另外,试验组的结直肠相对重量与体重校正长度与对照组存在显著差异,但由于大肠的消化能力相对较弱,因此其对动物营养吸收和生长发育的影响程度还需要进一步研究。
小肠吸收营养物质的主要部位是小肠绒毛,因此营养物质的吸收与利用效率很大程度上取决于小肠绒毛的发育状况。绒毛长度的增长能增加肠道与营养物质的接触面积,从而增强机体的消化吸收能力。肠细胞的生成率则反映在隐窝的深度上,当隐窝深度变浅时,表明肠道成熟的上皮细胞数量上升,分泌能力增强。V/C值能综合反映小肠的功能状况,比值上升表明消化吸收功能上升[17]。试验中,各Bt菌添加组胚后小鼠成年时的空肠绒毛长度及V/C值均在一定程度上高于对照组,同时其断奶至成年阶段的料重比值也较对照组略有降低,说明Bt菌剂可在一定程度上增进肠道的消化吸收能力。5×109cfu·mL-1水平添加组胚后小鼠成年时的空肠绒毛长度及V/C值显著高于对照组,而料重比值却与对照组不存在差异,这更多的可能是与绒毛另一个重要功能有关:通过其强有力、有规律摆动来排斥有害菌群的定植。
动物或人体的胃肠道内有大量的微生物群存在,一般情况下,微生物的种类与数量处于一种动态平衡的状态,从而维持动物机体的健康。在生理状态下,肠道微生态体系参与了宿主营养吸收、免疫激活、抗癌、抗衰老等多种生理过程,而在病理状态下则成为多种疾病与内源性感染的根源,如:自身免疫性疾病、代谢性疾病和肠道癌症等[18]。盲肠作为大肠的起始部分,下端有膨大的末端,相对于其他肠道部位其内容物排空时间较长,特定的生理环境促使盲肠微生物的种类和数量都相当丰富,因此对盲肠内容物微生物的检测在很大程度上能够代表动物内环境的情况。
肠道内最值得注意的菌应属大肠杆菌、双歧杆菌和乳酸菌。大肠杆菌属于条件致病菌,一般情况下不会导致机体发病;双歧杆菌能抑制病原菌的生长,促进肠道菌群平衡,参与动物机体的多种生理过程,对人类和动物体整个生命活动都有积极作用[19];乳酸菌具有增强肠道免疫功能以及促进肠道菌群恢复平衡状态的作用[20]。微生态学的观点认为,当肠道内大肠杆菌、肠球菌增长,双歧杆菌、乳酸菌下降(P<0.05)时,则会引起菌群失调[21]。按照这个标准来看,106cfu·mL-1水平添加组虽然增加了大肠杆菌数,但同时乳酸菌的数量也显著增加,维持了整个肠道内环境的平衡状态。而108,5×109cfu·mL-1水平添加的BtZ01菌使小鼠肠道内大肠杆菌数量明显减少,促进了肠道微环境的改善,说明高浓度Bt菌在动物体内对大肠杆菌具有一定抑制作用。这有可能是Bt菌与大肠杆菌竞争的结果,也可能是与Bt分泌的部分细胞毒素能够诱使大肠杆菌的类核物质在细胞中凝结具有一定的关联[22]。另外,BtZ01菌进入肠道后仅作为一种需氧过路菌存在,当其浓度达到一定值后,如本试验中的108cfu·mL-1及高于此值时,则可通过竞争性夺氧迅速消耗肠道空间内有限的氧气,从而影响大肠杆菌的生长与繁殖,同时为厌氧双歧杆菌的增殖提供有利条件。双歧杆菌的快速生长以及近乎绝对厌氧的内环境,使得乳酸杆菌的快速增殖受到了一定程度的限制,从而维持在一个相对稳定的值。而当BtZ01菌添加水平达5×109cfu·mL-1时,大肠杆菌数进一步骤减,为乳酸杆菌的增殖提供了一定的空间,而双歧杆菌数已趋于最大值,故不再增加。总之,当不同浓度的BtZ01菌进入肠道后,肠道内的正常微生物群总能做出最适宜的调整,以维持内环境的稳定,达到对机体的生长发育最有益或是伤害最小的状态。
4 结论
①高浓度的BtZ01菌对胚后幼年小鼠肠道发育具有一定的抑制作用。
②从长期饲养效果来看,饮水中添加BtZ01菌能够促进胚后成年小鼠小肠绒毛的增长,提高消化吸收和抑制有害菌群定植的能力。
[1]关雄,蔡峻. 我国苏云金杆菌研究60年[J]. 微生物学通报,2014,41(3):459-465.
[2]阮文丽,吴会会,刘乐承,等. 植物抗虫转基因研究进展[J]. 长江大学学报(自然科学版),2012,9(10):23-26.
[3]白成,刘丽平,鄢小宁,等. 苏云金芽孢杆菌的概况及其研究进展[J]. 热带农业科学,2012,32(8):33-38.
[4]曹琼,倪超超. 苏云金芽孢杆菌的生物防治安全性研究进展[J]. 湖北农业科学,2014(11):2485-2489.
[5]HILBECK A, BAUMGARTNER M, FRIED P M, et al. Effects of transgenicBacillusthuringiensiscorn-fed prey on mortality and development time of immature Chrysoperla cornea (Neuroptera: Chrysopidae)[J].EnvironmentalEntomology, 1998,27(2):480-487.
[6]王月丹. 转Bt基因大米对人类健康可能存在安全隐患[J]. 科学对社会的影响,2010(2):53-57.
[7]王忠华,倪新强,徐孟奎,等. Bt水稻“克螟稻”花粉对家蚕生长发育的影响[J]. 遗传,2001,23(5):463-515.
[9]郭星,许文涛,姚业成,等. 口服急性毒性试验中CrylC蛋白对鼠肠道菌群的影响[J]. 农业生物技术学报,2010,18(2):346-351.
[10]王小显,杨洪凤,薛雅蓉,等. 苏云金芽孢杆菌在小鼠肠道的消长及对小鼠肠道菌群的影响[J]. 畜牧与兽医,2013,45(3):27-30.
[11]SIEGEL J P. The Mammalian safety ofBacillusthuringiensis-Based Insecticides[J].JournalofInvertebratePathology, 2001, 77(1):13-21.
[12]张喆,袁衡,朱武,等. 甲醛和苯联合染毒对小鼠胚胎的影响[J]. 癌变·畸变·突变,2013,25(5):369-372.
[13]刘磊,朱立贤. 芽孢乳杆菌对肉仔鸡生产性能、肠道发育和微生物菌群的影响[J]. 动物营养学报,2011,23(12):2136-2142.
[14]HOOD D A, TERJUNG R L. Effect of alpha-ketoacid dehydrogenase phosphorylation on branched-chain amino acid metabolism in muscle[J].AmericanJournalofPhysiology-EndocrinologyandMetabolism, 1991, 261(5):628-634.
[15]周定刚,马恒东. 家畜解剖生理学[M]. 北京:中国农业出版社,2010.
[16]谢天宇,胡红莲,高民. 肠黏膜免疫屏障及其保护措施[J]. 动物营养学报,2014,26(5):1157-1163.
[17]任永军,雷岷,邝良德,等. 复合芽孢杆菌制剂对肉兔肠道发育和免疫功能的影响[J]. 动物营养学报,2014,26(1):144-152.
[18]PRAKASH S, RODES L, COUSSA-CHARLEY M, et al. Gut microbiota: next frontier in understanding human health and development of biotherapeutics[J].BiologicsTargets&Therapy, 2011, 5:71-86.
[19]吕锡斌,何腊平,张汝娇,等. 双歧杆菌生理功能研究进展[J]. 食品工业科技,2013,34(16):353-358.
[20]张扬,袁杰利. 肠道益生菌对机体免疫功能的影响[J]. 中国微生态学杂志,2003,15(4):246-248.
[21]何明清,程安春. 动物微生态学[M]. 成都:四川科学技术出版社,2004.
[22]MANASHEROB R, ZARITSKY A, METZLER Y, et al. Compaction of theEscherichiacolinucleoid caused by Cyt1Aa[J].Microbiology, 2003, 149(12):3553-3564.
(责任编辑卢福庄)
Effects of Bacillus thuringiensis BtZ01 on growth performance,intestinal development and microflora of post-embryonic mice
GU Ming-juan, CHEN Bo, ZHU Yao, TAO Liu-qing, LIANG Hua-yang, WANG Jun-jie, PAN Kang-cheng*
(AnimalMicroecologyInstitute,CollegeofVeterinaryMedicine,SichuanAgriculturalUniversity,Chengdu611130,China)
This experiment was conducted to investigate the effects ofBacillusthuringiensisBtZ01 on the growth performance,intestinal development and microflora of post-embryonic mice. A total of 48 pregnant mice were randomly allocated to 4 groups: control group fed with sterilized water and other three treatment groups fed with sterilized water containing 106, 108, 5×109cfu·mL-1BtZ01, respectively. Trial lasted 66 days which from mice pregnant to the post-embryonic mice grown-up. The results showed as follows:1) Drinking water added withBacillusthuringiensisBtZ01 had no significant effect on weight, length and feed/gain of post-embryonic mice (P>0.05). 2) The relative weight of jejunum-ileum and colon-rectum of post-embryonic mice at weaning (P<0.05) was significantly decreased in the treatment of 5×109cfu·mL-1BacillusthuringiensisBtZ01. AddingBacillusthuringiensisBtZ01 of 106and 108cfu·mL-1levels had no significant effect on relative weight and correction length of small intestine of post-embryonic mice at weaning and adulthood (P>0.05). 3) The villous length and V/C value of jejunum of post-embryonic mice at adulthood (P<0.05) was significantly increased in the treatment of 108and 5×109cfu·mL-1BacillusthuringiensisBtZ01. 4) The number ofE.coliin caecum of post-embryonic mice (P<0.01) was extremely significantly decreased in the treatment of 108and 5×109cfu·mL-1BacillusthuringiensisBtZ01. In conclusion, high dose ofBacillusthuringiensisBtZ01 has certain inhibitory effect on intestinal development of post-embryonic mice in youth. But over the long-term feeding result, drinking water added withBacillusthuringiensisBtZ01 could improve intestinal villi development and the function of digestion and absorption and have an ability to inhibit the harmful bacteria to colonization.
Bacillusthuringiensis; post-embryonic mice; intestinal development; microflora
10.3969/j.issn.1004-1524.2016.02.10
2015-08-27
“教育部长江学者和创新团队发展计划”创新团队资助项目(IRT0848);四川农业大学创新性实验计划和科研兴趣培养计划(1310626013);四川农业大学教学改革项目(X2010007)
谷明娟(1991—),女,内蒙古和县人,四川农业大学生物工程专业本科生。E-mail:gumingjuan0119@126.com
,潘康成,E-mail:pankangcheng71@126.com
S816.79
A
1004-1524(2016)02-0240-07
谷明娟,陈波,朱遥,等. 苏云金芽孢杆菌BtZ01对胚后小鼠生长、肠道发育和微生物菌群的影响[J].浙江农业学报,2016,28(2): 240-246.

