重金属Cr6+耐受细菌的筛选研究
姜 蒙,王 伟
(华东理工大学 生物反应器工程国家重点实验室,上海 200237)
重金属Cr6+耐受细菌的筛选研究
姜蒙,王伟*
(华东理工大学 生物反应器工程国家重点实验室,上海 200237)
土壤中重金属Cr6+污染日益严重,其对植物的影响也越来越大,并可通过食物链富集进入人和动物体内,从而危害人畜健康。试验在分别添加0.3和0.5 g·kg-1Cr6+的土样中进行耐性菌株的筛选,以期为微生物修复重金属污染提供技术支持。结果表明,该研究共获得了9株具有较好Cr6+耐性的菌株。它们均可在含0.5,1.0 mmol·L-1Cr6+的LB培养基中生长。其中,编号为J3,J5,J8的菌种耐性达到2 mmol·L-1,在含2 mmol·L-1Cr6+的液体培养基中培养48 h后,培养基中的Cr6+含量分别降低23%,36%,7%。经测定,上述3种菌分别为解淀粉芽孢杆菌(Bacillusamyloliquefaciens)、地衣芽孢杆菌(Bacilluslicheniformis)、沙福芽孢杆菌(Bacillussonorensis)。
重金属Cr6+;重金属耐性;土壤修复
重金属铬主要通过工业生产被释放到环境中,比如皮革鞣制、电镀和铬酸盐生产等[1]。铬进入作物体内主要积累在根部细胞,并使细胞膜的通透性增大。铬渗入细胞后可与细胞核内的核酸等大分子物质结合,抑制包括ATP酶在内的多种酶的活性,影响细胞正常的有丝分裂,并使DNA发生凝集,导致染色体发生断裂和畸变。此外,铬还可通过食物链富集进入人和动物体内,引发癌症等疾病,危害人畜健康,如水俣病、骨痛病等都是典型例证。因此,其在食品、水、土壤里的含量应受到严格的控制[2]。
目前,我国部分地区土壤遭受铬污染,严重危及粮食生产与人畜安全。传统的对重金属污染进行治理的方法主要是物理化学方法,但是该方法花费高,需要消耗大量的资源和专业设备,而且可能引发二次污染[3]。因此,迫切需要针对铬污染土壤探索、建立适宜的治理方法。近年来,微生物修复技术应运而生。该方法主要利用环境中的微生物对土壤进行修复,对环境的扰动较小,且成本远低于传统的物理化学方法。本文主要针对土壤中以重铬酸盐形式存在的六价重金属铬(Cr6+),筛选耐性细菌,探讨其对重金属铬的耐受性和修复能力,以期为土壤中Cr6+的生物修复提供技术支撑。
1 材料与方法
1.1土壤样品
于2012年6月取自无重金属污染的菜田,土壤为典型的灰潮土,pH 7.62。土壤总有机碳平均含量为(10.38±0.97) g·kg-1。
1.2试验方法
1.2.1土壤样品的处理
取回的土壤去除杂质并自然风干后过2 mm筛备用。在每个盆里放置1 000 g土壤样品,以重铬酸钠的形式向土壤中添加Cr6+,分别调节其离子浓度至0.3和0.5 g·kg-1,每个处理重复3次。第60天取土壤样品进行耐铬细菌的筛选。
1.2.2耐性菌株的筛选及鉴定
菌种筛选采用稀释平板涂布法,挑选单菌落保存菌种。对所挑选出的单菌落进行菌种形态鉴定,对初步筛选的菌株进行归类合并;之后,进一步对菌株进行分子生物学鉴定和生理生化鉴定。
1.2.3耐性菌株总DNA提取
采用Wilson方法[4]分别提取筛选到的耐性细菌总DNA。
1.2.4耐性菌株16S rDNA扩增
对提取到的细菌总DNA进行16S rDNA基因PCR扩增,选用通用引物27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R(5’-GGTTACCTTGTTACGACTT-3’)[5]。扩增反应体系如下:总反应体积50 μL,包括10×loading buffer (Mg2+plus) 5 μL,引物(10 μmol·L-1)各2 μL,dNTP mixture(2.5 mmol·L-1each)4 μL,模板1 μL,5 U·μL-1的TaKaRa rTaq酶0.25 μL,用超纯水补足体积至50 μL。细菌16S rDNA基因的扩增条件参照Don等[6]。扩增产物于1%的琼脂糖凝胶电泳中检测。
1.2.516S rDNA回收测序
对扩增产物进行1%琼脂糖凝胶电泳,在切胶仪中对目的条带进行切胶回收,用琼脂糖凝胶DNA回收试剂盒对回收条带进行纯化再回收。并用1%琼脂糖凝胶电泳检测纯度和亮度。纯化后的PCR扩增产物送上海生工生物工程技术服务有限公司进行测序,结果与NCBI基因库中所有已测定的原核生物16S rDNA序列进行比对[7]。用MEGA 5.1软件对所测序列和同源序列进行分析,构建系统发育树。
1.2.6菌株Cr6+耐受性测定
为检测所筛选菌株对重金属Cr6+的耐受程度,将菌株在LB培养基中培养,调节pH为7.5。培养基经高压灭菌后,重金属铬以Na2Cr2O7形式经过滤器消毒灭菌添加,Cr6+终浓度分别设置为0.5,1,2,3 mmol·L-1。
将含Cr6+培养基上形成的菌落与对照相比,定性筛选出耐受性较强的菌株。
1.2.7耐受菌种Cr6+降解能力测定
将上述分离得到的具有较好耐受性的菌株培养在Cr6+浓度分别为1和2 mmol·L-1的液体培养基中,25 ℃恒温摇床培养48 h,同时设置对照组,即将耐受菌株培养在未添加Cr6+的液体培养基中。Cr6+含量采用全谱直读等离子体发射光谱仪(ICP-AES)测定[8]。
2 结果与分析
2.1菌株Cr6+耐性及降解力
结果显示,本试验从土壤中分离得到的9种菌株在含有0.5和1 mmol·L-1Cr6+的培养基上均有菌落形成,但J1,J2,J4,J6,J7,J9在含1 mmol·L-1Cr6+的培养基上长势已明显变弱,只有J3,J5,J8菌株能在含2 mmol·L-1Cr6+的培养基上形成菌落,认定这3个菌株具有较强的Cr6+耐性。
将J3,J5,J8菌株进一步转移至含1 mmol·L-1Cr6+的液体培养基上培养,48 h后,J3,J5,J8菌株所在培养基中的Cr6+含量分别降低62%,67%,37%。当液体培养中的Cr6+浓度进一步增大到2 mmol·L-1时,J3,J5,J8菌株对Cr6+的降解能力减弱,培养基中的Cr6+含量分别降低23%,36%,7%。
2.2Cr6+耐受菌株生理生化特性鉴定
根据形态学观察发现,本研究所分离得到的耐受细菌(J3,J5,J8)在LB培养基中菌落形态明显不同,不是同一细菌。经革兰氏染色、镜检,均为革兰氏阳性菌,杆状;细菌培养3 d可产生芽孢,初步认定为芽孢杆菌属。为进一步确定J3,J5,J8的种,根据伯杰细菌鉴定手册(第8版)所述方法开展糖发酵、V.P试验、耐热性等生理生化试验,结果如表1所示。
表1菌株生理生化试验结果
Table 1Physiological and biochemical tests of isolated strains

指标J3J5J8接触酶+++厌氧生长+-+最高生长温度/℃~50~55~475%NaCl+++7%NaCl++-V.P试验+++淀粉水解+++明胶水解+++甲基红试验+++柠檬酸利用试验---水解酪素+++葡萄糖发酵+++乳糖发酵---蔗糖发酵+++pH5.7生长-+-马尿酸盐水解--+
注:“+”表示阳性,“-”表示阴性。
2.3Cr6+耐受菌的分子鉴定结果
将提取的各菌株DNA克隆、测序,结果如表2所示。
为进一步明确J3,J5,J8的种属关系,构建系统发育树研究其亲缘关系及进化水平,结果如图2所示。
结合形态特征、培养基特征、生理生化特征和分子生物学鉴定结果以及系统发育树,J3与Bacillusamyloliquefacienssubsp.plantarumFZB42(T)在系统发育树上处于同一分支,亲缘关系最近,相似度达到98.257%;J5与BacilluslicheniformisATCC14580(T)相似度达到98.624%,系统发育树也显示亲缘关系最近;J8与BacillussonorensisNRRLB-23154(T)处于系统发育树上同一分支,但节点值较低,而且相似度仅为95.494%。据此,初步确定J3为解淀粉芽孢杆菌(Bacillusamyloliquefaciens),J5为地衣芽孢杆菌(Bacilluslicheniformis),J8为沙福芽孢杆菌(Bacillussonorensis)。
3 讨论
Cr6+的毒害作用主要是由于它能引起细胞发生氧化应激反应,破坏细胞膜并损害DNA[9]。铬盐有铬酸盐和重铬酸盐两种形式,在过去二十年中,几乎大部分细菌修复作用的研究都是针对铬酸盐的耐受性及修复能力,对重铬酸盐的研究极少[10]。因此,本研究主要针对重铬酸盐污染,筛选耐Cr6+细菌。
表2菌种测序结果
Table 2Sequencing results of tested strains
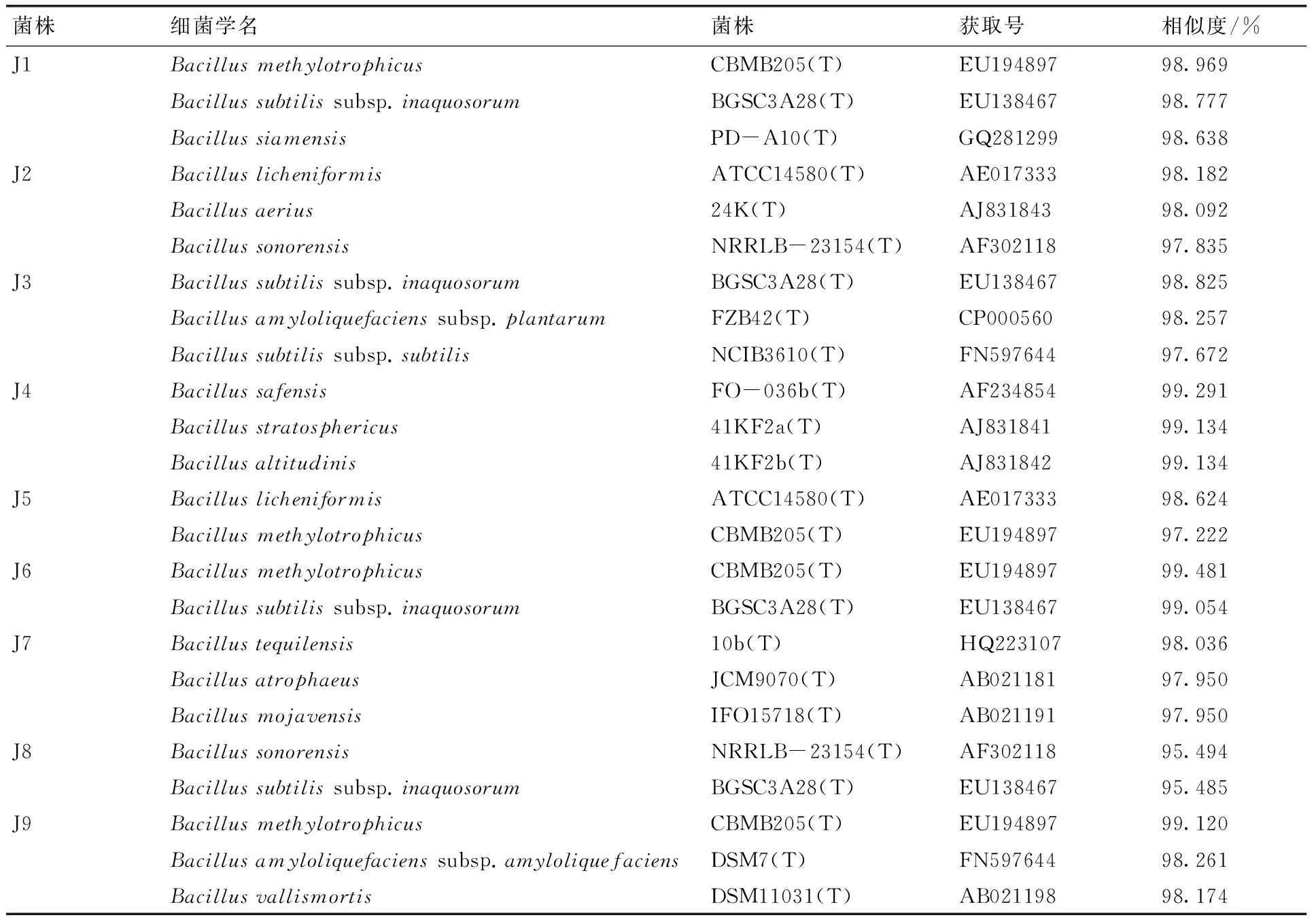
菌株细菌学名菌株获取号相似度/%J1BacillusmethylotrophicusCBMB205(T)EU19489798.969Bacillussubtilissubsp.inaquosorumBGSC3A28(T)EU13846798.777BacillussiamensisPD-A10(T)GQ28129998.638J2BacilluslicheniformisATCC14580(T)AE01733398.182Bacillusaerius24K(T)AJ83184398.092BacillussonorensisNRRLB-23154(T)AF30211897.835J3Bacillussubtilissubsp.inaquosorumBGSC3A28(T)EU13846798.825Bacillusamyloliquefacienssubsp.plantarumFZB42(T)CP00056098.257Bacillussubtilissubsp.subtilisNCIB3610(T)FN59764497.672J4BacillussafensisFO-036b(T)AF23485499.291Bacillusstratosphericus41KF2a(T)AJ83184199.134Bacillusaltitudinis41KF2b(T)AJ83184299.134J5BacilluslicheniformisATCC14580(T)AE01733398.624BacillusmethylotrophicusCBMB205(T)EU19489797.222J6BacillusmethylotrophicusCBMB205(T)EU19489799.481Bacillussubtilissubsp.inaquosorumBGSC3A28(T)EU13846799.054J7Bacillustequilensis10b(T)HQ22310798.036BacillusatrophaeusJCM9070(T)AB02118197.950BacillusmojavensisIFO15718(T)AB02119197.950J8BacillussonorensisNRRLB-23154(T)AF30211895.494Bacillussubtilissubsp.inaquosorumBGSC3A28(T)EU13846795.485J9BacillusmethylotrophicusCBMB205(T)EU19489799.120Bacillusamyloliquefacienssubsp.amyloliquefaciensDSM7(T)FN59764498.261BacillusvallismortisDSM11031(T)AB02119898.174

图2 J3,J5,J8菌株的16S rDNA系统发育树Fig.2 Neighbor-joining phylogenetic tree showing the relationships for 16S rDNA gene sequences of J3, J5, J8 and their closest relatives
针对重金属污染治理,目前普遍使用的还是传统的农业防治和工程物理化学方法。如林匡飞等[11]在含镉100 mg·kg-1的土壤上改种苎麻,5年后,土壤镉含量平均降低27.6%;Wasay等[12]采用淋洗法,对比弱有机酸盐(柠檬酸和酒石酸盐)和强螯合剂(EDTA和DTPA)对重金属Cr,Mn,Hg,Pb污染土壤修复的有效性,发现EDTA和DTPA能有效地去除Hg以外的重金属元素,但同时也提取出大量的土壤营养元素;而且,EDTA和DTPA被吸附于土壤颗粒表面,易对土壤造成新的污染。这些方法同时也大都存在花费高、需要消耗大量的资源和专业设备,而且可能引发次生污染等问题。微生物修复的优点是实施较简便,投资较少,更重要的是对环境破坏小。所以,近年来微生物修复重金属污染的研究越来越受到科研人员的关注。要采用微生物方法治理重金属污染,获得高效的菌种资源是成功的关键。目前在细菌、真菌、藻类微生物中均有重金属耐性菌株报道。如Wang等[13]对国内外重金属修复相关的微生物,包括细菌、真菌和藻类,进行了比较全面的综述,并列出各自的修复能力,从其研究中也可以看出,对Cr6+具有较好修复能力的微生物较少。Ziagova等[14]从矿区筛选出对Cd2+和Cr6+有较好修复能力的Pseudomonassp.和S.xylosus两株细菌,经进一步研究发现,它们对Cr6+的生物吸附能力分别达到95.0和143 mg·g-1。目前,已知的能够修复Cr6+的真菌种类更少,其能力相对细菌来说也较弱,主要包括:酿酒酵母(Saccharomycescerevisiae)、青霉菌属(Penicilliumsp.)和曲霉菌属(Aspergillussp.)。如Ozer等[15]研究发现,酿酒酵母(Saccharomycescerevisiae)在25 ℃时对Cr6+吸附达到最大值,但也仅为32.6 mg·g-1。Say等[16]在研究产紫青霉(Penicilliumpurpurogenum)对水溶液中Cr6+生物吸附时,发现pH对其影响较大,大约在pH 6.0时,生物吸附量最大,达36.5 mg·g-1。目前,报道的对重金属Cr有修复能力的藻类只有小球藻(Chlorellavulgaris)[17-18]、马尾藻类海草(Sargassumsp.)[19-20]和斜生栅藻(Scenedesmusobliquus)[18]。
本研究中筛选到3株对Cr6+具有较强耐性的菌株(J3,J5,J8),均可耐受2 mmol·L-1的Cr6+;并具有较好的修复能力,在含2 mmol·L-1Cr6+的液体培养基中培养48 h,Cr6+含量分别降低了23%,36%和7%,具有潜在的应用价值。经鉴定,它们均属于芽孢杆菌属,J3为解淀粉芽孢杆菌(Bacillusamyloliquefaciens),J5为地衣芽孢杆菌(Bacilluslicheniformis),J8为沙福芽孢杆菌(Bacillussonorensis)。国内外已经有关于地衣芽孢杆菌对Cr6+有修复能力的报道,如Zhou等[21]研究死亡的地衣芽孢杆菌细胞对Cr6+的生物吸附动力学时,发现含铬300 mg·L-1、pH 2.5、温度为50 ℃的处理液,其生物吸附量最大,达60.5 mg·g-1。本研究筛选到的3株细菌其耐受Cr6+的原理及修复原理有待进一步研究,对于其修复动力学的研究也将进行,以便在今后的修复应用中发挥最大效用。
[1]徐衍忠, 秦绪娜, 刘祥红, 等. 铬污染及其生态效应[J]. 环境科学与技术, 2002, 25(增刊): 8-9.
[2]PAWLISZ A V, KENT R A, SCHNEIDER U A, et al. Canadian water quality guidelines for chromium[J].EnvironmentalToxicology&WaterQuality, 1997, 12(2): 123-183.
[3]BELEZA V M, BOAVENTURA R A, ALMEIDA M F. Kinetics of chromium removal from spent tanning liquors using acetylene production sludge.[J].EnvironmentalScience&Technology, 2001, 35(21): 4379-4383.
[4]WILSON K. Preparation of genomic DNA from bacteria[M]// Current Protocols in molecular biology. New York: John Wiley & Sons, Inc., 2013: 143-151.
[5]POLZ M F, CAVANAUGH C M. Bias in template-to-product ratios in multitemplate PCR.[J].Applied&EnvironmentalMicrobiology, 1998, 64(10): 3724-3730.
[6]DON R H, COX P T, WAINWRIGHT B J, et al. Touchdown PCR to circumvent spurious priming during gene amplification.[J].NucleicAcidsResearch, 1991, 19(14): 4008.
[7]PATTANAPIPITPAISAL P, BROWN N, MACASKIE L. Chromate reduction and 16S rRNA identification of bacteria isolated from a Cr(Ⅵ)-contaminated site[J].AppliedMicrobiology&Biotechnology, 2001, 57(1/2): 257-261.
[8]ATANASSOVA D, STEFANOVA V, RUSSEVA E. Co-precipitative pre-concentration with sodium diethyldithiocarbamate and ICP-AES determination of Se, Cu, Pb, Zn, Fe, Co, Ni, Mn, Cr and Cd in water[J].Talanta, 1998, 47(5): 1237-1243.
[9]REYNOLDS M F, PETERSON-ROTH E C, BESPALOV I A, et al. Rapid DNA double-strand breaks resulting from processing of Cr-DNA cross-links by both MutS dimers[J].CancerResearch, 2009, 69(3): 1071-1079.
[10]FRANCISCO R, MORENO A, MORAIS P V. Different physiological responses to chromate and dichromate in the chromium resistant and reducing strainOchrobactrumtritici5bvl1[J].Biometals, 2010, 23(4): 713-725.
[11]林匡飞, 张大明, 李秋洪, 等. 苎麻吸镉特性及镉土的改良试验[J]. 农业环境科学学报, 1996 (1): 1-4.
[12]WASAY S A, BARRINGTON S, TOKUNAGA S. Organic acids for the in situ remediation of soils polluted by heavy metals: soil flushing in columns[J].Water, 2001, 127(1): 301-314.
[13]WANG J, CHEN C. Biosorbents for heavy metals removal and their future[J].BiotechnologyAdvances, 2009, 27(2): 195-226.
[14]ZIAGOVA M, DIMITRIADIS G, ASLANIDOU D, et al. Comparative study of Cd(Ⅱ) and Cr(Ⅵ) biosorption onStaphylococcusxylosusandPseudomonassp. in single and binary mixtures[J].BioresourceTechnology, 2007, 98(15): 2859-2865.
[15]OZER A, OZER D. Comparative study of the biosorption of Pb(Ⅱ), Ni(Ⅱ) and Cr(Ⅵ) ions onto[J].JournalofHazardousMaterials, 2003, 100: 219-229.
[16]SAY R, YILMAZ N, DENIZLI A. Removal of chromium(Ⅵ) ions from synthetic solutions by the fungusPenicilliumpurpurogenum[J].EngineeringinLifeSciences, 2004, 4(3): 276-280.
[17]AKSU Z. Investigation of simultaneous biosorption of copper(Ⅱ) and chromium(Ⅵ) on dried chlorella vulgaris from binary metal mixtures: Application of multicomponent adsorption isotherms[J].SeparationScience&Technology, 1999, 34(3): 501-524.
[18]DÖNMEZ G Ç, AKSU Z, ÖZTÜRK A, et al. A comparative study on heavy metal biosorption characteristics of some algae[J].ProcessBiochemistry, 1999, 34(9): 885-892.
[19]COSSICH E S, TAVARES C R G, RAVAGNANI T M K. Biosorption of chromium (Ⅲ) bySargassumsp. biomass[J].ElectronicJournalofBiotechnology, 2002,5(2): 133-140.
[20]SILVA E A, COSSICH E S, TAVARES C G, et al. Biosorption of binary mixtures of Cr(Ⅲ) and Cu(Ⅱ) ions by Sargassum sp[J].BrazilianJournalofChemicalEngineering, 2003, 20(3): 213-227.
[21]ZHOU M, LIU Y, ZENG G, et al. Kinetic and equilibrium studies of Cr(Ⅵ) biosorption by deadBacilluslicheniformisbiomass[J].WorldJournalofMicrobiology&Biotechnology, 2006, 23(1): 43-48.
(责任编辑高峻)
Screening of heavy metal Cr6+resistant strains
JIANG Meng, WANG Wei*
(StateKeyLaboratoryofBioreactorEngineering,EastChinaUniversityofScienceandTechnology,Shanghai200237,China)
Cr6+is a hazardous heavy metal element to plant growth, and can endanger human and animal health through food chain enrichment. In the present study, Cr6+resistant strains were screened from soils added with 0.3, 0.5 g·kg-1Cr6+, in order to provide technical support for microbial remediation of heavy metal pollution. It was shown that 9 Cr6+resistant strains were screened, all of which could grow normally in media with 0.5, 1.0 mmol·L-1Cr6+. Among them, strains named as J3, J5 and J8 were able to grow in media with 2 mmol·L-1Cr6+. Besides, after 48 h cultivation in media with 2 mmol·L-1Cr6+, Cr6+content in media with J3, J5, J8 was reduced by 23%,36%, 7%, respectively. Sequencing analysis showed that J3, J5, J8 wereBacillusamyloliquefaciens,Bacilluslicheniformis,Bacillussonorensis, respectively.
heavy metal Cr6+; heavy metal resistance; soil remediation
10.3969/j.issn.1004-1524.2016.02.24
2015-10-16
国家高技术研究发展计划(863计划)课题(2012AA101401)
姜蒙(1988—),男,山东济宁人,硕士,主要从事微生物学研究工作。E-mail: jiang-meng-1988@163.com
,王伟,E-mail: weiwang@ecust.edu.cn
S154.39
A
1004-1524(2016)02-0324-06
姜蒙,王伟. 重金属Cr6+耐受细菌的筛选研究[J]. 浙江农业学报,2016,28(2): 324-329.

