复方柴芩颗粒对实验性黄曲霉毒素慢性中毒鸭CYP450酶表达的影响
李 杨,高 祝,荣 茜,杨晓敏,张 睿,李英伦
(四川农业大学 动物医学院,四川 成都 611130)
复方柴芩颗粒对实验性黄曲霉毒素慢性中毒鸭CYP450酶表达的影响
李杨,高祝,荣茜,杨晓敏,张睿,李英伦*
(四川农业大学 动物医学院,四川 成都 611130)
建立肉鸭黄曲霉毒素(AFB1)慢性中毒模型,设立正常组、AFB1模型组、亚硒酸钠组、中药高剂量组、中药中剂量组和中药低剂量组,采用荧光定量PCR(RT-PCR)法和免疫蛋白印迹(Western-bolt)法检测肝标本中 CYP3A4,CYP1A2,CYP2E1的mRNA和蛋白表达来探讨复方柴芩颗粒对鸭黄曲霉毒素慢性中毒肝脏微粒体细胞色素P450(cytochrome P450,CYP450)酶系CYP3A4,CYP1A2和CYP2E1表达的影响,并借此深入探讨其解毒机制。结果显示,与模型组相比,中药高、中、低3个剂量组用药7,14和21 d后肝脏微粒体细胞色素P450酶系CYP3A4,CYP1A2和CYP2E1的mRNA相对表达量显著降低。与模型组相比,中药高、中、低3个剂量组用药7~14 d,则CYP3A4,CYP1A2和CYP2E1蛋白表达量显著降低;用药21 d后高剂量组3种基因型蛋白表达量显著降低。研究表明,复方柴芩颗粒连续用药1~2周能有效地降低由鸭黄曲霉毒素慢性中毒引起的CYP1A2,CYP2E1,CYP3A4 mRNA相对表达量和蛋白表达量升高的趋势,但随用药时间增加,各组的CYP1A2,CYP2E1,CYP3A4 mRNA相对表达量和蛋白表达量逐渐升高。
细胞色素CYP1A2;细胞色素CYP3A4;细胞色素CYP2E1;复方柴芩颗粒;黄曲霉毒素B1;mRNA表达;蛋白表达
花生、玉米等作物和动物饲料原料等极易受黄曲霉毒素污染,其中黄曲霉毒素B1(AFB1)是毒性最强的黄曲霉毒素亚型。畜禽长期饲用含有霉菌及霉菌毒素的饲料可导致其生长受阻,生产性能下降,给养殖业带来严重危害和经济损失。肝脏是黄曲霉素在动物体内的重要靶器官[1]。长期暴露黄曲霉素能够引起动物肝损伤甚至肝癌[2-3]。药物、毒物在体内的代谢也主要在肝脏进行,需要通过肝内存在的药物代谢酶(肝药酶)催化的氧化、还原、水解和结合等反应形成水溶性大、极性强的结合物,从尿、粪便和胆汁中排出体外[4-5]。人类对于肝微粒体(liver microsomes)细胞色素P450酶系(cytochrome P450,CYP450)的研究起始于20世纪70年代,这些酶因为可被诱导或抑制,并在多种生理及病理过程中起着重要的作用,而引起广泛关注[6]。细胞色素P450酶是一种以血红素为辅基的b族细胞色素超家族蛋白酶,因还原型细胞色素P450与一氧化碳复合物在450 nm处有一吸收峰,故命名为细胞色素P450[7]。AFB1毒性激活和代谢主要与CYP450的氧化作用有关[8]。复方柴芩颗粒主要成分为柴胡、黄芩、黄芪、五味子和泽泻五味中药,能有效防治肉鸭AFB1慢性中毒,减少肝细胞膜受损或细胞坏死程度,抑制脂质过氧化反应,上调肝脏抗氧化的能力。国内外对有关肉鸭的AFB1慢性中毒对CYP450超家族的影响研究报道极少,对其他物种的报道较多。为此,本试验利用肉鸭肝微粒体混合酶体外代谢体系,检测肉鸭AFB1慢性中毒过程中CYP1A2,CYP3A4,CYP2E1的mRNA和蛋白表达量,借此深入探讨复方柴芩颗粒在治疗肉鸭AFB1慢性中毒的药理作用。
1 材料与方法
1.1试验材料
1.1.1动物
126只1日龄樱桃谷肉鸭,由雅安某养殖场提供。
1.1.2试剂和药品
MSS1003黄曲霉毒素B1(AFB1)标准品(Pribolab北京泰勒棋科技公司代理);分析纯亚硒酸钠;复方柴芩颗粒(成分:柴胡、黄芩、黄芪、泽泻、五味子。四川农业大学中兽医实验室);ComSYBR qPCR Mix(LK-0107AB,上海诺伦公司);反转录试剂盒(LR-0103B, 上海诺伦公司);新鲜动物组织和细胞总RNA抽提试剂盒(LN-0108B,Novland Shanghai);SDS 上样缓冲液(2×);转膜缓冲液;10×TBS; 封闭液;洗脱液;Super-GL ECL 超敏发光液(上海诺伦公司);裂解液(上海诺伦公司);PVDF 转移膜(Millipore,美国);羊抗兔IgG(Jakeson,美国);羊抗鼠IgG(Jakeson,美国);Cytochrome-P450-3A4抗体(ab3572,abcam,英国);Cytochrome-P450-1A2抗体(ab22717,abcam,英国);Cytochrome-P450-2E1抗体(ab28146,abcam,英国);甘必应-鸭病毒性肝炎弱毒活疫苗(CH60株)(哈药集团)。
1.1.3仪器和材料
Centrifuge 5804R高速冷冻离心机(eppendorf,德国);Sorvall Stratos 型冷冻高速离心机(Thermo Scientific,美国);FuheHH-6型恒温水浴锅(金坛市富华仪器有限公司);各种型号移液枪(Thermo Scientific,美国);组织匀浆机;MX3000P实时荧光定量PCR仪(Agilent, Germany);PowerPacTMHC电泳仪(bio-rad);VE-180垂直电泳槽(天能);Semi-Dry Transfer Cell(bio-rad,美国);DY-B1脱色摇床(上海青浦沪西仪器公司);转膜滤纸(bio-rad,美国);KODAK X-Omat BT Film(Kodak,美国);X光片显影液、X光片定影液(Kodak,美国)。
1.2方法
1.2.1分组及饲养管理
(1)将1日龄126只健康樱桃谷肉鸭随机分成6组。分别为正常健康组(A组)、AFB1组(B组)、阳性对照组(C组)、高剂量药物组(D组)、中剂量药物组(E组)和低剂量药物组(F组),用正常基础配合日粮饲喂6 d。阳性对照药物为亚硒酸钠(Na2SeO3)。
(2)正常健康组饲喂7 d后,开始继续饲喂正常基础配合日粮,并灌服5 mL生理盐水。AFB1组饲喂含有AFB1 40 μg·kg-1的全价日粮,同样灌服5 mL生理盐水。三种剂量药物组在第7日开始饲喂同样含有AFB1 40 μg·kg-1的全价日粮,分别按高中低剂量灌服 复方柴芩颗粒(Medicine)2.0,1.0,0.5 g·mL-1(按原生药计)5 mL。亚硒酸钠组饲喂含AFB1 40 μg·kg-1的全价日粮并每日每只按肉鸭体重1 mg·kg-1的亚硒酸钠溶于5 mL水后灌服[9]。试验开始前1周动物房需彻底打扫,包括水壶、料槽、鸭笼等在内清洗干净并熏蒸消毒1 d,之后开门窗散味5 d后动物入住。在试验过程中,给试验动物提供适宜温度、24 h光照和干净充足的水源,2日龄时接种鸭病毒性肝炎弱毒活疫苗,10日龄时接种H5N1亚型禽流感灭活疫苗。
1.2.2样品采集处理
造模后第7,14,21天3个时间点分别在每组取7只肉鸭,颈静脉放血致死。快速取出肝脏,即用冰冷的生理盐水反复冲洗。放在冰盒中备用。
1.2.3肉鸭肝微粒体制备
在已取出的每个肝脏中准确称取2 g组织,将组织剪碎,按照1 g组织加4 mL TMS缓冲液(pH=7.5)标准,加入8 mL TMS缓冲液,放入组织匀浆机中,制成20%(m/V)匀浆。然后置低温高速离心机12 000g,4 ℃离心15 min,舍弃沉淀部分,移上清部分于2 mL EP管中,每管装1.2 mL上清液,保留4管。每管上清液中加入88 mmol·L-1CaCl2,使终浓度为8 mmol·L-1,混匀后放置5 min后25 000g,4 ℃离心15 min取沉淀;用200 μL Tris-HCl(pH=7.4)将沉淀重悬, 并加入200 μL 20%甘油于-80 ℃冻存,用于检测CYP3A4,CYP1A2,CYP2E1蛋白表达[10]。
1.2.4CYPs亚型药酶定量RT-PCR分析
(1)总RNA提取:将黄豆粒大小的肝组织转移至加有1 mL 裂解液的无RNA酶的离心管中,用电动匀浆机在冰浴中匀浆组织约15 s直到看不见明显的组织块。加入0.2 mL三氯甲烷,剧烈摇动10 s,室温放置1 min。4 ℃,12 000g离心15 min。将上清水相转移至另一新的无RNA酶离心管中,并加入等体积的100%乙醇。吸取全部样品,加入带有2 mL收集管的mini-spin离心柱。8 000g,室温离心15 s,弃尽流穿液。将剩余的样品转移至离心柱,重复离心1次。往离心柱中加入700 μL WB,轻盖盖子,8 000g,室温离心15 s,弃尽流穿液。重复离心1次,用500 μL WB洗涤离心柱两次。将离心柱转移至1个新的无RNA酶的1.5 mL离心管中,往硅胶膜中央滴加50 μL DEPC水,4 ℃,10 000g离心3 min洗脱RNA。
(2)荧光定量引物设计见表1。
表1qPCR引物序列
Table 1Sequence of primers for qPCR analysis

基因引物序列(5'-3')ActbF-ACCCCAAAGCCAACAGAGAGAAGR-GCACAGCCTGGATGGCTACATACCYP1A2F-GATCCAAACGAGAAGATCATCAACCR-ACAAGGTACATGAGGCTCCAGGACCYP2E1F-CCCAAGTCCTTCACCAGGCTGR-ACCTCCTTCACGGCCTTGTAGCCYP3A4F-GCTGCTCCTTGCTGCTTTTCTGR-GAATGCCCAGCTTCTTGAAGGTC
(3)设定好引物后,室温解冻样品组织和需要的试剂,开始PCR扩增。首先是反转录反应,按照变性反应42 ℃ 30 min 和退火反应85 ℃ 10 min的标准在PCR仪上进行。20 μL反应体系为:总RNA 2.0 μL,缓冲液10.0 μL,反转录引物(1 μmol·L-1)1.2 μL,MMLV反转录酶(200 U·μL-1)0.2 μL,加入DEPC处理过的ddH2O 6.6 μL。
(4)上述反应结束后进行定量PCR反应,20 μL反应体系为:定量PCR Master Mix 10.00 μL,上下游引物各0.08 μL,cDNA模板2.00 μL,TaqDNA 聚合酶(2.5 U·μL-1)0.40 μL,ddH2O 7.44 μL 。PCR反应参数为95 ℃, 3 min 变性;95 ℃, 12 s 和60 ℃, 40 s 循环40次结束。
1.2.5CYPs蛋白表达
每个组织细胞样本加入300 μL组织细胞裂解液, 用枪混匀使其完全裂解,将裂解物移至新的离心管中。直接取10 μL样本加入10 μL 2×SDS-PAGE loading buffer,混匀,100 ℃加热处理5 min,之后在冰上冷却,12 000g离心5 min去除不溶性沉淀。样品使用10% SDS-PAGE分离,每孔上样量为20 μL。电泳结束后,将PVDF膜在甲醇中浸泡1 min,再使用Transfer Buffer浸泡凝胶、滤纸和在甲醇中浸泡过的PVDF膜一起4 ℃放置10 min,然后制备转移三明治。使用Blocking Buffer封闭转印膜4 ℃封闭过夜,第2天用1×TBST洗涤3次,每次15 min。加入稀释好的一抗,37 ℃温育2 h。用1×TBST洗涤4次,每次10 min。之后加入稀释好的二抗,处理方法与一抗相同。用Super-GL ECL 超敏发光液进行化学发光检测,并对X光片曝光。经显影定影处理后,晾干的胶片最后用凝胶成像分析系统拍照,本试验采用的是Gel-Pro Analyzer软件来分析处理。
1.3统计学分析
2 结果与分析
2.1实时荧光定量PCR结果
2.1.1复方柴芩颗粒对CYP3A4 mRNA相对表达量的影响
在整个试验期3个时间点中,D,E,F三组的CYP3A4 mRNA相对表达量显著低于B组和C组,且显著高于A组(P<0.05),其中投药7和14 d后中药F组与D,E两组对比差异显著(P<0.05),D,E两组更接近A组水平;而投用药21 d的D组与E,F两组对比差异显著(P<0.05),D组更接近正常组水平。在3个时间点,C组显著高于其余五组(P<0.05)。B,C两组CYP3A4 mRNA相对表达量随时间先降低后升高,E组在用药21 d数值达最高,而F组在用药14和21 d的数值最低。试验表明,在给雏鸭饲喂含AFB1饲料后,CYP3A4 mRNA相对表达量显著升高(P<0.05),给雏鸭灌胃投用中药后,CYP3A4 mRNA相对表达量升高的趋势得到明显改善,其中高、中剂量投用药14 d,CYP3A4 mRNA相对表达量最接近正常值。见表2。
2.1.2复方柴芩颗粒对CYP1A2 mRNA相对表达量的影响
在整个试验期3个时间点中,D,E,F三组的CYP1A2 mRNA相对表达量显著低于B组和C组,且显著高于A组(P<0.05),其中投药后第7天中药D、E、F三组组间差异不明显,而投药14和21 d的F组与D,E两组对比差异显著(P<0.05),D、E两组更接近A组水平;在3个时间点,C组显著高于其余5组(P<0.05)。B,C,D,E和F组CYP1A2 mRNA相对表达量随时间先降低后升高,均在用药14 d时出现最低值。试验表明,在给雏鸭饲喂含AFB1饲料后,CYP1A2 mRNA相对表达量显著升高(P<0.05),给雏鸭灌胃投用中药后,CYP1A2 mRNA相对表达量升高的趋势得到明显改善,其中高、中剂量投用14 d,CYP1A2 mRNA相对表达量最接近正常值(表3)。
A: Actb; B: CYP1A2; C: CYP2E1; D: CYP3A4图1 荧光扩增曲线Fig.1 Fluorescence amplification curve
A: Actb; B: CYP1A2; C: CYP2E1; D: CYP3A4图2 熔解曲线Fig.2 Melting curve
表2各组CYP3A4 mRNA相对表达量
Table 2The mRNA relative expression amount of CYP3A4

投药时间/dA组B组C组D组E组F组71.02±0.03Ae3.32±0.12Ab4.55±0.10Aa1.78±0.09Ad1.98±0.05Bd2.73±0.06Ac141.04±0.03Ae3.07±0.08Bb3.83±0.07Ba1.63±0.08Ad1.95±0.04Bd2.49±0.08Bc211.05±0.03Ae3.39±0.08Ab4.37±0.04Aa1.81±0.08Ad2.37±0.05Ac2.48±0.27Bc
注:同行不同列数据后没有相同小写字母的表示差异显著(P<0.05),同列不同行数据后没有相同大写字母的表示差异显著(P<0.05)。表2—7同。
2.1.3复方柴芩颗粒对CYP2E1 mRNA相对表达量的影响
在整个试验期3个时间点中,除F组第7天外,D、E、F三组的CYP2E1 mRNA相对表达量显著低于B组和C组,均显著高于A组(P<0.05),其中投药7和14 d,中药F组与D,E两组对比差异显著(P<0.05),D、E两组更接近A组水平;而投药后第21天的D组与F组对比差异显著,D组更接近正常组水平。在3个时间点,C组显著高于其余5组(P<0.05)。B,C,D,E组CYP2E1 mRNA相对表达量有随时间增加而升高趋势,D,E组在各时间点的相对表达量更接近相同时间点的A组。试验表明,在给雏鸭饲喂含AFB1饲料后,CYP2E1 mRNA相对表达量显著升高(P<0.05),给雏鸭灌胃投用中药后,CYP2E1 mRNA相对表达量升高的趋势得到明显改善,其中高剂量投用7 d,CYP2E1 mRNA相对表达量最接近正常值(表4)。
表3各组CYP1A2 mRNA相对表达量
Table 3The mRNA relative expression amount of CYP1A2

投药时间/dA组B组C组D组E组F组71.06±0.03Ad2.91±0.04Bb4.00±0.11Aa1.75±0.04Bc1.84±0.04Bc2.13±0.03Bc140.98±0.64Ae2.79±0.04Bb3.60±0.03Ba1.54±0.01Cd1.63±0.07Bd2.08±0.02Bc211.06±0.03Ae3.29±0.13Ab4.10±0.12Aa1.92±0.02Ad2.15±0.12Ad2.64±0.04Ac
2.2Western-blot结果
结果显示,CYP3A4在57 kD左右有条带, CYP1A2在58 kD左右出现条带,CYP2E1在55 kD左右出现条带。
2.2.1复方柴芩颗粒对CYP3A4蛋白表达的影响
投药后第7天,D,E,F三组的CYP3A4蛋白表达量显著低于B组和C组,且显著高于A组(P<0.05),其中中药D,E,F三组组间对比差异显著(P<0.05);投药后第14天,D,E,F三组中除F组和B组对比未见显著差异外,D,E两组CYP3A4蛋白表达量显著低于B组和C组,且显著高于A组(P<0.05),D,E,F三组间未见显著差异;投药21 d后,D,E,F三组中只有D组显著低于B组,E和F组均和B组持平,未见显著差异。在3个时间点,C组显著高于其余5组(P<0.05)。D,E,F三组随时间增加CYP2E1蛋白表达量有升高趋势,在投药21 d数值最高。试验表明,在给雏鸭饲喂含AFB1饲料后,CYP3A4蛋白表达量显著升高(P<0.05),给雏鸭灌胃投用中药后,CYP3A4蛋白表达量升高的趋势得到明显改善,其中高剂量投用7 d,CYP2E1蛋白表达量最接近正常值。见表5。
表4各组CYP2E1 mRNA相对表达量
Table 4The mRNA relative expression amount of CYP2E1
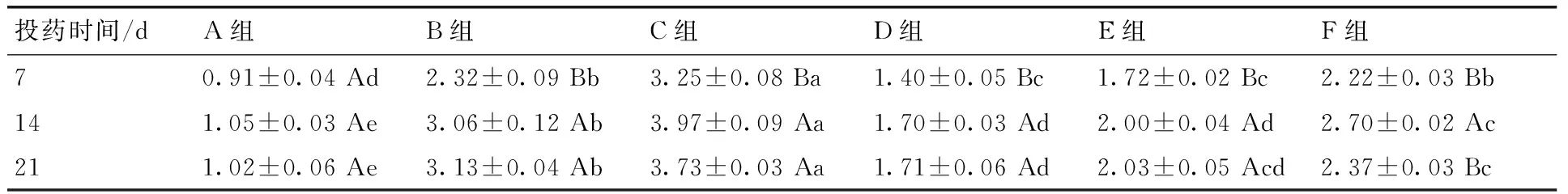
投药时间/dA组B组C组D组E组F组70.91±0.04Ad2.32±0.09Bb3.25±0.08Ba1.40±0.05Bc1.72±0.02Bc2.22±0.03Bb141.05±0.03Ae3.06±0.12Ab3.97±0.09Aa1.70±0.03Ad2.00±0.04Ad2.70±0.02Ac211.02±0.06Ae3.13±0.04Ab3.73±0.03Aa1.71±0.06Ad2.03±0.05Acd2.37±0.03Bc
2.2.2复方柴芩颗粒对CYP1A2蛋白表达的影响
投药7 d,D,E,F三组的CYP1A2蛋白表达量显著低于B组和C组,且显著高于A组(P<0.05),其中D组和E、F两组对比显著差异(P<0.05);投药14 d,D,E,F三组中除F组和B组对比未见显著差异外,D,E两组CYP3A4蛋白表达量显著低于B组和C组,且显著高于A组(P<0.05),这3组组间对比无显著差异;投药21 d,D,E,E,F三组中只有D组显著低于B组,E和F两组和B组对比,均未见显著差异,D组与F组相比差异显著(P<0.05)。3个时间点的C组显著高于其余5组(P<0.05)。D,E,F三组随投药时间增加CYP1A2蛋白表达量有升高趋势(P<0.05),在投药后第21天数值最高。试验表明,在给雏鸭饲喂含AFB1饲料后,CYP1A2蛋白表达量显著升高(P<0.05),给雏鸭灌胃投用中药后,CYP1A2蛋白表达量升高的趋势得到明显改善,其中高剂量投药7 d,CYP1A2蛋白表达最接近正常值(表6)。
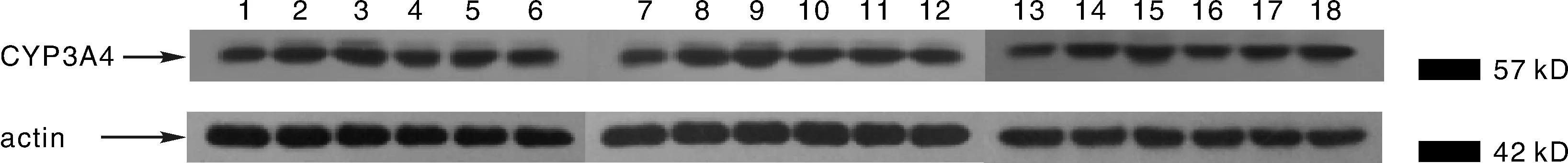
注: 从左到右1~6依次为A, B, C, D, E, F组7 d的样本; 7~12依次为A, B, C, D, E, F组14 d的样本; 13~18依次为A, B, C, D, E, F组21 d的样本。 图2—3同。图3 不同样本CYP3A4的表达(β-actin作为内参照)Fig.3 The CYP3A4 expression with western blot(β-actin as a reference)
表5各组CYP3A4蛋白表达
Table 5The protein expression of CYP3A4
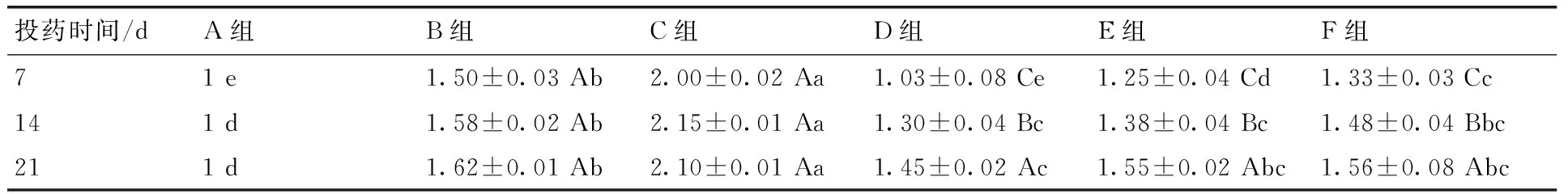
投药时间/dA组B组C组D组E组F组71e1.50±0.03Ab2.00±0.02Aa1.03±0.08Ce1.25±0.04Cd1.33±0.03Cc141d1.58±0.02Ab2.15±0.01Aa1.30±0.04Bc1.38±0.04Bc1.48±0.04Bbc211d1.62±0.01Ab2.10±0.01Aa1.45±0.02Ac1.55±0.02Abc1.56±0.08Abc
2.2.3复方柴芩颗粒对CYP2E1蛋白表达的影响
由表7可见,在给雏鸭饲喂含AFB1饲料后,CYP2E1蛋白表达量显著升高(P<0.05),给雏鸭灌胃投用中药后,蛋白表达量升高的趋势得到明显改善,整个试验期3个时间点中,D,E,F三组中,除投药21d的E,D两组与B组差异不明显之外,其余CYP2E1蛋白表达量均显著低于B组和C组,且高于A组(P<0.05)。其中投药7 d中药D,E,F三组组间对比未见显著差异(P<0.05),其中高剂量投药7 d,CYP2E1蛋白表达量最接近正常值;而投药7,14和21 d的三组中药中,D、F两组对比差异显著,且均为高剂量的D组更接近A组水平。在3个时间点,C组显著高于其余5组(P<0.05)。D,E,F三组随时间增加CYP2E1蛋白表达量升高(P<0.05),在投药21 d的数值最高。
4 讨论
研究表明,雏鸭是AFB1最敏感的动物之一,AFB1对肝的损伤最为严重[11]。许多中西药具有降低AFB1毒性,有效降低AFB1导致的肝损伤的药理作用[12]。复方柴芩颗粒是本实验室自制,以疏肝解郁、健脾除湿为治疗原则确定的由柴胡、黄芩、黄芪、五味子和泽泻五味中药组成的组方,结合中药药剂学的方法而制备的中药颗粒。
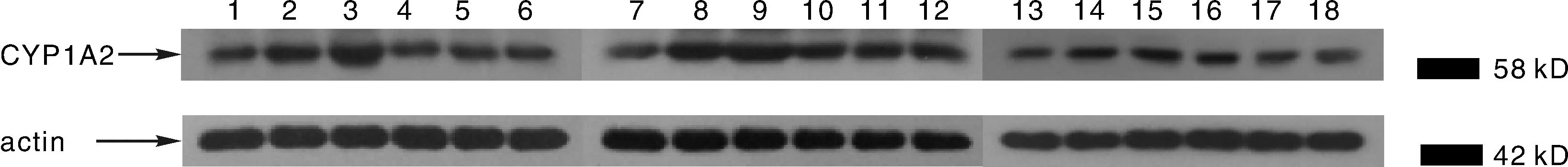
图4 不同样本CYP1A2的表达(β-actin作为内参照)Fig.4 The CYP1A2 expression with western blot(β-actin as a reference)
表6各组CYP1A2蛋白表达
Table 6The protein expression of CYP1A2
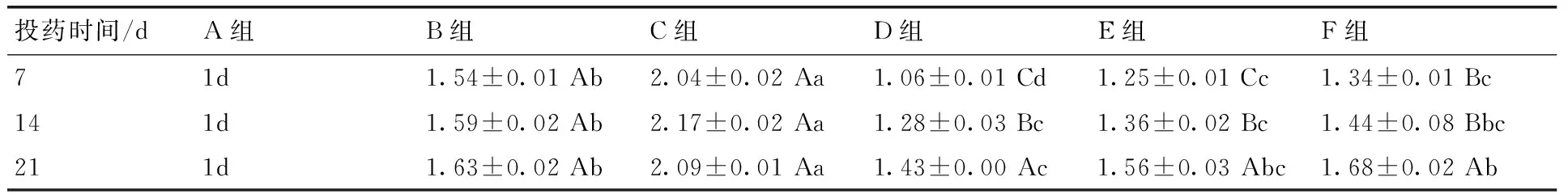
投药时间/dA组B组C组D组E组F组71d1.54±0.01Ab2.04±0.02Aa1.06±0.01Cd1.25±0.01Cc1.34±0.01Bc141d1.59±0.02Ab2.17±0.02Aa1.28±0.03Bc1.36±0.02Bc1.44±0.08Bbc211d1.63±0.02Ab2.09±0.01Aa1.43±0.00Ac1.56±0.03Abc1.68±0.02Ab
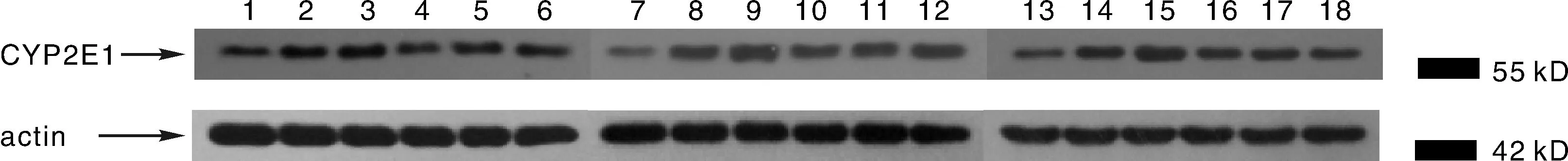
图5 不同样本CYP2E1的表达(β-actin作为内参照)Fig.5 The CYP2E1 expression with western blot(β-actin as a reference)
表7各组CYP2E1蛋白表达
Table 7The protein expression of CYP2E1

投药时间/dA组B组C组D组E组F组71Ad1.51±0.01Ab2.02±0.03Aa1.04±0.02Ccd1.23±0.03Cc1.34±0.08Cc141Ae1.58±0.02Ab2.17±0.04Aa1.27±0.01Bd1.36±0.01Bcd1.46±0.09Bc211Ad1.63±0.01Ab2.07±0.04Aa1.43±0.02Ac1.56±0.01Abc1.67±0.07Ab
研究表明,在肝脏中,CYP450酶系将AFB1代谢成AFP1,AFM1等物质,再由CYP450酶系中的一些酶激活AFP1,AFM1成环氧化物,后者与核酸或具有遗传特性的蛋白质形成络合物,与谷胱甘肽(GSH)共轭结合转变为二氢二醇,或与血清蛋白或其他大分子结合,进入动物血液和尿液中,完成解毒过程[13]。同时CYP450s系统中一些酶参与AFB1,AFQ1及AFB1-8,9-环氧化物的代谢,经羟基化作用后出现剧毒性和致癌性[14-15]。CYP450可以激活AFB1生成有毒性的物质,而肝损伤甚至肝癌亦能影响CYP450的表达[16]。据报道,至少有5个不同的人类肝脏CYP450亚酶,包括1A2,2A6,2B7,3A3,3A4,能够激活AFB1使其具有毒性[17]。Shimada等[18]报道CYP3A4是激活AFB1的最主要的细胞色素P450酶。在人肝微粒体中,CYP1A2主要参与AFB1到 AFM1的氧化,CYP3A4是参与AFB1 到AFQ1转化的主要CYP450超家族的亚型[19]。同样,在肉鸭中,CYP3A4和CYP1A2是作为激活AFB1的主要CYP450成员[20-21]。Aoyama等[22]报道CYP1A2,CYP3A4等能激活AFB1,使之具有毒性和致癌性,即CYP1A2,CYP3A4等参与AFB1的激活。但是卢凤美[23]报道,广西肝癌高发区和低发区肝癌患者的CYP3A4 mRNA的表达量均低于正常肝组织,推测出CYP3A4可能参与AFB1的解毒过程。本试验结果显示,AFB1组的CYP3A4,CYP1A2,CYP2E1的mRNA和蛋白表达升高,印证了Aoyama等的研究,即CYP3A4,CYP1A2和CYP2E1三种亚型能激活肉鸭体内的AFB1,使AFB1在体内具有生物毒性,即3种基因mRNA和蛋白表达越多,AFB1对机体产生的毒性越大。这也解释了为什么AFB1组的3种基因型表达比中药组多的原因。
研究表明,市面上一些具有保肝、护肝和抗肿瘤的中西药能在一定程度上降低或抵消AFB1的毒性,减少AFB1对肝脏的损伤[24]。金花茶浓缩液和银杏叶提取物通过降低CYPs活性表达来减少前致癌物的代谢,从而降低由AFB1引起的化学性肝损伤达到保护肝脏的作用[25-26]。而不同中西药及一些化学物质本身对于CYP450各种亚型的mRNA及蛋白表达影响不尽相同,例如乙酰乙酸抑制大鼠肝微粒体中CYP2E1 mRNA,但促进蛋白表达[27]。Shimamoto等[28]报道恩诺沙星能够抑制CYP1A,3A的活性和蛋白表达,却对mRNA水平没有影响。周常[29]报道小檗碱抑制CYP1A的酶活和mRNA,却对CYP1A的蛋白表达量没有影响。本试验显示,复方柴芩颗粒能缓解AFB1诱导CYP3A4,CYP1A2,CYP2E1的mRNA和蛋白表达的趋势。说明复方柴芩颗粒通过降低CYP3A4,CYP1A2,CYP2E1的mRNA和蛋白表达水平,来减少AFB1前体毒物的激活,降低肝损伤,达到保肝作用。从数值上看,高剂量组投药7和14 d,CYP3A4,CYP1A2,CYP2E1的mRNA和蛋白表达量更接近正常组。
硒(Se)是特殊的微量元素,既是生物体必需的,同时也是毒性极强的微量元素,它的治疗剂量与中毒剂量非常接近。内服或注射剂量过大或多次连续使用,会造成动物中毒[30]。国内外关于Se对CYP450的影响的报道并不一致,其对CYP450不同亚型的影响不尽相同。Gregory等[31]报道,在含AFB1日粮中添加Se对CYP450无任何影响。而另一个报道,缺硒能导致雄性大鼠肝脏微粒体中CYP4B1的表达量增加23倍[32]。本试验中阳性对照组的CYP3A4,CYP1A2,CYP2E1的mRNA和蛋白表达在3个时间点上都高于正常组和AFB1组,说明Se诱导了CYP3A4,CYP1A2,CYP2E1的mRNA和蛋白的表达。由于无文献报道明确解释该现象,故推测原因可能是亚硒酸钠连续投用21 d,由于Se蓄积造成影响,使得提高CYPs表达来提高肝脏的自身代谢能力,以清除包括硒在内的体内蓄积的毒素。另外,提示我们:硒的保肝作用可能不是通过CYP450酶系实现的。
综上所述,本试验得到重要结论,即复方柴芩颗粒通过降低CYP3A4,CYP1A2,CYP2E1的mRNA和蛋白表达,来减少AFB1前体毒物的激活,降低肝损伤,达到保肝作用。而作为阳性对照的药物亚硒酸钠却在整个试验过程中诱导了CYP3A4,CYP1A2,CYP2E1的mRNA和蛋白表达,由于亚硒酸钠对AFB1慢性中毒药理作用也是公认的,所以复方柴芩颗粒和硒的保肝作用途径是否不同,还需进一步研究来验证。
[1]EGNER P A,WANG J B,ZHU Y R,et al. Chlorophyllinintervention reduces aflatoxin-DNA adducts in individuals at high risk for liver cancer[J].ProceedingsoftheNationalAcademyofScienceoftheUnitedStatesofAmerica,2001, 98(25):14601-14606.
[2]安虹,邹广迅. 黄曲霉素毒性效应机制的研究进展[J]. 安徽农业科学,2011, 39(24):15007-15009, 15012.
[3]张立峰. 黄曲霉毒素:世界上最强的致癌物[J]. 热点关注,2012(2):24-25.
[4]孙忠实,朱珠. 药物代谢性相互作用研究进展[J]. 药物不良反应杂志,2000,2(1):6.
[5]胡蕾,高利臣,卓伟,等. CYP450氧化还原酶的药物基因组学研究进展[J]. 中国临床药理学与治疗学,2012,17(7):820-827.
[6]姚欣,钱元恕. 肝外药物代谢酶的研究进展[J]. 国外医学(药学分册),2003,30(2):97-101.
[7]郑丽莉,朱宇旌,邵彩,等. 动物体内细胞色素酶P3A4与饲料黄曲霉毒素Bl毒性的关系[J]. 动物营养学报,2013,25(1):13-20.
[8]范岚,彭向东,郭志华,等. CYP450氧化还原酶的遗传多态对药物代谢的影响[J]. 中国药理学通报,2009,25(9):1131-1133.
[9]唐华乔. “保肝护肾脱霉素”对樱桃谷肉鸭黄曲霉霉变饲料中毒的治疗效果评价[D]. 雅安:四川农业大学,2013.
[10]徐淑云,卞如濂,陈修. 药理实验方法学[M]. 3版. 北京:人民卫生出版社,2001:512-513.
[11]杜艳平. 黄曲霉毒素B1致癌机制及植物性化学物防治的研究进展[J]. 现代食品与药品杂志,2006,l6(1):3-8.
[12]闫超. 饲料中黄曲霉毒素B1(AFB1)的毒害及解毒措施[J]. 今日畜牧兽医,2005,25(12):35-37.
[13]AKIYAMA T E, GONZALEZ F J. Regulation of P450 genes by liver-enriched transcription factors and nuclear receptors[J].BiochimicaEtBiophysicaActa(GeneralSubjects),2003,1619(3):223-234.
[14]DENISSENKO M F, CAHILL J, KOUDRIAKOVA B.Quantitation and mapping of aflatoxin B1-induced DNA damage in genomic DNA using aflatoxin B1-8,9-epoxide and microsomal activation systems[J].MutationResearch, 1999, 425(2):205-211.
[15]欧超,郑海平,曹骥,等. CYP3A4在黄曲霉毒素B1诱发大鼠肝癌过程中的表达及意义[J]. 中国肿瘤临床,2011,38(14):822-829.
[16]BIRUKOV K G, LEITINGER N, BOCHKOV V N, et al. Signal transduction pathways activated in human pulmonary endothclial cells by OxPAPC, a bioactive component of oxidized lipoproteins[J].MicrovascularResearch, 2004, 67(1):18-28.
[17]AOYAMA T, YAMANO S, GUZELIAN E S, et a1. Five of 12 forms of vaccinia vires-expressed human hepatic cytochrome P450 metabolically activate aflatoxin B1[J].ProceedingsoftheNationalAcademyofSciences, 1990, 87(12):4790-4793.
[18]SHIMADA T, GUENGEDCH F P. Evidence for cytochrome P-450NF, the nifedipine oxidase, being the principal enzyme involved in the bioactivation of aflatoxins in human liver[J].ProceedingsoftheNationalAcademyofSciences, 1989, 86(2):462-465.
[19]GALLAGHER E P, WIENKERS L C, STAPLETON P L, et a1. Role of human microsomal and human complementary DNA-expressed cytochromes P4501A2 and P4503A4 in the bioactivation of aflatoxin B1[J].CancerResearch, 1994, 54(1):101-108.
[20]DIAZ J, MURCIA W, SANDRA M, et al. The role of selected cytochrome P450 enzymes on the bioactivation of aflatoxin B1 by duck liver microsomes[J].AvianPathology, 2010, 39(4):279-285.
[21]OMIECINSKI C J, REMMEL R P, HOSAGRAHARA V P. Concise review of the cytochrome P450s and their role in toxicology[J].ToxicologicalSciences, 1991, 48(2):151-156.
[22]AOYAMA T, YAMANO S, GUZELIAN P S, et al. Five of 12 forms of vaccinia virus-expressed human hepatic cytochrome P450 metabolically activate aflatoxin B1[J]. Proceedings of the National Academy of Sciences, 1990, 87(12):4790-4793.
[23]卢凤美. 广西肝癌高、低发区CYP3A4、CYP3A5基因多态性的对比研究[D]. 南宁:广西医科大学,2008.
[24]罗仁夏,林如涛,陆元斌,等. 茵陈蒿对黄曲霉毒素B1诱导效应的抑制[J]. 福建医科大学学报,1990,24 (4):352-354.
[25]欧超,郑海平,曹冀,等. 黄曲霉毒素B1诱发大鼠肝癌过程中对CYP3A4活性的影响[J]. 中国癌症防治杂志,2011,3(2):110-113.
[26]欧超,郑海平,曹冀,等. 银杏叶提取物对AFB1诱发大鼠肝癌过程中CYP3A4活性的影响[J]. 时珍国医国药,2012, 23(7):1656-1658.
[27]PORTER T D, COON M J. Cytochrome P450:Multiplicity of isoforms,substrates,and catalytic and regulatory mechanisms[J].JournalofBiologicalChemistry, 1991, 266(21):13459-13472.
[28]SHIMAMOTO Y TASAKI T, KITAMURA H, et a1. Decrease in hepatic CYP2C11 mRNA and increase in heme oxygenase activity after intracerebroventricular injection of bacterial endotoxin[J].TheJournalofVeterinaryMedicalScience, 1999, 61(6):609-613.
[29]周常. 中药对异育银鲫CYP450的诱导与抑制及对恩诺沙星代谢的影[D]. 上海:上海海洋大学,2011.
[30]李国江,付连军,姜成,等. 新生犊牛急性亚硒酸钠中毒的诊断报告[J]. 畜牧与兽医,2008,40(11):40.
[31]GREGORY J F, EDDS G T. Effect of dietary selenium on the metabolism of aflatoxin B1 in turkeys[J].FoodandChemicalToxicology, 1984, 22(8):637-642.
[32]符晨星,贺建华,侯德兴. 硒对动物黄曲霉毒素B1中毒的缓解作用[J]. 湖南饲料,2011 (6):27-38.
(责任编辑卢福庄)
Effects of Compound Chai Qin Particles on mRNA expression and protein expression of CYP450 in aflatoxicosis chronic poisoned ducklings
LI Yang, GAO Zhu, RONG Qian, YANG Xiao-min, ZHANG Rui, LI Ying-lun*
(CollegeofVeterinaryMedicine,SichuanAgriculturalUniversity,Chengdu611130,China)
The aflatoxin B1(AFB1) chronic poisoning model of ducklings was set up, and one-day-old ducklings were divided into 6 groups. The real-time fluorescence quantitative PCR and western blot were used to investigate the influence of Compound Chai Qin Particles on the mRNA expression and protein expression of CYP3A4, CYP1A2 and CYP2E1 in treated ducks. The mRNA expressions of CYP3A4, CYP1A2 and CYP2E1 of the high-dose, middle-dose, low-dose groups were significantly lower than those of model group in this experiment. The protein expressions of CYP3A4, CYP1A2 and CYP2E1 of the high-dose, middle-dose, low-dose groups were significantly lower than those of model group in experimental 7th to 14th day. And the protein expressions of CYP3A4, CYP1A2 and CYP2E1 of the high-dose groups were significantly lower than those of model group on 21st day. It was concluded that Compound Chai Qin Particles could effectively decrease mRNA expression and protein expression of CYP1A2, CYP2E1 and CYP3A4 in liver microsomes of AFB1 chronic poisoned ducklings. However, with the medication time extended, the mRNA expression and protein expression of CYP1A2, CYP2E1 and CYP3A4 gradually increased.
cytochrome CYP 1A2; cytochrome CYP 3A4; cytochrome CYP 2E1; Compound Chai Qin Particles; aflatoxin B1; mRNA expression; protein expression
10.3969/j.issn.1004-1524.2016.02.06
2015-07-03
四川省科技厅重大项目(201378017)
李杨(1991—),女,内蒙古满洲里人,在读硕士研究生,研究方向为中兽医与中兽药。E-mail:liyangkimi@163.com
,李英伦,E-mail:liyinglun01@163.com
S834;S853.7
A
1004-1524(2016)02-0211-10
李杨,高祝,荣茜,等. 复方柴芩颗粒对实验性黄曲霉毒素慢性中毒鸭CYP450酶表达的影响[J].浙江农业学报, 2016,28(2): 211-220.

