foxo3a在脓毒血症患者外周血单个核细胞的表达变化及意义
周超 刘彦 张文锋 陈楠 李培志
(1. 成都市第六人民医院肝胆外科, 四川 成都 610051;2. 成都市第五人民医院消化内科, 四川 成都 611130;3.重庆医科大学附属第二医院肝胆外科, 重庆 400010)
·论著·
foxo3a在脓毒血症患者外周血单个核细胞的表达变化及意义
周超1刘彦2张文锋3陈楠3李培志3
(1. 成都市第六人民医院肝胆外科, 四川 成都 610051;2. 成都市第五人民医院消化内科, 四川 成都 611130;3.重庆医科大学附属第二医院肝胆外科, 重庆 400010)
目的检测叉头蛋白O3a(forkhead box O3a,foxo3a)在脓毒血症患者外周血单个核细胞(peripheral blood mononuclear cell,PBMC)的表达变化,并探讨其在脓毒血症发生过程中的作用。方法分离急性梗阻性化脓性胆管炎(acute obstructive suppurative cholangitis,AOSC)患者(n=27)治愈1周后的PBMC和血清,以及健康志愿者(n=12)的PBMC和血清,分别用蛋白印记法(western blotting,WB)和实时荧光定量聚合酶链反应法(qRT-PCR)检测PBMC中foxo3a、核因子κB p65(NF-κB p65)和核转录因子κB抑制因子(IκB)和蛋白及基因的表达和磷酸化水平;并用酶联免疫吸附法(ELISA)检测血清中脂多糖(LPS)、肿瘤坏死因子α(TNF-α)和白介素10(IL-10)的含量。结果27例AOSC患者血清中LPS、TNF-α和IL-10的含量明显高于治愈后1周及12例健康志愿者。同时,AOSC患者foxo3a的蛋白和基因的表达量明显低于健康志愿者,但是在治愈1周后,foxo3a的蛋白和基因的含量恢复到正常水平,p-foxo3a与foxo3a的表达呈负相关;另外,NF-κB p65在发病初期增高,治愈1周后基本恢复正常,而IκB及p-IκB表达与foxo3a与p-foxo3a变化相似。这些结果说明在AOSC 中foxo3a的磷酸化过程参与调控NF-κB的激活及机体炎症因子的失衡。结论foxo3a在脓毒血症发生过程中可通过磷酸化降解IκB或直接激活NF-κB,可作为缓解脓毒血症发生初期的治疗靶点之一。
脓毒血症;叉头蛋白O3a;核转录因子κB抑制因子
脓毒血症(sepsis)是由重症胆管炎、蜂窝织炎、脓肿等感染病灶引发的全身炎性反应综合征和继发多器官功能衰竭,病情凶险,病死率极高[1-2]。肠道细菌及脂多糖(lipopolysaccharide,LPS)移位和炎症介质紊乱等参与了脓毒血症发生和发展过程[3-4]。通常,细菌和LPS移位至外周血中,通过toll受体家族(toll like receptors, TLRs)激活下游核因子κB(nuclear fator κB,NF-κB),产生大量的促炎因子肿瘤坏死因子α(tumor necrosis factor α,TNFα),白介素1β(interleukin 1β,IL-1β)等,打破体内炎症介质平衡,加剧脓毒血症及多器官功能衰竭等[5-6]。
NF-κB的激活需要首先磷酸化锚钉在NF-κB多聚体上的核转录因子κB抑制因子(inhibitor of NF-κB, IκB)。IκB磷酸化后,NF-κB多聚体激活并入核,进而促进TNFα等促炎因子转录和表达[7-8]。因此,调控IκB磷酸化的过程对阻断细菌或LPS诱导的炎症反应,以及平衡体内炎症介质有重大的意义。而新近报道,叉头蛋白O3a(forkhead box O3a,foxo3a)在体外克罗恩病细胞模型中发现其不仅可直接参与IκB的磷酸化过程,并具有协同激活NF-κB的作用[9-10]。但是,在脓毒血症休克患者中,foxo3a是否参与到细菌和LPS移位至外周血,并调控NF-κB通路激活过程中,目前尚无报道。因此,本实验将检测foxo3a在急性梗阻性化脓性胆管炎(acute obstructive suppurative cholangitis,AOSC)患者外周血单个核细胞(peripheral blood mononuclear cell,PBMC)的表达变化,并探讨其在AOSC中对NF-κB通路激活的作用。
1 材料和方法
1.1病例对象本组病例选自2014年1月~2015年12月重庆医科大学附属第二医院收治被诊断为急性梗阻性化脓性胆管炎患者27例。诊断以入院磁共振胰胆管成像(magnetic resonance cholangiopancreatography,MRCP)或计算机断层扫描(computed tomography, CT)检查以及结合临床表现和血清学检测结果为准,诊断均由3位具有20年以上临床经验的肝胆外科主任医师共同决定。诊断标准参考2013版《东京指南》[11]。另选健康自愿者12例作对照。
1.1.1入选标准①重庆医科大学附属第二医院顺序收治诊断为急性梗阻性化脓性胆管炎患者,年龄<70岁。②有胆管炎及胆总管梗阻病理基础,符合胆总管引流术指正。③符合以下1项或1项以上:发热或低体温(体温>38.3℃,或<36℃);脉搏>90次/min或>正常范围2倍以上;呼吸急促(R>20次/min);意识改变;水肿或正净流液平衡(24 h内>20 ml/kg); 高糖血症(>7.7 mmol/L)。④符合以下1项或1项以上:外周血白细胞计数>12×109/L或<4×109/L或幼稚白细胞>10%;血浆C反应蛋白>正常值两倍以上;血浆降钙素原>正常值两倍以上。⑤收缩血压<90 mmHg或平均动脉压<70mmHg或收缩压下降超过40 mmHg或低于正常值二分之一。⑥符合以下1项或1项以上:动脉血氧低下(PaO2/FiO2<300);急性少尿或无尿;肌酐增加值>0.5 mg/dL;凝血功能异常(INR>1.5或aPTT>60 s);麻痹性肠梗阻;血小板计数<10×109/L;总胆红素>7 mg/dL。 ⑦符合以下1项或1项以上:血钙>1 mmol/L; 毛细血管充盈或紫癜。⑧此次发病前未接受任何抗感染治疗及解除胆道梗阻治疗。
1.1.2排除标准①符合入选标准但拒绝实验安排患者。②年龄>70岁。③引起胆管炎或胆道梗阻为肿瘤或先天性硬化性胆管炎。④入院前已经接受抗感染及解除胆道梗阻治疗。⑤有心脏等重大器官器质性疾病等手术禁忌症,接受胆道穿刺或胆道手术存在巨大风险。
1.1.3AOSC治愈标准此次胆道梗阻得以解除;无胆道梗阻和脓毒血症的临床症状,即体温、脉搏、血压、意识、尿量和血氧饱和度等正常,无腹痛、黄疸等;血液学检查指标如白细胞、血小板计数正常,胆红素、PTT、C反应蛋白等恢复正常水平。
1.2方法
1.2.1PBMC的分离入组患者签署知情同意书后分别于治疗前(early stage,ES)及治愈后1周(cure group,CG)分别用无内毒素乙二胺四乙酸真空抗凝管抽取外周血10 ml。外周血经梯度密度离心(3000 g×10 min)后收集上层血清用于酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)检测,剩余血细胞加入等体积PBS(0.01M,PH=7.4)充分混匀;取与上述混合液等体积的外周血单个核细胞分离液(LDS1075,天津灏洋)加入新的离心管中,将混合液小心加入分离液的上层,水平梯度密度离心(400 g×20 min)后加入10 ml PBS水平离心(400 g×10 min×2次);最后,获得的细胞沉淀即为PBMC,继续用于蛋白印记法(western blotting,WB)和实时荧光定量聚合酶链反应法(real-time quantitative polymerase chain reaction,qRT-PCR)检测。健康志愿者(healthy volunteers,HV)根据上述方法抽取外周血并分离PBMC进行相同检测。
1.2.2qRT-PCR检测首先提取PBMC总RNA:提取总RNA步骤按照试剂盒说明书操作(CW0597,北京康为世纪),即每107个细胞加入1 ml裂解液裂解细胞,再转移到无酶EP管进行震荡、离心,经氯仿萃取、乙醇溶解、去除细胞蛋白和基因组DNA后,用RNase H2O溶解并检测RNA浓度。然后用SYBR®Green法进行RNA逆转录(RR047a,takara)和Premix Ex TaqⅡ法(RR820L,takara)进行SYBR PCR反应:①去除基因组DNA:20 μl体系(4 μl 5×gDNA Eraser Buffer,2 μl gDNA Eraser,2 μg 总RNA和补充体积的RNase H2O)42℃水浴 2 min。②逆转录:2 μl 的PrimeScript RT Enzyme Mix I、2 μl 的RT Primer Mix、8 μl的 5×PrimeScript Buffer、8 μl的无RNase dH2O和20 μl去除基因组gDNA后的总RNA产物。37℃,15 min;85℃,5 s;4℃保存。③PCR反应:25 μl反应体系(12.5 μl 2×SYBR®Premix Ex Taq Ⅱ、1 μl PCR Forward Primer(10 μmol/L)、1 μl PCR Reverse Primer(10 μmol/L)、2 μl反转录溶液和8.5 μl RNase dH2O)进行预变性:95℃,30 s,1循环;然后扩增:95℃,5 s;60℃,60 s;总共40循环。最后用-△△Ct=-[(Ct目的-Ct内参)实验组-(Ct目的-Ct内参)对照组]进行半定量分析。目的基因的引物序列及大小,引物由上海生工生物公司合成,见表1。

表1 目的分子引物设计
1.2.3WB检测首先提取PBMC总蛋白,即每107个细胞加入100 μl RIPA裂解液裂解细胞,经震荡、高速离心后获取细胞总蛋白上清;BCA法测得蛋白含量,按每个样本50 μg的蛋白质上样,按每孔等质量等体积加入,进行10% SDS-PAGE,100 V恒压电泳120 min;250 mA,60 min湿转至PVDF膜中,5% BSA室温封闭90 min;加一抗体(兔抗foxo3a抗体(1∶500,sc-11351,Santa Cruz),兔抗p-foxo3a(1∶500,sc-101683, Santa Cruz),小鼠抗IκB抗体(1:500,sc-135945, Santa Cruz),兔抗p-IκB抗体(1∶500,sc-101705, Santa Cruz),兔抗NF-κB p65抗体(1∶500, sc-109, Santa Cruz),小鼠抗β-actin抗体(1∶250, BM0627,武汉博士德))后4℃孵育过夜;洗涤后,加HRP标记的二抗(山羊抗兔IgG(1∶2000,BA1054,武汉博士德),山羊抗鼠IgG,1∶2000,BA1075,武汉博士德)),室温孵育90 min;TBST洗涤后,ECL试剂盒在凝胶成像系统发光检测;利用Image Lab软件扫描目的条带和相应的β-actin条带,并测量灰度值。然后将目的条带的灰度值与β-actin的灰度值进行比较,所得的比值为目的蛋白的相对蛋白表达量。
1.2.4ELISA检测收集各组的血清,分别用人脂多糖(lipopolysaccharide,LPS)试剂盒(xy-0784E,上海信裕生物)、人TNF-α试剂盒(EK0525,武汉博士德)和人IL-10试剂盒检测(EK0416,武汉博士德)检测上述细胞因子及LPS含量,即:加样品和标准品,37℃ 90 min,不洗;加生物素标记抗体,37℃ 60 min;洗涤缓冲液洗涤3次;加 ABC反应液,37℃ 30 min。洗涤缓冲液洗涤5次;加TMB反应液,37℃ 30 分钟;加入TMB终止液,读数。制作标准曲线,根据样品的OD值计数出血清中相应分子的含量。
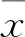
2 结果
2.1患者一般情况及术后并发症AOSC患者27例中,发病时间2小时~13天,合并心功能不全2例,肺功能不全1例,乙肝肝硬化3例,肾功能不全1例。既往具有胆道病史24例,胆道手术史10例;发热或寒战23例,黄疸25例,上腹痛27例;21例有典型Charcot’s三联征表现,16例有Reynold’s五联征表现。患者均有炎症反应证据(白细胞计数、C反应蛋白或降钙素原异常)和肝功能异常等。因胆囊结石继发胆总管结石18例,其中Mirziz’s 综合征3例;肝胆管结石5例,其中肝内外胆管结石3例,肝内胆管结石2例;单纯胆管良性狭窄3例,胆总管下端扩张1例。患者治疗前、治愈后一周及健康志愿者12例一般情况,见表2。
AOSC患者接受治疗后均无死亡病例,住院时间9~15天;其中15例行胆总管切开取石术+T管引流术,5例行胆管穿刺术,4例行胆肠吻合术,2例行肝叶切除术。术后均给予抗炎、保肝、营养支持及补液治疗。术后有4例患者出现手术相关严重并发症,其中肺炎2例,调整抗生素后痊愈;肝断面积液伴感染1例, 行穿刺引流术后痊愈;胆漏1例,保守治疗后停止。所有痊愈1周后均给予MRCP、CT或T管照影以确定此次梗阻完全解除,并复查相关血清学指标。
2.2血清中LPS、TNF-α和IL-10的表达变化AOSC患者入院前血清中LPS明显比健康志愿者高,经过手术及抗感染治疗后,LPS含量降至正常水平。同样,促炎因子TNF-α在AOSC感染高峰期含量明显高于健康志愿者,治愈后TNF-α水平下降至正常水平。而抗炎因子IL-10在患者入院前水平高于健康志愿者组,而治愈后水平下降,但仍略高于健康志愿者。以上结果说明,AOSC患者感染高峰期肠道LPS移位至外周血中,激活炎症信号通路,破坏机体内促炎因子和抗炎因子平衡,见图1。
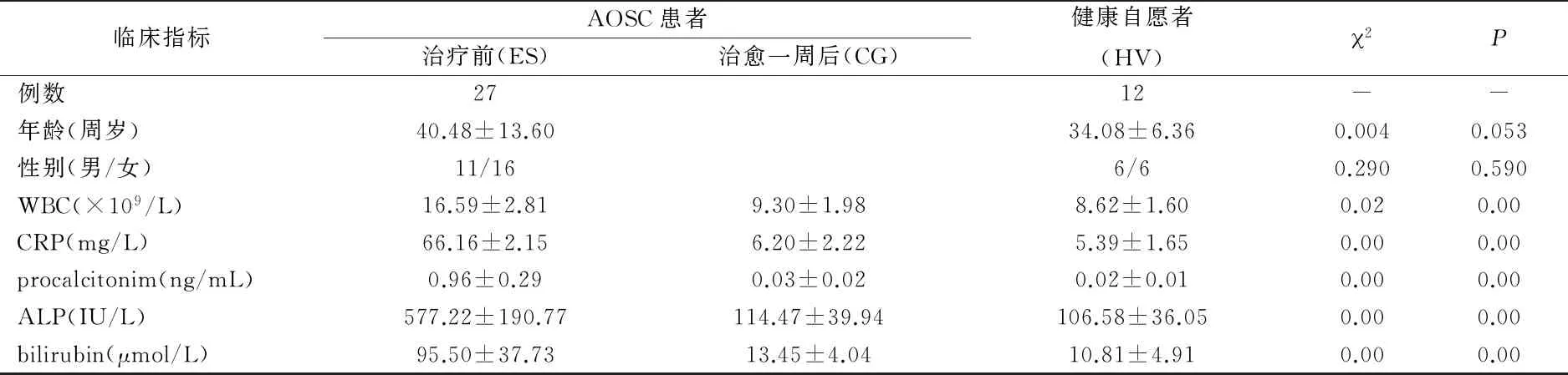
表2 AOSC患者与健康志愿者的一般情况比较
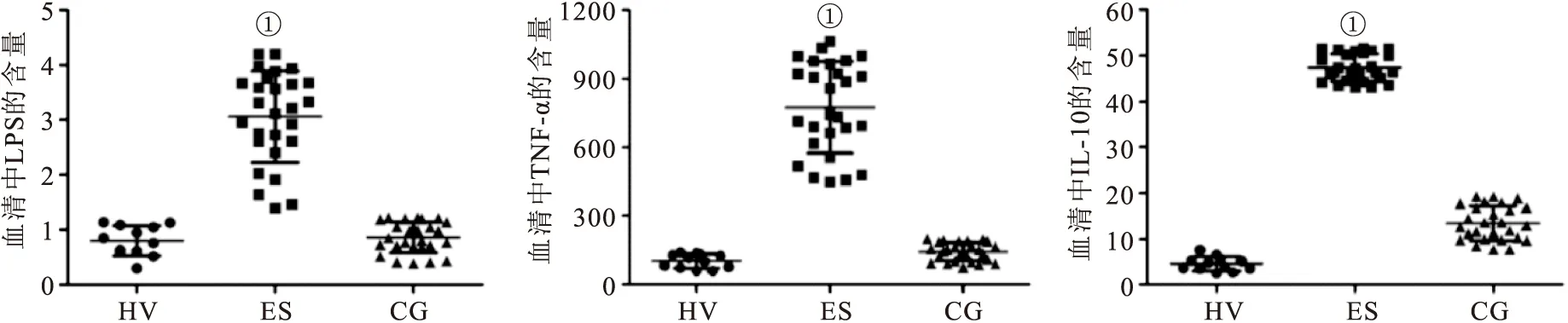
图1ELISA检测血清中LPS、TNF-α和IL-10的表达变化
Figure 1The change serum levels of LPS, TNF-α and IL-10
注:ES与HV、CG比较,①P<0.05
2.3PBMC中foxo3a和NF-κB通路的基因和蛋白表达变化AOSC患者入院时PBMC中foxo3a的mRNA和蛋白的表达量明显低于健康志愿者高,经过治疗后,foxo3a的mRNA和蛋白表达降至正常水平。而PBMC的p-foxo3a在AOSC患者入院时表达剧增,而在健康志愿者和治愈后患者中表达处于低水平。同时,PBMC中IκB在AOSC患者入院时、治愈后及健康志愿者基因和蛋白的表达趋势与foxo3a相似,而p-IκB在AOSC患者入院时、治愈后及健康志愿者基因和蛋白的表达趋势则与p-foxo3a相似。另外,PBMC中NF-κB P65在AOSC患者入院时表达升高,而在治愈后下降至正常水平。以上结果说明,脓毒血症发生时,PBMC中foxo3a参与调控NF-κB信号通路激活过程,见图2。
3 讨论
在本实验中,我们检测了AOSC患者治疗前后外周血血清中LPS和炎症因子的变化,并检测了PBMC中foxo3a基因和蛋白变化以及NF-κB信号通路激活情况,上述指标亦与健康志愿者进行对比。结果提示脓毒血症的发生与肠道LPS移位密切相关,并引起机体促炎因子和抗炎因子的失衡;同时,foxo3a磷酸化参与了NF-κB信号通路激活并促进机体炎症因子失活的过程。
foxo3a是转录因子叉头蛋白家族成员之一,亦是PI3K /Akt信号通路的下游分子[12-14]。炎症信号磷酸化激活PI3K/Akt后,诱导Akt与核内foxo3a结合并磷酸化。磷酸化foxo3a脱离DNA上结合位点,并从核内排出进入胞质从而降低其转录活性,阻断TLR4信号通路的转导[15-16]。在病原体激活的抗原递呈细胞中,foxo3a能够抑制TNF-α和IL-6等炎症因子的产生[17-18];在大剂量LPS刺激下,炎症细胞内foxo3a的表达急剧下降[15]。我们实验中观察到血清中LPS含量增加时,PBMC内foxo3a水平下降,而磷酸化水平升高。当患者治愈后,LPS恢复正常水平,PBMC内foxo3a含量亦恢复正常。因此, foxo3a参与了脓毒血症发生过程中由肠道LPS移位引发的炎症因子紊乱的过程。
肠道LPS及细菌移位激活PBMC的TLR4信号通路,进一步促进NF-κB炎症信号放大。NF-κB信号通路是LPS刺激炎症细胞分泌大量促炎因子如TNF-α的主要机制之一。研究表明,NF-κB激活需要IκB磷酸化降解,而foxo3a可直接参与到IκB磷酸化过程[19]。我们实验中也观察到AOSC患者PBMC的foxo3a磷酸化水平升高后,IκB磷酸化水平提高,同时,细胞内IκB降解,进一步提高NF-κB P65的表达,促进TNF-α的分泌并打破机体炎症因子平衡。但是,Thompson等人报道大剂量LPS刺激炎症细胞后foxo3a可直接激活NF-κB,促进NF-κB入核[20]。可见,foxo3a可通过两种方式激活NF-κB通路,参与脓毒血症的发生过程。
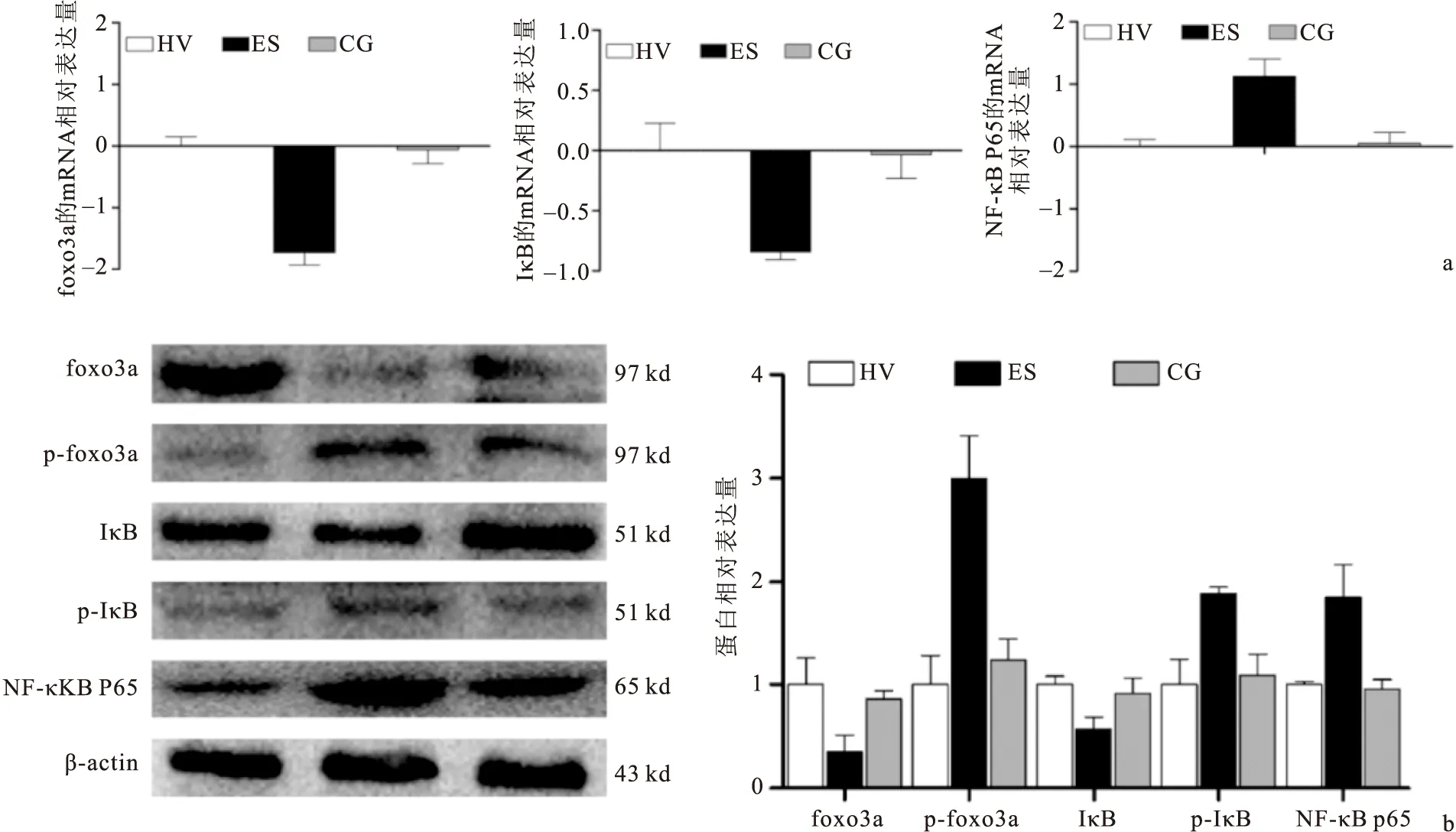
图2qRT-PCR和WB检测PBMC中foxo3a等相关基因和蛋白的表达变化
Figure 2Protein and mRNA levels of foxo3a associated molecular between the AOSC patients and healthy volunteers
注:a. foxo3a、IκB和NF-κB P65的mRNA表达变化;b. foxo3a、p- foxo3a、IκB、p-IκB和NF-κB P65的蛋白表达变化;ES与HV、CG比较,P<0.05
4 结论
本实验显示,AOSC患者PBMC中IκB与其磷酸化水平与foxo3a及磷酸化水平呈正相关,也进一步阐明了foxo3a在脓毒血症发生过程中激活NF-κB的机制,提示foxo3a可作为早期缓解脓毒血症的治疗靶点之一。
[1]Rhee C, Murphy MV, Li L,etal. Comparison of trends in sepsis incidence and coding using administrative claims versus objective clinical data[J]. Clin Infect Dis, 2015,60(1):88-95.
[2]Gohil SK, Cao C, Phelan M,etal. Impact of Policies on the Rise in Sepsis Incidence, 2000-2010[J]. Clin Infect Dis, 2016.
[3]Anderson ST, Commins S, Moynagh PN,etal. Lipopolysaccharide-induced sepsis induces long-lasting affective changes in the mouse[J]. Brain Behav Immun, 2015, 43:98-109.
[4]Anderson ST, O’Callaghan EK, Commins S,etal. Does prior sepsis alter subsequent circadian and sickness behaviour response to lipopolysaccharide treatment in mice[J]. J Neural Transm (Vienna), 2015,122 (1):63-73.
[5]Liu Z, Shi Q, Liu J,etal. Innate Immune Molecule Surfactant Protein D Attenuates Sepsis-induced Acute Pancreatic Injury through Modulating Apoptosis and NF-κB-mediated Inflammation[J]. Sci Rep, 2015, (5):17798.
[6]Liu J, Abdel-Razek O, Liu Z,etal. Role of surfactant proteins A and D in sepsis-induced acute kidney injury[J]. Shock, 2015,43(1):31-83.
[7]Sharma A, Matsuo S, Yang WL,etal. Receptor-interacting protein kinase 3 deficiency inhibits immune cell infiltration and attenuates organ injury in sepsis[J]. Crit Care, 2014,18(4):142.
[8]Furuya S, Kono H, Hara M,etal. Interleukin 17A plays a role in lipopolysaccharide/D-galactosamine-induced fulminant hepatic injury in mice[J]. J Surg Res, 2015,199(2):487-493.
[9]Kang DW, Park MK, Oh HJ,etal. Phospholipase D1 has a pivotal role in interleukin-1β-driven chronic autoimmune arthritis through regulation of NF-κB, hypoxia-inducible factor 1α, and FoxO3a[J]. Mol Cell Biol, 2013, 33(14):2760-2772.
[10] Shang YC, Chong ZZ, Hou J,etal. Wnt1, FoxO3a, and NF-kappaB oversee microglial integrity and activation during oxidant stress[J]. Cell Signal, 2010, 22(9):1317-1329.
[11] Takada T, Strasberg SM, Solomkin JS,etal. TG13: Updated Tokyo Guidelines for the management of acute cholangitis and cholecystitis[J]. J Hepatobiliary Pancreat Sci, 2013, 20(1):1-7.
[12] Nho RS, Peterson M, Hergert P,etal. FoxO3a (Forkhead Box O3a) deficiency protects Idiopathic Pulmonary Fibrosis (IPF) fibroblasts from type I polymerized collagen matrix-induced apoptosis via caveolin-1 (cav-1) and Fas[J]. PLoS One, 2013,8(4):61017.
[13] Nepal S, Kim MJ, Hong JT,etal. Autophagy induction by leptin contributes to suppression of apoptosis in cancer cells and xenograft model: involvement of p53/FoxO3A axis[J]. Oncotarget, 2015,6(9):7166-7181.
[14] Im J, Hergert P, Nho RS. Reduced FoxO3a expression causes low autophagy in idiopathic pulmonary fibrosis fibroblasts on collagen matrices[J]. Am J Physiol Lung Cell Mol Physiol, 2015,309(6):552-561.
[15] Togher S, Larange A, Schoenberger SP,etal. FoxO3 is a negative regulator of primary CD8+ T-cell expansion but not of memory formation[J]. Immunol Cell Biol, 2015, 93(2):120-125.
[16] Mehta A, Zhao JL, Sinha N,etal. The MicroRNA-132 and MicroRNA-212 Cluster Regulates Hematopoietic Stem Cell Maintenance and Survival with Age by Buffering FOXO3 Expression[J]. Immunity, 2015, 42(6): 1021-1032.
[17] Tikhanovich I, Kuravi S, Campbell RV,etal. Regulation of FOXO3 by phosphorylation and methylation in hepatitis C virus infection and alcohol exposure[J]. Hepatology, 2014, 59(1): 58-70.
[18] Butt AM, Feng D, Idrees M,etal. Computational identification and modeling of crosstalk between phosphorylation, O-β-glycosylation and methylation of FoxO3 and implications for cancer therapeutics[J]. Int J Mol Sci, 2012,13(3):2918-2938.
[19] Schweitzer K, Naumann M. CSN-associated USP48 confers stability to nuclear NF-κB/RelA by trimming K48-linked Ub-chains[J]. Biochim Biophys Acta, 2015,1853(2):453-469.
[20] Thompson MG, Larson M, Vidrine A,etal. FOXO3-NF-κB RelA Protein Complexes Reduce Proinflammatory Cell Signaling and Function[J]. J Immunol, 2015,195(12):5637-5647.
Changes of forkhead box O3a in the peripheral blood mononuclear of patients with sepsis
ZHOU Chao1, LIU Yan2, ZHANG Wenfeng3,et al
(1.DepartmentofHepatobiliarySurgery,TheSixthPeople’sHospitalofChengdu,Chengdu610051,China; 2.ChongqingKeyLaboratoryofHepatobiliarySurgery,DepartmentofHepatobiliarySurgery,TheSecondAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400010,China; 3.DepartmentofGastroenterology,TheFifthPeople’sHospitalofChengdu,Chengdu611130,China)
ObjectiveTo detect the level of forkhead box O3a (foxo3a) in the peripheral blood mononuclear (PBMC) of patients with sepsis before and after treatment and further discuss the function of foxo3a in the process of sepsis.MethodsThe PBMC was separated from acute obstructive suppurative cholangitis (AOSC) patients (n=27) on admission (ES), after cured for 1 week (CG) and healthy volunteers (n=12) (HV). The serum levels of lipopolysaccharide (LPS), tumor necrosis factor α (TNF-α) and interleukin 10 (IL-10) were detected by enzyme linked immunosorbent assay (ELISA) methods. The mRNA levels of foxo3a, nuclear fator κB P65 (NF-κB) and inhibitor of NF-κB (IκB) were detected by real-time quantitative polymerase chain reaction (qRT-PCR). The protein levels of foxo3a, p-foxo3a, IκB, p-IκB and NF-κB were tested by western blotting (WB). ResultsThe levels of LPS, TNF-α and IL-10 in ES were significantly higher than that in HV and CG. The mRNA levels of foxo3a and IκB in ES were lower than that in HV and CG, while NF-κB P65 in ES was higher than that in HV and CG. The protein levels of foxo3a and IκB in ES were lower than HV and CG, while p-foxo3a, p-IκB and NF-κB P65 were higher than HV and CG. ConclusionThe foxo3a for phosphorylation activation of IκB or directly activation of NF-κB participate the originating process of sepsis and hinting the therapeutic potentialities in the early stage of sepsis.
Sepsis; foxo3a; IκB; Inhibitor of NF-κB
国家自然科学基金(81401622)
张文锋,博士,E-mail:zhangwenfeng07@163.com
R631+.4
Adoi:10.3969/j.issn.1672-3511.2016.10.002
2016-04-01; 编辑: 陈舟贵)

