白术内酯Ⅰ对慢性萎缩性胃炎大鼠胃黏膜保护作用
河北北方学院附属第一医院消化内科
李 多 于永强 高会斌 刘德清△(张家口 075000)
白术内酯Ⅰ对慢性萎缩性胃炎大鼠胃黏膜保护作用
河北北方学院附属第一医院消化内科
李多于永强高会斌刘德清△(张家口 075000)
提要目的:探讨白术内酯Ⅰ对慢性萎缩性胃炎(CAG)大鼠胃黏膜保护机制。方法: 实验动物随机分为空白对照组、模型组、白术内酯Ⅰ组(10、20、40 mg/kg), 采用脱氧胆酸钠和热盐水交替灌胃、结合饥饱失常方法制备CAG大鼠模型, 治疗8周后, 采用ELISA法检测白细胞介素-8(IL-8)含量、Western blot法检测热休克蛋白70(HSP 70)、核转录因子-k B(NF-kB)和环氧合酶-2(COX-2)蛋白表达。结果: 与空白对照组对比, 模型组HSP70蛋白表达降低(P<0.01), IL-8含量(P<0.01)增加、NF-κB和COX-2蛋白表达升高(P<0.01); 与模型组对比, 白术内酯Ⅰ高、中、低3个剂量组提高HSP70蛋白表达, 降低IL-8含量、NF-κB和COX-2蛋白表达(P<0.05), 以白术内酯Ⅰ组(40 mg/kg)作用显著。结论: 白术内酯Ⅰ对CAG大鼠的保护作用是通过抗炎作用。
白术内酯Ⅰ;慢性萎缩性胃炎;白细胞介素-8;热休克蛋白70;核转录因子-kB;环氧合酶-2
慢性萎缩性胃炎(CAG)是消化系统多发病, 是一种以胃黏膜广泛性或局部性固有腺体萎缩、黏膜层变薄、黏膜肌层变厚为主要病理改变的慢性胃炎, 并且常伴有炎性反应、肠上皮化生以及不典型增生。[1]CAG于1978年被世界卫生组织列为胃癌前状态。CAG是一个多阶段、多病因、多基因逐渐变异积累的过程。 它常与幽门螺杆菌感染、烟酒、饮食、十二指肠反流等致病因素有关。中医药在治疗CAG中也起到积极的作用, 有文献报道, 胃炎Ⅰ号[2]、复方中药安胃汤[3]等在治疗CAG中效果明显。枳术宽中也是治疗胃肠道疾病常用药, 其君药为白术, 白术为菊科植物白术(Atractylodes macrocephala Koidz)的干燥根, 主产于浙江、湖北等省。其性味甘、苦、温, 具有健脾益气、燥湿利水、止汗、安胎的功效, 其有效成分单体白术内酯Ⅰ调节胃肠道功能和促进营养物质吸收的功效, 具有抗炎[4]、抗肿瘤、增强免疫力作用。[5-6]CAG研究结果显示, CAG模型中白介素-8[7]、(IL-8)、热休克蛋白70[8](HSP 70)、核转录因子-kB[9](NF-kB)和环氧合酶-2[10](COX-2)蛋白在疾病进展中有重要作用。IL-8可促使NF-kB表达并发生活化, 导致炎症级联反应, 胃黏膜受损, 慢慢形成CAG。而在细胞核内NF-K B可增加COX-2的合成。 而HSP70竞争性抑制N-kB活化,阻断IL-8的过量生成, 中断IL-8与NF-kB的炎症级联反应,[11]保护胃黏膜, 阻止CAG发生。因此, 本实验探讨白术内酯Ⅰ对CAG大鼠模型体内IL-8、HSP70、NF-kB、COX-2的影响, 为临床工作提供理论基础。
1 材料和方法
1.1材料实验动物为8周龄SPF级SD大鼠, 由河北北方学院动物中心提供, 共70只, 雌雄对半, 体质量180~200 g。在实验过程中, 分笼饲养, 室温18℃~25℃, 湿度50%~60%, 空气新鲜, 自由摄食、饮水, 通风良好, 符合实验动物伦理学原则。 白术内酯Ⅰ对照品(批号111687), 购于中国生物制品药品鉴定所; 脱氧胆酸钠, IL-8 Elisa试剂盒(批号131209), 兔抗鼠HSP多克隆抗体(批号bs-1105R)、兔抗鼠NF-kB多克隆抗体(批号bs-1361R)、兔抗鼠COX-2多克隆抗体(批号bs-0081R), Goat Anti- rabbit Ig G/HRP(批号bs-0295G-HRP), BCA蛋白浓度测定试剂盒(批号140821), 预染宽范围蛋白质分子量标准条带(批号111687), DAB显色剂(批号ZLI-9017)购于北京博奥森生物技术有限公司。
1.2方法
1.2.1CAG模型的建立:选用50只SD大鼠, 随机分为空白对照组10只, 造模组40只, 参考相关文献[12]大鼠先以0.2%的脱氧胆酸钠溶液灌胃, 1.5 mL/只·d-1, 间隔时间为5 h, 再用 50℃热盐水灌胃, 2 mL/只·d-1, 并且加用饥饱失常(即2 d喂食, 足量, 1 d停食)的方法, 随机剖杀, 光镜下胃黏膜病理学检查, 确认模型成功, 持续造模共8周。模型成功后, 随机分为模型组, 白术内酯Ⅰ高、中、低3个剂量组, 每组10只,动物如有死亡, 及时补充。 空白对照组大鼠给予相应等量的蒸馏水, 正常喂养, 自由活动饮水。
1.2.2模型鉴定标准:参照《中药新药临床研
究指导原则》(2002) CAG的病理诊断标准[13]: 固有腺体萎缩, 黏膜肌层增厚, 可有肠上皮或假幽门腺上皮化生, 固有膜验证, 可有淋巴滤泡形成。
1.2.3给药:白术内酯Ⅰ溶液的配制: 各治疗组从第 9 周始每日上午8点分别灌胃给药, 空白对照组和模型组给予等体积的生理盐水。按照大鼠与人体表面积比例系数换算,[14]白术内酯Ⅰ高剂量组40 mg/kg, 白术内酯Ⅰ中剂量组20 mg/kg, 白术内酯Ⅰ低剂量组10 mg/kg, 每天称大鼠体质量1次, 依据大鼠末次体质量调整给药剂量, 给药时间8周。
1.3IL-8的测定采集大鼠空腹动脉血5 mL, 及时分离血清, 取上清液, 置于-20℃冰箱备用。采用ELISA试剂盒进行检查, 严格按照IL-8试剂盒说明书步骤操作, 绘制标准曲线得出IL-8含量。
1.4HSP70、NF-kB、COX-2检测大鼠处死后, 取全胃胃窦黏膜组织, 放入-80℃。 提取组织中总蛋白:将剪刀剪碎组织块, 加入400 μL裂解液于匀浆器中进行匀浆。然后置于冰上裂解30 min后, 移入离心管中, 4℃12 000 r/min 离心5 min, 取上清液分装, 放置-20℃保存。 采用BCA法测蛋白含量, 每孔蛋白上样量为 25 μg, 将1份蛋白与4份5×上样缓冲液混匀, 100℃煮沸5 min, 离心上样;SDS-PAGE电泳, 转膜, 封闭, 然后分别与兔多克隆一抗HSP70 (1︰200), NF-kB (1︰200), COX-2 (1︰200) 4℃孵育过夜, 冲洗辣根过氧化酶标记二抗(1︰1500)室温孵育1 h, 冲洗, DAB显色, 以GAPDH为内参照, 用凝胶分析软件Qantity one对蛋白条带灰度值进行分析。

2 结果
2.1白术内酯Ⅰ降低CAG模型大鼠血清IL-8含量与空白对照组比较, 模型组血清IL-8含量升高, 差异具有非常显著性(P<0.01),说明CAG模型大鼠血清中IL-8含量有明显升高。 与模型组比较, 白术内酯Ⅰ高、中、低3个剂量组中血清IL-8含量显著下降(P<0.05), 且随着剂量的增高血清IL-8含量显著下降(P<0.01),说明白术内酯Ⅰ降低CAG模型大鼠血清IL-8含量,并与白术内酯Ⅰ剂量的高低有关。详见表1。
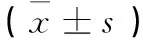

分组例数 剂量(mg/kg)IL-8(pg/mL)空白对照组106.67±0.25模型组1021.92±1.06**白术内酯Ⅰ低剂量组101017.47±1.34△白术内酯Ⅰ中剂量组102013.01±1.12△△白术内酯Ⅰ高剂量组10409.18±0.98△△
注:与空白对照组比较,** P<0.01;与模型组比较,△ P<0.05, △△ P<0.01
2.2白术内酯Ⅰ对CAG模型大鼠蛋白表达影响与空白对照组比较, 模型组HSP70蛋白表达减少, NF-kB、COX-2蛋白表达升高, 差异具有非常显著性(P<0.01),说明CAG模型大鼠HSP70蛋白表达明显下降, NF-kB、COX-2蛋白表达明显升高。与模型组比较, 白术内酯Ⅰ3个剂量组中HSP70蛋白表达显著增加, NF-kB、COX-2蛋白表达显著下降(P<0.05), 说明白术内酯Ⅰ提高CAG模型大鼠HSP70蛋白表达, 降低CAG模型大鼠NF-kB、COX-2蛋白表达。详见表2。
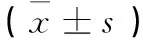

分组例数剂量(mg/kg) HSP70NF-κBCOX-2空白对照组102.20±0.010.23±0.040.43±0.09模型组101.10±0.08**0.76±0.05**1.23±0.09**白术内酯Ⅰ低剂量组10101.39±0.07△0.65±0.07△1.03±0.07△白术内酯Ⅰ中剂量组10201.57±0.06△△0.52±0.07△△0.83±0.09△△白术内酯Ⅰ高剂量组10401.86±0.08△△0.41±0.06△△0.63±0.08△△
注:与空白对照组比较,** P<0.01;与模型组比较,△ P<0.05, △△ P<0.01
3 讨论
IL-8是一种糖蛋白, 定位于人染色体4q12-21, 由3个内含子和4个外显子组成, 包括69、72和77个氨基酸3种形式, 其中72个氨基酸是活性形式, 长5.2 kb。 研究表明, 炎症参与某些肿瘤病理学发展过程。炎症细胞可分泌大量细胞因子与细胞外基质形成新微环境, 还可以形成炎性细胞因子网络, 促进肿瘤的发生, 细胞迁移和侵袭。CAG发展为胃癌与幽门螺旋杆菌感染密切相关。幽门螺旋杆菌感染引起胃黏膜慢性炎症, 释放大量IL-8、NF-κB等炎性因子, IL-8、NF-κB持续高表达, 抑制肌体免疫应答、导致胃黏膜细胞恶变等; 同时高表达的炎性因子通过不同作用机制促进胃癌的形成与发展。[15]文献报道, IL-8在胃癌肿瘤组织、血清中高表达。 付浩等[16]研究发现, IL-8蛋白阳性表达率在正常胃黏膜-癌前状态-胃癌的发生过程中逐渐升高。本实验结果显示, 与空白对照组比较, 模型组血清IL-8含量升高, 具有显著差异;说明CAG模型大鼠血清中IL-8含量明显升高。与模型组比较, 白术内酯Ⅰ组血清IL-8含量显著下降, 说明白术内酯Ⅰ降低CAG模型大鼠血清IL-8含量。
HSP70是应激反应蛋白并在生物进化过程中高度保守, 是细胞内分子伴侣, 当组织遇到各种不良刺激时 它能结合未折叠或新生蛋白, 辅助或稳定其形成正确空间构象; 调节细胞免疫系统, 维持调节蛋白整体性; 还可以结合变性蛋白, 使结合蛋白降解。有研究发现, 在如胃溃疡、慢性胃炎等胃黏膜病变损伤修复中, 诱导HSP70表达可增强胃黏膜细胞的抵抗力, 保护胃黏膜细胞。有研究表明, 诱导HSP70表达增加能减轻肝切除、急、慢性胃溃疡、慢性结肠炎等疾病的组织损伤, 增强细胞抵抗力。[17]目前HSP70在慢性萎缩性胃炎中的作用机制可能为HSP70可增强细胞的应激反应状态, 调节增殖与凋亡的动态平衡, 减少突变, 另外研究发现幽门螺杆菌感染可能通过抑制HSP70表达, 获得免疫逃避, 而长期定植。本实验结果显示, 与空白对照组比较, 模型组HSP70蛋白表达减少, 具有显著差异;说明CAG模型大鼠HSP70蛋白表达明显下降。与模型组比较, 白术内酯Ⅰ组HSP70蛋白表达显著增加, 说明白术内酯Ⅰ提高CAG模型大鼠HSP70蛋白表达。
NF-κB是一种多向性细胞核转录因子, 以无活性的形式存在, 无调节基因转录功能, 只有被激活时, NF-κB进入细胞核发挥重要作用。大量文献报道, NF-κB参与肌体的炎症反应、免疫应答, 调控细胞增殖、凋亡相关基因, 调控肿瘤细胞生长。NF-κB与COX-2的关系也非常密切。[18]COX-2则是一种胞装蛋白, 与炎症、肿瘤等病理过程相关。COX-2可通过AKT信号转导通路激活细胞NF-κB, COX-2选择性抑制剂, 可抑制NF-κB活性, 抑制肿瘤增殖, COX-2在肿瘤形成中的作用机制可能为催化致癌物质的形成, 催化前列腺素, 调节细胞生长分化, 增加细胞与胞外基质的黏附力等。本实验结果显示, 与空白对照组比较, 模型组NF-κB蛋白表达升高, 具有显著差异;说明CAG模型大鼠NF-κB、COX-2蛋白表达明显升高。与模型组比较, 白术内酯Ⅰ组NF-κB、COX-2蛋白表达显著下降, 说明白术内酯Ⅰ降低CAG模型大鼠NF-κB、COX-2蛋白表达。
其中在炎症反应中IL-8可促使NF-κB表达并发生活化, 两者相互影响, 导致炎症级联反应, 胃黏膜在这种长期炎症作用下受损, 慢慢形成CAG。此外, 在细胞核内NF-κB可增加前列腺素合成限速酶COX-2的合成。而HSP70竞争性抑制NF-κB活化, 阻断IL-8的过量生成, 中断IL-8与NF-κB的炎症级联反应,[11]保护胃黏膜, 阻止CAG发生。本实验结果表明, 白术内酯Ⅰ可能通过抑制IL-8的释放、降低NF-κB和COX-2的合成、提高HSP70的合成, 切断炎症因素对胃黏膜的损伤, 对CAG起到治疗作用, 为临床用药提供实验数据和理论依据。
[1]铁玲玲, 姜树民. 姜树民以痈论治慢性萎缩性胃炎[J]. 实用中医内科杂志,2014,28(11): 10-11
[2]韦玉娜, 张静, 王文杰,等. 胃炎Ⅰ号对慢性萎缩性胃炎PCNA、Bcl-2和Bax表达的影响[J]. 世界华人消化杂志,2015,23(6): 944-948
[3]林寿宁, 韦维, 黄贵华,等. 复方中药安胃汤对慢性萎缩性胃炎大鼠模型TFF mRNA表达的影响[J]. 世界华人消化杂志,2011,19(1): 68-73
[4]熊蕴珠. 白术内酯Ⅰ对MyD88+人卵巢癌细胞分泌的免疫抑制因子TGF-β1、IL-17A、IL-10和IL-4的影响[D].成都:成都中医药大学.2014.42-43
[5]高小玲, 汪保英, 尹素改,等. 白术内酯对IEC-6细胞及食管癌细胞ECA9706增殖能力的影响[J]. 中华中医药杂志,2015,30(3): 921-923
[6]王嫦鹤, 耿庆光, 王雨轩. 白术内酯Ⅰ对免疫性肝损伤的保护作用[J]. 中国中药杂志,2012,37(12): 1 809-1 813
[7]Li ZW, Wu Y, Sun Y, et al. Inflammatory cytokine gene polymorphisms increase the risk of atrophic gastritis and intestinal metaplasia[J]. World J Gastroenterol,2010,16(14): 1 788-1 794
[8]周嘉鹤, 傅志泉, 邓建平,等. 健脾和胃化瘀中药对慢性萎缩性胃炎患者胃黏膜热休克蛋白70表达的影响[J]. 中国中西医结合杂志,2015, 33(4): 406-410
[9]Lin HY, Zhao Y, Yu J N,et al. Effects of traditional Chinese medicine Wei-Wei-Kang-Granule on the expression of EGFR and NF-KB in chronic atrophic gastritis rats[J]. Afr J Tradit Complement Altern Med,2012,9(1): 1-7
[10]Ock CY, Kim EH, Choi DJ,et al. 8-Hydroxydeoxyguanosine: not mere biomarker for oxidative stress, but remedy for oxidative stress-implicated gastrointestinal diseases[J]. World J Gastroenterol,2012, 18(4): 302-308
[11]Wang L, Liu Y, Jin H,et al. Electrical stimulation induced Hsp70 response in C2C12 cells[J]. Exerc Immunol Rev,2010,16(5):1 686-1 697
[12]李红平, 毛万姬, 邹学正. 丹白麦门冬汤对慢性萎缩性胃炎大鼠胃黏膜病理形态学的影响[J]. 陕西中医, 2007, 28(2): 243-245
[13]郑筱萸. 中药新药临床研究指导原则[S]. 北京: 中国医药科技出版社, 2002. 124
[14]苗明三. 实验动物和动物实验技术[M]. 北京: 中国中医药出版社, 2003.142
[15]Munoz A and Costa M. Nutritionally mediated oxidative stress and inflammation[J]. Oxid Med Cell Longev, 2013(12):610 950
[16]付浩, 王旭光, 富伟能,等. IL-8基因在幽门螺杆菌相关性胃疾病中的表达[J]. 中国医科大学学报,2009, 38(1): 26-27
[17]Takahashi T, Otaka M, Odashima M,et al. Correlation of heat shock protein expression to gender difference in development of stress-induced gastric mucosal injury in rats[J]. J Clin Biochem Nutr, 2010,47: 64-73
[18]Terzuoli E, Meini S, Cucchi P,et al.Antagonism of bradykinin B2 receptor prevents inflammatory responses in human endothelial cells by quenching the NF-kB pathway activation[J]. PLoS One, 2014, 9:e 84 358
(2016-02-29收稿)
Protection of Atractylenolide I for Gastric Mucosa of Chronic Atrophic Gastritis Rats
Digestive System Department of No. 1 Affiliated Hospital, Hebei North University
LIDuoYUYong-qiangGAOHui-binLIUDe-qing(Zhangjiakou 075000)
Objective: to explore the protective mechanism of Atractylenolide I for gastric mucosa of chronic atrophic gastritis (GAC) rats. Methods: The laboratory animals were randomly divided into control group, model group and Atractylenolide I group (10, 20, 40 mg/kg). The models were established by alternate intragastric administration with sodium deoxycholate and hot saline, which was combined with irregular diet. 8 weeks later, ELISA was taken to detect IL-8 content, and Western blot to detect HSP 70, NF-κB and COX-2 expressions. Results: Compared to control group, HSP 70 of model group decreased (P<0.01), IL-8 increased (P<0.01), , NF-κB and COX-2 increased (P<0.01); compared to model group, low, medium and high dose groups of Atractylenolide I increased HSP 70 expression, decreased IL-8, NF-κB and COX-2 (P<0.05), especially significantly in the high dose group (40 mg/kg) . Conclusion: Atractylenolide I may provide protection for CAG rats through anti-inflammatory action.
Atractylenolide I; chronic atrophic gastritis (GAC); IL-8 (interleukin-8); HSP 70 (heat shock protein 70); NF-κB (nuclear factor-κB); COX-2
R285.5
A
1007-5615(2016)03-0005-04
△河北省康保县人民医院内科(康保 076650)

