白芍配方颗粒质量标准的提高研究*
河北中医学院河北省中药配方颗粒工程技术研究中心
曹文利 曹秀莲 王晓亚 范 帅 康立英 姜 海△ 牛丽颖(石家庄 050091)
方 药 研 究
白芍配方颗粒质量标准的提高研究*
河北中医学院河北省中药配方颗粒工程技术研究中心
曹文利曹秀莲王晓亚范帅康立英姜海△牛丽颖(石家庄 050091)
提要目的:通过定性鉴别和定量分析研究,提高白芍配方颗粒质量标准控制。方法:采用薄层色谱方法以白芍对照药材作为对照,对白芍配方颗粒进行多信息定性鉴别;利用高效液相色谱法同时测定芍药苷和芍药内酯苷含量,增加含测控制指标。结果:薄层鉴别中,白芍配方颗粒供试品色谱与白芍对照药材色谱相应位置显相同颜色的主斑点;含量测定中,芍药苷在0.068~0.678 μg范围内,呈线性关系( r2=0.999 8);以测定的峰面积为纵坐标,芍药内酯苷在0.068~0.676 μg范围内,呈线性关系(r2=0.999 8),线性关系良好;平均回收率分别为99.35%和101.53%(n=6)准确度良好。结论:本方法可行,重复性良好,完善和提高了白芍配方颗粒的质量控制。
白芍配方颗粒;全息薄层色谱;芍药苷;芍药内酯苷;高效液相色谱法;质量标准
白芍配方颗粒为符合炮制规范白芍饮片(毛莨科植物芍药Paeonia lactiflora Pall.的干燥根)经过提取、浓缩、干燥和制粒等现代制药技术加工所得,作为传统中药饮片的有益补充,被应用于临床。目前在全国范围内各生产企业皆用其内控标准进行中药配方颗粒的质量控制,白芍配方颗粒质量标准仅对芍药苷单一指标进行了鉴别和含量测定。2015年12月食品药品监管总局发布《中药配方颗粒管理办法(征求意见稿)》公告,未来监管部门将逐步放开中药配方颗粒生产市场,中药配方颗粒在临床的应用越来越广泛。《中药配方颗粒管理办法(征求意见稿)》要求应体现多成份和整体质量控制,因此进一步完善和提高白芍配方颗粒的质量标准很有意义。本研究按照2015版《中国药典》一部,参考有关的文献[1-3],以白芍对照药材为对照,采用薄层指纹色谱方法对白芍配方颗粒进行多信息的定性鉴别;基于高效液相色谱法同条件同时测定白芍配方颗粒中的芍药苷和芍药内酯苷活性成分,保证了配方颗粒对中药材信息传承控制,提高了白芍配方颗粒质量控制水平。
1 仪器与试药
1.1仪器高效液相色谱仪:岛津LC-15C液相色谱仪,SPD-15C 型紫外检测器,SIL-10AF自动进样器、CTO-15C柱温箱、岛津高效液相色谱LC工作站;电子分析天平:TB-215、BSA2245-CW(赛多利斯);硅胶G板(青岛海洋化工厂);乙腈为色谱纯、水为纯化水,其他试剂均为分析纯。
1.2试药芍药苷购自中国药品生物制品检定所(批号:110736-201438);芍药内酯苷购自上海源叶生物科技有限公司(批号:20120816);白芍对照药材(批号:120905-201109)购自中国食品药品检定研究院;白芍配方颗粒(批号:14070911、14081921、14101511)由石家庄神威药业集团有限公司提供。
2 方法与结果
2.1定性鉴别实验
2.1.1供试品溶液的制备:取白芍配方颗粒粉末适量,称定0.5 g,加甲醇溶液3 mL溶解,超声处理10 min,滤过,即得供试品溶液。
2.1.2对照药材溶液的制备:取白芍对照药材适量,称定0.3 g,加甲醇3 mL,超声处理10 min,滤过,作为对照药材溶液。
2.1.3薄层色谱鉴别:按照《中国药典》2015年版薄层色谱法(附录IV B)试验方法,吸取供试品溶液和对照药材溶液各5 μL,点于同一硅胶G 薄层板上,将三氯甲烷-乙酸乙酯-甲醇-甲酸试液(40︰5︰10︰0.2)作为展开剂,展开8 cm,取出,晾干,喷以5%香草醛硫酸溶液,加热105℃至薄层板上斑点显色清晰。
2.1.4鉴别结果:白芍配方颗粒供试品与白芍对照药材在色谱相应的位置上,显相同颜色的主斑点。见图1。
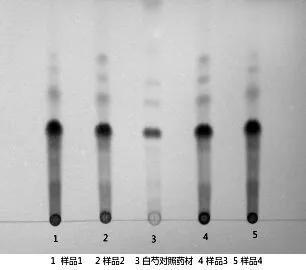
图1薄层色谱鉴别结果
2.2含量测定
2.2.1对照品溶液的制备:取在80℃条件下干燥至恒重的对照品芍药苷和芍药内酯苷约10 mg,精密称定,分别放置于10 mL容量瓶中,分别加甲醇溶解至刻度,摇匀,得芍药苷和芍药内酯苷对照品母液;精密量取芍药苷和芍药内酯苷对照品母液0.3 mL,放置于10 mL容量瓶中,加甲醇稀释至刻度,摇匀,得每1 mL含30 μg的芍药苷和芍药内酯苷混合对照品溶液。
2.2.2供试品溶液制备:取供试品白芍配方颗粒粉末约0.1 g,精密称定,置于具塞锥形瓶,精密加入稀乙醇溶液50 mL,称定重量,超声30 min,取出,放冷;再次称定重量,补足减失的重量,摇匀,过滤,即得。
2.2.3色谱条件:色谱柱, Diamosil C18柱(4.6×150 mm,5 μm);流动相, 乙腈-0.1%磷酸溶液(15︰85);流速,1 mL/min;检测波长,230 nm;柱温, 40℃;理论板数按芍药苷和芍药内酯苷峰计算应不低于3 000。
2.2.4专属性试验:分别取供试品溶液、混合对照品溶液和空白溶剂,按照“2.2.3”项色谱条件进样采集。结果表明,混合对照品溶液和供试品溶液色谱中芍药内酯苷和芍药苷保留时间一致,且阴性对照无干扰峰, 如图2。
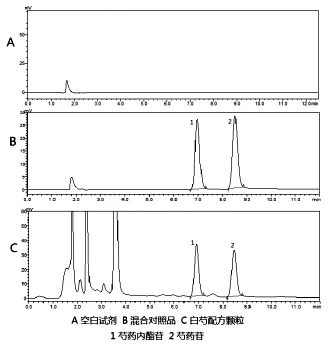
图2白芍配方颗粒、混合对照品和空白试剂HPLC图
2.2.5线性关系:精密吸取混合对照品溶液2、4、8、12、20 μL按“2.2.3”项色谱条件测定。测定的峰面积作为纵坐标,以芍药苷的进样量为横坐标,绘制标准曲线,在0.068~0.678 μg范围内,呈线性关系,回归方程为:Y=174 336X-119 111,r2=0.999 8;以测定的峰面积为纵坐标,芍药内酯苷的进样量为横坐标,绘制标准曲线,在0.068~0.676 μg范围内,呈线性关系,回归方程为:Y=145 830X-107 146,r2=0.999 8,标准曲线见图3,芍药苷和芍药内酯苷线性关系良好。
2.2.6精密度:精密吸取芍药苷和芍药内酯苷混合对照品溶液10 μL,依照“2.2.3”项所述色谱条件连续进样6次,芍药苷和芍药内酯苷色谱峰面积RSD分别为0.40%和0.36%,小于2%,说明仪器精密度良好。
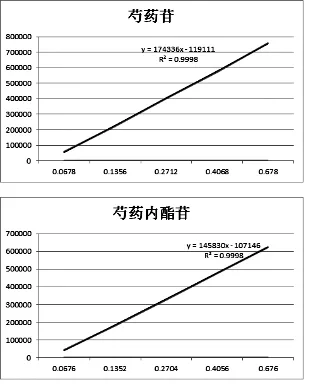
图3对照品芍药苷和芍药内酯苷的标准曲线图
2.2.7稳定性试验:精密称取供试品白芍配方颗粒(批号:14101511)约0.1 g,按上述供试品溶液制备方法制备。精密吸取白芍配方颗粒供试品溶液10 μL,分别在0、2、4、8、12、18 h进样,按“2.2.3”项所述色谱条件分别进样测定,计算芍药苷和芍药内酯苷峰面积RSD分别为1.88%和1.53%(n=6),小于2%,结果表明白芍配方颗粒供试品溶液在18 h内稳定。
2.2.8重复性考察:精密称取同一批供试品样品(批号:14101511)6份,每份约0.1 g,按供试品溶液制备方法制备,精密吸取10 μL,依照“2.2.3”项所述色谱条件进样,计算得供试品溶液芍药苷和芍药内酯苷含量RSD分别为1.76%和1.83%(n=6),小于2%,结果表明样品测定重复性良好。
2.2.9准确度考察:采用加样回收法,按照对照品溶液制备方法分别得含芍药苷和芍药内酯苷80%、100%和120%的样品3份;按照供试品制备方法得同一批(批号:14101511)样品9份,每份约0.1 g,精密称定,精密加入一定量混合对照品,依照供试品溶液制备方法制备。依照“2.2.3”项所述色谱方法测定,芍药苷和芍药内酯苷平均回收率分别为99.35%和101.53%(n=6),RSD分别为1.09%和1.36%,小于2%,符合规定,方法准确度良好。
2.2.103批样品含量测定:采用上述色谱方法,对本品3批样品芍药苷含量为17.21、17.18、17.32 mg/mL,RSD值分别为1.79%、0.25%和0.18%;芍药内酯苷含量为26.68、26.48、26.91 mg/mL,RSD值分别为0.19%、1.38%和1.87%。3批配方颗粒芍药苷和芍药内酯苷含量RSD值均小于2%,符合规定,含量测定结果可靠,本方法适用于芍药苷和芍药内酯苷两指标同时测定。
3 讨论
本研究依据《中国药典》2015版一部中白芍的薄层鉴别方法,并参考有关文献,[2]以白芍对照药材代替芍药苷对照品作为对照,更能体现和控制配方颗粒对白芍药材的信息传承;改进展开条件,采用了白芍总苷有效部位指纹薄层色谱方法,不仅有芍药苷紫色斑点,同时还有其他苷类信息,体现信息更加丰富;供试品色谱斑点清晰、分离度佳,重现性亦良好。本方法更好控制了白芍配方颗粒鉴别信息,进一步保证了配方颗粒与药材的一致性。
近期有关白芍现代研究表明,[4-6]芍药苷和芍药内酯苷均为白芍的入血成分,是白芍发挥药效的活性成分。同时,白芍总苷体内代谢研究[6]表明芍药苷在体内可能部分转化为芍药内酯苷。因此,芍药内酯苷也是白芍的重要活性成分,将芍药内酯苷和芍药苷同时作为白芍配方颗粒的质量控制指标具有重要意义。本研究以药典方法为基准,采用液相色谱方法同条件同时测定了芍药苷和芍药内酯苷两个成份含量,将芍药苷和芍药内酯苷同时作为含测指标,加强了白芍配方颗粒的质量控制。
本方法简便、快捷、有效,很好体现目前质量控制的新要求,从整体方面和多成份方面控制质量,能够提升白芍配方颗粒的质量控制水平,保障配方颗粒白芍药材信息的传承。
[1]中国药典委员会. 中华人民共和国药典[S]. 北京: 化学工业出版社, 2010. 68-69
[2]谢培山, 林巧玲. 白芍总苷薄层指纹图谱实验研究[J]. 中药新药与临床药理研究, 2004, 15(3): 171-172
[3]姜弘,孟舒,陈再兴. 白芍配方颗粒制备工艺和质量标准研究[S]. 中药材, 2008, 31(4): 605-607
[4]王巧,郭洪祝,霍长虹,等. 白芍化学成分研究[J].中草药,2007,38(7):972-976
[5]张玲非,刘敏彦,潘会敏,等. 白芍总苷在免疫性肝损伤大鼠的药代动力学研究[J].中国药理学通报, 2011,27(10):1 462-1 466
[6]Cao W, Wang X, Niu L, et al. Studies on metabolism of total glucosides of paeony from Paeoniae Radix Alba in rats by UPLC-Q-TOF-MS/MS[J]. Biomed Chromatogr, 2015,29(11): 1 769-1 779
(2016-06-12收稿)
牛丽颖,女,教授,硕士研究生导师。
R284.2
A
1007-5615(2016)03-0046-03
*河北省高等学校科学技术研究项目:No.ZD2015001;河北省中医药管理局资助项目:No.2015006;河北中医学院青年基金项目:No.QN2015030
△石家庄神威药业集团有限公司

