金针菇JA/SA信号通路基因鉴定及其对外源JA/SA应答
李 肖,汪健芳 ,严俊杰,陈炳智,谢 斌,陈仁良,温志强,江玉姬,谢宝贵*
(1.福建农林大学生命科学学院菌物研究中心,福建 福州 350002;2.福建农林大学食品科学学院,福建 福州 350002)
金针菇JA/SA信号通路基因鉴定及其对外源JA/SA应答
李肖1,汪健芳1,严俊杰1,陈炳智2,谢斌1,陈仁良1,温志强1,江玉姬2,谢宝贵1*
(1.福建农林大学生命科学学院菌物研究中心,福建福州350002;2.福建农林大学食品科学学院,福建福州350002)
本研究鉴定了金针菇茉莉酸(JA)信号通路的4个关键基因:COI1、PDF1.2、MYC2-1、MYC2-2与水杨酸(SA)信号通路的4个关键基因:PR1-1、PR1-2、NPR1-1、NPR1-2。NBT染色法和荧光定量结果表明,金针菇JA/SA信号通路可应答外源JA/SA,50 μmol · L-1外源JA 和500 μmol · L-1外源SA处理金针菇菌丝12 h可显著提高JA/SA信号通路基因的转录水平,基因PDF1.2响应JA诱导最明显,可作为JA信号通路标记基因;JA/SA信号转导途径间存在协同或拮抗作用:SA信号转导通路中NPR1蛋白对JA信号转导通路中PDF1.2基因表达有抑制作用,外源JA/SA的相对浓度决定其作用的强弱。
金针菇; 茉莉酸; 水杨酸; NBT; 基因表达
茉莉酸(jasmonic acid,JA)和水杨酸(salicylic acid,SA)在植物中研究较为广泛,两者在植物防御信号传导中起重要作用[1]。但JA和SA在真菌中研究较少,主要在球二孢属Botryodiplodia和赤霉菌属Gibberella中有见报道[2-7]。真菌中有关 JA 信号转导途径研究报道较多的是关于致病真菌和腐生真菌以及与植物共生的外生菌根真菌,其会通过产生某种特异性蛋白抑制植物 JA 及 SA 的合成,从而降低植物的防御体系以达到侵染致病或共生的目的[7]。但关于大型真菌中JA/SA信号转导途径却鲜有报道。
金针菇Flammulinavelutipes(Curtis)Singer具有较高食药用价值,是目前被广泛人工栽培的食用菌之一。金针菇异核菌丝经一个阶段生长发育后,受到外界环境的胁迫:温度、水分和湿度、空气、光线等,菌丝扭结形成原基,进而发育形成子实体[8]。金针菇是否存在JA/SA信号转导途径,金针菇是否会响应外源JA和SA的胁迫,外源添加JA和SA对金针菇子实体的发育是否会产生影响,目前未知。
本研究以金针菇为试验材料,在金针菇L11基因组和H1123转录组序列测定以及基因注释基础上[9],获取金针菇JA/SA信号转导通路中关键基因,初步探究这些基因在外源添加JA/SA诱导下的表达模式,并构建JA/SA信号转导途径,为进一步探究金针菇中JA/SA信号转导途径对外源信号的响应以及通路间的相互作用关系提供理论依据。
1 材料与方法
1.1试验材料
供试双核体菌株H1123由福建省食用菌种质资源保藏与管理中心提供。金针菇菌株L11参考基因组和转录组数据分别下载自:DDBJ/EMBL/GenBank(http://www.ncbi.nlm.nih.gov/)和Sequence Read Archive(SRA)数据库,登录号为APIA00000000 (BioProject: 191865) 和SRP072148。
1.2JA/SA信号通路途径构建及基因分析
以金针菇L11基因组数据为基础,利用本地BLASTP程序(E-value ≤ 5e-10)将拟南芥(Arabidopsisthaliana)、葡萄(Grapevine)的JA和SA信号转导途径相关蛋白氨基酸序列,与金针菇L11基因组预测的蛋白序列进行同源比对,寻找金针菇基因组中的JA和SA信号转导途径相关基因。参照刘朋虎等[10]的方法,将转录组数据map到参考序列,确定基因的转录起始及终止位点,并采用ZOOM lite(1.5.4)软件通过双末端方法和错配匹配(错配为40),对基因的内含子和外显子位置及数目进行分析。
采用NCBI数据库(National Center for Biotechnology Information)中的Protain Blast(http://blast.ncbi.nlm.nih.gov/Blast.cgi?PROGRAM=blastp和PAGE_TYPE=BlastSearch和LINK_LOC=blasthome)对信号转导途径相关基因编码的蛋白氨基酸序列进行同源比对再次验证。
1.3JA和SA处理
JA和SA分别处理:将PDA平板上新鲜的H1123菌种打孔,等量接种至新的150 mL PDA液体培养基,然后置于25℃、190 r·min-1摇床恒温培养 7 d后,分别添加不同体积的10 mmol·L-1JA和SA使其终浓度分别为JA(10、50、100、250 和500 μmol·L-1)和SA(10、100、250、500 和1 000 μmol·L-1)[11],在25℃条件下处理菌丝6 h后,选取等大的菌丝球用5 g·L-1的氮蓝四唑(nitro blue tetrazolium,NBT)染色:每个处理添加10 mL染液,25℃处理40 min后拍照。另取同批次同处理的液体培养基收集菌丝,将菌丝置于液氮中冻存待用(下同)。JA和SA溶液含0.01%吐温20和9 ‰无水乙醇,NBT染液浓度为5 g·L-1,所用溶剂为 pH 6.0 的PBS缓冲溶液(下同)。用Tween 20、乙醇和水混合液处理作为对照。
筛选最佳处理浓度CJA、CSA后,用最佳浓度CJA和CSA分别处理金针菇菌丝0.5、1、3、6、12和24 h后,进行NBT染色观察,另取同批次、同处理的液体培养基收集菌丝,将菌丝置于液氮中冻存待用,筛选最佳处理时间TJA和TSA。
SA和JA交叉处理:用最佳浓度为CSA的SA处理金针菇菌丝最佳时间TSA后,添加终浓度为0、10、50、100、250和500 μmol · L-1JA处理金针菇菌丝TJA;用最佳浓度为CJA的JA处理金针菇菌丝最佳时间TJA后,添加终浓度为0、10、250、500 和1 000 μmol · L-1SA处理金针菇菌丝TSA。收集各处理的菌丝置于液氮中冻存待用。
1.4荧光定量PCR检测基因的相对表达量
总RNA的提取和cDNA合成:收集菌丝后,采用OMEGA E.Z.N.A.Plant RNA Kit(R6827-01)试剂盒(Omega Bio-Tek, 美国)分别提取以上材料总RNA,使用TransScript All-in-One First-Strand cDNA Sythesis SuperMix for qPCR试剂盒(全式金生物技术有限公司,北京)合成cDNA。采用Primer Premier 5.0 设计RT-qPCR引物,以GAPDH基因(F: CCT CTG CTC ACT TGA AGG GT;R: GCG TTG GAG ATG ACT TTG AA)作为内参基因检测相对表达量[12]。引物(表1)由上海生工生物工程股份有限公司合成。RT-qPCR 反应体系使用TransStart TOP Green qPCR试剂(全式金生物技术有限公司,北京),程序按照试剂盒的使用说明书操作(两步法),退火温度设置为60℃,循环数设置为40,每个反应进行3个平行试验。相对表达量计算采用2-△△Ct法处理。
2 结果与分析
2.1金针菇JA/SA信号途径构建及基因分析
以金针菇菌株L11的基因组数据为基础,根据本地BLASTP比对结果可知,在金针菇L11基因组中存在4个JA信号转导途径相关蛋白,分别是1个COI1,2个MYC2,1 PDF1.2;4个SA信号转导途径相关蛋白分别是2个PR1、2个NPR1,将上述各基因的蛋白氨基酸序列采用NCBI网站在线BLASTP进行同源比对再次验证,比对结果显示:E值介于1.00E-77~4.00E-45,相似性介于34~56,比对分值介于24~438,由于个别蛋白与植物相应蛋白亲缘关系较远,分值较低。但信号转导途径相关基因的蛋白都含有其标志性功能结构域,这表明金针菇JA/SA信号途径中相关蛋白与植物中相应蛋白可能具有相似的功能特点(表1)。上述基因已提交至GenBank(表1)。
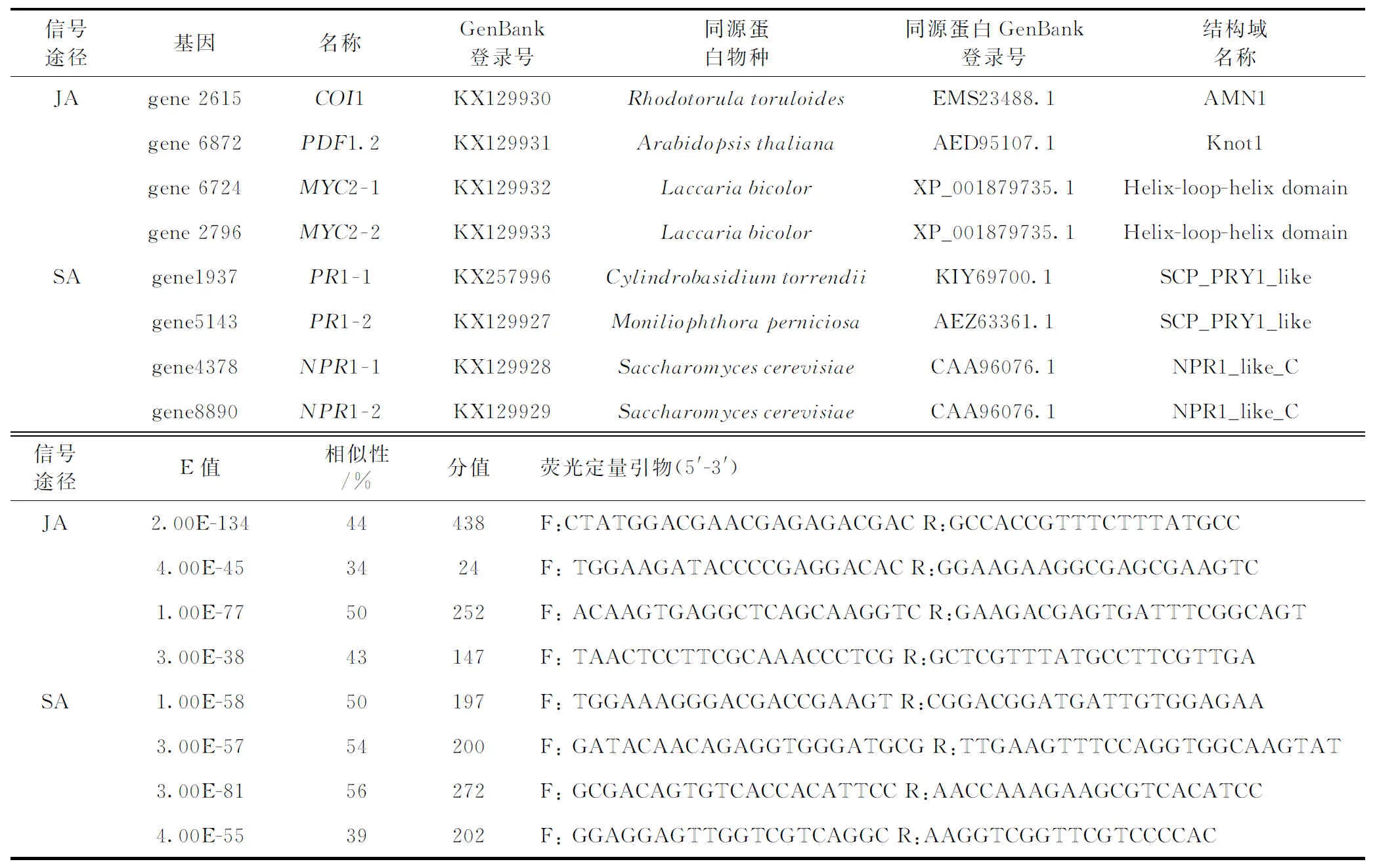
表1 金针菇JA/SA信号通路关键基因分析
2.2不同浓度JA/SA诱导下基因的表达模式
JA/SA均可诱导真菌产生一系列活性氧簇(reactive oxygen species,ROS),包括: O2-、H2O2及HO2-、-OH 等[13-14],可利用染色法鉴定ROS的生成量[15-17]。JA/SA处理后,对金针菇菌丝进行NBT染色。结果显示,菌丝球会被染色为浅紫色,且在JA浓度为50 μmol·L-1、SA浓度为500 μmol·L-1紫色最深,即此时菌丝中产生的氧负离子的量最多,受到JA/SA的胁迫最明显。
不同浓度JA/SA处理后,各基因相对表达量均呈上调表达趋势(图2-A、B)。 JA浓度为50 μmol·L-1时,COI1、PDF1.2和MYC2-1、MYC2-2相对表达量达到最高水平,并且MYC2-1和MYC2-2表达量模式完全一致,此4个基因都响应低浓度外源JA的诱导。PDF1.2在最低浓度JA处理时,就受到明显胁迫,且相对表达量变化趋势较大,此外高浓度JA有可能对JA信号通路产生抑制作用(图2-A)。SA浓度为500 μmol·L-1时,PR1-1、PR1-2、NPR1-1和NPR1-2的表达量达到最高,且基因表达模式基本一致,说明此4个基因皆响应外源SA的胁迫(图2-B)。以上定量结果与NBT染色结果一致(图1-A)。
2.3不同时间JA/SA诱导下基因的表达模式
金针菇菌丝分别经JA(50 μmol·L-1)和SA(500 μmol·L-1)处理后,不同时间点的NBT检测结果显示,JA和SA处理金针菇菌丝12 h,菌丝球染至紫色最深(图1-B),即此时菌丝中产生氧负离子的量最多,说明JA/SA对菌丝处理12 h的效果最好,对JA、SA信号转导通路胁迫最明显。
50 μmol·L-1JA处理金针菇菌丝后,随处理时间延长,COI1、PDF1.2和MYC2-1、MYC2-2相对表达水平呈先降低后增加再降低的表达模式,在12 h各基因相对表达量达到最高水平,之后逐渐降低(图2C)。且在500 μmol·L-1SA处理后,随时间的增加,PR1-1、PR1-2、NPR1-1和NPR1-2在12 h相对表达量最高,之后降低,与JA的最佳处理时间一致(图2D)。以上定量结果与NBT染色结果一致(图1-B)。
2.4JA/SA处理对信号转导途径的交互影响
在JA处理后,随添加SA浓度的升高,PDF1.2表达出现低浓度促进,高浓度抑制,且在SA 浓度为500 μmol·L-1时,SA对PDF1.2抑制作用最明显,高达10倍,而此时NPR1-1和NPR1-2受到的抑制作用最小,且有上调的趋势(图3-A)。添加SA后再添加不同浓度JA,PDF1.2表达出现了相同的变化趋势,但其影响小于前一种处理(图3-B)。说明金针菇中JA/SA信号转导途径中也存在拟南芥类似的协同或拮抗作用,并且体现在SA信号转导通路中NPR1蛋白对JA信号转导通路中PDF1.2基因表达的抑制,且这种作用关系会受到两者相对浓度变化的影响。说明在金针菇的防卫体系中,激素浓度对于其最终的调控结果是很关键的。
3 讨 论
用拟南芥中JA/SA信号通路基因对金针菇基因组进行同源比对,共鉴定到JA/SA信号通路各4个基因且都响应外源JA/SA的诱导,说明金针菇也存在植物中常见的抗病防卫体系,包括JA和SA信号传导途径。有研究显示,当植物受到外界胁迫时,MYC2等转录因子被大量释放,MYC2以COI1依赖的方式正向调节受伤或JA激活的基因PDF1.2的表达,从而启动相应JA抗性相关基因的转录[11,18-19]。本研究以金针菇为试验材料,外源施加JA,JA信号传导途径中相关的信号转导因子会受到激活作用,COI1、PDF1.2、MYC2-1和MYC2-2的基因一直超量表达,且COI1、MYC2-1和MYC2-2表达量变化趋势较小,PDF1.2则有较大的变化,由此可以推测,金针菇中存在JA信号转导途径,在外源添加JA可模拟菌丝响应外界胁迫,COI1、MYC2-1和MYC2-2调控了下游PDF1.2基因的表达,但MYC2、COI1以及PDF1.2之间具体的分子作用机理仍需进一步研究。有研究发现,NPR1作用于SA的下游,可与TGA类转录因子相互作用,这类转录因子可与PR类防御蛋白编码基因启动子中的SA应答原件结合,从而调控PR类防御蛋白编码基因的表达,而病程相关的蛋白PR基因的变动能够特异的诱导植物产生SAR,从而启动植物的广谱抗病[20]。外源添加SA,可不同程度诱导金针菇PR1-1、PR1-2、NPR1-1和NPR1-2上调表达,且NPR1-1和NPR1-2微小的变化及会引起PR1-1、PR1-2较大幅度的改变,由此可以进一步说明,基因NPR1-1和NPR1-2会响应外源SA的激活作用,启动SA信号转导途径,进一步诱导PR1-1、PR1-2表达量的提高。以上的结果表明外源JA、SA可能分别启动了金针菇JA、SA信号转导途径中的应答基因,并进行大量转录,且基因的转录水平均会受到JA/SA处理浓度和处理时间的影响,这与王文艳等的研究结果一致[11]。
研究结果显示:金针菇JA/SA信号转导途径中也存在与拟南芥类似的拮抗或协同作用,它们之间的相对浓度决定着这种相互关系的强弱,其拮抗作用的响应基因为PDF1.2。根据本研究的试验结果,参照拟南芥等植物的JA/SA信号转导途径[21-23],笔者初步构建了金针菇JA/SA信号转导途径(图3),金针菇受到外源JA诱导时,会激活下游COI1和MYC2基因的表达,从而激活下游植物防御蛋白基因PDF1.2的表达,响应外界的JA胁迫;金针菇受到SA诱导时,会激活下游基因NPR1的表达,从而进一步诱导病程相关蛋白PR1的表达,以应对外界的SA胁迫。而金针菇JA/SA信号转导途径以及SA对JA信号通路的拮抗或协同作用的分子机制则需要进一步的研究。
金针菇目前已被菇农及工厂广泛栽培,搔菌是栽培技术要点之一。该过程的实质是对金针菇的表面菌丝进行伤害,促进金针菇响应外界伤害,从而激活下游的信号分子,促使金针菇原基形成、子实体生长整齐[24-27]。在拟南芥中JA是伤害反应(机械损伤)的信号分子,可响应机械胁迫;我们进一步试验还表明JA处理金针菇栽培料生长菌丝后,能促进原基的形成,且子实体生长较整齐(数据未公布),说明JA对金针菇的胁迫作用类似搔菌(机械损伤)的作用。后期我们将继续深入研究JA对金针菇出菇的影响,以期进一步探究金针菇出菇的分子机理。
[1]彭金英, 黄永平, 植物防御反应的两种信号转导途径及其相互作用[J]. 植物生理与分子生物学学报, 2005, 31(4): 347-353.
[2]CROSS B E, WEBSTER G R B. New metabolites ofGibberellafujikuroi. Part XV[J]. N-jasmonoyl-and N-dihydrojasmonoyl-isoleucine, Journal of the Chemical Society C: Organic, 1970, 13: 1839-1842.
[3]ALDRIDGE D C, GALT S, GILES D, et al. Metabolites ofLasiodiplodiatheobromae[J].Journal of the Chemical Society C: Organic, 1971, 1623-1627.
[4]MIERSCH O, SCHNEIDER G, SEMBDNER G, et al. Cyclopentane fatty acids fromGibberellafujikuroi[J].Phytochemistry, 1992, 31(11): 3835-3837.
[5]MIERSCH O, SCHNEIDER G, SEMBDNER G, et al. (+)-7-iso-Jasmonic acid and related compounds fromBotryodiplodiatheobromae[J], Phytochemistry, 1987, 26(4): 1037-1039.
[6]MIERSCH O, SCHNEIDER G, SEMBDNER G. Jasmonic acid like substances from the cultural filtrate ofBotryodiplodiatheobromae[J],Phytochemistry, 1989, 28(5): 1203-1305.
[7]MIERSCH O, SCHNEIDER G, SEMBDNER G. Hydroxylated jasmonic acid and related compounds fromBotryodiplodiatheobromae[J]. Phytochemistry, 1991, 30(12), 4049-4051.
[8]黄毅.食用菌栽培[M].北京:高等教育出版社,1998:178-193.
[9]刘芳. 金针菇基因组和转录组测序与初步研究[D]. 福州: 福建农林大学, 2013: 1-138.
[10]刘朋虎, 谢宝贵, 邓优锦等. 草菇gpi基因结构及其异核体表达协同增效作用[J]. 食用菌学报, 2012, 18(4): 1-5.
[11]王文艳, 岳林许, 张演义等. 葡萄SA和JA信号转导重要基因克隆及其对外源信号应答分析[J]. 园艺学报, 2012, 39(5): 817-827.
[12]吴光美, 严俊杰, 杨志云等. 与金针菇子实体发育有关的漆酶编码基因Fv-lac4的结构及表达差异分析[J]. 基因组学与应用生物学, 2015, 33(6): 1254-1260.
[13]周莹, 寿森炎, 贾承国等. 水杨酸信号转导及其在植物抵御生物胁迫中的作用[J]. 自然科学进展, 2007, 17(3): 305-311.
[14]BANUELOS G R, ARGUMEDO R, PATEL K, et al. The developmental transition to flowering inArabidopsisis associated with an increase in leaf chloroplastic lipoxygenase activity[J]. Plant Science, 2008, 174(3): 366-373.

[16]FRAHRY G, SCHOPFER P. NADH-stimulated, cyanide-restistant superoxide production in maize coleoptiles analysed with a tetrazoliumbasedassay[J]. Planta,2001,212:175-183.
[17]SHI L, GONG L, ZHANG X, et al. The regulation of methyl jasmonate on hyphal branching and GA biosynthesis inGanodermalucidumpartly via ROS generated by NADPH oxidase[J]. Fungal Genetics and Biology, 2015, 81: 201-211.
[18]BROWSE J. Jasmonate passes muster: a receptor and targets for the defense hormone[J]. Annual Review of Plant Biology, 2009, 60: 183-20.
[19]KAZAN K, MANNERS J M. MYC2: the master in action[J]. Molecular Plant, 2013, 6(3): 686-703.
[20]CAO H, BOWLING S A, GORDON A S, DONG X N. Characterization of anArabidopsisthalianasismutant that is non-responsive to induce of systemic acquired resistance[J]. Plant Cell, 1994, 6: 1583-1592.
[21]NDAMUKONG I, ABDALLAT A A, THUROW C, et al. SA-inducibleArabidopsisglutaredoxin interacts with TGA factors and suppresses JA-responsive PDF1.2 transcription[J]. The Plant Journal, 2007, 50(1): 128-139.
[22]DONG X. SA, JA, ethylene, and disease resistance in plants[J]. Current opinion in plant biology, 1998,1(4): 316-323.
[23]LORENZO O, SOLANO R. Molecular players regulating the jasmonate signalling network[J]. Current opinion in plant biology, 2005, 8(5): 532-540.
[24]王兆生. 日本工厂化优质金针菇[J]. 食用菌, 1994, (5): 28-29.
[25]邢作山, 周传建, 郭惠等. 金针菇工厂化瓶栽技术[J]. 西北园艺, 2014, (9): 38-41.
[26]黄毅. 食用菌工厂化栽培实践[M], 福州: 福建科学技术出版社, 2014:193-203.
[27]尹永刚, 冯占, 余养朝. 金针菇工厂化瓶栽的设备、设施与技术要点[J]. 食药用菌, 2015, 23(1): 48-49.
(责任编辑:柯文辉)
Identification of Genes in JA/SA Signaling Pathways inFlammulinavelutipesand Their Response to Exogenous JA/SA
LI Xiao1,WANG Jian-Fang1,YAN Jun-Jie1,CHEN Bing-Zhi2,XIE Bin1,CHEN Ren-Liang1,WEN Zhi-Qiang1,JIANG Yu-Ji1,XIE Bao-Gui1*
(1.MycologicalResearchCenter,FujianAgricultureandForestryUniversity,Fuzhou,Fujian350002,China;2.CollegeofFoodScience,FujianAgricultureandForestryUniversity,Fuzhou,Fujian350002,China)
In this study, we identified 4 key genes of JA signaling pathway (COI1、PDF1.2、MYC2-1、MYC2-2) and SA signaling pathway (PR1-1、PR1-2、NPR1-1、NPR1-2) inFlammulinavelutipes, respectively. The results of NBT staining and RT-qPCR demonstrated that JA/SA signaling pathways ofF.velutipesresponsed to exogenous JA/SA. In addition, the expression levels of these genes of JA/SA signaling pathway significantly increased under the treatment of exogenous 50 μmol · L-1JA and 500 μmol · L-1SA for 12 h, respectively. It was worth noting thatPDF1.2 could be considered as the marker gene of JA signaling pathways for its response to exogenous JA obviously. The antagonistic effect between JA and SA signaling pathways may also exist inF.velutipesand the protein NPR1 of SA signaling pathways had inhibitory effect on the genePDF1.2 expression level of JA signaling pathways which could be affected by the relative concentration of exogenous JA/SA.
Flammulinavelutipes; jasmonic acid; salicylic acid; NBT; gene expression
2016-05-20初稿;2016-07-03修改稿
李肖(1990- ),女,在读硕士研究生,主要从事食用菌分子生物学研究(E-mail:2916025601@qq.com)
谢宝贵(1962-),男,教授,主要从事食用菌遗传育种研究(E-mail:mrcfafu@163.com)
国家重点基础研究发展计划(973 项目) (2014CB138302)
Q 785
A
1008-0384(2016)07-677-06
李肖,汪健芳,严俊杰,等.金针菇JA/SA信号通路基因鉴定及其对外源JA/SA应答[J].福建农业学报,2016,31(7):677-682.
LI X,WANG J-F,YAN J-J,et al.Identification of Genes in JA/SA Signaling Pathways inFlammulinavelutipesand Their Response to Exogenous JA/SA[J].FujianJournalofAgriculturalSciences,2016,31(7):677-682.

