不同硬度条件下Cd2+和Cu2+对稀有鮈鲫的急性毒性
熊小琴,罗思,吴本丽,3,王剑伟
1.中国科学院水生生物研究所,武汉430072
2.中国科学院大学,北京100049
3.安徽省农业科学院水产研究所,合肥230031
不同硬度条件下Cd2+和Cu2+对稀有鮈鲫的急性毒性
熊小琴1,2,罗思1,2,吴本丽1,2,3,王剑伟1,*
1.中国科学院水生生物研究所,武汉430072
2.中国科学院大学,北京100049
3.安徽省农业科学院水产研究所,合肥230031
为研究水体硬度对稀有鮈鲫Cd2+和Cu2+毒性效应的影响,开展了96 h急性毒性试验。试验结果发现,当水体硬度(以CaCO3计,下同)为50 mg·L-1、250 mg·L-1、450 mg·L-1时,Cd2+对稀有鮈鲫的96 h半数致死浓度(96 h-LC50)分别为4.30 mg·L-1、12.06 mg·L-1、19.99 mg·L-1,对应的安全浓度(SC)依次为0.430 mg·L-1、1.206 mg·L-1、1.999 mg·L-1;Cu2+对稀有鮈鲫的96 h-LC50分别为0.046 mg·L-1、0.148 mg·L-1、0.228 mg·L-1,对应的SC依次为0.0046 mg·L-1、0.0148 mg·L-1、0.0228 mg·L-1。计算得到Cd2+对稀有鮈鲫急性毒性与水体硬度的拟合方程为ln 96 h-LC50=0.687 lnH-1.243(r=0.998);Cu2+对稀有鮈鲫急性毒性与水体硬度的拟合方程为ln 96 h-LC50=0.727 lnH-5.923(r=0.999),Cd2+和Cu2+对稀有鮈鲫的硬度斜率分别为0.687和0.727。这些结果表明,水体硬度可有效降低Cd2+和Cu2+对稀有鮈鲫的急性毒性,且稀有鮈鲫的硬度斜率与其他物种差异较大。在评估不同硬度水体下Cd2+和Cu2+的生物毒性及其生态风险时,应根据测试物种特异的硬度斜率而定。
水体硬度;Cd2+;Cu2+;稀有鮈鲫;急性毒性
熊小琴,罗思,吴本丽,等.不同硬度条件下Cd2+和Cu2+对稀有鮈鲫的急性毒性[J].生态毒理学报,2016,11(3):316-322
Xiong X Q,Luo S,Wu B L,et al.Acute toxicity of cadmium and copper toGobiocypris rarusunder different water hardness[J].Asian Journal of Ecotoxicology,2016,11(3):316-322(in Chinese)
随着工农业的发展,排污量逐渐增加,我国水体重金属污染问题已十分突出,江河湖库底质的污染率高达80.1%[1]。以长江水系为例,各个江段均已受到不同程度的重金属污染[2]。水体中的重金属浓度过高时可对生物产生直接毒性作用。此外,由于重金属具有亲脂性、高富集性和难降解性等特点,它们进入水体后极易在水生生物体内积累,并随着生物营养级的升高而增大,进一步增加其潜在危害[3-4]。有研究表明,在已知的人类疾病中70%~80%与水体重金属污染有关[5]。在我国,重金属被认为是严重威胁生态环境和人类健康的污染物之一[6]。
铜和镉是我国水体中2个较为常见的重金属污染物。镉(Cd2+为主)由于能使蛋白质变性,且无法通过水体的自净作用去除,是一种会对环境、水生生物和人体健康造成潜在危害的重金属[[7]。美国毒性管理委员会(ATSRD)把镉列为第六大危害人体健康的有毒物质,联合国环境规划署(DNFP)将镉列入重点研究的环境污染物,世界卫生组织(WTO)把镉作为优先研究的食品污染物。相比之下,由于藻类控制剂硫酸铜(CuSO4)的广泛使用已使铜(Cu2+为主)成为养殖水体重要的污染物[8]。近年来,我国水体已受到不同程度的镉和铜污染[9-12],从我国七大水系的调研结果可以看出,长江水系Cd污染仅次于Hg、COD、BOD和挥发酚;黄河水系有16.7%的断面总Cd含量超标;淮河干流总Cd含量超标率为16.7%;海滦河总Cd含量平均超标率为16.7%~83.9%;大辽河水系污染较轻,在对所统计的26个国控湖泊、水库的监测中发现了不同程度的Cd污染,污染程度仍次于Hg[13]。非污染水体中铜含量在2 μg·L-1以下,但在污染较严重的矿区附近沉积物中的铜含量可高达5 000 mg·kg-1以上,如江西德兴铜矿区、湖北大冶市铜绿山矿区、浙江哩铺铜矿区附近沉积物中铜含量都远远超过了国家环境二级标准[14]。因此,开展Cd2+和Cu2+的生物毒性测试及其生态风险评估对于水质基准制定和生态环境保护具有重要的意义。
大量研究表明,水体理化因子如温度、硬度、碱度、有机碳含量、pH等[15-18],以及生物因子如生长期、摄食等[19-20]都可能对重金属的生物毒性测试造成影响,进而影响实验结果的可比性和有效性[21]。尽管水体硬度减缓重金属生物毒性的作用机制存在争议[18,22,23],水体硬度对重金属生物毒性的减缓作用已被广为认可。王伟莉等[24]研究发现,Cd2+和Cu2+对金鲫鱼的急性毒性均随着水体硬度的增加而减低。此外,周永欣等[25]还研究发现,水体硬度对Cu2+生物毒性的减缓作用在不同物种之间存在差异,水体硬度对鲢的保护作用明显大于对大鳞副泥鳅的保护作用。中国地表水总硬度范围较广在4.5~ 15 600 mg·L-1(以CaCO3计)之间,小于150 mg·L-1的软水和极软水面积占42%,150~300 mg·L-1的适度硬水占34%,300~450 mg·L-1的硬水占11%,大于450 mg·L-1的极硬水占13%[26]。以流域分,总硬度从高到低的排列顺序为:珠江流域、长江流域、红河流域、怒江流域、澜沧江流域、伊洛瓦底江流域[27]。从全国范围来看,受干旱程度和降水大小的影响,总硬度的变化趋势为:从东到西逐渐降低,从南到北逐渐升高。
稀有鮈鲫(Gobiocypris rarus)是我国《化学品测试方法》和《水和废水检测方法》推荐使用的测试生物中唯一的本土鱼类,其鱼类急性毒性测试方法已形成国家标准(GB/T 29763-2013)。目前,稀有鮈鲫已被广泛应用于重金属、有机污染物等毒性效应测试及其生态风险评估的研究中[28]。本研究通过96 h急性毒性试验,测定了不同硬度条件下重金属Cd2+和Cu2+对稀有鮈鲫的急性毒性,旨在为稀有鮈鲫的毒性测试方法的规范化和标准化提供数据参考。
1 材料与方法(Materials and methods)
1.1 实验材料
受试生物稀有鮈鲫取自中国科学院水生生物研究所自行培育的封闭群Ihb:IHB第8代,体长(2.51± 0.09)cm,体重(0.258±0.037)g。受试毒物CdCl2·2.5 H2O购自Geel(Belgium)公司,ACS级,用去离子水配成浓度为10 g·L-1(以Cd2+计)的储备液;CuCl2· 2H2O购自国药集团化学试剂有限公司,分析纯(AR)级,用去离子水配成浓度为5 g·L-1(以Cu2+计)的储备液。
1.2 实验方法
急性毒性试验方法参照GB/T 29763-2013。分别进行了不同水体硬度(以CaCO3计,全文同)条件下Cd2+和Cu2+对稀有鮈鲫的急性毒性试验。试验用水为曝气48 h后的稀释水,稀释水由CaCl2· 2H2O、MgSO4·7H2O、NaHCO3、KCl和去离子水配制[25]。实验容器为无缝玻璃缸(8 L,20 cm×20 cm× 20 cm),每个实验容器盛放实验液5 L,每缸10尾,每个浓度设置3个平行,并设空白对照。采用半静态试验方法,每隔24h更换一半试验液。试验温度为(25± 1)℃,光照周期为12 h:12 h。分别于24 h、48 h、72 h、96 h记录各组鱼死亡数目。死亡判断标准为:玻璃棒反复触动无任何反应。试验期间,采用水质分析仪(Hach 30Qd,USA)在换水前后测量各个试验组的水温、电导率、pH和溶氧及其氧饱和度等水质参数。
根据美国国家环境保护局(US EPA)技术文件对水质基准中硬度斜率毒性数据的计算要求[25],同时,结合中国各个地区水硬度差异较大的实情,设置低硬度50 mg·L-1,中等硬度250 mg·L-1,和高硬度450 mg·L-1。通过预实验确定在不同水体硬度条件下受试鱼全部死亡的最低浓度和全部存活的最高浓度,以此来设置正式实验浓度范围,按几何级数设置试验浓度组(表1)。
1.3 数据统计与分析
实验所得数据采用SPSS 16.0软件进行半数致死剂量的计算,主要得出24 h、48 h、72 h和96 h的半致死浓度及其95%置信区间,采用经验公式推算安全浓度,SC=0.1×96 h LC50,并通过一元线性回归分析半致死浓度与硬度的相关性。数据分析中所用浓度均为设置浓度。
2 结果(Results)
2.1 水质
实验暴露期间的硬度、温度、pH、电导率、溶氧及其氧饱和度等水质参数见表2。实测硬度值与预设硬度值差别不大。
2.2 中毒症状

表1 不同水体硬度条件下Cd2+和Cu2+的浓度设置Table 1 Concentrations of Cd2+and Cu2+under different water hardness

表2 毒性实验中的水质参数Table 2 Physical and chemical characteristics of the test waters
实验观察发现,对照组中稀有鮈鲫游动自如,行为正常,无死亡发生。处理组中稀有鮈鲫在接触毒物后,可观察到明显的中毒症状,尤其是高浓度组中试验鱼暴露2 h左右表现为:浮头、局促不安、四处乱串、上下游动和打转等现象;随后,鱼体运动迟缓,身体逐渐失去平衡,直至死亡。死亡时,沉于缸底,身体有不同程度的弯曲,口和鳃盖多呈张开状态,鳍基部有充血现象等。中毒症状随着暴露浓度和暴露时间的增加而愈发明显。
2.3 不同水体硬度条件下Cd2+和Cu2+对稀有鮈鲫的急性毒性
Cd2+和Cu2+对稀有鮈鲫的半致死浓度(LC50)及安全浓度见表3和表4。Cd2+和Cu2+对稀有鮈鲫的96 h-LC50值均随着水体硬度的增加而降低,即随着水体硬度的增加,2种重金属离子对稀有鮈鲫的急性毒性逐渐下降。水体硬度从50 mg·L-1升高至250 mg·L-1时,Cd2+对稀有鮈鲫的急性毒性降低约2.8倍,从250 mg·L-1升高至450 mg·L-1时,Cd2+对稀有鮈鲫的急性毒性降低约1.7倍。相比之下,水体硬度从50 mg·L-1升高至250 mg·L-1时,Cu2+对稀有鮈鲫的急性毒性降低约3倍,从250 mg·L-1升高至450 mg·L-1时,Cu2+对稀有鮈鲫的急性毒性降低约1.5倍。通过线性拟合发现,水体硬度值与Cd2+和Cu2+对稀有鮈鲫的96 h-LC50值的自然对数均呈正相关关系,拟合方程分别为ln96 h-LC50=0.687lnH-1.243(r= 0.998),ln96 h-LC50=0.727 lnH-5.923(r=1),Cd2+和Cu2+的生物毒性硬度斜率依次为0.687和0.727。
3 讨论(Discussion)
3.1 铜和镉对稀有鮈鲫的急性毒性
本研究测定了不同硬度水体下Cd2+和Cu2+对稀有鮈鲫的急性毒性。在水体硬度为250 mg·L-1时,稀有鮈鲫对Cd2+和Cu2+的96 h-LC50分别为12.06mg·L-1和0.148 mg·L-1。这与吴本丽等[28]所报道的Cd2+对稀有鮈鲫急性毒性结果一致。国家环保部1986年制订的《生物监测技术规范(水环境部分)》中将化学物质对鱼类的毒性分为5个等级:LC50
我国渔业相关水质标准包括《渔业水质标准》(GB 11607-1989)、《地表水环境质量标准》(GB 3838-2002)、《海水水质标准》(GB 3097-1997)和《无公害水产品产地环境标准》(GB/T 18407.4-2001)等。进行一般性的渔业生态环境水质评价时,主要依据《渔业水质标准》,选取其中的项目和浓度限值,而《渔业水质标准》中没有规定的项目,则参考其他相应标准。一般按照水域类别和不同功能区划分选择《地表水环境质量标准》和《海水水质标准》中的项目及相应级别的浓度限值。镉和铜在国家《渔业水质标准》中最高允许排放浓度分别为0.005和0.01 mg·L-1,而在国家《地表水环境质量标准》中的最高允许浓度分别为0.01和1.0 mg·L-1。本研究中,稀有鮈鲫在所设硬度条件下铜的安全浓度均远远低于1.0 mg·L-1。显然,含铜地表水如果执行国家《地表水环境质量标准》,将有可能对鱼类及其他水生生物带来较大的危害。未来标准修订中是否应该对铜进行更严格的控制,值得进一步研究。
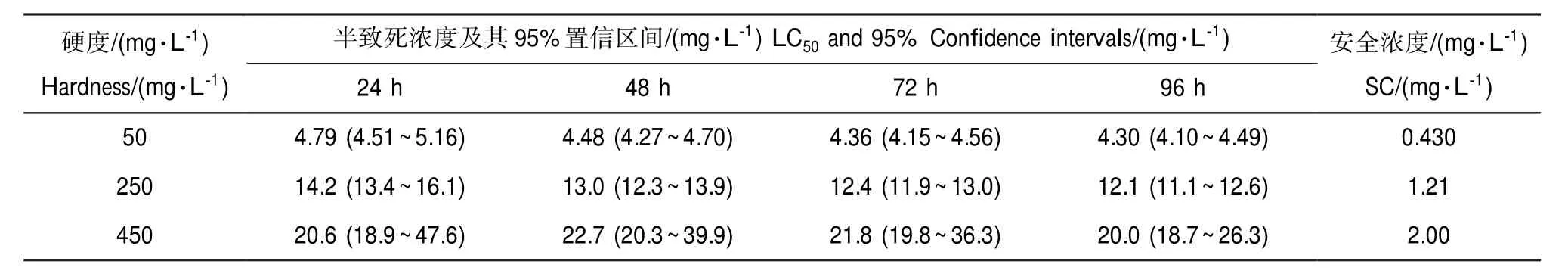
表3 不同硬度条件下Cd2+对稀有鮈鲫的急性毒性Table 3 Acute toxicity of Cd2+toG.rarusunder different water hardness

表4 不同硬度条件下Cu2+对稀有鮈鲫的急性毒性Table 4 Acute toxicity of Cu2+toG.rarusunder different water hardness
3.2 水体硬度对Cd2+和Cu2+急性毒性的影响
10~250 mg·L-1CaCO3的高质量自然水、饮用水以及标准稀释水"ISO7346/3"[29]常被用作稀有鮈鲫的养殖和试验用水,而有关水体硬度对稀有鮈鲫毒性测试结果的影响还未见报道。本研究结果表明,水体硬度可有效减低Cd2+和Cu2+对稀有鮈鲫的急性毒性。Cd2+和Cu2+在低硬度条件下导致100%死亡(EC100)的最低浓度在中等硬度条件下均无一尾死亡;中等硬度条件下,Cd2+的EC100在高硬度水体中的死亡率约为25%,Cu2+的EC100在高硬度水体中的死亡率约为55%。水体硬度越高,Cd2+和Cu2+对稀有鮈鲫的急性毒性越弱,这与先前的研究结果一致[22,24-25]。对于水体硬度能有效减弱重金属毒性效应的机理,一般认为在较高硬度水体中,碳酸根、重碳酸根离子与重金属离子形成络合态离子或者沉淀,以及和钙镁离子共同作用形成更多不溶性碳酸盐或碳酸钙吸附在鰓上,从而降低生物对重金属的吸收[18,30-31];有学者提出Ca2+、Mg2+和重金属离子在细胞膜上存在竞争吸附关系,高硬度水体中Ca2+和Mg2+浓度的增加减少了重金属离子进入生物膜的通道,进而降低了生物对重金属的吸收[22,32-33];还有学者认为Ca2+和Mg2+比例的改变影响了生物膜的渗透性,从而影响了重金属离子的被动运输过程[34]。不过,也有部分研究发现水体硬度对重金属积累和毒性没有影响[35-37],甚至还有研究表明水体硬度与重金属毒性呈负相关关系[23]。笔者认为这可能与不同测试物种、测试方法以及相关的检测指标有关。
尽管重金属生物毒性的影响因素很多,但水体硬度对重金属毒性的影响最具广泛性。因此,US EPA将水体硬度作为研究重金属安全阈值(水质基准)时必须考虑的因素之一,大部分重金属的水质基准都与水体硬度有函数关系。通过对不同硬度条件下生物毒性的数据分析,可以计算出硬度斜率用于表征硬度对污染物毒性效应影响的大小。US EPA制定的Cd2+和Cu2+基准的硬度斜率分别为1.0166和0.942[38-39]。闫振广等[40]研究得到Cd2+对我国淡水水生生物的硬度斜率分别为1.1530。王伟莉等[24]研究得到Cd2+对金鲫鱼毒性硬度斜率为0.513和0.923。Bjerselius等[22]研究发现,Cu2+对鲑鳟鱼的硬度斜率为0.91。周永欣等[25]研究发现,Cu2+对草鱼、鲢鱼和大鳞副泥鳅的硬度斜率分别为0.9051,1.0207和0.7506。本研究中Cd2+和Cu2+对稀有鮈鲫的硬度斜率分别为0.697和0.727,这些数值均明显低于上述研究结果。稀有鮈鲫是我国《化学品测试方法》推荐使用的测试物种之一,且作为唯一的本土测试鱼类,在重金属毒性测试及其风险评估中具有重要的作用。采用上述研究所得的硬度斜率推算重金属的生物毒性时势必会低估其在低硬度水体的生态风险以及高估其在高硬度水体下的生态风险。因此,在评估不同硬度水体下Cd2+和Cu2+的生物毒性及其生态风险时,应根据测试物种特异的硬度斜率而定。
致谢:感谢中国科学院水生生物研究所周炳升研究员在文章修改中给予的帮助。
(References):
[1] 周怀东,彭文启.水污染与水环境修复[M].北京:化学工业出版社,2005:8-15
Zhou H D,Peng W Q.Water Pollution and Water Environmental Restoration[M].Beijing:Chemical Industry Press,2005:8-15(in Chinese)
[2] 王岚,王亚平,许春雪,等.长江水系表层沉积物重金属污染特征及生态风险性评价[J].环境科学,2012,33 (8):2599-2606
Wang L,Wang Y P,Xu C X,et al.Pollution characteristics and ecological risk assessment of heavy metals in the surface sediments of the Yangtze River[J].Environmental Sciences,2012,33(8):2599-2606(in Chinese)
[3] 毕春娟,陈振楼,许世远,等.长江口潮滩大型底栖动物对重金属的累积特征[J].应用生态学报,2006,17(2): 309-314
Bi C J,Chen Z L,Xu S Y,et al.Heavy metals accumulation in macrobenthos in intertidal flat of Yangtze Estuary [J].The Journal of Applied Ecology,2006,17(2):309-314 (in Chinese)
[4] Wang W X,Ke C.Dominance of dietary intake of cadmium and zinc by two marine predatory gastropods[J].A-quatic Toxicology,2002,56:153-165
[5] 陈学傲.环境卫生学[M].北京:人民卫生出版社,2001: 78-117
Chen X A.Environmental Hygiene[M].Beijing:People's Medical Publishing House,2001:78-117(in Chinese)
[6] Cheng S.Heavy metal pollution in China:Origin,pattern and control[J].Environmental Science and Pollution Research,2003,10:192-198
[7] Tu Y J,You C F,Chang C K.Kinetics and thermodynam-ics of adsorption for Cd on green manufactured nano-particles[J].Journal of Hazardous Materials,2012,235:116-122
[8] 李达,陈道印,肖秀兰.硫酸铜引起鱼类中毒的原因初析[J].淡水渔业,2000,30(5):38-39
Li D,Chen D Y,Xiao X L.The cause of fish poisoning bycopper sulfate[J].Freshwater Fisheries,2000,30(5): 38-39(in Chinese)
[9] 田成秀,李文明,郑长远.河流重金属研究进展[J].青海师范大学学报:自然科学版,2011(4):25-28
Tian C,Li W M,Zheng C Y.Study on heavy metals in river[J].Journal of Qinghai Normal University:Natural Science Edition,2011(4):25-28(in Chinese)
[10] 邱鸿荣,罗建中,郑国辉,等.西南涌流域底泥重金属污染特征及潜在生态危害评价[J].中国环境监测, 2012,28(6):32-36
Qiu H R,Luo J Z,Zheng G H,et al.Investigation of heavy metals pollution and potential ecological risk assessmental in sediment of Xinan river watershed[J].Environmental Monitoring in China,2012,28(6):32-36(in Chinese)
[11] Fan Q,He J,Xue H,et al.Heavy metal pollution in the Baotou section of the Yellow River,China[J].Chemical Speciation&Bioavailability,2008,20(2):65-76
[12] 雷沛,张洪,单保庆.丹江口水库典型库湾及支流沉积物重金属污染分析及生态风险评价[J].长江流域资源与环境,2013,22(1):110-117
Lei P,Zhang H,Shan B Q.Analysis of heavy metals pollution and ecological risk assessment in the sediments from the representative river mouths and tributaries of the Danjiangkou Reservoir[J].Resources and Environment in the Yangtze Basin,2013,22(1):110-117(in Chinese)
[13] 朱映川,刘雯,周遗品,等.水体重金属污染现状及其治理方法研究进展[J].广东农业科学,2008(8):143-146
Zhu Y C,Liu W,Zhou Y P,et al.Reused path of heavy metal pollution in hydro-environment and its research advance[J].Guangdong Agricultural Sciences,2008(8): 143-146(in Chinese)
[14] 金勇,付庆灵,郑进,等.超积累植物修复铜污染土壤的研究现状[J].中国农业科技导报,2012,14(4):93-100
Jin Y,Fu Q L,Zheng J,et al.Research status on phytoremediation of copper contaminated soil with hyperaccumulator[J].Journal of Agricultural Science and Technology (Beijing),2012,14(4):93-100(in Chinese)
[15] Playle R C,Gensemer R W,Dixon D G.Copper accumulation on gills of fathead minnows-influence of water hardness,complexation and pH of the gill microenvironment[J].Environmental Toxicology and Chemistry,1992, 11:381-391
[16] Erickson R J,Benoit D A,Mattson V R,et al.The effects of water chemistry on the toxicity of copper to fathead minnows[J].Environmental Toxicology and Chemistry, 1996,15:181-193
[17] Pyle G G,Swanson S M,Lehmkuhl D M.The influence of water hardness,pH,and suspended solids on nickel toxicity to larval fathead minnows(Pimephales promelas) [J].Water Air and Soil Pollution,2002,133:215-226
[18] Miller T G,Mackay W.The effects of hardness,alkalinity and pH of test water on the toxicity of copper to rainbow trout(Salmo gairdneri)[J].Water Research,1980,14:129-133
[19] Gopalakrishnan S,Thilagam H,Raja P V.Comparison of heavy metal toxicity in life stages(spermiotoxicity,egg toxicity,embryotoxicity and larval toxicity)ofHydroides elegans[J].Chemosphere,2008,71:515-528
[20] Shimizu M,Morita S.Effects of fasting on cadmium toxicity,glutathione metabolism,and metallothionein synthesis in rats[J].Toxicology and Applied Pharmacology, 1990,103:28-39
[21] Hrovat M,Segner H,Jeram S.Variability ofin vivofish acute toxicity data[J].Regulatory Toxicology and Pharmacology,2009,54:294-300
[22] Bjerselius R,Winberg S,Winberg Y,et al.Ca2+protects olfactory receptor function against acute Cu(II)toxicity in Atlantic salmon[J].Aquatic Toxicology,1993,25:125-137
[23] Yim J H,Kim K W,Kim S D.Effect of hardness on acute toxicity of metal mixtures usingDaphnia magna: Prediction of acid mine drainage toxicity[J].Journal of Hazardous Materials,2006,138:16-21
[24] 王伟莉,焦聪颖,闫振广,等.水体硬度对铜和镉生物毒性的影响[J].环境工程技术学报,2013,3(3):272-278
Wang W L,Jiao C Y,Yan Z G,et al.Effect of water hardness on ecotoxicity of cadmium and copper to aquatic organisms[J].Journal of Environmental Engineering Technology,2013,3(3):272-278(in Chinese)
[25] 周永欣,周仁珍,尹伊伟.在不同水硬度下铜对草鱼,鲢和大鳞泥鳅的急性毒性[J].暨南大学学报:自然科学版,1992,13(3):62-67
Zhou Y X,Zhou R Z,Yin Y W.Acute toxicity of copper to the grass carps,silver carp and loach under different water hardness[J].Journal of Jinan University:Natural Science,1992,13(3):62-67(in Chinese)
[26] 周怀东,彭文启,杜霞,等.中国地表水水质评价[J].中国水利水电科学研究院学报,2004,2(4):21-30
Zhou H D,Peng W Q,Du X,et al.Assessment of surfacewater quality in China[J].Journal of China Institute of Water Resources and Hydropower Research,2004,2(4): 21-30(in Chinese)
[27] 李艳华.云南省地表水水化学特征及成因[J].云南环境科学,2006,25(B06):103-105
Li Y H.Chemical characteristics and origins of surface water in Yunnan Province[J].Yunnan Environmental Science,2006,25(B06):103-105(in Chinese)
[28] 吴本丽,曹岩,罗思,等.封闭群稀有鮈鲫对几种常见化学品的敏感性[J].中国环境科学,2014,34(4):1059-1066
Wu B L,Cao Y,Luo S,et al.Sensitivity of rare minnow (Gobiocypris rarus,IHB)to several common chemicals [J].China Environmental Science,2014,34(4):1059-1066 (in Chinese)
[29] 国家环境保护总局《化学品测试方法》编委会.化学品测试方法[S].北京:中国环境科学出版社,2004
The editorial committee of State Environmental Protection Administration.The Guidelines for the Testing of Chemicals[S].China Environmental Sciences Press,2004(in Chinese)
[30] Stiff M J.Copper/bicarbonate equilibria in solutions of bicarbonate ion at concentrations similar to those found in natural water[J].Water Research,1971,5(5):171-176
[31] Sylva R N.The environmental chemistry of copper(II)in aquatic systems[J].Water Research,1976,10(9):789-792
[32] Javid A,Javed M,Abdullah S.Nickel bio-accumulation in the bodies ofCatla catla,Labeo rohitaandCirrhina mrigaladuring 96-hr LC50exposures[J].International Journal of Agriculture and Biology,2007,9:139-142
[33] Pyle G G,Swanson S M,Lehmkuhl D M.The influence of water hardness,pH,and suspended solids on nickel toxicity to larval fathead minnows(Pimephales promelas) [J].Water,Air,and Soil Pollution,2002,133(1-4):215-226
[34] Bonga S W,Löwik C,Van der Meij J.Effects of external Mg2+and Ca2+on branchial osmotic water permeabiligy and prolactin secretion in the teleost fishSarotherodon mossambicus[J].General and Comparative Endocrinology,1983,52:222-231
[35] Markich S J,King A R,Wilson S P.Non-effect of water hardness on the accumulation and toxicity of copper in a freshwater macrophyte(Ceratophyllum demersum):How useful are hardness-modified copper guidelines for protecting freshwater biota?[J].Chemosphere,2006,65:1791-1800
[36] Riethmuller N,Markich S J,van Dam R A,et al.The Effect of True Water Hardness and Alkalinity on the Toxicity of Cu and U to Two Tropical Australian Freshwater Organisms[M].Darwin:Northern Territory University, 2000:212-256
[37] Fortin C,Denison F H,Garnier-Laplace J.Metal-phytoplankton interactions:Modeling the effect of competing ions(H+,Ca2+,and Mg2+)on uranium uptake[J].Environmental Toxicology and Chemistry,2007,26(2):242-248
[38] United States Environmental Protection Agency(US EPA).Update of Ambient Water Quality Criteria for Cadmium[R].Washington DC:Office of Water,Office of Science and Technology,2001
[49] United States Environmental Protection Agency(US EPA).Aquatic Life Ambient Freshwater Quality Criteria-Copper 2007 Revision[R].Washington DC:Office of Water,Office of Science and Technology,2007
[40] 闫振广,孟伟,刘征涛,等.我国淡水水生生物镉基准研究[J].环境科学学报,2009,29(11):2393-2406
Yan Z G,Meng W,Liu Z T,et al.Biological criteria for freshwater Cd in China[J].Acta Scientiae Circumstantiae, 2009,29(11):2393-2406(in Chinese)◆
Acute Toxicity of Cadmium and Copper to Gobiocypris rarus under Different Water Hardness
Xiong Xiaoqin1,2,Luo Si1,2,Wu Benli1,2,3,Wang Jianwei1,*
1.Institute of Hydrobiology,Chinese Academy of Sciences,Hubei 430042,China
2.University of Chinese Academy of Sciences,Beijing 100049,China
3.Fisheries Research Institute,Anhui Academy of Agricultural Sciences,Anhui 230031,China
2 September 2015 accepted 23 November 2015
In the present study,the effects of water hardness(as CaCO3)on the acute toxicity to Chinese rare minnow(Gobiocypris rarus)were investigated.For cadmium(Cd),the 96-h median lethal concentration(96h-LC50) was 4.30,12.06,19.99 mg·L-1,under 50,250 and 450 mg·L-1concentrations of CaCO3,respectively,and the corresponding safety concentration(SC)was 0.430,1.206 and 1.999 mg·L-1.For copper(Cu),the 96 h-LC50was 0.046,0.148,0.228 mg·L-1,respectively,and the corresponding SC was 0.0046,0.0148,0.0228 mg·L-1,respective-ly.The relationship between acute toxicity of Cd to rare minnow and water hardness is:ln 96 h-LC50=0.687 lnH-1.243(r=0.998),while for Cu,the relationship is:ln 96 h-LC50=0.727 lnH-5.923(r=0.999).The hardness slope of toxicity of Cd2+and Cu2+was 0.687 and 0.727,respectively.The results showed that the water hardness effectively reduced the acute toxicity of Cd2+and Cu2+toG.rarus,and the hardness slope of heavy metals inG.raruswas quite different from that in other species.The present study also imply that the toxicity and ecological risk evaluation of Cd2+and Cu2+under different water hardness conditions should depend on the specific hardness slopes of different species.
water hardness;Cd2+;Cu2+;Gobiocypris rarus;acute toxicity
2015-09-02 录用日期:2015-11-23
1673-5897(2016)3-316-07
X171.5
A
10.7524/AJE.1673-5897.20150902002
简介:王剑伟(1967—),男,理学博士,研究员,主要研究方向鱼类实验动物学。
国家科技支撑计划973项目(2011BAI15B01-41);科技部863计划资源环境领域重大项目(2012AA06A302)
熊小琴(1988—),女,博士,研究方向为生态毒理学,E-mail:xiongxiaoqinxxq@163.com
*通讯作者(Corresponding author),E-mail:wangjw@ihb.ac.cn

